Производные меркаптоацетиламида, способ их получения, фармацевтическая композиция на их основе, способ ее получения и способ лечения сердечно-сосудистого болезненного состояния
Иллюстрации
Показать всеИзобретение относится к новым производным меркаптоацетиламида, которые являются ингибиторами ангиотензин-превращающего фермента и нейтральной эндопептидазы и применимы для лечения сердечно-сосудистого болезненного состояния. Описываются производные меркаптоацетиламида, имеющие формулу (I)
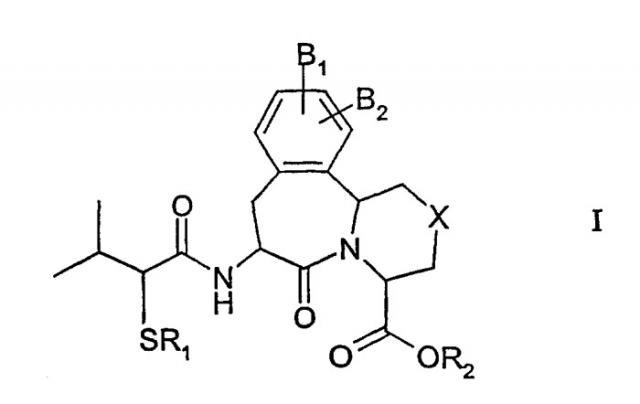
в которой: R1 представляет водород или ацильную группу; R2 представляет водород или дифенилметил; Х представляет -(СН2)n, где n равно целому числу 1; B1 и В2 каждый независимо представляет водород; или его фармацевтически приемлемые соли или его стереоизомеры. Также описываются способ получения соединений формулы I и формулы II, способ лечения сердечно-сосудистого болезненного состояния, фармацевтическая композиция на основе соединений формулы I и способ ее получения. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 6 н. и 8 з.п. ф-лы, 3 табл., 1 ил.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
1. Область техники
Настоящее изобретение относится к новым соединениям, обладающим как ингибирующей активностью в отношении ангиотензин-превращающего фермента, так и ингибирующей активностью в отношении нейтральной эндопептидазы и к способам их получения. Настоящее изобретение также относится к фармацевтическим композициям, содержащим такие соединения двойного ингибирующего действия или их фармацевтически приемлемые соли и к их применению для получения лекарственных средств.
2. Уровень техники
Ангиотензинпревращающий фермент (АПФ) представляет собой пептидилдипептидазу, которая катализирует превращение ангиотензина I в ангиотензин II. Ангиотензин II является сосудосуживающим агентом, который также стимулирует секрецию альдостерона корой надпочечников. Ингибирование АПФ предотвращает как конверсию ангиотензина I в ангиотензин II, так и метаболизм брадикинина, приводящий к пониженной циркуляции ангиотензина II и альдостерона и к повышенным концентрациям брадикинина в системе кровообращения. В дополнение к таким нейрогормональным изменениям наблюдаются понижение сопротивления периферических сосудов и кровяного давления, в особенности у индивидуумов с высокой циркуляцией ренина. Другие фармакологические эффекты, связанные с ингибированием АПФ, включают регрессию гипертрофии левого желудочка, улучшение клинических признаков при сердечной недостаточности и снижение смертности у пациентов с застойной сердечной недостаточностью (ЗСН) или дисфункцией левого желудочка после инфаркта миокарда.
Нейтральная эндопептидаза (НЭП) представляет собой фермент, ответственный за метаболизм предсердного натриуретического пептида (ПНП). Ингибирование НЭП приводит к повышенным концентрациям ПНП, которые в свою очередь приводят к натриурезу, диурезу и уменьшению внутрисосудистого объема, венозного оттока и кровяного давления. ПНП выделяется миоцитами предсердия в ответ на растяжение предсердия или увеличение внутрисосудистого объема. Было показано, что повышенные концентрации ПНП в плазме представляют потенциальный компенсаторный механизм при различных болезненных состояниях, включающих застойную сердечную недостаточность, почечную недостаточность, гипертоническую болезнь и цирроз.
Секреция ПНП миоцитами предсердия вызывает расширение кровеносных сосудов, диурез, натриурез и ингибирование высвобождения ренина и секреции альдостерона. Напротив, ангиотензин II приводит к сужению сосудов, реабсорбции натрия и воды и к продуцированию альдостерона. Две эти гормональные системы взаимодействуют противоположно направленным взаимоуравновешивающим образом, сохраняя нормальные физиологические сосудистые и гемодинамические ответы. Патент США 5430145 описывает трициклические производные меркаптоацетиламида, используемые в качестве ингибиторов АПФ и НЭП. Настоящее изобретение относится к конкретным соединениям, покрываемым общим описанием патента США 5430145, которые имеют неожиданно улучшенные свойства АРМЭ (абсорбции, распределения, метаболизма, экскреции) по сравнению с соединениями, представленными в нем в примерах.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение относится к соединению формулы I:
в которой:
R1 представляет водород, -СН2ОС(О)С(СН3)3 или ацильную группу;
R2 представляет водород, -СН2О-С(О)С(СН3)3, С1-С4-алкил, арил, арил(С1-С4-алкил) или дифенилметил;
X представляет -(CH2)n, где n равно целому числу 0 или 1, -S-, -O-,
где R3 представляет водород, С1-С4-алкил, арил или арил(С1-С4-алкил), и R4 представляет -CF3, С1-С10-алкил, арил или арил(С1-С4-алкил);
В1 и В2 каждый независимо представляет водород, гидрокси или -OR5, где R5 представляет С1-С4-алкил, арил или арил(С1-С4-алкил), или В1 и В2 присоединены к соседним атомам углерода так, что В1 и В2, взятые вместе с соседними атомами углерода, образуют бензольное кольцо или метилендиокси.
В одном осуществлении настоящее изобретение относится к соединению формулы I, в которой R1 представляет ацетил. В другом осуществлении настоящее изобретение относится к соединению формулы I, в которой R1 представляет водород. В следующем осуществлении настоящее изобретение относится к соединению формулы I, в которой R2 представляет водород. В следующем осуществлении настоящее изобретение относится к соединению формулы I, в которой В1 и/или В2 представляют водород. В еще одном осуществлении настоящее изобретение относится к соединению формулы I, в которой Х представляет -СН2.
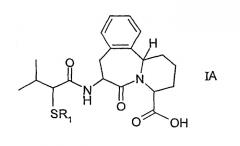
В одном осуществлении настоящее изобретение относится к соединению формулы IA:
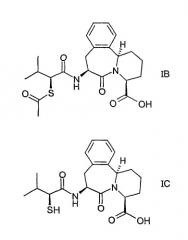
в которой R1 представляет ацетил или водород. Структурой предпочтительных соединений согласно настоящему изобретению являются соединения формул IB и IC, приведенные ниже:
Соединения формулы I, включающие соединения формул IA, IB и IC, являются особенно полезными в качестве ингибиторов АПФ и НЭП двойного действия.
Настоящее изобретение относится соответственно к фармацевтической композиции, включающей эффективное для ингибирования АПФ и/или НЭП количество соединения формулы I в смеси или в контакте каким-либо иным образом с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "С1-С4-алкил", как он использован в данном описании, относится к насыщенной прямой или разветвленной одновалентной углеводородной цепи из одного, двух, трех или четырех атомов углерода и включает метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил и подобные. Термин "С1-С10-алкил" относится к насыщенной прямой или разветвленной одновалентной углеводородной цепи из одного-десяти атомов углерода и включает метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, изопентил, гексил, 2,3-диметил-2-бутил, гептил, 2,2-диметил-3-пентил, 2-метил-2-гексил, октил, 4-метил-3-гептил и подобные.
Термин "арил", как он использован в данном описании, относится к фенильной или нафтильной группе, незамещенной или замещенной одним-тремя заместителями, выбранными из группы, состоящей из метилендиокси, гидрокси, С1-С4-алкокси, фтора и хлора. Включенный в объем настоящего изобретения термин "арил(С1-С4-алкил)" представляет собой фенилметил (бензил), фенилэтил, п-метоксибензил, п-фторбензил и п-хлорбензил.
Термин "С1-С4-алкокси", как он использован в данном описании, относится к одновалентному заместителю, который состоит из прямой или разветвленной алкильной цепи, имеющей от одного до 4 атомов углерода, связанных через атом кислорода простой эфирной группы, и имеющей свободную валентную связь у кислорода простой эфирной группы, и включает метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси и подобные.
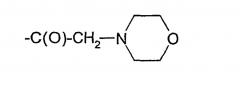
Термин "гетероцикл", как он использован в данном описании, означает любую группу с замкнутым кольцом, в которой один или более атомов кольца представляют элемент, отличный от углерода, и включает, но не ограничивается ими, пиперидинил, пиридинил, изоксазолил, тетрагидрофуранил, пирролидинил, морфолинил, пиперазинил, бензимидазолил, тиазолил, тиенил, фуранил, индолил, 1,3-бензодиоксолил, тетрагидропиранил, имидазолил, тетрагидротиенил, пиранил, диоксанил, пирролил, пиримидинил, пиразинил, тиазинил, оксазолил, пуринил, хинолинил и изохинолинил.
Термин "галоген" или "Hal", как он использован в данном описании, относится к члену семейства фтора, хлора, брома или йода.
Термин "арильная группа", как он использован в данном описании, относится к алифатическим и ароматическим ацильным группам и к тем, которые получают из гетероциклических соединений. Например, ацильная группа может быть низшей или (С1-С4)алканоильной группой, такой как формил или ацетил, ароильной группой, такой как бензоил, или гетероциклической ацильной группой, включающей один или более гетероатомов O, N и S, такой как группа
Термин "стереоизомер", как он использован в данном описании, является общим термином, используемым для всех изомеров индивидуальных молекул, которые отличаются только ориентацией их атомов в пространстве. Термин "стереоизомер" включает изомеры зеркального отображения (энантиомеры), геометрические (цис/транс или E/Z) изомеры и изомеры соединений с более чем одним хиральным центром, которые не являются зеркальными отображениями друг друга.
Обозначения "R" и "S", как они использованы в данном описании, являются общепринятыми в органической химии для обозначения специфической конфигурации хирального центра. Термин "R" (rectus - правый) относится к конфигурации хирального центра с расположением порядка групп (от самого высокого ко второму самому низкому) по часовой стрелке, если смотреть вдоль связи по направлению к группе самого низкого порядка. Термин "S" (sinister - левый) относится к конфигурации хирального центра с расположением порядка групп (от самого высокого ко второму самому низкому) против часовой стрелки, если смотреть вдоль связи по направлению к группе самого низкого порядка. Порядок групп основан на правилах последовательности, по которым присвоение приоритета основывается, прежде всего, на атомном числе (по порядку понижения атомного числа). Список и обсуждение приоритетов имеются в книге Stereochemistry of Organic Compounds, Ernest L. Eliel, Samuel H. Wilen and Lewis N. Mander, editors, Wiley-Interscience, John Wiley & Sons, Inc., New York, 1994.
В дополнение к системе (R)-(S) в данном описании может также использоваться более старая система D-L для обозначения абсолютной конфигурации, в особенности по отношению к аминокислотам. В этой системе проекционная формула Фишера ориентирована так, чтобы углерод номер 1 основной цепи был наверху. Приставку "D" используют для представления абсолютной конфигурации изомера, в котором функциональная (определяющая) группа находится справа от углерода в хиральном центре, а "L" для изомера, в котором она находится слева.
Термин "лечение", как он использован в данном описании, означает, но не ограничивается этим, любое лечение, облегчающее симптомы, устраняющее этиологию симптомов или на временной, или на постоянной основе, или предотвращающее или замедляющее проявление симптомов и развитие указанного заболевания, расстройства или состояния.
Термин "пациент", как он описан в данном описании, относится к теплокровному животному, такому как млекопитающее, которое поражено определенным заболеванием, расстройством или состоянием. Совершенно понятно, что морские свинки, собаки, кошки, крысы, мыши, лошади, домашний скот, овцы и люди являются примерами животных в объеме значения термина.
Термин "фармацевтически приемлемая соль", как он использован в данном описании, предназначен для применения к любой соли, будь она выше известной или открытой в будущем, которая используется опытным специалистом в данной области и которая является нетоксичной органической или неорганической аддитивной солью, которая пригодна для применения в качестве фармацевтического агента. Примеры оснований, которые образуют подходящие соли, включают гидроксиды щелочных и щелочноземельных металлов, такие как гидроксиды натрия, калия, кальция или магния; аммиак и алифатические, циклические или ароматические амины, такие как метиламин, диметиламин, триэтиламин, диэтиламин, изопропилдиэтиламин, пиридин и пиколин. Примеры кислот, которые образуют подходящие соли, включают неорганические кислоты, такие как, например, хлористоводородная, бромистоводородная, серная, фосфорная и подобные, и органические кислоты, такие как, например, уксусная, пропионовая, гликолевая, молочная, пировиноградная, малоновая, янтарная, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, гидроксималеиновая и дигидроксималеиновая, бензойная, фенилуксусная, 4-аминобензойная, 4-гидроксибензойная, антранилиновая, коричная, салициловая, 4-аминосалициловая, 2-феноксибензойная, 2-ацетоксибензойная, миндальная и подобные, и органические сульфокислоты, такие как метансульфоновая и п-толуолсульфоновая кислоты.
Термин "фармацевтический носитель", как он использован в данном описании, относится к известным фармацевтическим эксципиентам, используемым для приготовления фармацевтически активных соединений для введения, которые являются практически нетоксичными и не вызывающими чувствительность в условиях применения. Точная пропорция таких эксципиентов определяется растворимостью и химическими свойствами активного соединения, выбранным способом введения, а также обычной фармацевтической практикой.
ХИМИЧЕСКИЕ СИНТЕЗЫ
Соединения согласно настоящему изобретению могут быть получены следующим образом.
Трициклическая группа соединений формулы I может быть получена при использовании хорошо известных и доступных рядовым специалистам методик и методов. Патент США 5430145 описывает примеры подходящих методик, и содержание которого включено в данное описание в качестве ссылки. Одна из таких методик, показанная на схеме А, описана ниже.
СХЕМА А
На стадии а подходящее производное блокированного фталимидом (S)-фенилаланина структуры 2 может быть получено реакцией подходящего производного (S)-фенилаланина структуры 1 с фталевым ангидридом в подходящем апротонном растворителе, таком как диметилформамид.
На стадии b подходящее производное блокированного фталимидом (S)-фенилаланина структуры 2 может быть превращено в соответствующий хлорангидрид кислоты с последующим взаимодействием с подходящим метиловым эфиром аминокислоты структуры 3 по реакции сочетания. Например, подходящее производное блокированного фталимидом (S)-фенилаланина структуры 2 может реагировать с оксалилхлоридом в подходящем апротонном растворителе, таком как метиленхлорид. Образовавшийся хлорангидрид кислоты может затем сочетаться с подходящим метиловым эфиром аминокислоты структуры 3 при использовании подходящего основания, такого как N-метилморфолин, в подходящем апротонном растворителе, таком как диметилформамид, давая соответствующее производное метилового эфира 1-оксо-3-фенилпропиламинокислоты структуры 4.
На стадии с гидроксиметиленовая функциональная группа соответствующего производного метилового эфира 1-оксо-3-фенилпропиламинокислоты структуры 4 может быть окислена в соответствующий альдегид структуры 5 с помощью хорошо известных и принятых в практике методик окисления. Например, гидроксиметиленовая функциональная группа соответствующего производного метилового эфира 1-оксо-3-фенилпропиламинокислоты структуры 4 может быть окислена в соответствующий альдегид структуры 5 посредством окисления по Сверну с использованием оксалилхлорида и диметилсульфоксида в подходящем апротонном растворителе, таком как метиленхлорид.
На стадии d соответствующий альдегид структуры 5 может быть циклизован в соответствующий енамин структуры 6 путем кислотного катализа. Например, соответствующий альдегид структуры 5 может быть циклизован в соответствующий енамин структуры 6 обработкой трифторуксусной кислотой в подходящем апротонном растворителе, таком как метиленхлорид.
На стадии е подходящий енамин структуры 6 может быть превращен в соответствующее трициклическое соединение структуры 7 по катализируемой кислотой реакции Фриделя-Крафтса. Например, подходящий енамин структуры 6 может быть превращен в соответствующее трициклическое соединение структуры 7 обработкой смесью трифторметансульфоновой кислоты и трифторуксусного ангидрида в подходящем апротонном растворителе, таком как метиленхлорид.
На стадии е по условиям разработки может быть необходимо переэтерифицировать карбоксильную функциональную группу. Например, для получения соответствующего дифенилметилового эфира может быть использована обработка сырого продукта бромдифенилметаном в подходящем апротонном растворителе, таком как диметилформамид, вместе с ненуклеофильным основанием, таким как карбонат цезия.
На стадии f фталимидная защитная группа соответствующего трициклического соединения структуры 7 может быть удалена с использованием методов и методик, хорошо известных в данной области техники. Например, фталимидная защитная группа соответствующего трициклического соединения структуры 7 может быть удалена с использованием моногидрата гидразина в подходящем протонном растворителе, таком как метанол, что дает соответствующее аминосоединение структуры 8.
На стадии g может быть получено соответствующее (S)-ацетатное соединение структуры 10 реакцией соответствующего аминосоединения структуры 8 с соответствующим (S)-ацетатом структуры 9. Например, соответствующее аминосоединение структуры 8 может быть введено в реакцию с соответствующим (S)-ацетатным соединением структуры 9 в присутствии агента сочетания, такого как EEDQ (1-этоксикарбонил-2-этокси-1,2-дигидрохинолин), DCC (1,3-дициклогексилкарбодиимид) или диэтилцианофосфонат, в подходящем апротонном растворителе, таком как метиленхлорид, с получением соответствующего (S)-ацетоксисоединения структуры 10.
На стадии h (S)-ацетатная функциональная группа соответствующего амидного соединения структуры 10 может быть гидролизована в соответствующий (S)-спирт структуры 11 основанием, таким как гидроксид лития, в подходящей смеси растворителей, таких как тетрагидрофуран и этанол.
На стадии i (S)-спиртовая функциональная группа соответствующего амидного соединения структуры 1а может быть превращена в соответствующий (R)-тиоацетат или (R)-тиобензоат структуры 12а. Например, соответствующий (S)-спирт структуры 11а может быть обработан тиоуксусной кислотой по реакции Mitsunobu с использованием трифенилфосфина и DIAD (диизопропилазодикарбоксилата) в подходящем апротонном растворителе, таком как тетрагидрофуран.
На стадии j (S)-спиртовая функциональная группа соответствующего амидного соединения структуры 11a может быть превращена в соответствующий (R)-спирт структуры 11b. Например, соответствующий (S)-спирт структуры 11а может быть обработан уксусной кислотой по реакции Mitsunobu с использованием трифенилфосфина и DIAD в подходящем апротонном растворителе, таком как тетрагидрофуран. Полученный (R)-ацетат может быть затем гидролизован подходящим основанием, таким как гидроксид лития.
На стадии k (R)-спиртовая функциональная группа соответствующего амидного соединения структуры 11b может быть превращена в соответствующий (S)-тиоацетат или (S)-тиобензоат структуры 12b. Например, соответствующий (R)-спирт структуры 11b может быть обработан тиолуксусной кислотой по реакции Mitsunobu с использованием трифенилфосфина и DIAD в подходящем апротонном растворителе, таком как тетрагидрофуран.
Как суммировано в таблице 1, группы R1 и R2 соединений структур 12а и 12b могут быть заменены с использованием хорошо известных и доступных рядовым специалистам методов и методик, для получения соответствующих соединений структур 13а-14а и 13b-14b.
Например, дифенилметиловая эфирная функциональная группа соответствующего соединения структуры 12а может быть удалена с использованием трифторуксусной кислоты, давая соответствующее соединение карбоновой кислоты структуры 13а. Аналогично, дифенилметиловая эфирная функциональная группа соответствующего соединения структуры 12b может быть удалена с использованием трифторуксусной кислоты, давая соответствующее соединение карбоновой кислоты структуры 13b.
(R)-тиоацетатная или (R)-тиобензоатная функциональная группа соответствующего соединения структуры 13а может быть удалена гидроксидом лития в подходящей смеси растворителей, таких как тетрагидрофуран и этанол, давая соответствующее (R)-тиосоединение структуры 14а. Аналогично, (S)-тиоацетатная или (S)-тиобензоатная функциональная группа соответствующего соединения структуры 13b может быть удалена гидроксидом лития в подходящей смеси растворителей, таких как тетрагидрофуран и этанол, давая соответствующее (S)-тиосоединение структуры 14b.
| Таблица 1 | ||
| замена групп R1 и R2 | ||
| Соединение | R1 | R2 |
| 13а и 13b | COCH3 или COPh | H |
| 14a и 14b | H | H |
Хотя общие методики, представленные на схеме А, показывают получение соединений формулы I, в которой группа -COOR2 имеет (S)-конфигурацию, соединения формулы I, в которой группа -COOR2 имеет (R)-конфигурацию, могут быть получены по аналогичным методикам заменой метилового эфира (S)-аминокислоты структуры 3 на стадии b соответствующим метиловым эфиром (R)-аминокислоты.
Исходные материалы для использования в общих методиках синтеза, представленных на схеме А, являются легко доступными для среднего специалиста в данной области. Например, некоторые (R)- и (S)-карбоксиацетатные или бензоатные исходные материалы структуры 9 могут быть получены стереоизбирательным восстановлением соответствующих пируватных соединений альпинборанами, как описано в J.Org.Chem. 47, 1606 (1982), J.Org.Chem. 49, 1316 (1984) и J.Am.Chem.Soc. 106, 1531 (1984), с последующей обработкой полученного спирта уксусным ангидридом или ангидридом бензойной кислоты для получения соответствующих (R)- или (S)-карбоксиацетатных или бензоатных соединений структуры 9.
Альтернативно, некоторые трициклические соединения структуры 7 могут быть получены так, как описано в Заявке на Европейский патент ЕР 249223А.
Настоящее изобретение относится к способу получения соединения приведенной выше формулы I, включающему:
реакцию соединения формулы II
где R2, X, B1 и B2 являются такими, как определено выше, и Hal представляет галоген,
с соединением формулы R1SH, где R1 является таким, как определено выше, в присутствии основания, такого как карбонат щелочного металла.
Настоящее изобретение относится далее к способу получения соединения формулы II, включающему реакцию соединения формулы III
где R2, X, B1 и B2 являются такими, как определено выше,
с соединением формулы IV
где Hal представляет галоген.
Альтернативный способ получения соединения формулы I согласно настоящему изобретению включает реакцию соединения формулы III
где R2, X, B1 и B2 являются такими, как определено выше,
с соединением формулы V
где R1 является таким, как определено выше.
В последнем способе соответствующее аминосоединение формулы III может реагировать с соответствующим (S)- или (R)-тиоацетатом формулы V, давая, соответственно, соответствующий (S)- или (R)-тиоацетат формулы I, как описано выше для схемы А, стадия g.
Схема В предлагает другую общую методику синтеза соединений формулы I.
СХЕМА В
R1 представляет СОСН3, COPh,
Х представляет О, S, NH или (CH2)n
N равно 0 или 1.
На стадии а подходящее аминосоединение структуры 28, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1, реагирует с соответствующей (R)-бромкислотой структуры 33, давая соответствующее (R)-бромамидное соединение структуры 34, в которой Х представляет О, S, NH или (CH2)n, где n равно 0 или 1, в условиях, подобных тем, которые были описаны выше для схемы А, стадия g.
Альтернативно, подходящее аминосоединение структуры 28, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1, реагирует с соответствующей (S)-бромкислотой, давая соответствующий (S)-бромамид, где Х представляет О, S, NH или (CH2)n, где n равно 0 или 1, или подходящее аминосоединение структуры 28, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1, реагирует с соответствующей энантиомерной смесью бромкислот, давая соответствующую диастереомерную смесь бромамида, где Х представляет О, S, NH или (CH2)n, где n равно 0 или 1, как описано выше для схемы А, стадия g.
На стадии b (R)-бромфункциональную группу соответствующего (R)-бромамидного соединения структуры 34, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1, превращают в соответствующий (S)-тиоацетат или (S)-тиобензоат структуры 36, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1.
Альтернативно, (S)-бромфункциональную группу соответствующего (S)-бромамида, где X представляет О, S, NH или (CH2)n, где n равно 0 или 1, превращают в соответствующий (R)-тиоацетат или (R)-тиобензоат, где X представляет О, S, NH или (CH2)n, где n равно 0 или 1.
Например, подходящее (R)-бромамидное соединение структуры 34, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1, реагирует с тиолуксусной кислотой или тиолбензойной кислотой структуры 35 в присутствии основания, такого как карбонат цезия или натрия. Реагенты обычно контактируют в подходящем органическом растворителе, таком как смесь диметилформамида и тетрагидрофурана. Реагенты обычно перемешивают вместе при комнатной температуре в течение периода времени в интервале от 1 до 8 часов. Полученный (S)-тиоацетат или (S)-тиобензоат структуры 36, в которой X представляет О, S, NH или (CH2)n, где n равно 0 или 1, выделяют из реакционной зоны методами экстракции, которые известны в данной области. Он может быть очищен хроматографией.
Альтернативно, бромфункциональную группу подходящей диастереомерной смеси бромамидов, описанных выше, где X представляет О, S, NH или (CH2)n, где n равно 0 или 1, превращают в соответствующую диастереомерную смесь тиоацетатных или тиобензоатных соединений, где X представляет О, S, NH или (CH2)n, где n равно 0 или 1.
Хотя схема В предложена для получения соединений формулы I, в которой трициклическая группа имеет 4-карбоксифункциональную группу (S)-конфигурации, когда, например, Х представляет -СН2, соединения формулы I, в которой карбоксифункциональная группа имеет (R)-конфигурацию, могут быть получены заменой соответствующего аминосоединения структуры 28 (4R)-карбоксиаминосоединением, получение которого описано на схеме А.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие примеры представляют типичные синтезы, описанные на схеме В. Понятно, что данные примеры являются только иллюстративными и не предназначены каким-либо образом ограничить объем настоящего изобретения. Как использовано в данном описании, следующие обозначения имеют следующие значения: "г" означает граммы, "ммоль" означает миллимоли, "мл" означает миллилитры, "°С" означает градусы по Цельсию.
ПРИМЕР 1
Получение (R)-2-бром-3-метилбутаноевой кислоты (структура 33)
К охлажденному раствору D-валина (12,7 г, 100 ммоль) в 100 мл 2,5н серной кислоты и 49% HBr (33 г, 200 ммоль) при -10°С добавляли нитрит натрия (6,90 г, 100 ммоль) в 50 мл воды в течение 30 минут. Перемешивание в интервале температур между -5°С и -10°С продолжали дополнительно в течение 3 часов. Реакционную смесь экстрагировали метиленхлоридом (2×150 мл), сушили над MgSO4 и концентрировали, получая светло-желтое масло (9,7 г, 50%, 53,6 ммоль).
ПРИМЕР 2
Получение дифенилметилового эфира [4S-[4α,7α(S),12bβ]]-7-[[2(S)-ацетилтио-3-метил-1-оксобутил]амино]-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазептн-4-карбоновой кислоты
Схема В, стадия а: дифенилметиловый эфир [4S-[4α,7α(S),12bβ]]-7-[[2(S)-бром-3-метил-1-оксобутил]амино]-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазепин-4-карбоновой кислоты
(R)-2-Бром-3-метилбутаноевую кислоту (900 мг, 5,0 ммоль) и дифенилметиловый эфир [4S-[4α,7α(S),12bβ]]-7-(амино)-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазепин-4-карбоновой кислоты (1,76 г, 4,0 ммоль) растворяли в сухом метиленхлориде (5 мл) и обрабатывали EDC (1,0 г, 5,0 ммоль) при 25°С в течение 2 часов. Через 18 часов оставались только следы дифенилметилового эфира [4S-[4α,7α(S),12bβ]]-7-(амино)-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазепин-4-карбоновой кислоты. Смесь разбавляли метиленхлоридом (75 мл), промывали 10% хлористоводородной кислотой и насыщенным гидрокарбонатом натрия. Затем смесь сушили (MgSO4), концентрировали в вакууме и очищали флэш-хроматографией, получая указанное в заголовке соединение (C33H35N2O4Br) (2,4 г, 4,0 ммоль).
Схема В, стадия b: дифенилметиловый эфир [4S-[4α,7α(S),12bβ]]-7-[[2(S)-ацетилтио-3-метил-1-оксобутил]амино]-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазепин-4-карбоновой кислоты
Тиолуксусную кислоту (456 мг, 6,0 моль) и карбонат цезия (325,8 мг, 3,0 ммоль) растворяли в метаноле (5 мл) в атмосфере азота и упаривали досуха. К смеси добавляли упаренный продукт со стадии а (4,0 ммоль), растворенный в 5 мл сухого диметилформамида, с последующим перемешиванием в атмосфере азота в течение 2 часов. Смесь распределяли между этилацетатом (100 мл) и рассолом, промывали 10% хлористоводородной кислотой и насыщенным гидрокарбонатом натрия, сушили (MgSO4), фильтровали и концентрировали, получая сырой продукт (2,2 г) в виде светло-желтой пены. Продукт растворяли в метиленхлориде и очищали хроматографией (25% этилацетат/гексан) на 200 мл диоксида кремния, используя 20% этилацетат. Фракции объединяли и концентрировали, получая указанное в заголовке эфирное соединение (2,15 г).
ПРИМЕР 3
Получение [4S-[4α,7α(S),12bβ]]-7-[[2(S)-ацетилтио-3-метил-1-оксобутил]амино]-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазепин-4-карбоновой кислоты
Сырой продукт, полученный в примере 2 (3,5 ммоль), растворяли в метиленхлориде (6,0 мл) и анизоле (1,0 мл), охлаждали до -50°С и обрабатывали трифторуксусной кислотой (6,0 мл). Смеси давали нагреться до 25°С и перемешивали в течение 2 часов, концентрировали в вакууме и очищали хроматографией (1:1 этилацетат/гексан плюс 1% уксусной кислоты), получая указанное в заголовке соединение
Молекулярная масса = 432,54
Молекулярная формула = С22H28N2O5S
Данные 1Н- и 13С-ЯМР для MDL107688 (ДМСО-d6, 300K, нумерация не в соответствии с номенклатурой IUPAC):
| Положение | 13С (м.д.) | 1Н (м.д.) |
| 1 | 171,79 | - |
| 1-СООН | - | 12,07 |
| 2 | 50,53 | 4,99 м |
| 3 | 24,98 | 2,21 м, 1,69 м |
| 4 | 16,93 | 1,67 м, 1,67 м |
| 5 | 24,69 | 2,38 м, 1,92 м |
| 6 | 49,78 | 5,60 |
| 7 | 171,37 | - |
| 8 | 48,10 | 5,60 |
| 9 | 35,60 | 3,22 дд, 2,97 дд |
| 10 | 136,72 | - |
| 11 | 136,89 | - |
| 12 | 124,83 | 7,19 д |
| 13 | 125,21 | 7,08 т |
| 14 | 126,67 | 7,13 т |
| 15 | 130,10 | 7,07 д |
| 16 | - | 8,33 д |
| 17 | 169,11 | - |
| 18 | 53,82 | 4,12 д |
| 19 | 30,69 | 2,14 м |
| 20* | 20,18 | 0,99 д |
| 21* | 19,29 | 0,94 д |
| 24 | 194,36 | - |
| 25 | 30,34 | 2,36 с |
| *: нет четкого различия между положениями 20 и 21 |
ПРИМЕР 4
Получение [4S-[4α,7α(S),12bβ]]-7-[[3-метил-1-оксо-2(S)-тиобутил]амино]-1,2,3,4,6,7,8,12b-октагидро-6-оксопиридо[2,1a][2]бензазепин-4-карбоновой кислоты
Продукт, полученный в примере 3 (75 мг, 0,17 ммоль) растворяли в 1,0 мл дегазированного метанола в атмосфере азота и обрабатывали гидроксидом лития (0,4 мл 1 н. раствора). После перемешивания при 25°С в течение 1,5 часов раствор концентрировали в вакууме, разбавляли водой (2 мл) и подкисляли хлористоводородной кислотой (0,5 мл 1 н. раствора). Полученный продукт фильтровали и сушили в вакууме, получая указанное в заголовке соединение в виде белого твердого вещества (55 мг, 0,14 ммоль, 83%).
Молекулярная масса = 390,50
Молекулярная формула = С20H26N2O4S
Данные 1Н- и 13С-ЯМР для MDL108048 (ДМСО-d6, 300K, нумерация не в соответствии с номенклатурой IUPAC):
| Положение | δ(13С) | м(13С) | δ(1Н) | nJCH |
| 1 | 171,86 | с | - | 1,68 |
| 2 | 50,63 | д | 4,98 | 5,60, 1,68 |
| 3 | 25,04 | т | 2,23, 1,68 | 4,98, 1,65 |
| 4 | 17,00 | т | 1,65 | 4,98, 1,91, 1,68, (5,60) |
| 5 | 24,77 | т | 2,38, 1,91 | 5,60, 1,65 |
| 6 | 49,95 | д | 5,60 | 7,19, 4,98, 1,91 |
| 7 | 171,55 | с | - | 5,63, 3,25, 2,97 |
| 8 | 47,89 | д | 5,632 | 3,25, 2,97 |
| 9 | 36,05 | т | 3,25, 2,97 | 7,07, 5,63 |
| 10 | 136,86* | с | - | 3,25, 2,97, 5,63, 7,19 |
| 11 | 138,82* | с | - | 5,63, 7,08, 3,25, 2,97 |
| 12 | 124,87 | д | 7,185 | 7,13, 5,60, (3,25), (2,97) |
| 13 | 125,31 | д | 7,084 | 7,07, (3,25), (2,97) |
| 14 | 126,70 | д | 7,127 | 7,19 |
| 15 | 130,11 | д | 7,073 | 7,08, 3,25, 2,97 |
| 16 | NH | - | 8,30 | 5,63 |
| 17 | 171,29 | с | - | 8,30, 3,33, 1,94 |
| 18 | 48,85 | д | 3,326 | 1,94, 0,98, 0,94 |
| 19 | 32,46 | д | 1,936 | 3,33, 0,99, 0,94 |
| 20 | 19,32 | кв | 0,987 | 0,94, 1,94, 3,33 |
| 21 | 20,58 | кв | 0,944 | 0,99, 1,94, 3,33 |
| *: нет четкого различия между положениями 20 и 21 |
Соединения согласно настоящему изобретению могут быть использованы для лечения теплокровных животных или млекопитающих, включая мышей, крыс и людей, страдающих от болезненных состояний, таких как, но не ограниченных ими, гипертония, застойная сердечная недостаточность, сердечная гипертрофия, почечная недостаточность и/или цирроз.
Эффективным ингибирующим АПФ и НЭП количеством соединения формулы I является количество, которое эффективно для ингибирования АПФ и НЭП, которое дает, например, гипотензивный эффект.
Эффективная ингибирующая АПФ и НЭП доза соединения формулы I может быть легко определена при использовании обычных методов и при наблюдении результатов, полученных в аналогичных обстоятельствах. При определении эффективной дозы принимают во внимание ряд факторов, включающих, но не ограниченных ими, вид животного, размеры животного, возраст и общее состояние здоровья, конкретное заболевание, степень развития или тяжесть заболевания, реакцию индивидуального пациента, конкретное вводимое соединение, выбранный режим дозировки и применение сопутствующего лечения.
Эффективное ингибирующее и АПФ, и НЭП количество соединения формулы I должно обычно варьироваться от примерно 0,01 мг на килограмм массы тела в день (мг/кг/день) до примерно 20 мг/кг/день. Предпочтительной является суточная доза от примерно 0,1 мг/кг до примерно 10 мг/кг.
Для эффективного лечения пациента соединения формулы I могут вводиться в любых формах и любыми способами, которые делают соединение биологически доступным в эффективных количествах, включая пероральный и парентеральный способы. Например, соединение можно вводить перорально, подкожно, внутримышечно, внутривенно, трансдермально, назально, ректально, и подобным образом. Обычно предпочтительным является пероральное введение. Опытный специалист в области приготовления препаративных форм может легко выбрать приемлемые форму и способ введения в зависимости от болезненного состояния, которое следует лечить, стадии заболевания и других принимаемых в рассмотрение обстоятельств.
ПРЕПАРАТИВНЫЕ ФОРМЫ
Соединения формулы I могут быть введены в виде фармацевтических композиций или лекарственных средств, которые получены объединением соединений формулы I с фармацевтически приемлемыми носителями или эксципиентами, доля и природа которых определяются выбранным способом введения и обычной фармацевтической практикой.
Настоящее изобретение относится к фармацевтическим композициям, включающим эффективное количество соединения формулы I в смеси или связанных иным образом с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
Фармацевтические композиции или лекарственные средства готовят хорошо из