Способы лечения ревматических заболеваний с применением растворимого ctla4
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтическим композициям и способам лечения аутоиммунных заболеваний, ревматических заболеваний, иммунных расстройств, связанных с отторжением трансплантата, посредством введения субъекту мутантных молекул растворимого CTLA4. Их можно вводить совместно или последовательно со вторым агентом, который выбирают из группы, состоящей из кортикостероида, нестероидного противовоспалительного препарата, азатиоприна, метотрексата, блокатора или антагониста TNFα, гидроксихлорокина, сульфасалазина, соли золота, анакинры, циклофосфамида и лефлуномида. При этом молекула CTLA4, показанная на Фиг.23, содержит мутацию в положении +104 CTLA4, где лейцин замещен глутаминовой кислотой, и мутацию в положении +29 CTLA4, где аланин замещен на тирозин. Молекула CTLA4 может содержать внеклеточный домен и иметь последовательность, показанную на Фиг.19, начинающуюся с метионина в положении +1 или с аланина в положении -1 и заканчивающуюся аспарагиновой кислотой в положении +124. При этом молекула CTLA4 может представлять собой L104EA29YIg, начиная с метионина в положении +1 или с аланина в положении -1 и кончая лизином в положении +357, как показано на Фиг.19. Изобретение обеспечивает блокирование иммунного взаимодействия между Т- и В-клетками и предупреждение активации В-клеток за счет связывания молекулы В7 с помощью молекул указанного CTLA4, мутации в которых приводят к положительным изменениям авидности связывания с В7. 6 н. и 25 з.п. ф-лы, 2 табл., 33 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится в целом к области ревматических заболеваний. В частности, изобретение относится к методам терапии ревматических заболеваний и композициям, предназначенным для лечения ревматических заболеваний, таких как ревматоидный артрит, путем введения субъекту эффективного количества растворимого мутантного CTLA4.
Предпосылки создания изобретения
В настоящее время не существует методов лечения ревматических заболеваний. Терапевтические агенты применяются скорее для лечения симптомов. Как правило, терапевтические агенты принимают в течение длительного времени, и терапевтическое значение часто снижается из-за побочных эффектов.
Ревматические заболевания охватывают группу заболеваний, которые поражают скелетно-мышечные и соединительные ткани организма. Эти заболевания характеризуются хроническим воспалением, которое часто ведет к длительному поражению, деформации, атрофии тканей и к потери ими трудоспособности. Ревматические заболевания поражают связки, костные ткани, мягкие ткани или спинной мозг (Mathies, H. 1983, Rheuma) и делятся на ревматический артрит, дегенеративный ревматизм, суставной ревматизм или коллагеноз. Известно, что некоторые ревматические заболевания представляют собой аутоиммунные заболевания, вызываемые изменением иммунной реакции субъекта.
Ревматоидный артрит является прогрессирующим ревматическим заболеванием, поражающим 2% взрослого населения развитых стран (Utsinger, P.D., et al., 1985, Rheumatoid Arthritis, p.140). Это заболевание характеризуется стойким синовитом, который вызывает разрушение хряща и эрозию костей, ведущие к структурной деформации периферических суставов. Симптомы, обусловленные ревматоидным артритом, включают набухание суставов, хрупкость суставов, воспаление, утреннюю тугоподвижность суставов и боль, в особенности, при сгибании. Больные в стадии прогрессирующего артрита страдают структурными поражениями, включая разрушение суставов с эрозией костей (в "Principals of Internal Medicine", Harrison, 13th edition, pages 1648-1655). Кроме того, больные могут иметь другие клинические симптомы различных органических патологических изменений, включая патологические изменения кожи, почек, сердца, легких, центральной нервной системы и глаз вследствие васкулита, вызванного аутоиммунным процессом.
Другие симптомы, которые коррелируют с ревматоидным артритом, включают повышенную скорость оседания эритроцитов и повышенные уровни сывороточного С-реактивного белка (CRP) и/или растворимого рецептора IL-2 (IL-2r). Скорость оседания эритроцитов повышена почти у всех больных активным ревматоидным артритом. Уровень сывороточного С-реактивного белка также повышен и коррелирует с активностью заболевания и вероятностью прогрессирующего поражения суставов. Кроме того, в сыворотке крови и синовиальной жидкости больных активным ревматоидным артритом повышается уровень растворимого IL-2r, продукта активированных Т-клеток (см. "Principals of Internal Medicine", Harrison, 13th edition, pages 1650).
Полагают, что ревматоидный артрит является аутоиммунным заболеванием, опосредуемым Т-клетками, включая межмолекулярные взаимодействия между Т-лимфоцитами и антигенпрезентирующими клетками. Как правило, величина Т-клеточного ответа определяется костимулирующим ответом, выявляемым с помощью взаимодействия между молекулами Т-клеточной поверхности и их лигандами (Mueller, et al., 1989, Ann. Rev. Immunol. 7:445-480). Ключевые костимулирующие сигналы вызываются взаимодействием между рецепторами Т-клеточной поверхности, CD28 и CTLA4, и их лигандами, такими как молекулы, родственные В7, CD80 (т.е. В7-1) и CD86 (т.е. В7-2), на антигенпрезентирующих клетках (Linsley, P. and Ledbetter, J. 1993 Ann. Rev. Immunol. 11:191-212). Активация Т-клеток в отсутствие костимуляции вызывает анергический Т-клеточный ответ (Schwartz, R.H., 1992, Cell, 71:1065-1068), при этом иммунная система становится толерантной к стимуляции.
Так как полагают, что ревматоидный артрит является опосредуемым Т-клетками заболеванием иммунной системы, единственной стратегией создания новых агентов для терапии ревматоидного артрита является идентификация молекул, которые блокируют костимулирующие сигналы между Т-лимфоцитами и антиген презентирующими клетками, блокируя взаимодействие между эндогенным CD28 или CTLA4 и В7. Потенциальные молекулы включают молекулы растворимого CTLA4, которые модифицированы так, чтобы связываться с В7 с более высокой авидностью, чем CTLA4 дикого типа (последовательность которого показана на Фигуре 23), или CD28, тем самым блокируя костимулирующие сигналы.
Растворимые формы CD28 и CTLA4 созданы путем слияния вариабельных (V) внеклеточных областей CD28 и CTLA4 с константными областями иммуноглобулина (Ig), при этом образуются CD28Ig и CTLA4Ig. Нуклеотидная аминокислотная последовательность CTLA4Ig показана на Фигуре 24, причем белок начинается с метионина в положении +1 или аланина в положении -1 и оканчивается лизином в положении +357. CTLA4Ig связывается с CD80-позитивными и CD86-позитивными клетками более прочно, чем CD28Ig (Linsley, P., et al., 1994, Immunity 1:793-800). Найдено, что многие Т-клеточные иммунные реакции блокируются CTLA4Ig как in vitro, так и in vivo. (Linsley, P., et al., 1991b, см. выше; Linsley, P., et al., 1992a, Science 257:792-795; Linsley, P., et al., 1992b, J. Exp. Med. 176:1595-1604; Lenschow, D.J., et al. 1992, Science 257:789-792; Tan, P., et al., 1992, J. Exp. Med. 177:165-173; Turka, L.A., 1992, Proc. Natl. Acad. Sci. USA, 89:11102-11105).
С целью изменения аффинности связывания с природными лигандами, такими как В7, слитые молекулы растворимого CTLA4Ig модифицируют с помощью мутации аминокислот на участке CTLA4 молекулы. Области CTLA4, которые, мутируя, изменяют аффинность или авидность связывания с лигандами В7, включают гипервариабельный участок 1 (CDR-1, как описано в патентах США 6090914; 5773253; 5844095; в одновременно рассматриваемой патентной заявке США 60/214065; и в Peach et al., 1994, J. Exp. Med., 180:2049-2058) и участки, подобные гипервариабельному участку 3 (CDR-3) (CDR-3 представляет собой консервативный участок внеклеточной области CTLA4, как описано в патентах США 6090914; 5773253; 5844095; в одновременно рассматриваемой патентной заявке США 60/214065; и в Peach et al., 1994, J. Exp. Med., 180:2049-2058. CDR-3-подобный участок охватывает участок CDR-3 и продолжается, включая несколько аминокислот, в 3'-5' направлении и/или в 5'-3' направлении от мотива CDR-3). CDR-3- подобный участок включает гексапептидный мотив MYPPPY, являющийся высококонсервативным у всех представителей семейства CD28 и CTLA4. Мутагенез со сканированием аланина с помощью гексапептидного мотива в CTLA4 и в избранных остатках в CD28Ig уменьшает или сводит на нет связывание с CD80 (Peach, R.J., et al., 1994, J. Exp. Med., 180:2049-2058).
Молекулы растворимого CTLA4Ig дополнительно модифицируют с помощью чередования гомологичных участков CTLA4 и CD28. Эти химерные CTLA4/CD28 гомологичные мутантные молекулы идентифицировали гексапептидный мотив MYPPPY, общий для CTLA4 и CD28, так же как некоторые неконсервативные аминокислотные остатки CDR-1- и CDR-3-подобных участков CTLA4, как участки, ответственные за увеличение авидности связывания CTLA4 с CD28 (Peach, R.J., et al., 1994, J. Exp. Med., 180:2049-2058).
Молекулы растворимого CTLA4, так же как CTLA4Ig, молекулы мутантного CTLA4, или химерные CTLA4/CD28 гомологичные мутантные молекулы, описанные выше, вводят новую группу терапевтических лекарственных препаратов для лечения ревматических заболеваний.
Современная терапия ревматических заболеваний, таких как ревматоидный артрит, включает применение неспецифических цитотоксических иммунодепрессантов, таких как метотрексат, циклофосфамид, азатиоприн, циклоспорин А и блокаторы или антагонисты фактора альфа некроза опухолевых клеток (TNFα). Эти иммунодепрессанты подавляют общую иммунную систему субъекта, и продолжительное их применение повышает риск инфицирования. Кроме того, эти лекарственные препараты лишь замедляют развитие ревматоидного артрита, которое возобновляется с повышенной скоростью после прекращения лечения. Далее, продолжительное лечение этими неспецифическими препаратами вызывает вредные побочные эффекты, включая тенденцию к злокачественному развитию, почечной недостаточности, ослаблению костного мозга, пневмосклерозу, злокачественности, диабету и нарушению функции печени. Эти лекарственные препараты также постепенно теряют эффективность после 2-5 лет применения (Kelley's Textbook of Rheumatology, 6th Edition, pages 1001-1022).
Или же терапевтические агенты, которые являются неспецифическими иммунодепрессантами и противовоспалительными лекарственными средствами, применяли для ослабления симптомов. Эти лекарственные препараты зависят от дозы и не предотвращают развитие болезни. Эти препараты включают стероидные соединения, такие как преднизон и метилпреднизолон. Стероидные соединения также вызывают значительные побочные эффекты, связанные с длительностью их применения (Kelley's Textbook of Rheumatology, 6th Edition, pages 829-833).
Таким образом, современные методы лечения ревматоидного артрита имеют ограниченную эффективность, дают значительные побочные эффекты и не могут применяться непрерывно в течение длительного времени.
Следовательно, существует необходимость в эффективных и более мощных терапевтических средствах, лишенных недостатков обычных методов и агентов и нацеленных на патофизиологический механизм аутоиммунитета, для лечения ревматических заболеваний, таких как ревматоидный артрит.
Сущность изобретения
Данное изобретение включает композиции и способы лечения ревматических заболеваний путем введения субъекту молекул растворимого CTLA4, которые связываются с молекулами В7 на поверхности В7-позитивных клеток, тем самым ингибируя связывание эндогенных В7 молекул с CTLA4 и/или CD28 на поверхности Т-клеток. Молекулы растворимого CTLA4, используемого в способах и композициях по изобретению, включают:
а) молекулу CTLA4, которая содержит внеклеточный домен и имеет мутацию в положении +104 CTLA4, где лейцин в положении +104 замещен глутаминовой кислотой, и мутацию в положении +29 CTLA4, где аланин в положении +29 замещен на тирозин;
б) молекулу, которая представляет собой L104EA29YIg, начиная с метионина в положении +1 или с аланина в положении -1 и кончая лизином в положении +357, растворимый CTLA4 применяют совместно или последовательно со вторым агентом, который выбирают из группы, состоящей из кортикостероида, нестероидного противовоспалительного препарата, азатиоприна, метотрексата, блокатора или антагониста TNFα, гидроксихлорокина, сульфасалазина, соли золота, анакинры, циклофосфамида и лефлуномида.
Ревматическое заболевание выбирают из ревматоидного артрита, полимиозита, склеродермии, смешанной соединительнотканной болезни, воспалительного ревматизма, дегенеративного ревматизма, внесуставного ревматизма, коллагеноза, хронического полиартрита, артропатического псориаза, анкилозирующего спондилоартрита, ювенильного ревматоидного артрита, нодозного полиартрита, системной красной волчанки, прогрессирующего системного склероза, плечелопаточного периартрита, подагры, хондрокальциноза, дерматомиозита, мышечного ревматизма, миозита и миогелеза.
При применении способов и фармацевтических композиций в соответствии с изобретением симптом, ассоциированный с ревматическим заболеванием, ослабляется, при этом симптом выбирают из группы, состоящей из опухания суставов, боли, слабости, утренней тугоподвижности, структурного нарушения, повышенного уровня сывороточного С-реактивного белка, повышенного уровня растворимого уровня IL-2r, повышенного уровня растворимого ICAM-1, повышенного уровня растворимого Е-селектина и повышенной скорости оседания эритроцитов.
Структурное поражение при использовании изобретения уменьшается или предупреждается.
Субъекту вводят растворимый CTLA4 в количестве 0,5-100 мг/кг веса субъекта, предпочтительно 0,5-10 мг/кг веса.
Предпочтительным является, когда второй агент представляет собой метотрексат.
Растворимый CTLA4 вводят внутривенной инфузией (вливанием) в дни 1, 15, 29 и 57.
Краткое описание фигур
Фигура 1А: Демографические данные контингента больных. Демографические данные, включающие пол, расу и длительность заболевания, как описано ниже, в Примере 3.
Фигура 1В: Демографические данные контингента больных. Демографические данные, включающие пол, возраст и интенсивность заболевания по оценке пациента и врача, как описано ниже, в Примере 3.
Фигура 1С: Демографические данные контингента больных, описанного ниже, в Примере 3. Демографические данные, включающие интенсивность заболевания, скорость оседания эритроцитов (ESR, СОЭ), физическую функцию (потеря трудоспособности, оцениваемая с помощью анкеты) и С-реактивный белок (CRP, ЦРБ).
Фигура 1D: Демографические данные контингента больных, описанного ниже, в Примере 3. Демографические данные, включающие опухание суставов, болезненность суставов, утреннюю тугоподвижность и боль.
Фигура 1Е: Демографические данные контингента больных, описанного ниже, в Примере 3. Демографические данные, включающие предыдущее лечение.
Фигура 2: Краткие сведения о случаях прекращения (лечения) на 85 день по причине, описанной ниже, в Примере 3.
Фигура 3А: Реакции ACR на 85 день, описанные ниже, в Примере 3: Реакции ACR-20, -50 и -70.
Фигура 3В: Реакции ACR-20 на 85 день, включая реакцию на плацебо, как описано ниже, в Примере 3: реакция ACR-20 с 95%-ным доверительным пределом.
Фигура 3С: Реакции ACR-20 на 85 день, как описано ниже, в Примере 3: расхождение реакций ACR-20 с 95%-ными доверительными интервалами.
Фигура 4А: Подсчет основных (20% улучшение) клинических реакций в опухшем и болезненном суставе в процентах пациентов на 85-ый день, как описано ниже, в Примере 3: основная клиническая реакция, ACR-20.
Фигура 4В: Подсчет основных (20% улучшение) клинических реакций опухшего и болезненного сустава в процентах пациентов на 85-ый день, как описано ниже, в Примере 3: изменение клинической реакции, улучшение в процентах.
Фигура 5А: Болезненная реакция (по шкале Ликерта (Likert), среднее отклонение от базовой линии) в процентах пациентов на 85-ый день, как описано ниже, в Примере 3: величина изменения болевых ощущений по сравнению с базовой линией-фоном.
Фигура 5В: Изменение течения болезни в целом по оценке пациента (среднее отклонение от фона по шкале Ликерта) в процентах пациентов на 85-ый день, как описано ниже, в Примере 3: общие изменения интенсивности заболевания у больного.
Фигура 5С: Изменение течения болезни в целом по оценке врача общие изменения интенсивности заболевания по оценке врача.
Фигура 5D: Боль (среднее отклонение от фона по шкале Ликерта) в процентах пациентов на 85-ый день, как описано ниже, в Примере 3: изменение боли по сравнению с фоном (базовой линией).
Фигура 6А: Общая оценка больным изменения интенсивности заболевания по сравнению с фоном по 2-балльной системе на 85-ый день, как описано ниже, в Примере 3: улучшение в ходе болезни.
Фигура 7А: Снижение уровней С-реактивного белка (CRP, ЦРБ) в процентах на 85-ый день, как описано ниже, в Примере 3: уменьшение уровней ЦРБ по сравнению с фоном.
Фигура 7В: Расхождение величин уменьшения уровней С-реактивного белка (ЦРБ) на 85-ый день, как описано ниже, в Примере 3: уменьшение расхождения уровней ЦРБ в процентах с 95%-ными доверительными интервалами.
Фигура 7С: Среднее понижение уровней С-реактивного белка (ЦРБ) на 85-ый день, как описано ниже, в Примере 3: среднее изменение по сравнению с фоном (базовой линией).
Фигура 8: Понижение уровней растворимого рецептора IL-2, среднее изменение по сравнению с базовой линией на 85-ый день, как описано ниже, в Примере 3.
Фигура 9А: Действие CTLA4Ig на болезненные суставы во времени, как описано ниже, в Примере 3: среднее отклонение (медиана) от базовой линии.
Фигура 9В: Действие CTLA4Ig на болезненные суставы во времени, как описано ниже, в Примере 3: среднее отклонение от базовой линии.
Фигура 10А: Действие CTLA4Ig на опухшие суставы во времени, как описано ниже, в Примере 3: среднее отклонение (медиана) от базовой линии.
Фигура 10В: Действие CTLA4Ig на опухшие суставы во времени, как описано ниже, в Примере 3: среднее отклонение от базовой линии.
Фигура 11: Влияние CTLA4Ig на среднее изменение во времени оценки боли по сравнению с базовой линией, как описано ниже, в Примере 3.
Фигура 12А: Влияние CTLA4Ig на оценку пациентом среднего изменения во времени интенсивности заболевания, по сравнению с базовой линией, как описано ниже, в Примере 3.
Фигура 12В: Влияние CTLA4Ig на оценку врачом среднего изменения во времени интенсивности заболевания, по сравнению с базовой линией, как описано ниже, в Примере 3.
Фигура 13А: Действие L104EA29YIg на болезненные суставы во времени, как описано ниже, в Примере 3: среднее отклонение (медиана) от базовой линии.
Фигура 13В: Действие L104EA29YIg на болезненные суставы во времени, как описано ниже, в Примере 3: среднее отклонение от базовой линии.
Фигура 14А: Действие L104EA29YIg на опухшие суставы во времени, как описано ниже, в Примере 3: среднее отклонение (медиана) от базовой линии.
Фигура 14В: Действие L104EA29YIg на опухшие суставы во времени, как описано ниже, в Примере 3: среднее отклонение от базовой линии.
Фигура 15: Влияние L104EA29YIg на среднее изменение во времени оценки боли по сравнению с базовой линией, как описано ниже, в Примере 3.
Фигура 16А: Влияние L104EA29YIg на оценку пациентом среднего изменения интенсивности заболевания во времени, по сравнению с базовой линией, как описано ниже, в Примере 3.
Фигура 16В: Влияние L104EA29YIg на оценку врачом среднего изменения интенсивности заболевания во времени, по сравнению с базовой линией, как описано ниже, в Примере 3.
Фигура 17: Улучшение в процентах состояния больного с нарушением трудоспособности по сравнению с базовой линией, по оценке Анкеты состояния здоровья (HAQ) на 85 день при лечении CTLA4Ig и L104EA29YIg, как описано ниже, в Примере 3.
Фигура 18: Нуклеотидная и аминокислотная последовательность L104EIg, описанного ниже, в Примере 1.
Фигура 19: Нуклеотидная и аминокислотная последовательность L104EA29YIg, описанного ниже, в Примере 1.
Фигура 20: Нуклеотидная и аминокислотная последовательность L104EA29LIg, описанного ниже, в Примере 1.
Фигура 21: Нуклеотидная и аминокислотная последовательность L104EA29TIg, описанного ниже, в Примере 1.
Фигура 22: Нуклеотидная и аминокислотная последовательность L104EA29WIg, описанного ниже, в Примере 1.
Фигура 23: Нуклеотидная и аминокислотная последовательность рецептора CTLA4.
Фигура 24: Нуклеотидная и аминокислотная последовательность CTLA4Ig.
Фигура 25: CTLA4Ig (дорожка 1), L104EIg (дорожка 2) и L104EA29YIg (дорожка 3) на SDS геле (Фиг.25А); и хроматограммы CTLA4Ig (Фиг.25В) и L104EA29YIg (хроматография по размеру молекул).
Фигуры 26 (левый и правый рисунки): Ленточная диаграмма внеклеточной IgV-складки CTLA4, построенная при разрешении структуры, определенной методом ЯМР-спектроскопии.
На Фиг.26 (правый рисунок) дан (в увеличенном масштабе) вид участка CDR-1 (S25-R33) и участка MYPPPY, показывающий расположение и ориентацию боковой цепи мутаций, повышающих авидность, L104 и А29.
Фигуры 27А и 27В: анализы методом FACS, показывающие связывание L104EA29YIg, L104EIg и CTLA4Ig с человеческими CD80-или CD86-трансфецированными СНО-клетками, как описано ниже, в Примере 2.
Фигуры 28А и 28В: Диаграммы, показывающие ингибирование пролиферации CD80-позитивных и СD86-позитивных СНО-клеток, как описано ниже, в Примере 2.
Фигуры 29А и 29В: Диаграмма, показывающая, что L104EA29YIg более эффективно ингибирует пролиферацию первичных и вторичных аллостимулированных Т-клеток, чем CTLA4Ig, как описано ниже, в Примере 2.
Фигуры 30А-С: Диаграммы, иллюстрирующие, что L104EA29YIg более эффективно, чем CTLA4Ig, ингибирует продуцирование цитокинов - IL-2 (Фиг.30А), IL-4 (Фиг.30В) и гамма (γ)-интерферона (Фиг.30С) - аллостимулированных человеческих Т-клеток, как описано ниже, в Примере 2.
Фигура 31: Диаграмма, показывающая, что L104EA29YIg более эффективно ингибирует пролиферацию фитогемагглютинин (РНА)-стимулированных Т-клеток, чем CTLA4Ig, как описано ниже, в Примере 2.
Фигура 32: Диаграмма, иллюстрирующая анализ равновесного связывания L104EA29YIg, L104EIg и CTLA4Ig дикого типа с CD86Ig.
Фигуры 33А и В: Уменьшение среднего изменения уровней растворимого ICAM-1 и растворимого Е-селектина по сравнению с базовой линией на 85 день, как описано ниже, в Примере 3.
Подробное описание изобретения
Определения
Все научные и технические термины, применяемые в данной заявке, имеют значение, обычно используемое в технике, если не указано иначе. Следующие слова и выражения, применяемые в данной заявке, имеют нижеуказанные значения.
Применяемый в данном описании термин "лиганд" относится к молекуле, которая специфически распознает другую молекулу и связывается с ней, например лигандом для CTLA4 является молекула В7.
Применяемый в данном описании "CTLA4 дикого типа", или "немутированный (немутантный) CTLA4" имеет природную аминокислотную последовательность, полноразмерный CTLA4, показанную на Фигуре 23 (а также описанную в патентах США 5434131, 5844095, 5851795), или ее любой фрагмент или производное, которые распознают В7 и связываются с ним, или влияют на В7 так, что блокируется связывание с CD28 и/или CTLA4 (например, эндогенный CD28 и/или CTLA4). В конкретных вариантах изобретения внеклеточная область CTLA4 дикого типа начинается с метионина в положении +1 и заканчивается аспарагиновой кислотой в положении +124, или внеклеточная область CTLA4 дикого типа начинается с аланина в положении -1 и заканчивается аспарагиновой кислотой в положении +124. CTLA4 дикого типа представляет собой белок клеточной поверхности, содержащий N-концевой внеклеточный домен, трансмембранный домен и С-концевой цитоплазматический домен. Внеклеточный домен связывается с молекулами-мишенями, такими как молекула В7. В клетке природный белок, CTLA4 дикого типа, транслируется в виде незрелого полипептида, который включает сигнальный пептид на N-концевом участке. Незрелый полипептид претерпевает посттрансляционное процессирование, которое включает отщепление и удаление сигнального пептида с образованием продукта расщепления CTLA4, имеющего вновь образованный N-концевой участок, который отличается от N-концевого участка незрелой формы. Специалист в данной области техники поймет, что может происходить дополнительное пост-трансляционное процессирование, при котором удаляется одна или более аминокислот из вновь образованного N-концевого участка продукта расщепления CTLA4. Или же сигнальный пептид может удаляться не полностью, при этом образуются молекулы, которые начинаются до обычной стартовой аминокислоты - метионина. Так, молекула зрелого белка CTLA4 включает внеклеточный домен или любой его участок, который связывается с В7.
Применяемое в данном описании выражение "молекула мутантного CTLA4", "мутантная молекула CTLA4" обозначает CTLA4 дикого типа, как показано на Фигуре 23, или любой ее участок или производное, которое содержит мутацию или ряд мутаций (предпочтительно, во внеклеточном домене CTLA4 дикого типа). Молекула мутантного CTLA4 имеет последовательность, аналогичную, но не идентичную, последовательности молекулы CTLA4 дикого типа, но все еще связывающуюся с В7. Мутации могут включать один или более аминокислотных остатков, замещенных аминокислотой, имеющей консервативную (например, замена лейцина на изолейцин) или неконсервативную (например, замена глицина на триптофан) структуру или химические свойства, аминокислотные делеции, добавления, сдвиги рамки считывания или усечения. Молекулы мутантного CTLA4 могут содержать в себе молекулу не-CTLA4 или могут быть с ней связаны. Мутантные молекулы могут быть растворимыми (т.е. циркулирующими) или связанными с клеточной поверхностью. Дополнительные молекулы мутантного CTLA4 включают такие молекулы, которые описаны в патентных заявках США №№09/865321; 60/214065 и 60/287576; и в патентах США 6090914; 5844095 и 5773253; и Peach, R.J., et al., в J. Exp. Med., 180:2049-2058 (1994). Молекулы мутантного CTLA4 можно получать синтетическим путем или методом рекомбинантной ДНК.
"CTLA4Ig" представляет собой слитый белок, содержащий внеклеточный домен CTLA4 дикого типа, соединенный с Ig-хвостом, или его частью, которая связывается с В7. Конкретный вариант изобретения содержит внеклеточный домен CTLA4 дикого типа (как показано на Фигуре 23), начиная с метионина в положении +1 и кончая аспарагиновой кислотой в положении +124; или начиная с аланина в положении -1 и заканчивая аспарагиновой кислотой в положении +124; участок соединения - глутаминовый аминокислотный остаток в положении +125; и иммуноглобулиновый участок, охватывающий область от глутаминовой кислоты в положении +126 до лизина в положении +357 включительно (ДНК, кодирующая CTLA4Ig, депонирована 31 мая 1991 года в Американской коллекции типовых культур (культур клеток (АТСС), 10801 University Blvd., Manassas, VA 20110-2209, согласно условиям Будапештского соглашения, и ей присвоен номер АТСС 68629; Linsley, P., et al, 1994, Immunity 1:793-80). CTLA4Ig-24, клеточная линия яичников китайского хомячка (СНО), экспрессирующая CTLA4Ig, депонирована 31 мая 1991 года, идентификационный номер в АТСС CRL-10762). Молекулы растворимого CTLA4Ig, применяемого в способах и/или наборах по изобретению, могут включать или могут не включать сигнальную (лидерную) пептидную последовательность. Как правило, в способах и/или наборах по изобретению молекулы не включают сигнальную пептидную последовательность.
"L104EA29YIg" обозначает слитый белок, который представляет собой растворимый мутантный CTLA4, молекула которого содержит внеклеточный домен CTLA4 дикого типа с аминокислотными заменами A29Y (аминокислотная замена остатка аланина на остаток тирозина в положении +124) и L104E (замена остатка лейцина на остаток глутаминовой кислоты в положении +104) или часть его, которая связывается с молекулой В7, соединенная с Ig-хвостом (включенная в Фигуру 19; ДНК, кодирующая L104EA29YIg, депонирована 20 июня 2000 года с номером АТСС РТА-2104; одновременно рассматривается в патентных заявках США 09/579927; 60/287576 и 60/214065, вводимых в данное описание в качестве ссылки). Молекулы растворимого L104EA29YIg, в способах и/или наборах по изобретению, могут включать или могут не включать сигнальную (лидерную) пептидную последовательность. Как правило, в способах и/или наборах по изобретению молекулы не включают сигнальную пептидную последовательность.
Применяемый в данном описании термин "растворимый" относится к любой молекуле, или к ее фрагментам, или к ее производным, не связанным с клеткой или не присоединенным к клетке, т.е. циркулирующим. Например, CTLA4, В7 или CD28 можно сделать растворимыми, присоединяя иммуноглобулиновый (Ig) фрагмент к внеклеточному домену CTLA4, В7 или CD28, соответственно. Или же такое соединение, как CTLA4, можно сделать растворимым, удаляя из его молекулы трансмембранный домен. Как правило, растворимые молекулы в способах по изобретению не включают сигнальную (или лидерную) последовательность.
Применяемое в данном описании выражение "молекулы растворимого CTLA4" обозначает не связанные с клеточной поверхностью (т.е. циркулирующие)молекулы CTLA4 или любой функциональный участок молекулы CTLA4, который связывается с В7, включая, но без ограничения: слитые белки CTLA4Ig (например, АТСС 68629), в которых внеклеточный домен CTLA4 слит с фрагментом иммуноглобулина (Ig), что делает слитую молекулу растворимой, или их фрагменты или производные; белки с внеклеточным доменом CTLA4, слитые или связанные с участком биологически активного или химически активного белка, такие как Е-7 генный продукт вируса папилломы (CTLA4-E7), ассоциированный с меланомой антиген р97 (CTLA4-p97), или белок ВИЧ env (CTLA4-env gp120), или их фрагменты или производные; гибридные (химерные) слитые белки, такие как CD28/CTLA4Ig, или их фрагменты или производные; молекулы CTLA4, у которых удален трансмембранный домен, чтобы сделать белок растворимым (Oaks, M.K., et а1., 2000, Cellular Immunology, 201:144-153), или их фрагменты или производные. "Молекулы растворимого CTLA4" также включают их фрагменты, участки или производные и молекулы растворимого мутантного CTLA4, обладающие СТLА4-связывающей активностью. Молекулы растворимого CTLA4, применяемые в способах по изобретению, могут включать или могут не включать сигнальную (лидерную) пептидную последовательность. Как правило, молекулы в способах по изобретению не включают сигнальную (или лидерную) последовательность.
Применяемое в данном описании выражение "внеклеточный домен CTLA4" обозначает участок CTLA4, который распознает лиганды CTLA4, такие как молекулы В7, и связывается с ними. Например, внеклеточный домен CTLA4 содержит область от метионина в положении +1 до аспарагиновой кислоты +124 (Фигура 23). Или же внеклеточный домен CTLA4 содержит область от аланина в положении -1 до аспарагиновой кислоты в положении +124 (Фигура 23). Внеклеточный домен включает фрагменты или производные CTLA4, которые связываются с молекулой В7. Внеклеточный домен CTLA4, как показано на Фигуре 23, может также включать мутации, которые изменяют авидность связывания молекулы CTLA4 с молекулой В7.
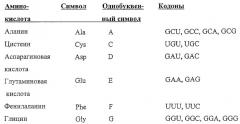
Применяемый в данном описании термин "мутация" обозначает изменение в нуклеотидной или аминокислотной последовательности в молекуле дикого типа, например изменение в ДНК и/или аминокислотных последовательностях внеклеточного домена CTLA4 дикого типа. Мутация в ДНК может изменять кодон, приводящий к изменению аминокислотной последовательности. Изменение ДНК может включать замены, делеции, инсерции, альтернативный сплайсинг или усечения. Аминокислотное изменение может включать замены, делеции, инсерции, добавления, усечения или ошибки при процессинге (процессировании) или расщеплении белка. Или же мутации в нуклеотидной последовательности могут приводить к молчащей мутации в аминокислотной последовательности, что достаточно понятно из уровня техники. Следует обратить внимание, что определенные нуклеотидные кодоны кодируют одну и ту же аминокислоту.
Примеры включают нуклеотидные кодоны CGU, CGG, CGC и CGA, кодирующие аминокислоту аргинин (R); или кодоны GAU и GAC, кодирующие аминокислоту-аспарагиновую кислоту (D). Следовательно, белок может кодироваться молекулой одной или более аминокислот, которые отличаются своей специфической нуклеотидной последовательностью, но кодируют белковые молекулы, имеющие идентичные последовательности. Последовательности, кодирующие аминокислоты, суть следующие:
Мутантная молекула может содержать одну или более мутаций.
Применяемые в данном описании выражения "не-CTLA4 белковая последовательность" или "не-CTLA4 молекула" обозначают любую белковую молекулу, которая не связывается с В7 и не препятствует связыванию CTLA4 с этой мишенью. Пример включает, но без ограничения, константную область иммуноглобулина (Ig) или ее фрагмент. Предпочтительно, константная область иммуноглобулина представляет собой константную область Ig человека или обезьяны, например С(гамма)1, включая шарнирную, СН2 и СН3 области человеческого Ig. Константная область Ig может мутировать с ослаблением своих эффекторных функций (Патенты США 5637481; 5844095 и 5434131).
Применяемые в данном описании термины "фрагмент" или "участок" обозначают любую часть или сегмент молекулы CTLA4, предпочтительно, внеклеточный домен CTLA4 или его часть или сегмент, который распознает свою мишень, например, молекулу В7, и связывается с ней.
Применяемое в данном описании обозначение "В7" относится к семейству молекул В7, включая, но без ограничения, В7-1 (CD-80), B7-2 (CD-86) и В7-3, которые могут распознавать CTLA4 и/или CD28 и связываться с ними.
Применяемое в данном описании выражение "В7-позитивные клетки" обозначает любые клетки, экспрессирующие на клеточной поверхности молекулы В7 одного или более типов.
Применяемый в данном описании термин "производное" обозначает молекулу, которая имеет общую с молекулой-предшественником гомологию последовательности и активность. Например, производное CTLA4 включает молекулу растворимого CTLA4, имеющую аминокислотную последовательность, по меньшей мере, на 70% сходную с внеклеточным доменом CTLA4 дикого типа, которая распознает В7 и связывается с ним, например CTLA4Ig или L104EA29YIg, молекула мутантного CTLA4.
Применяемый в данном описании термин "блокировать" или "ингибировать" рецептор, сигнал или молекулу обозначает препятствовать активации рецептора, сигнала или молекулы, что обнаруживается с помощью общепризнанного в технике теста. Например, блокаду опосредуемого клетками иммунного ответа можно обнаружить, определяя ослабление симптомов, связанных с ревматическим заболеванием. Блокада (или ингибирование) может быть частичной или общей (тотальной).
Употребляемое в данном описании выражение "блокировать взаимодействие с В7" означает препятствовать связыванию В7 с его лигандами, такими как CD28 и/или CTLA4, тем самым мешать взаимодействию Т-клеток и В-позитивных клеток. Примеры агентов, которые блокируют В7-взаимодействия, включают, но без ограничения, молекулы, такие как антитело (или его фрагмент или производное), которое распознает любые из молекул CTLA4, CD28 и/или В7 (например, В7-1, B7-2); молекулы растворимой формы (или их часть или производное), например растворимого CTLA4; пептидный фрагмент или другую малую молекулу, предназначенную для того, чтобы препятствовать клеточному сигналу с помощью взаимодействия, опосредуемого CTLA4/CD28/B7. В предпочтительном варианте изобретения блокирующим агентом является молекула растворимого CTLA4, например CTLA4Ig (ATCC 68629) или L104EA29YIg (ATCC PTA-2104), молекула растворимого CD28, например CD28Ig (ATCC 68628), молекула растворимого В7, например B7Ig (ATCC 68627), моноклональное антитело против В7 (например, НВ-253, ATCC CRL-2223, ATCC CRL-2226, ATCC HB-301, ATCC HB-11341 и моноклональные антитела, описанные Anderson et al. в патенте США 6113898 или Yokochi et al., 1982. J. Immun., 128(2)823-827), моноклональное антитело против CTLA4 (например, ATCC HB-304 и моноклональные антитела, описанные в ссылках 82-83) и/или моноклональное антитело против CD28 (например, ATCC ИВ-11944 и моноклональное антитело, mAb 9.3, описанное Hansen (Hansen et al., 1980. Immunogenetics 10: 247-260) или Martin (Martin et al., 1984. J. Clin. Immun., 4(1): 18-22)).
Употребляемое в данном описании выражение "заболевание иммунной системы" обозначает любое заболевание, опосредуемое взаимодействием Т-клеток с В7-позитивными клетками, включая, но без ограничения, аутоиммунные заболевания, нарушения, связанные с трансплантацией, и иммунопролиферативные заболевания. Примеры заболеваний иммунной системы включают гомологическую болезнь (GVHD) (например, в результате пересадки костного мозга или при индукции толерантности), иммунные нарушения, вызванные отторжением трансплантата, хроническим отторжением и алло- и ксенотрансплантатов, включая плотные ткани (органы), кожу, островки, мышцы, гепатоциты, нейроны. Примеры иммунопролиферативных заболеваний включают, но без ограничения, псориаз, Т-клеточную лимфому, Т-клеточный острый лимфобластный лейкоз, тестикулярную ангиоцентрическую Т-клеточную лимфому, доброкачественный лимфоцитарный васкулит, волчанку (например, красную волчанку, волчаночный нефрит), тиреоидит Хашимото (Hashimoto), первичную микседему, болезнь Грейвса (базедову болезнь), злокачественную анемию, аутоиммунный атрофический гастрит, болезнь Аддисона, диабет (например, инсулинзависимый сахарный диабет, сахарный диабет типа I, сахарный диабет типа II), синдром Гудпасчера, тяжелую псевдопаралитическую миастению, пузырчатку, болезнь Крона, симпатическую офтальмию, аутоиммунный увеит, рассеянный склероз, аутоиммунную гемолитическую анемию, идиопатическую тромбоцитопению, первичный билиарный цирроз, хронический активный гепатит, язвенный колит, синдром Сегрена, ревматические заболевания (например, ревматоидный артрит), полимиозит, склеродерму и смешанную соединительнотканную болезнь.
Употребляемый в данном описании термин "ревматические заболевания" обозначает любое заболевание, которое действует на суставы, кости, мягкие ткани или спинной мозг (Mathies, H. 1983, Rheuma), и включает острый суставной ревматизм (ревматическую атаку), дегенеративный ревматизм, внесуставной ревматизм и коллагенозы. Помимо этого, ревматические заболевания включают, но без ограничения, хронический полиартрит, суставной псориаз, анкилозирующий спондилоартрит, ревматоидный артрит, нодозный полиартрит, системную красную волчанку, прогрессирующий системный склероз, плече-лопаточный периартрит, подагру, хондрокальциноз, дерматомиозит, фиброзит, миозиты и миогелез. Известно, что некоторые ревматические заболевания представляют собой аутоиммунные заболевания, вызываемые изменившейся иммунной реакцией субъекта.
Употребляемый в данном описании термин "генная терапия" обозначает процесс (способ) лечения заболевания с помощью такой генетической обработки, при которой нуклеотидная последовательность переносится в клетку, затем клетка экспрессирует какой-либо генетический продукт, кодируемый нуклеиновой кислотой. Например,