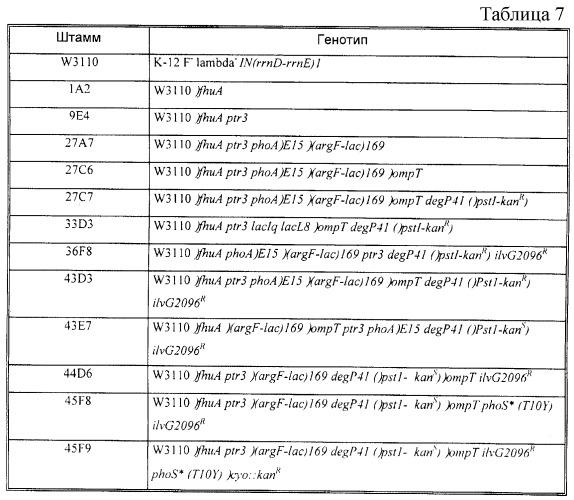
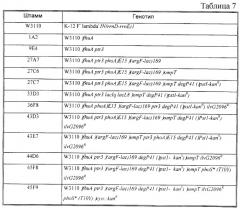
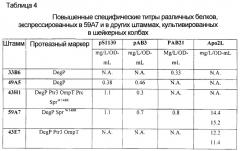
Бактерия е.coli, продуцирующая гетерологичный полипептид, и способ продуцирования полипептида
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой бактерию E.coli, которая является дефицитной по хромосомным генам degP и prc, кодирующим протеазы DegP и Prc соответственно, и имеет мутантный ген spr, который включает последовательность супрессора prc E.coli, с точковой мутацией в положении 148, что приводит к замене триптофана на аргинин в положении 148. Культивированием указанной бактерии получают гетерологичный полипептид. Заявленное изобретение позволяет получить гетерологичные полипептиды с высокой степенью эффективности. 2 н. и 21 з.п. ф-лы, 13 ил., 7 табл.
Реферат
Предпосылки создания изобретения
1. Область, к которой относится изобретение
Настоящее изобретение относится к использованию дефицитных по протеолизу бактериальных штаммов-хозяев. Более конкретно, настоящее изобретение относится к указанным штаммам-хозяевам, у которых предотвращено разложение гетерологичного полипептида и увеличен выход таких полипептидов.
2. Описание прототипов изобретения
Штаммы E.coli, дефицитные по протеазам или генам, контролирующим регуляцию протеаз, являются известными. См., например, заявку Beckwith & Strauch, WO 88/05821, опубликованную 11 августа 1988; Chaudhury & Smith, J.Bacteriol., 160: 788-791 (1984); Elish et al., J.Gen.Microbiol., 134:1355-1364 (1988); Baneyx & Georgiou, "Expression of proteolytically sensitive polypeptides in Esherichia coli", Stability of Protein Pharmaceuticals, Vol.3: Chemical and Physical Pathways of Protein Degradation, Ahern and Manning, eds. (Plenum Press, New York, 1992), p.69-108.
Некоторые из этих штаммов были использованы в целях эффективного продуцирования чувствительных к протеолизу белков, в частности белков, которые, возможно, имеют лекарственное или коммерческое значение. В патенте США № 5508192 (Georgiou et al.) описано конструирование дефицитных по множеству протеаз и/или дефицитных по белкам теплового шока бактериальных хозяев. Такими хозяевами являются бактерии, дефицитные по одной, двум, трем или четырем протеазам, и бактерии с одной протеазой, которые также несут мутацию в гене rpoH. Примерами описанных штаммов, дефицитных по протеазе, являются штаммы, у которых отсутствуют гены degP, ompT, ptr3 и/или prc(tsp), при этом сообщалось, что degP, rpoH-штамм продуцирует высокие титры рекомбинантных белков в E.coli. Park et al. Biotechnol. Prog., 15:164-167 (1999) также сообщали, что штамм (НМ114), дефицитный по двум протеазам клеточной оболочки (degP, prc), растет быстрее и продуцирует больше гибридных белков, чем другие штаммы, дефицитные по большему числу протеаз. Эти авторы заявили, что за 29 часов указанный штамм растет до плотности 47,86 г/л из расчета сухой массы клеток в условиях культивирования с подпиткой и с использованием рН-стата. Продуцированным белком был гибридный белок, А-β-лактамазная активность которого на 30% превышала β-лактамазную активность, наблюдаемую у его родительского штамма кS272.
Белок Prc был сначала выделен Hara et al., J. Bacteriol., 173:4799-4813 (1991) как периплазматическая протеаза, которая расщепляет карбокси-конец периплазматического белка 3, связывающегося с пенициллином (РВР3). Затем этот белок был также идентифицирован как протеаза, которая селективно разлагает белки с неполярным С-концом, и был переименован в Tsp (Silber et al., Proc. Natl. Acad. Sci. USA, 89:295-299 (1992)). Было показано, что ген prc кодирует белок размером 75 кДа, который необходим для защиты клеток от комбинированного теплового и осмотического шока (Hara et al., см. выше). Было подтверждено, что предпочтительность к субстрату определяется С-концевыми последовательностями (Keiler et al., Protein Sci. 4: 1507-1515 (1995)). Уровень протеолиза зависит от идентичности остатков или функциональных групп у С-конца белка-субстрата. Присутствие свободной δ-карбоксильной группы является важным фактором для определения эффективности расщепления близкородственных пептидов с неполярными С-концевыми последовательностями протеазой Prc.
Prc-гомологи были идентифицированы в дивергентной группе прокариотов, включая несколько цианобактерий (Brand et al., Plant Mol. Biol., 20: 481-491 (1992); Shestakov et al., J. Biol. Chem., 269:19354-19359 (1994)), Neisseria gonorrhoeae (Black et al., J. Bacteriol., 177:1952-1958 (1995)), Haemophilus influenzae (Fleischmann et al., Science, 269:496-512 (1995)) и Bartonella bacilliformis (GenBank, регистрационный номер L37094). Домен в белках семейства Prc аналогичен домену в белках, связывающихся с ретинолом, что указывает на присутствие общего домена укладки, который может образовывать "карман" связывания в этих белках для гидрофобных субстратов (Silber et al., см. выше; Shestakov et al., см. выше).
Hara и др. (см. выше) обнаружили, что терморезистентные ревертанты prc-мутантов содержат мутации экстрагенного супрессора (spr). Кроме того, они установили, что продукт гена spr дикого типа представляет собой липопротеин в оболочечной фракции. Они также высказали предположение, что ген spr дикого типа может кодировать фермент, гидролизующий пептидогликан (Hara et al., Microbiol Drug Resistance, 2:63-72 (1996)). Было установлено, что если ген spr не является функциональным в prc-плюс-окружении, то супрессором для spr-мутации является РВР7, другой связывающийся с пенициллином белок (Hara et al., см. выше). Клонирование spr и получение prc-мутанта, в котором Spr не разлагается под действием протеазы, было также описано Hara et al., в Abstract for Table Ronde Roussel Uclat no.86, Versailles, May 1997, где авторы пришли к заключению, что prc и spr являются супрессорами по отношению друг к другу.
Были также выделены три мультикопийных prc супрессора с использованием условно-летального фенотипа prc(tsp)-дефицитного штамма E.coli (Bass et al., J.Bacteriol., 178: 1154-1161 (1996)). Ни один из этих супрессоров не является родственным гену spr. Одна серия этих супрессоров представляет собой два предполагаемых тандемно расположенных гена протеазы, которые были картированы в локусе 72,5 min на хромосоме. Эти два гена являются гомологами htrA, кодирующими белки, которые на 58 и 35% идентичны соответственно сериновой протеазе HtrA (DegP). Другим типом идентифицированного супрессора является ген dksA (супрессор dnak), который также представляет собой многокопийный супрессор, дефицитный по генам теплового шока dank, dnaj и grpE. Ген dksA был также независимо выделен как многокопийный супрессор с мутацией mukB, которая необходима для хромосомного распределения. Третьим типом супрессора является ген усеченного липопротеина А (rlpA).
Очевидно, что ген degP регулирует синтез протеазы клеточной оболочки DegP (HtrA). degP-дефицитный мутант был впервые сконструирован Beckwith и Strauch (см. выше) и снова введен в хромосому E.coli. HtrA имеет большую молекулярную массу, составляющую примерно 500 кДа, и представляет собой белок теплового шока, протеолитическая активность которого играет важную роль в выживании E.coli при высоких температурах, таких как температуры выше 42°С (Skorko-Glonek et al., Gene, 163: 47-52 (1995)). Ряд обычно нестабильных белков клеточной оболочки может быть стабилизирован введением degP-мутации (Beckwith & Strauch, Proc.Natl. Acad. Sci., USA, 85:1676-1570 (1988)). Недавно сообщалось, что при наблюдении под электронным микроскопом и в химическом анализе на перекрестное связывание белок HtrA ведет себя как додекамер, состоящий из двух "стэков" гексамерных колец (Kim et al., J.Mol.Biol. 294: 1363-1374 (1999)). Развертывание молекул белковых субстратов, например, под действием высоких температур или посредством восстановления дисульфидных связей имеет важное значение для их проникновения во внутреннюю полость двойного кольцеобразного HtrA, где может происходить расщепление пептидных связей (Kim et al., см. выше).
Многие гетерологичные полипептиды были продуцированы в различных дефицитных по протеазам штаммах. Однако многие из этих штаммов дают относительно низкий титр продукта и/или имеют плохой рост. Поэтому необходимо получить такой дефицитный по протеазам штамм, который не продуцирует усеченного продукта и дает высокий титр этого продукта.
Краткое описание изобретения
Для достижения вышеуказанных целей было заявлено настоящее изобретение. В одном своем аспекте настоящее изобретение относится к штаммам E.coli, которые являются дефицитными по хромосомным генам degP и prc, кодирующим протеазы DegP и Prc, соответственно, и имеют или включают мутантный ген spr, продукт которого ингибирует рост штаммов, обнаруживающих фенотип, несущий prc-мутанты. Предпочтительно, чтобы этот штамм не был дефицитным по хромосомному гену ptr3, кодирующему протеазу III, и/или по хромосомному гену ompT, кодирующему протеазу OmpT. Предпочтительно этот штамм E.coli сконструируют путем введения мутантного гена spr в degPΔ-prcΔ-штамм для его выживания в стационарной фазе процесса ферментации E.coli при высокой клеточной плотности.
В другом варианте осуществления изобретения указанный штамм содержит нуклеиновую кислоту, кодирующую полипептид, гетерологичный для этого штамма, предпочтительно чувствительный к протеолизу полипептид, а более предпочтительно эукариотический полипептид.
В другом варианте своего осуществления настоящее изобретение относится к способу продуцирования гетерологичного полипептида, то есть полипептида, который является гетерологичным для этого штамма. Этот способ предусматривает сначала культивирование штамма E.coli, который является дефицитным по хромосомному гену prc, кодирующему протеазу Prc, и имеет или включает мутантный ген spr, продукт которого ингибирует рост штаммов, обнаруживающих фенотип, несущий prc-мутанты. Этот штамм также включает нуклеиновую кислоту, кодирующую указанный гетерологичный полипептид. Культивирование осуществляют так, чтобы оно приводило к экспрессии данной нуклеиновой кислоты. Во второй стадии этого способа указанный полипептид выделяют из этого штамма, либо из цитоплазмы, либо из периплазмы, либо из культуральной среды, предпочтительно из периплазмы или культуральной среды, а наиболее предпочтительно из цельного бульона для ферментации. Предпочтительно указанный полипептид представляет собой лиганд Аро2 или антитело, включая фрагмент антитела.
Краткое описание графического материала
На фигурах 1А-1Е представлены полная нуклеотидная последовательность и кодируемая аминокислотная последовательность (SEQ ID NO:1 и 2 соответственно) экспрессирующего кластера, используемого для получения рY0317, плазмиды для продуцирования анти-VEGF Fab. Остатки, обозначенные жирным шрифтом, означают CDR-остатки, происходящие от исходного мышиного антитела А.4.6.1. Остатки, обозначенные курсивом и подчеркнутые, означают каркасные мышиные остатки, которые необходимы для связывания с антигеном.
На фигурах 2А и 2В представлена карта плазмиды рY0317 (фиг. 2А), а также показано конструирование плазмиды рY0317tet20 (фиг. 2А и 2В).
На фигуре 3 представлена карта плазмиды рАРАро2-Р2RU.
На фигуре 4 представлена нуклеотидная последовательность кДНК человеческого лиганда Аро-2 (SEQ ID NO:3) и его аминокислотная последовательность (SEQ ID NO:4). "N" в положении нуклеотида 447 (в SEQ ID NO:3) указывает на то, что нуклеотидным основанием может быть "Т" или "G".
На фигуре 5 представлена диаграмма дериватизации штаммов E.coli 59А7, 49А5 и 43Н1.
На фигуре 6 показан двумерный гель как продукт ферментации клеточного осадка штамма 49А5 (prc-плюс-штамма), экспрессирующего гибрид анти-CD18 rhuFab'2-LZ в виде гетерологичного полипептида. Все LC-пятна обведены кружками.
На фигуре 7 показан двумерный гель как продукт ферментации клеточного осадка штамма 43Н1 (prc-минус-штамма), экспрессирующего гибрид анти-CD18 rhuFab'2-LZ в виде гетерологичного полипептида. В этом геле продукты LC-расщепления отсутствуют.
На фигуре 8 показано пять пиков, полученных в анализе с использованием АМЕ5ТМ/обращенно-фазовых колонок, и при этом показано сравнение распределения разделенных таким образом фрагментов антитела rhuFab'2-LZ(хCD18). По оси "у" отложена площадь под конкретными пиками, 1-5. На оси "х" показаны три штамма-продуцента rhuFab'2-LZ(хCD18): 43Н11 (prc-), 49А5 (prc+) и 58Н2 (prc-репарированный 43Н1). Жирно очерченный серый столбец соответствует LC-115, черный столбец соответствует LC, белый столбец соответствует LC-димеру, серый столбец с тонкой штриховкой соответствует Fab-подобной молекуле, а столбец с жирной штриховкой соответствует Fab'2-LZ. Из графика можно видеть, что пик 1 (LC-115) отсутствует в штамме с prc-делецией.
На фигуре 9 показаны профили роста, полученные при стандартной ферментации с высокой клеточной плотностью, prc-минус-штамма без мутантного гена spr (58В3, трансформированного рS1130) (квадраты), и prc-минус-штамма с мутантным геном spr (59А7, трансформированного рS1130) (ромбы), где указанные кривые выражают зависимость OD550 от времени ферментации (часы).
На фигуре 10 показана гуманизированная последовательность LC каппа-цепи антитела против CD18 (SEQ ID NO:5), при этом были вычислены значения pI предполагаемых продуктов разложения LC. Расщепления, отмеченные косой чертой, были подтверждены масс-спектрометрией. См. ниже таблицу 3.
На фигуре 11 показан гель с семью дорожками, полученный с использованием различных хозяев и трех типов белков. Этот гель показал, что LC-"клип" (продукт расщепления) размером 20 кД (LC 182) отсутствует в клетках штамма 43Н1 (prc-), экспрессирующего анти-VEGF Fab и гибридные молекулы Fab'2-LZ против тканевого фактора. Дорожка 1 соответствует фрагменту F(ab)'2-LZ 6хHis против тканевого фактора, штамм-хозяин 33В6; дорожка 2 соответствует фрагменту F(ab)'2-LZ 6хHis против тканевого фактора, штамм-хозяин 43Н1; дорожка 3 соответствует фрагменту анти-CD18 F(ab)'2-LZ 6хHis, штамм-хозяин 49А5; дорожка 4 соответствует фрагменту анти-CD18 F(ab)'2-LZ 6хHis, штамм-хозяин 41Н1; дорожка 5 соответствует рВR322, штамм-хозяин 49А5; дорожка 6 соответствует анти-VEGF Fab, штамм-хозяин 43Н1; и дорожка 7 соответствует анти-VEGF Fab, штамм-хозяин 43Е7. Обозначения НС и Н означают тяжелую цепь, а LC и L означают легкую цепь.
На фигуре 12 показан двумерный гель, полученный в шейкерной колбе для клеточного осадка штамма 59А7 (prc-минус-штамма), экспрессирующего анти-VEGF Fab (рY0317tet20) в виде гетерологичного полипептида. В этом геле продукты расщепления LC и два фрагмента расщепления НС, обнаруженные в prc-плюс-клетках, отсутствуют. Также показаны только два отдельных НС-"клипа" (фрагмента расщепления), детектированные в 59А7, которые представляют собой продукты расщепления либо OmpT, либо Рtr3.
На фигуре 13 показан двумерный гель, полученный в шейкерной колбе для клеточного осадка штамма 60С1 (prc-плюс-штамма), экспрессирующего анти-VEGF Fab (рY0317tet20) в виде гетерологичного полипептида. В этом геле было детектировано множество фрагментов расщепления LC и два фрагмента расщепления НС.
Подробное описание предпочтительных вариантов осуществления изобретения
Определения
Используемый здесь термин "полипептид" относится в основном к пептидам и к белкам, имеющим длину примерно в более чем десять аминокислот. "Гетерологичными" полипептидами считаются полипептиды, которые являются чужеродными для используемой клетки-хозяина, такие как человеческий белок, продуцируемый E.coli. Хотя указанный полипептид может быть прокариотическим или эукариотическим, однако предпочтительным является эукариотический полипептид, а более предпочтительным - полипептид млекопитающего.
Примерами полипептидов млекопитающих являются такие молекулы, как, например, ренин, гормон роста, включая человеческий гормон роста; бычий гормон роста; фактор высвобождения гормона роста; паратиреоидный гормон; тиреоидстимулирующий гормон; липопротеины; 1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин, тромбопоэтин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда; антикоагулянты, такие как Белок С; атриальный натрийуретический фактор; поверхностно-активное вещество на поверхности легких; активатор плазминогена, такой как урокиназа или активатор плазминогена человеческой мочи или тканевый активатор плазминогена (t-РА); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли -альфа и -бета; антитела против домена(ов) ЕrbB2, такие как 2С4 (WO 01/00245; гибридома АТСС НВ-12697), которые связываются с областью внеклеточного домена ЕrbB2 (например, любые один или несколько остатков в этой области примерно от остатка 22 до остатка 84 ЕrbB2 включительно), энкефалиназа; альбумин сыворотки, такой как альбумин сыворотки человека; фактор ингибирования мюллеровых протоков; А-цепь релаксина; В-цепь релаксина; прорелаксин; пептид, ассоциированный с мышиным гонадотропином; микробный белок, такой как бета-лактамаза; ДНКаза; ингибин; активин; васкулярный эндотелиальный фактор роста (VEGF); рецепторы для гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; нейротропный фактор, такой как нейротропный фактор головного мозга (BDNF), нейротропин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервной ткани, такой, как NGF; кардиотропины (фактор гипертрофии сердца), такие как кардиотропин-1 (СТ-1); тромбоцитпроизводный фактор роста (PDGF); фактор роста фибробластов, такой как α-FGF и β-FGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-1, TGF-2, TGF-3, TGF-4 или TGF-5; инсулиноподобный фактор роста -I и -II (IGF-1 и IGF-II); дес(1-3)-IGF-I (IGF-1 головного мозга); белки, связывающиеся с инсулиноподобным фактором роста; белки CD, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуцирующие факторы; иммунотоксины; белок морфогенеза кости (ВМР); интерферон, такой как интерферон-альфа, -бета и -гамма; альбумин сыворотки, такой как альбумин человеческой сыворотки (HSA) или альбумин бычьей сыворотки (BSA); колониестимулирующие факторы (CSF), например М-CSF, GM-CSF и G-CSF; интерлейкины (IL), например IL-1-IL-10; антитело против HER-2; лиганд Аро2; супероксиддисмутаза; Т-клеточные рецепторы; мембранные белки клеточной поверхности; фактор, ускоряющий распад; вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; "хоминг"-рецепторы; адрессины; регуляторные белки; антитела и фрагменты любого из перечисленных выше полипептидов.
Предпочтительными и представляющими интерес полипептидами являются такие полипептиды, как HSA, BSA, антитело против IgE, антитело против CD20, антитело против IgG, t-PA, gp120, антитело против CD11a, антитело против CD18, 2C4, антитело против VEGF, VEGF, TGF-бета, активин, ингибин, антитело против HER-2, ДНКаза, IGF-1, IGF-II, IGF-1 головного мозга, гормон роста; цепи релаксина, фактор высвобождения гормона роста; цепи инсулина или проинсулин, NGF, NT-3, BDNF, лиганд Аро2 и урокиназа. Особенно предпочтительными полипептидами млекопитающих являются антитела, включая полноразмерные антитела, фрагменты антител и лиганд Аро2. Более предпочтительными антителами являются человеческие или гуманизированные антитела. Такими антителами являются, например, анти-IgE, анти-IgG, анти-Her-2, анти-CD11а, анти-CD18, анти-CD20 и анти-VEGF антитела, антитело 2С4, BSA или HSA. Еще более предпочтительным является анти-CD18 антитело, анти-VEGF антитело, антитело против тканевого фактора, антитело 2С4, анти-Her-2 антитело, анти-CD20 антитело, анти-CD40 антитело или анти-CD11а антитело. Фрагментами антитела, входящими в определение полипептида, являются, например, Fab, Fab', Fab'2 или Fab'2-лейциновая молния (LZ), а наиболее предпочтительно такими фрагментами являются анти-CD18 Fab'2-LZ, Fab'2 против тканевого фактора-LZ-6хhis, анти-VEGF Fab, his-меченный анти-CD18 Fab'2-LZ и lys-меченный анти-CD18 Fab'2-LZ.
Термин "чувствительный к протеолизу", используемый здесь по отношению к полипептидам, относится к полипептидам, которые имеют предрасположенность к расщеплению, являются восприимчивыми к расщеплению или расщепляются одной или несколькими протеазами E.coli либо в нативном состоянии или во время секреции.
Ферментация или культивирование при "высокой плотности клеток" означает процесс, при котором обычно периодически добавляют сначала несколько микроэлементов для роста клеток, а затем для регуляции добавления глюкозы используют отношение между поглощением О2 и поглощением глюкозы, благодаря которому можно легко измерить уровень растворенного кислорода. Для достижения более высокой клеточной плотности можно непрерывно добавлять аммиак, а для поддержания клеточного роста на некоторых стадиях ферментации могут быть добавлены дополнительные микроэлементы (например, Р, К, S и Mg), как подробно описано в примерах, приведенных ниже.
Выражение "мутантный ген spr, продукт которого ингибирует рост штаммов, обнаруживающих фенотипы, несущие prc-мутанты", означает супрессор prc (spr) E.coli (кодирующий Prcsup), имеющий последовательность, описанную Hara et al., 1996 (см. выше), или супрессор, который является мутированным при условии, что указанный генный продукт функционирует как супрессор роста штаммов с фенотипом prc-мутантов. Предпочтительной мутацией является точковая мутация. Более предпочтительной является точковая мутация W148R, где кодон TGG заменен на CGG, что приводит к замене триптофана аргинином в положении аминокислоты 148.
Используемый здесь термин "антитело" имеет широкий смысл и конкретно означает интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные, по крайней мере, из двух интактных антител, и фрагменты антител при условии, что они обладают нужной биологической активностью.
Используемый здесь термин "моноклональное антитело" означает антитело, полученное из популяции в основном гомогенных антител, то есть отдельных антител, составляющих данную популяцию, которые являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются в высокой степени специфическими, то есть они направлены против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо своей специфичности моноклональные антитела имеют то преимущество, что они могут быть синтезированы без примеси других антител. Термин "моноклональный" указывает на характер антитела, полученного в основном из гомогенной популяции антител, и не должен обязательно указывать на какой-либо конкретный способ его получения. Так, например, моноклональные антитела, используемые в настоящем изобретении, могут быть получены с использованием гибридомной техники, впервые описанной Koehler et al., Nature, 256: 495 (1975), либо оно может быть получено методом рекомбинантных ДНК (см, например, патент США № 4816567). "Моноклональные антитела" могут быть также выделены из фаговых библиотек с использованием техники, описанной, например, Clackson et al. Nature, 352:624-628 (1991) и Marks et al., J. Mol.Biol, 222:581-597 (1991).
Конкретно описанные здесь моноклональные антитела считаются "химерными" антителами, если в них часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующей последовательности в антителах, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу антител, тогда как другая(ие) цепь(и) идентична(ы) или гомологична(ы) соответствующей последовательности в антителах, происходящих от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают нужной биологической активностью (патент США № 4816567; и Morrison et al., Proc.Natl. Acad. Sci., USA, 81:6851-6855 (1984)). Представляющими интерес химерными антителами являются "приматизированные" антитела, содержащие вариабельные последовательности антигенсвязывающего домена, происходящие от приматов, не являющихся человеком (например, низших узконосых обезьян, человекообразных обезьян и т.п.) и последовательности человеческой константной области.
"Фрагменты антитела" содержат часть интактного антитела, а предпочтительно его антигенсвязывающую или вариабельную область. Примерами фрагментов антитела являются Fab, Fab', F(ab')2 и Fv-фрагменты; диантитела, линейные антитела; одноцепочечные молекулы антитела и мультиспецифические антитела, образованные из фрагментов антитела.
"Интактным" антителом является антитело, которое содержит антиген-связывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, СН1, СН2 и СН3. Константными доменами могут быть константные домены нативной последовательности (например, константные домены нативной последовательности человека) или вариант их аминокислотной последовательности. Предпочтительным интактным антителом является антитело с одной или несколькими эффекторными функциями.
"Эффекторные функции" антитела означают биологические активности, которые приписываются Fc-области (Fc-область нативной последовательности или Fc-область с модификацией в аминокислотной последовательности) антитела. Примерами эффекторных функций антитела являются связывание с С1q, комплемент-зависимая цитотоксичность, связывание с Fc-рецептором, антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC), фагоцитоз, негативная регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора, BCR) и т.п.
В зависимости от аминокислотной последовательности константного домена тяжелых цепей антитела интактные антитела могут относиться к различным "классам". Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть, кроме того, подразделены на "подклассы" (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, соответствующие различным классам антител, обозначены α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации иммуноглобулинов различных классов хорошо известны.
Термины "антитело-зависимая клеточно-опосредованная цитотоксичность" и "ADCC" означают клеточно-опосредованную реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие Fc-рецепторы (FcR)(например, природные киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и тем самым вызывают лизис этой клетки-мишени. Первичные клетки, опосредующие ADCC, клетки - природные киллеры, экспрессируют лишь FcRIII, тогда как моноциты экспрессируют FcRI, FcRII и FcRIII. Экспрессия FcR на гемопоэтических клетках систематизирована в таблице 3 на странице 464 работы Ravetch & Kinet, Annu. Rev. Immunol., 9:457-492 (1991). Для оценки представляющей интерес ADCC-активности молекулы может быть осуществлен in vitro анализ на ADCC, такой как анализ, описанный в патентах США № 5500362 или 5821337. Эффекторными клетками, подходящими для таких анализов, являются мононуклеарные клетки периферической крови (МКПК) и клетки - природные киллеры (NK). Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, на модели животного, как описано, например, Clynes et al., Proc. Natl. Acad. Sci. USA., 95:652-656 (1998).
"Человеческие эффекторные клетки" представляют собой лейкоциты, экспрессирующие один или несколько FcR и осуществляющие эффекторные функции. Предпочтительными являются клетки, экспрессирующие, по крайней мере, FcRIII и осуществляющие эффекторную функцию ADCC. Примерами человеческих лейкоцитов, опосредующих ADCC, являются мононуклеарные клетки периферической крови (МКПК), клетки - природные киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, при этом предпочтительными являются МКПК и NK. Эффекторные клетки могут быть выделены из их природных источников, например из крови или из МКПК, как описано в настоящей заявке.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины, имеющие размер примерно в 150000 дальтон и состоящие из двух идентичных легких цепей (L) и двух идентичных тяжелых цепей (Н). Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, и число дисульфидных связей для тяжелых цепей различных изотипов иммуноглобулина варьируется. Каждая тяжелая и легкая цепь также имеет дисульфидные мостики, расположенные внутри цепи на соответствующем расстоянии друг от друга. Каждая тяжелая цепь на своем одном конце имеет вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет на одном конце вариабельный домен (VL), а на другом конце константный домен. Константный домен легкой цепи находится на одном уровне с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи находится на одном уровне с вариабельным доменом тяжелой цепи. Очевидно, что конкретные аминокислотные остатки образуют область контакта между вариабельными доменами легкой цепи и тяжелой цепи.
Термин "вариабельный" означает, что некоторые части вариабельных доменов у различных антител сильно отличаются по своей последовательности, и этим фактом обусловлено связывание и специфичность каждого конкретного антитела с его конкретным антигеном. Однако такая вариабельность неравномерно распределена по вариабельным доменам антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными областями, находящимися в вариабельных доменах как легкой, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен нативной тяжелой и легкой цепей содержит четыре FR, образующие, главным образом, конфигурацию β-складчатого листа, и связанные тремя гипервариабельными областями, которые образуют петли, соединяющие, а в некоторых случаях образующие часть β-складчатой структуры. Эти гипервариабельные области в каждой цепи расположены вместе в непосредственной близости от FR и вместе с гипервариабельными областями другой цепи они участвуют в образовании антиген-связывающего сайта антитела (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC).
Используемый здесь термин "гипервариабельная область" означает аминокислотные остатки антитела, ответственные за связывание с антигеном. Гипервариабельная область обычно содержит аминокислотные остатки из "области, определяющей комплементарность" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи, и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)), и/или остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia & Lesk, J. Mol. Biol. 196: 901-917 (1987)). Остатки "каркасной области" или "FR" представляют собой остатки вариабельного домена, не являющиеся остатками определенной здесь гипервариабельной области.
Гидролиз антител папаином приводит к образованию двух идентичных ангигенсвязывающих фрагментов, называемых "Fab"-фрагментами, каждый из которых имеет антигенсвязывающий сайт, и другого "Fc"-фрагмента, название которого указывает на его способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта и который, кроме того, способен перекрестно связываться с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный сайт узнавания антигена и антигенсвязывающий центр. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, тесно и не-ковалентно связанных друг с другом. Указанная область имеет такую конфигурацию, при которой взаимодействие трех гипервариабельных областей каждого вариабельного домена определяет антигенсвязывающий центр на поверхности димера VH-VL. В целом, шесть гипервариабельных областей сообщают данному антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv-фрагмента, содержащая только три гипервариабельные области, специфичные к антигену) обладает способностью распознавать антиген и связываться с антигеном, хотя и с более низкой аффинностью, чем целый сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов тем, что они имеют несколько дополнительных остатков у карбокси-конца домена тяжелой цепи СН1, включая один или несколько цистеинов шарнирной области антитела. Fab'-SH имеет то же определение, что и Fab', где цистеиновый(е) остаток(ки) константных доменов несет(ут), по крайней мере, одну свободную тиоловую группу. F(ab')2-фрагменты антитела были сначала продуцированы как пары Fab'-фрагментов, между которыми находятся цистеиновые остатки шарнирной области. Также известны и другие типы химического связывания фрагментов антитела.
"Легкие цепи" антител, происходящих от позвоночных любого вида, могут быть отнесены к одному из двух явно выраженных типов, названных каппа (6) и лямбда (8), исходя из аминокислотных последовательностей их константных доменов.
"Одноцепочечные Fv-фрагменты" или "оцFv-фрагменты" антитела включают VH- и VL-домены антитела, где эти домены присутствуют в одной полипептидной цепи. Предпочтительно, чтобы полипептид Fv, кроме того, содержал полипептидный линкер между доменами VH и VL, что позволяет оцFv образовывать нужную структуру для связывания с антигеном. Описание оцFv см. в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol.113, Rosenburg & Moore eds. (Springer-Verlag, New York, 1994), pp.269-315, оцFv-фрагменты антитела против ErbB2 описаны в WO 93/16185; в патенте США № 5571894, и в патенте США № 5587458.
Термин "диантитела" означает небольшие фрагменты антител с двумя антиген-связывающими сайтами, фрагменты которых содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в той же самой полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким, чтобы соединять эти два домена на одной и той же цепи, эти домены вынуждены образовывать пару с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Более подробно диантитела описаны, например, в ЕР 404097; WO 93/11161; и в работе Hollinger et al., Proc.Natl. Acad. Sci., USA, 90: 6444-6448 (1993).
"Очеловеченные" (гуманизированные) формы не-человеческих антител (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую от не-человеческого иммуноглобулина. В большинстве случаев "очеловеченные" антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки от гипервариабельной области реципиента заменены остатками от гипервариабельной области не-человеческого антитела (антитела-донора), такого как антитела мышиного, крысиного, кроличьего антитела или антитела примата, не являющегося человеком, которое обладает нужной специфичностью, аффинностью и активностью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина могут быть заменены соответствующими остатками не-человеческого антитела. Кроме того, "очеловеченные" антитела могут содержать остатки, которые отсутствуют в антителе-реципиенте или в антителе-доноре. Эти модификации вносят для улучшения свойств антитела. Вообще говоря, "очеловеченные" антитела могут включать, в основном, весь, по крайней мере, один и обычно два вариабельных домена, в которых все или почти все гипервариабельные петли являются петлями не-человеческого иммуноглобулина, и все или почти все FR являются каркасными областями последовательности человеческого иммуноглобулина. "Очеловеченное" антитело может также, но необязательно, содержать, по крайней мере, часть константной области иммуноглобулина (Fc), а обычно - константную область человеческого иммуноглобулина. Более подробное описание см. в работе Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 322: 323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992).
"Выделенное" антитело представляет собой антитело, которое было идентифицировано, выделено и/или отделено от компонента его природного окружения. Примесными компонентами его природного окружения являются материалы, которые негативно влияют на диагностическое или терапевтическое использование указанного антитела, и такими компонентами могут быть ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления изобретения указанное антитело может быть очищено (1) на более чем 95% по массе антитела, как определено по методу Лоури, а наиболее предпочтительно более чем на 99 мас.%, (2) до степени, достаточной для получения, по крайней мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающейся чашкой, или (3) до гомогенности посредством электрофореза в ПААГ с ДСН в восстанавливающих или в не-восстанавливающих условиях с использованием окрашивания кумасси синим или предпочтительно серебром. Выделенным антителом является антитело, полученное in situ в рекомбинантных клетках, поскольку в нем отсутствует, по крайней мере, один компонент его природного окружения. Однако обычно выделенное антитело получают с проведением, по крайней мере, одной стадии очистки.
Экспрессионные "регуляторные последовательности" представляют собой ДНК-последователь