Способ получения 7-замещенных стероидных соединений, соединения, способы получения эплеренона, продукт
Иллюстрации
Показать всеОписан способ получения новых 7-замещенных стероидных соединений общей формулы I, где
R1-Н или -COR2; где R2-С1-6алкил, С1-6алкокси, Z1--СН2- или , где R3 находится в α-конфигурации; R3-Н или -COR2, Z2-CH- или Z1 и Z2 вместе
- двойная связь, Q -
Y--CN, -СН2-СН=СН2 или ,
CHR4C(O)Ar, CHR4С(O)С1-6алкил, CHR4C(O)XAr или CHR4C(O)XC1-6алкил, где R4-OC1-6алкил или арил, Х=O или S, являющихся промежуточными соединениями в синтезе эплеренона.
6 н. и 1 з.п. ф-лы, 1 табл.
Реферат
Уровень техники
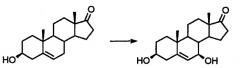
Некоторые С-7-замещенные стероиды, например эплеренон, являются хорошо известными в отношении их антагонистической активности в отношении альдостерона и таким образом они пригодны для лечения и профилактики заболеваний кровеносной системы. Эплеренон является предметом нескольких патентов и заявок, например патентов США № 4559332 и 5981744 и публикаций международных заявок WO98/25948 и WO97/21720. Однако в результате появления новых и расширенных клинических применений эплеренона возрастает необходимость в усовершенствованных способах производства его и других близких стероидов. Основным затруднением для эффективного синтеза эплеренона и близких стероидных соединений является введение в положение С-7 карбоксильной группы или функциональной группы, которая может быть трансформирована в карбоксильную группу.
Известно, что аллильные производные и, в частности, аллильные ацетаты, бензоаты, пивалаты и тому подобное, взаимодействуют с нуклеофильными реагентами в присутствии кислоты Льюиса в способе, называемом "аллилированием", как уже было описано ранее. Реакцию аллилирования использовали для целого ряда субстратов. Например, было показано, что при аллилировании гликали дают аллилгликозиды, гликозилцианиды и гликозалазиды (Yadav J.S. et al., Tetrahedron Lett., 2001, 42, 4057). Аллильные ацетаты и карбонаты дают соответствующие цианиды (Yasushi T. et al., J. Org. Chem., 1993, 58, 16). Богатые электронами ароматические и гетероароматические соединения дают соответствующие аллилированные продукты (Malkov A.V. et al., J. Org. Chem., 1999, 64, 2751). Однако реакция аллилирования до настоящего времени не применялась к стероидам для получения 7-замещенных стероидов, пригодных для превращения в 7-карбоксизамещенные стероиды, такие как эплеренон. 3,17-Диацетокси-7-гидроксиандрост-5-ен или соответствующие 7-метансульфонаты подвергали взаимодействию с фенолом и анизолом с использованием жесткого катализатора хлорида алюминия (Negi A.S. et al., Steroids, 1995, 60, 470). Образовавшиеся в результате 7-арильные производные получают с низким выходом в виде смеси С-7-эпимеров. Кроме того, 7-арильные производные, в лучшем случае, будет трудно применять для получения 7-карбоксизамещенных стероидов.
Сущность изобретения
Данное изобретение относится к способам получения новых 7-карбоксизамещенных стероидных соединений формулы I,
формула I
в которой R1 является -COR2;
R2 представляет собой С1-6алкил или С1-6алкокси;
Z1 является СН2 или
, где OR3 находится в α-конфигурации;
R3 представляет собой Н или -COR2;
Z2 является -СН-; или
Z1 и Z2, взятые вместе, образуют углерод-углеродную двойную связь;
Q представляет собой
;
Y является -CN, -CH2-CH=CH2,
CHR4C(O)Ar, CHR4C(O)C1-6алкил, CHR4C(O)XAr или CHR4C(O)XC1-6алкил;
где R4 = ОС1-6алкил или арил,
Х = О или S.
Данные новые промежуточные соединения пригодны для получения 7-карбоксизамещенных стероидных соединений и, в частности, изобретение относится к новым и преимущественным способам получения метилового эфира 9,11-α-эпокси-17-α-гидрокси-3-оксопрегн-4-ен-α-21-дикарбоновой кислоты γ-лактона (эплеренона; эпоксимексренона).
Ключевой стадией в способах по настоящему изобретению является взаимодействие нового стероидного промежуточного соединения формулы II,
формула II
в которой R1 и R3 независимо выбраны из Н, С(O)OR2 или COR2, и, по меньшей мере, один из R1 или R2 представляет собой C(O)OR2 или COR2;
Z1, Z2, R2 и Q имеют значения, определенные для формулы I;
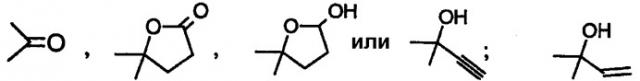
с нуклеофильным реагентом, выбранным из группы С1-4триалкилсилилцианидов, С1-4триалкилсилиленоэфиров, С1-4триалкилсилилоксикетентиоацеталей (т.е. RCH=C(OSiRC1-C6алкил)SRC1-6алкил), аллилтриС1-4алкилсиланов, аллилтри-С1-4алкилстаннанов, 2-С1-4алкилфуранов и 2-С1-4алкилпирролов в присутствии катализатора - кислоты Льюиса.
В соединении формулы II имеется структурный элемент производного аллилового спирта в положениях -С-5, -С6, -С7-OR3. Новые схемы синтеза, в которых используется преимущество реакции "аллилирования", подробно описаны в разделе "Описание предпочтительных вариантов осуществления".
Описание предпочтительных вариантов осуществления
Определения
При подробном описании используются следующие определения. Термин "алкил", сам или как часть другого заместителя, означает, если не указано иначе, нормальный либо разветвленный, или циклический углеводородный радикал или их сочетание. Примеры насыщенных углеводородных радикалов включают, но не ограничиваются такими группами, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)этил, циклопропилметил, их гомологи и изомеры, например, н-пентил, н-гексил, н-гептил, н-октил и тому подобное.
Термин "арил", (Ar), используется ли он самостоятельно или в сочетании с другими терминами (например, арилокси, арилтиокси, аралкил), означает, если не указано иначе, ароматический заместитель, который может представлять собой единичное кольцо или множественные кольца (до трех колец), которые сконденсированы вместе или связаны ковалентно.
Термин "нуклеофильный реагент" означает богатые электронами реагенты, которые обладают тенденцией к атаке ядра углерода, как описано Morrison R.T. et al., Organic Chemistry, sixth edition, Prentice Hall pub., 1992, p. 172.
Термин "кислота Льюиса" означает акцептор электронной пары, как определено McQuarrie D.A. et al., General Chemistry, third edition, W.H.Freeman and Company pub., 1991, p. 665.
Описание предпочтительных вариантов осуществления
Заявители, с удивлением, установили, что карбоксипроизводные С-7-гидрокси-С-5Δ6-еновых стероидов формулы II вступают в реакцию аллилирования с различными нуклеофильными реагентами с образованием соответствующих С-7-замещенных стероидных производных формулы I, как представлено в таблице 1. Подходящие нуклеофильные реагенты включают, но не ограничиваются ими, С1-4триалкилсилилцианиды, С1-4триалкилсилиленоэфиры, триалкилсилилоксикетентиоацетали (RCH=C(OSiR3)SR), аллилтри-С1-4алкилсиланы, аллилтри-С1-4алкилстаннаны, 2-С1-4аллилфураны и 2-С1-4алкилпирролы в присутствии катализатора - кислоты Льюиса. Подходящие кислоты Льюиса включают, но не ограничиваются ими, трифлаты переходных элементов (OTf=OSO2CF3), такие как Sc(OTf)3, Ce(OTf)3, Fe(ClO4)2, Cu(ClO4)2 и Yb(OTf)3, и комплексы молибдена(II), такие как Mo(CO)5(OTf2) и [Mo(CO)4Br2]2.
| Таблица 1 | |||||
| Стероидный субстрат | Нуклеофильный реагент | Катализатор | Растворитель/Температура | Продукт | Выход, % |
| TMSCN | Sc(OTf)3 | Ацетонитрил/комнатная температура | 40 | ||
| 2-метилфуран | Sc(OTf)3 | Дихлорметан 0-15°С | 74 | ||
| 2-метилфуран | Sc(OTf)3 | Ацетонитрил/комнатная температура | 96 | ||
| 2-метилфуран | Sc(OTf)3 | Дихлорметан/комнатная температура | 63 | ||
| 2-метилфуран | Sc(OTf)3 | Ацетонитрил/комнатная температура | 87 | ||
| 2-метилфуран | Ce(OTf)3 | Ацетонитрил/-14°С | 77 | ||
| 2-метилфуран | Yb(OTf)3 | Ацетонитрил/комнатная температура | 96 | ||
| Sc(OTf)3 | Ацетонитрил/комнатная температура | 83 | |||
| TMSCN = триметилсилилцианид |
В тех же условиях, однако, индол и орцинол дают выход < 10% и сложные смеси. Винилтриметилсилан и триметилсилилацетилен не подвергаются взаимодействию.
Схемы, представляющие сущность изобретения
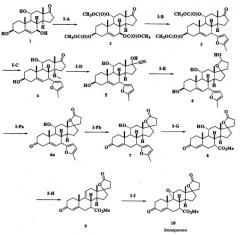
Как уже отмечалось выше, соединения формулы I можно использовать в качестве исходных соединений при синтезе эплеренона. На схемах I и II приводится схематичная диаграмма примеров применения соединения формулы I, полученного способом по данному изобретению, для получения эплеренона.
Схема I
Схема II
Исходное соединение 1 (схема I), (3β, 7β, 11α-тригидрокси-5-андростен-17-он) для схем I-II получают одним из двух путей. Первый путь представляет собой вначале контактирование 5-андростен-3β-ол-17-она с глубинной культурой Diplodia qossypina ATCC 20517 (синоним Botryodiplodia theobromae IFO 6469) с получением 5-андростен-3β,7β-диол-17-она (смотри пример 10), затем контактирование 5-андростен-3β,7β-диол-17-она с глубинной культурой Aspergillus ochraceus ATCC 18500 с получением 5-андростен-3β,7β,11α-триол-17-она (схема I). Альтернативно можно подвергнуть 5-андростен-3β-ол-17-он контактированию с глубинной культурой Absidia coerulea ATCC 6647 с получением 5-андростен-3β,7β,11α-триол-17-она (схема I).
Стадии IA и IIB
Гидроксильные промежуточные соединения 1 и 11 (схема II) ацилируют с использованием ацилирующего реагента в присутствии третичного органического основания способами, хорошо известными в данной области, с получением соединений 2 и 12. Ацилирующие реагенты включают ангидриды низших алкановых кислот, хлорангидриды низших алкановых кислот, низшие алкилкарбонилхлориды, ангидриды низших алкилкарбоновых кислот и тому подобное. Подходящие третичные органические основания включают пиридин, 4-диметиламинопиридин, триэтиламин, диизопропилэтиламин и тому подобное. Альтернативно можно получить смешанные карбонаты (RO-CO-O-) взаимодействием с алкоксикарбонилоксибензотриазолом в присутствии третичного органического основания при модификации опубликованных способов (Harada T. et al., J. Carbohydrate Chem., (1995), 14, 165).
Стадии I-B и II-E
Взаимодействие триацилированных соединений 2 (схема I) и 14 (схема II) с нуклеофильным реагентом в присутствии кислоты Льюиса, обычно в инертном растворителе, таком как ацетонитрил или метиленхлорид, дает, соответственно, соединения 3 (схема I) и 15 (схема II). Подходящие нуклеофильные реагенты включают, но не ограничиваются ими, триалкилсилилцианиды, 3-силил-замещенные алкены, енолацетаты, простые силиленолэфиры, аллилстаннаны, N-алкилпирролы, N,N-диалкиланилины, силиленолтиоэфиры, сложные силиленолэфиры и богатые электронами гетероароматические соединения, такие как 2-алкилзамещенный фуран. Подходящие кислоты Льюиса включают, но не ограничиваются ими, трифлаты переходных элементов (OTf=OSO2CF3), такие как Sc(OTf)3, Ce(OTf)3 и Yb(OTf)3, и комплексы молибдена(II), такие как Mo(CO)5(OTf2) и [Mo(CO)4Br2]2.
Стадии I-С и II-F
Гидролиз ацильных групп соединения 3 (схема I) и 15 (схема II) с получением соединения 4 (схема I) или 16 (схема II) проводят с использованием гидроокиси щелочного металла, бикарбоната или карбоната, таких как гидроокись натрия, карбонат калия, бикарбонат натрия, гидроокись цезия, бикарбонат лития и тому подобное, с использованием метанола в качестве растворителя, необязательно вместе с сорастворителем.
Стадии I-D и II-A
17-Оксо промежуточные соединения 4 (схема I) и 1 (схема II) подвергают взаимодействию с ацетиленом с получением соответствующего аддукта 5 (схема I) и 11 (схема II) согласно способам, описанным в литературе (например, смотри Schwede W. et al., Steroids, (1998), 63, 166; Corey E.J. et al., J. Amer. Chem. Soc. (1999), 121, 710-714; Schwede W. et al., Steroids (1998), 63(3), 166-177; Ali H. et al., J. Med. Chem. (1993), 36(21), 3061; Turuta A.M. et al., Mendeleev Commun. (1992), 47-8; Kumar V. et al., Tetrahedron (1991), 47(28), 5099; Page P.C., Tetrahedron (1991), 47, 2871-8; Curts S.W. et al., Steroids (1991), 56, 8; Kataoka H. et al., Chem. Lett. (1990), 1705-8; Christiansen R.G. et al., J. Med. Chem. (1990), 33(8), 2094-100). Необязательно тригидроксипроизводное 1 на стадии II-A можно триметилсилилировать без его выделения до добавления ацетилена. Силилирование проводят с помощью гексаметилдисилазана и мягкого кислотного катализатора, такого как триметилсилилхлорид или сахарин. После добавления ацетилена триметилсилильные группы удаляют во время обработки реакционной смеси слабой минеральной кислотой, уксусной кислотой, фосфорной кислотой, фторидом тетраалкиламмония и тому подобное.
Стадия Е
Лактольные промежуточные соединения 6 (схема I) и 13 (схема II) получают гидроформилированием соединения 5 и 12 с использованием окиси углерода и водорода в присутствии каталитического количества катализатора родия и координационного лиганда родия согласно способам, описанным в литературе (Wuts P.G.M. et al., J. Org. Chem. 1989, 54, 5180; Botteghi C. et al., Tetrahedron, 2001, 57, 1631). Реакцию проводят под давлением 14-500 фунтов/кв. дюйм, предпочтительно в пределах 100-200 фунтов/кв. дюйм. Соотношение водорода и окиси углерода находится в пределах от 1/5 до 5/1, обычно составляет 1/1. Подходящие катализаторы на основе родия включают ацетат родия, хлорид родия и дикарбонилацетилацетонатородий II. Подходящие лиганды включают триарилфосфины, триалкилфосфиты, бидентатные фосфины, такие как ксантфос, бидентатные фосфиты и тому подобное.
Стадии I-Fa и II-D
Окисление соединения 6 (схема I) в соединение 6а (схема I) и соединения 13 (схема II) в соединение 14 (схема II) можно проводить с помощью различных обычных окислителей. Примеры подходящих окислителей включают: йодосукцинимид/йодид тетрабутиламмония (Kraus, George A. Bioorganic & Medicinal Chemistry Letters (2000), 10(9), 895-897; Barrett, A.G.M. et al., J. Org. Chem. (1989), 54(14), 3321); реагент Джонса (хромовая кислота в ацетоне) (Panda J. et al., Tetrahedron Letters (1999), 40, 6693; Tomioka K. et al., J. Org. Chem. (1988), 53(17), 4094); карбонат серебра (Chow T.J. et al., J. Chem. Soc., Perkin Transactions 1, (1999), 1847); хлорхромат пиридиния (Uchiyama M. et al., Tetrahedron Letters (2000), 41(51), 10013; Vanderiei J.M. de L., Synthetic Communications (1998), 28(16), 3047; Kassou M. et al., Journal of Organic Chemistry (1997), 62, 3696; Rehnberg N. et al., J. Org. Chem. (1990), 55(14), 4340-9; RuO4/соли тетраалкиламмония/N-оксид трет-амина (Jeewoo K. et al., Chem. Lett. (1995), (4), 299); дихромат пиридиния (Paquette L.A. et al., J. Am. Chem. Soc. (1995), 117(4), 1455-6); гипохлорит натрия/ N-оксид трет-амина (Waldemar A. et al., Chem. Rev., (2001), 101, 3499); алкоголяты алюминия/ацетон (Ooi T. et al., Synthesis (2002), 279); Djerassi C. et al., Org. React. (1951), 6, 207); триацетоксипериодоиндан (Martin J.C. et al., J. Amer. Chem. Soc., (1991), 113, 7277).
Стадия Fb
В тех случаях, когда окисление на стадии Fa приводит к образованию несопряженной двойной связи в положении 5-6, миграцию двойной связи в соединении 6а (схема I) из положения С5-6 в положение С4-5 проводят взаимодействием соединения 6а (схема I) с органической или неорганической кислотой в инертном органическом растворителе или водной смеси растворителей при температуре 0°С-80°С. Подходящие органические кислоты включают, но не ограничиваются ими, толуолсульфоновую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, трифторуксусную кислоту, щавелевую кислоту, трихлоруксусную кислоту и тому подобное. Подходящие неорганические кислоты включают, но не ограничиваются ими, соляную кислоту, бромистоводородную кислоту, фосфорную кислоту, перхлорную кислоту и тому подобное. Альтернативно, катализатор может представлять собой третичное органическое основание, такое как триэтиламин, диазабициклоундекан (DBU) и тому подобное, или неорганическое основание, такое как гидроокись натрия, гидроокись калия, гидроокись кальция и тому подобное. Миграция двойной связи была уже описана ранее (Bakshi et al., патент США № 5237064; Pollack et al., J. Amer. Chem. Soc., 1987, 109, 5048; Tsubuki et al., J. Org. Chem., 1992, 57, 2930; Zenge et al., J. Amer. Chem. Soc., 1991, 113, 3838).
Стадии I-H и II-I,J
Дегидратацию 11-гидрокси промежуточных соединений 7 (схема I) и 18 (схема II) проводят с использованием пентахлорида фосфора, как было ранее описано (патент США № 4559332). Альтернативно, 11-гидрокси промежуточные соединения можно превратить в сульфониловый эфир, например, в метансульфонат или п-толуолсульфонат, с последующей обработкой основанием для проведения дегидратации, как описано в заявках WO97/21720 и WO98/25948.
Стадии I-H и II-H
Превращение фуранового кольца в соединении 7 (схема I) в метиловый эфир соединения 8 (схема II) проводят озонолизом, окислением и эстерификацией, как описано в примерах.
Стадии I-J и II-K
Превращение известного промежуточного соединения 9 (схема I) в соединение 10 (схема I) (эплеренон) описано в патентах США № 4559332 и 5981744.
Примеры
Получение исходного соединения 1, способ 1
Стадия 1: Биоконверсия 5-андростен-3β-ол-17-она в 5-андростен-3β,7β-диол-17-он
Биоконверсию 5-андростен-3β-ол-17-она в 5-андростен-3β,7β-диол-17-он проводят с использованием глубинной культуры Diplodia gossypina ATCC 20571 (синоним Botryodiplodia theobromae IFO 6469) в ферментере емкостью 10 л.
(А) Стадия первичного посева
Замороженные вегетативные клетки Diplodia gossypina ATCC 20571 размораживают, переносят на чашки с картофельным-декстрозным агаром (PDA) и инкубируют при 28°С в течение 72 ч. Единичные колонии мицелия (диаметром 6-7 мм) используют для посева в покрытые силиконом качалочные колбы с метками емкостью 500 мл, содержащие 100 мл среды для первичного посева. Среда для первичного посева состоит из (на литр воды RO, т.е. воды подвергнутой обратноосмотическому обессоливанию): декстрина, 50 г; соевой муки, 35 г; церелозы, 5 г; хлорида кобальта гексагидрата, 2 мг; силиконового противовспенивателя (SAG 471), 0,5 мл; перед стерилизацией значение рН доводят до 7,0-7,2 гидроокисью натрия (2 н. раствором). Diplodia gossypina ATCC 20571 инкубируют в течение 48 ч при 28°С с использованием термостата-встряхивателя с контролируемой окружающей средой при 280 об/мин (орбитальный ход 1").
(В) Стадия вторичного посева
В ферментеры для вторичного посева емкостью 10 л вносят 1,2 мл вегетативной культуры первичного посева (количество внесенного посевного материала составляет 0,012% [об./об.]). Среда для вторичного посева состоит из (на литр воды RO): церелозы, 60 г; соевой муки, 25 г; соевого масла, 30 мл; сульфата магния гептагидрата, 1 г; дигидрофосфата калия, 0,74 г; полиоксиэтиленсорбитана моноолеата, 2 мл; силиконового противовспенивателя (SAG 471), 0,5 мл; перед стерилизацией значение рН доводят до 3,95-4,00 концентрированной серной кислотой. Ферментеры, содержащие среду для вторичного посева, стерилизуют в течение 20 мин при 121°С с использованием как согревающего пара (в паровой рубашке), так и введения пара. Скорость перемешивания во время стерилизации равняется 200 об/мин. После стерилизации рН среды доводят до 4,0 с использованием стерильной серной кислоты (5% раствора). Diplodia gossypina ATCC 20571 инкубируют при 28°С с использованием следующих первоначальных параметров: перемешивание, 100 об/мин; противодавление = 5 фунтов/кв. дюйм избыточного давления; воздушный поток = 2,5 SLM (0,25 об./об/мин); нижнее значение DO (растворенный кислород), 30%; без контроля значения рН. Когда значение DO вначале уменьшается до 30%, то воздушный поток увеличивают до 5 SLM (0,5 об./об/мин). Когда культура вновь достигает нижнего значения DO, то значение DO поддерживают на 30% регуляцией воздушного потока. Культуры вторичного посева собирают примерно через 60 ч после посева, когда значение скорости потребления кислорода (СПК) находится в пределах примерно от 10 до примерно 15 мМ/л/час.
(С) Биоконверсия стероидов
В ферментеры для биоконверсии стероидов емкостью 10 л вносят 500 мл вегетативной культуры второго посева (количество внесенного посевного материала составляет 5% [об./об.]). Среда для биоконверсии стероидов является такой же, как среда для вторичного посева. Условия стерилизации и доведение рН являются такими же, как описано для среды вторичного посева. Diplodia gossypina ATCC 20571 инкубируют при 28°С с использованием в основном таких же первоначальных параметров, которые использовали для культивирования вторичного посева, за исключением того, что нижнее значение DO повышают с 30% до 50%. Когда значение DO вначале уменьшается до 50%, то воздушный поток увеличивают с 2,5 SLM (0,25 об./об/мин) до 5 SLM (0,5 об./об/мин). Когда культура вновь достигает нижнего значения DO, то значение DO поддерживают равным 50%, регулируя перемешивание. Через 24 ч после посева в ферментер вносят микронизированный 5-андростен-3β-ол-17-он, разведенный в минимальном объеме 0,2% полиоксиэтиленсорбитана моноолеата, с интервалом 1 ч, пока не вносят в целом 400 г. Примерно через 3 суток после посева в ферментер емкостью 10 л вносят еще 100 г церелозы.
Культуры для биоконверсии анализируют ежедневно на выработку 5-андростен-3β,7β-диол-17-она с использованием ТСХ. Один миллилитр цельной культуральной жидкости экстрагируют 10 мл метанола. Клетки отделяют от водно-метанольной смеси центрифугированием (3000×g в течение 10 мин) и несколько микролитров наносят на пластинку для ТСХ. Пластинку для ТСХ обрабатывают в системе циклогексан:этилацетат:метанол (90:60:15) и продукт проявляют опрыскиванием пластинки для ТСХ 50% серной кислотой с последующим прокаливанием в сушильном шкафу. Продукт сравнивают с соответствующим стандартом, который становится синим при опрыскивании 50% серной кислотой. Биоконверсия 5-андростен-3β-ол-17-она в 5-андростен-3β,7β-диол-11-он заканчивается примерно через 4 суток после посева.
(D) Выделение
Цельную культуральную жидкость, полученную при сборе, центрифугируют и обогащенные твердые частицы отделяют центрифугированием. Обогащенные твердые частицы экстрагируют 10 л метиленхлорида и обогащенный экстракт выделяют центрифугированием. Экстракт обрабатывают и концентрируют примерно до 1 л упариванием, и взвесь кристаллов охлаждают до -10°С. Кристаллы отделяют фильтрованием, промывают холодным метиленхлоридом для удаления окраски и высушивают с получением 227 г очищенного кристаллического 5-андростен-3β,7β-диол-17-она.
Стадия 2: биоконверсия 5-андростен-3β,7β-диол-17-она в 5-андростен-3β,7β,11α-триол-17-он
Биоконверсию 5-андростен-3β,7β-диол-17-она в 5-андростен-3β,7β,11α-триол-17-он проводят с использованием глубинной культуры Aspergillus ochraceus ATCC 18500 (синоним NRRL 405) в ферментере емкостью 10 л.
(А) Стадия первичного посева
Культуры Aspergillus ochraceus ATCC 18500 первичного посева готовят, как описано для Diplodia gossypina ATCC 20571 на стр. 14-15.
(В) Стадия вторичного посева
В ферментеры для вторичного посева емкостью 10 л вносят 1,2 мл вегетативной культуры первичного посева (количество внесенного посевного материала составляет 0,012% [об./об.]). Среда для вторичного посева состоит из (на литр воды RO): церелозы, 40 г; соевой муки, 25 г; соевого масла, 30 мл; сульфата магния гептагидрата, 1 г; дигидрофосфата калия, 0,74 г; нонилфеноксиполиэтоксиэтанола, 0,25 мл; силиконового противовспенивателя (SAG 471), 0,5 мл; перед стерилизацией значение рН доводят до 3,95-4,00 концентрированной серной кислотой. Ферментеры, содержащие среду для вторичного посева, стерилизуют в течение 20 мин при 121°С с использованием как согревающего пара, так и введения пара. Скорость перемешивания во время стерилизации равняется 200 об/мин. После стерилизации рН среды доводят до 4,0 с использованием стерильной серной кислоты (5% раствора). Aspergillus ochraceus ATCC 18500 инкубируют при 28°С с использованием следующих первоначальных параметров: перемешивание, 100 об/мин; противодавление = 5 фунтов/кв. дюйм избыточного давления; воздушный поток = 2,5 SLM (0,25 об./об/мин); нижнее значение DO, 50%; без контроля значения рН. Когда значение DO вначале уменьшается до 50%, то воздушный поток увеличивают до 5 SLM (0,5 об./об/мин). Когда культура вновь достигает нижнего значения DO, то значение DO поддерживают равным 50% с использованием регуляции перемешивания. Культуры вторичного посева собирают примерно через 50-54 ч после посева, когда значение СПК находится в пределах примерно от 20 до примерно 26 мМ/л/час.
(С) Биоконверсия стероидов
В ферментеры для биоконверсии стероидов емкостью 10 л вносят 500 мл вегетативной культуры второго посева (количество внесенного посевного материала составляет 5% [об./об.]). Среда для биоконверсии стероидов в основном является такой же, как среда для вторичного посева, за исключением того, что концентрацию нонилфеноксиполиэтоксиэтанола повышают с 0,25 мл/л до 2 мл/л и значение рН до стерилизации доводят до 2,95-3,00 концентрированной серной кислотой. Условия стерилизации являются такими же, как описаны для среды вторичного посева. После стерилизации рН среды доводят до 3,0 с использованием стерильной серной кислоты (5% раствор). Aspergillus ochraceus ATCC 18500 инкубируют при 28°С с использованием в основном таких же первоначальных параметров, которые использовали для культивирования вторичного посева, за исключением того, что вначале перемешивание проводят при 200 об./мин. Примерно через 18 ч после посева 200 г микронизированного 5-андростен-3β,7β-диол-17-она, разведенного в минимальном объеме 0,2% нонилфеноксиполиэтоксиэтанола, вносят в ферментер емкостью 10 л.
Культуры для биоконверсии анализируют ежедневно на выработку 5-андростен-3β,7β,11α-триол-17-она с использованием ТСХ, как описано в примере 10. Биоконверсия 5-андростен-3β,7β-диол-17-она в 5-андростен-3β,7β,11α-триол-17-он заканчивается примерно через 4 суток после посева.
(D) Выделение
Твердые частицы в цельной культуральной жидкости отделяют центрифугированием. Жидкость отбрасывают. Обогащенные твердые частицы экстрагируют 10 л смеси 80% ацетон/20% вода при температуре 45°С-50°С, и теплый экстракт осветляют фильтрованием. Обогащенный фильтрат концентрируют упариванием для удаления ацетона с получением водной суспензии сырых кристаллов. Сырые кристаллы отделяют фильтрованием и маточный раствор отбрасывают. Содержащие воду кристаллы растирают в 600 мл метиленхлорида для удаления примесей, растворяют в 700 мл метанола (при нагревании до 55°С) и затем обесцвечивают с помощью 5 г угля Darco G-60. После фильтрования для удаления угля фильтрат концентрируют для кристаллизации продукта. Затем метанол удаляют добавлением 300 мл н-бутилацетата и концентрированием до густой взвеси кристаллов. Кристаллы отфильтровывают, промывают н-бутилацетатом и высушивают с получением 158 г очищенного кристаллического 5-андростен-3β,7β,11α-триол-17-она.
Получение соединения 1, способ 2: биоконверсия 5-андростен-3β-ол-17-она в 5-андростен-3β,7β,11α-триол-17-он
Биоконверсию 5-андростен-3β-ол-17-она в 5-андростен-3β,7β,11α-триол-17-он проводят с использованием глубинной культуры Absidia coerulea ATCC 6647 в ферментере емкостью 10 л.
(А) Стадии первичного посева
Культуры Absidia coerulea ATCC 6647 первичного посева готовят, как описано для Diplodia gossypina ATCC 20571 на стр. 14-15.
(В) Стадия вторичного посева
В ферментеры для вторичного посева емкостью 10 л вносят 1,2 мл вегетативной культуры первичного посева (количество внесенного посевного материала составляет 0,012% [об./об.]). Среда для вторичного посева состоит из (на литр воды RO): декстрина, 50 г; соевой муки, 35 г; церелозы, 5 г; хлорида кобальта гексагидрата, 2 мг; силиконового противовспенивателя (SAG 471), 0,5 мл; перед стерилизацией значение рН доводят до 4,95-5,00 концентрированной серной кислотой. Ферментеры, содержащие среду для вторичного посева, стерилизуют в течение 20 мин при 121°С с использованием как согревающего пара, так и введения пара. Скорость перемешивания во время стерилизации равняется 200 об/мин. После стерилизации рН среды доводят до 5,0 с использованием стерильной серной кислоты (5% раствора). Absidia coerulea ATCC 6647 инкубируют при 28°С с использованием следующих первоначальных параметров: перемешивание, 100 об/мин; противодавление = 5 фунтов/кв. дюйм избыточного давления; воздушный поток = 2,5 SLM (0,25 об./об/мин); нижнее значение DO, 30%; без контроля значения рН. Когда значение DO вначале уменьшается до 30%, то воздушный поток увеличивают до 5 SLM (0,5 об./об/мин). Когда культура вновь достигает нижнего значения DO, то значение DO поддерживают на 30%, регулируя перемешивание. Культуры вторичного посева собирают примерно через 76 ч после посева, когда значение СПК находится в пределах примерно от 4 до примерно 7 мМ/л/час.
(С) Биоконверсия стероидов
В ферментеры для биоконверсии стероидов емкостью 10 л вносят 500 мл вегетативной культуры второго посева (количество внесенного посевного материала составляет 5% [об./об.]). Среда для биоконверсии стероидов состоит из (на литр воды RO): декстрина, 50 г; соевой муки, 35 г; церелозы, 20 г; силиконового противовспенивателя (SAG 471), 0,5 мл; перед стерилизацией значение рН доводят до 2,95-3,00 концентрированной серной кислотой. Условия стерилизации являются такими же, как описаны для среды вторичного посева. После стерилизации рН среды доводят до 3,0 с использованием стерильной серной кислоты (5% раствор). Absidia coerulea ATCC 6647 инкубируют при 28°С с использованием таких же первоначальных параметров, которые использовали для культивирования вторичного посева. Примерно через 17 ч после посева в ферментер емкостью 10 л вносят 200 г микронизированного 5-андростен-3β-ол-17-она, разведенного в минимальном объеме 0,2% октилфеноксиполиэтоксиэтанола.
Культуры для биоконверсии анализируют ежедневно на выработку 5-андростен-3β,7β,11α-триол-17-она с использованием ТСХ, как описано в примере 1. Биоконверсия 5-андростен-3β-ол-17-она в 5-андростен-3β,7β,11α-триол-17-он заканчивается примерно через 6-7 суток после посева.
(D) Выделение
Твердые частицы в цельной культуральной жидкости отделяют центрифугированием. Жидкость отбрасывают. Обогащенные твердые частицы экстрагируют 10 л смеси 80% ацетон/15% вода при температуре 45°С-50°С и теплый экстракт осветляют фильтрованием. Обогащенный фильтрат концентрируют упариванием для удаления ацетона с получением водной суспензии сырых кристаллов. Сырые кристаллы отделяют фильтрованием и маточный раствор отбрасывают. Содержащие воду кристаллы растирают в 600 мл метиленхлорида для удаления примесей, растворяют в 700 мл метанола (при нагревании до 55°С) и затем обесцвечивают с помощью 5 г угля Darco G-60. После фильтрования для удаления угля фильтрат концентрируют для кристаллизации продукта. Затем метанол удаляют добавлением 300 мл н-бутилацетата и концентрируют до густой взвеси кристаллов. Кристаллы отфильтровывают, промывают н-бутилацетатом и высушивают с получением 75,5 г неочищенного кристаллического 5-андростен-3β,7β,11α-триол-17-она.
Сырые кристаллы растирают в 600 мл метиленхлорида для удаления дополнительных примесей, растворяют в 700 мл метанола (при нагревании до 55°С) и затем обесцвечивают 5 г угля Darco G-60. После фильтрования для удаления угля фильтрат концентрируют для кристаллизации продукта. Затем метанол удаляют добавлением 300 мл н-бутилацетата и концентрированием до густой взвеси кристаллов. Кристаллы отфильтровывают, промывают н-бутилацетатом и высушивают с получением 42,1 г очищенного кристаллического 5-андростен-3β,7β,11α-триол-17-она.
Пример 1: получение трикарбоната 2
К 250 мл 3 н. раствора в круглодонной колбе добавляют триол 1 (схема I) (10,00 г, 31 ммоль), растворенный в пиридине (100 мл). К данному раствору добавляют триэтиламин (31 мл, 218 ммоль), карбометоксибензотриазол (24,2 г, 125 ммоль) и 4-N,N-диметиламинопиридин (1,2 г, 9,4 ммоль). Суспензию перемешивают в течение 2 ч, в течение этого периода времени все вещества растворяются. Добавляют дополнительное количество карбометоксибензотриазола (12 г, 62 ммоль) и триэтиламина (10 мл, 73 ммоль). По растворении твердых частиц реакция заканчивается. Медленно добавляют воду (300 мл) и смесь охлаждают на ледяной бане. Осадок отфильтровывают и промывают 10% HCl (2×35 мл) и гексаном (3×50 мл) и высушивают в вакуумном сушильном шкафу в течение 24 ч с получением указанного в заголовке соединения 2 (схема I). С13 ЯМР (CDCl3) δ 217,78, 155,60, 155,23, 154,88, 144,48, 122,35, 78,58, 76,81, 75,39, 55,29, 54,93, 51,09, 49,47, 47,79, 38,48, 37,89, 36,19, 36,08, 27,96, 23,58, 19,07, 14,40.
Пример 2: получение фурана 3 (схема I)
Раствор трикарбоната 2 (1,0 г, 2,02 ммоль) в 7 мл ацетонитрила при комнатной температуре обрабатывают 2-метилфураном (0,2 мл, 2,22 ммоль) и 0,298 г Sc(OTf)3 в течение 1 ч. Данные ТСХ (смесь 30% EtOAc/Hex) показывают, что реакция закончилась. Хроматография на силикагеле со смесью 25% EtOAc/Hex дает 0,92 г (выход 96%) фурана 3. С13 ЯМР (CDCl3) δ 217,88, 171,08, 155,34, 154,93, 152,38, 151,49, 140,72, 123,98, 110,56, 106,45, 77,50, 75,89, 60,51, 54,98, 54,71, 47,45, 46,57, 38,73, 37,66, 36,21, 35,91, 27,96, 22,22, 19,14, 13,98, 13,77.
Пример 3: получение диола 4 (схема I)
Раствор дикарбоната 3 (1,0 г) в 10 мл МеОН обрабатывают 500 мг К2СО3 и подогревают до 40°С. Затем смесь перемешивают, пока данные ТСХ показывают, что реакция закончилась. По окончании суспензию выливают в воду и продукт выделяют EtOAc. Концентрирование органической фракции дает диол 4 в виде вязкого масла. 1Н ЯМР (CDCl3) δ 5,7(с, Н), 5,45(д, J=5,7 Гц, 1Н), 3,45(м, 1Н), 3,29(т, J=5,1 Гц, 1Н), 2,09(с, 3Н), 1,1(с, 3Н), 0,75(с, 3Н).
Пример 4: получение алкина 5 (схема I)
Раствор 2,8 г (25,0 ммоль) трет-BuOK в 50 мл ТГФ при -10°С барботируют ацетиленом в течение 30 мин. Затем медленно добавляют раствор кетона 11 в 10 мл ТГФ, продолжая барботирование ацетиленом. Смесь перемешивают при -10°С в течение 1 ч и затем добавляют 2,0 мл уксусной кислоты в 10 мл воды. Продукт выделяют экстракцией EtOAc после того, как смесь выливают в воду. Толуол используют для удаления уксусной кислоты азеотропной перегонкой. Данные ЯМР свидетельствуют о наличии небольших количеств уксусной кислоты и толуола; выход 2,25 г. С13 ЯМР (CDCl3) δ 153,77, 151,21, 142,66, 122,83, 110,12, 106,1, 87,3, 79,42, 74,03, 72,29, 69,48, 50,61, 47,49, 45,70, 43,64, 42,87, 39,38, 39,06, 38,29, 37,68, 31,84, 23,7, 21,26, 19,27, 14,19, 13,9.
Пример 5: получение лактола 6 (схема I)
Раствор 1,55 г алкина 5 (схема I), 27 мг Rh2(OAc)2 и 92 мг Ph3Р в 20 мл EtOAc находится под давлением 100 фунтов/кв. дюйм СО и 100 фунтов/кв. дюйм Н2 и его нагревают до 80°С в течение ночи. Смесь концентрируют и хроматографируют на силикагеле с использованием смеси 90% EtOAc/Hex с получением 2 фракций. Данные ЯМР показывают, что фракция 1 представляет собой выделенное исходное соединение. Фракция 2 является желаемым лактолом. Данные 13С ЯМР показывают сигналы смеси лактола при 94,8 и 94,5 м.д.
Пример 6: получение 5,6-енона 6а (схема I)
Смесь 2,0 г лактола, 50 мг KBr, 12 мг ТЕМРО, 800 мг NaHCO3 в 20 мл СН2Cl2 и 5 мл воды охлаждают до 5°С. Затем данную смесь медленно обрабатывают 8 мл 1,1М раствора NaOCl, поддерживая температуру ниже 6°С. После добавления смесь перемешивают еще в течение 30 мин и затем продукт выделяют с использованием СН2Cl2 с получением соединения 6а (схема I). С13 ЯМР (CDCl3) δ 209,82, 176,37, 153,19, 151,78, 143,34, 128,15, 121,41, 110,62, 106,53, 94,35, 72,0, 55,39, 50,44, 47,99, 44,41, 42,26, 39,03, 38,63, 37,1, 35,67, 31,9, 29,19, 23,39, 18,33, 15,69, 14,07.
Пример 7: получение 4,5-енона 7 (схема I) с использованием кислоты
Смесь 5,6-енона 6а (схема I) (500 мг) и щавелевой кислоты (200 мг) в этаноле (10 мл) нагревают при 40°С в течение 3 ч. Этанол удаляют при пониженном давлении и остаток растворяют в этилацетате (50 мл), органический раствор промывают водой (2×50 мл), высушивают над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле с получением 4,5-енона 7 (схема I).
Пример 8: получение 4,5-енона 7 с использованием основания
Смесь 5,6-енона 6а (500 мг) и DBU (200 мг) в тетрагидрофуране (5 мл) кипятят с обратным холодильником в течение 3 ч, затем охлаждают, разбавляют раствором хлорида аммония и экстрагируют этилацетатом. Экстракт высушивают над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией на силикагеле с получением 4,5-енона 7.
Пример 9: получение диенона 9 (схема I)
Раствор 1,2 г спирта 7 растворяют в 10 мл ТГФ и охлаждают до -33°С. Затем одной порцией добавляют PCl5 (950 мг). Раствор перемешивают в течение 3 ч при -33°С и затем быстро гасят добавлением воды. Продукт выделяют EtOAc с получением диена 9 (схема I). Его очищают хроматографией на силикагеле с использованием смеси EtOAc/гексан.
Пример 10: получение метиловых эфиров из фурановых заме