Применение перфторалкилсодержащих комплексов металлов в качестве контрастных веществ в магнитно-резонансной томографии для визуализации бляшек, опухолей и некрозов
Иллюстрации
Показать всеИзобретение относится к области медицины и касается применения гадолиниевого комплекса [1-(4-перфтороктилсульфонил)пиперазин]амид 6-N-[1,4,7-трис(карбоксилатометил)-1,4,7,10-тетраазациклододекан-10-N-(пентаноил-3-аза-4-оксо-5-метил-5-ил)]-2-N-[1-0-α-D-карбонилметилманнопираноза]-L-лизина в качестве контрастного вещества при магнитно-резонансной томографии (МРТ) для визуализации бляшек. Изобретение повышает точность диагностики. 4 табл., 18 ил.
Реферат
Настоящее изобретение относится к применению перфторалкилсодержащих комплексов металлов, характеризующихся критической концентрацией мицеллообразования менее 10-3 молей/л, гидродинамическим диаметром мицелл (2Rh) более 1 нм и релаксационностью протонов в плазме (R1) более 10 л/ммоль-с, в качестве контрастных веществ в магнитно-резонансной (МР) томографии для визуализации бляшек, лимфатических узлов, инфарцированной и некротической ткани, а также для независимой визуализации некротической ткани и опухолевой ткани. При создании изобретения было установлено, что перфторалкилсодержащие комплексы металлов, обладающие указанными выше свойствами, наиболее пригодны для независимой визуализации бляшек, опухолей и некрозов с помощью МР-томографии и одновременно позволяют охватить играющую важную роль в диагностике инфарктов и некрозов область томографии.
Артериосклероз представляет собой имеющее наиболее важное значение и наиболее часто встречающееся болезненное изменение артерий, сопровождающееся уплотнением и утолщением их стенок, утратой их стенками эластичности и стенозом. Артериосклероз является наиболее частой причиной смерти в западных промышленно развитых странах. Изменения стенок сосудов в результате отложения липидов, разрастания соединительной ткани и кальциноза с неравномерным распределением приводят к нестабильности стенок сосудов, их сужению и к отложению сгустков. Подобное заболевание обусловлено самыми различными экзогенными и эндогенными факторами, соответственно болезнями, например гипертонией, гиперлипидемией, гиперфибриногенемией, сахарным диабетом, токсинами, никотином, комплексами антиген-антитело, воспалительными процессами, гипоксией, психическим стрессом, возрастом и проблемами в семейных отношениях. Под влиянием всех подобных факторов нарушается целостность внутренней оболочки сосудов, нарушается контроль за ростом гладкомышечных клеток стенок сосудов, а также нарушается процесс разложения компонентов состарившихся клеток. Собственно артериосклероз в принципе не поддается лечению, и поэтому все врачебные усилия преимущественно сводятся к предупреждению этого заболевания за счет уменьшения факторов риска его возникновения, например за счет использования средств, понижающих уровень липидов в крови.
Для диагностики артериосклероза в настоящее время в клинической практике преимущественно используется ангиография, которая в этой области является своего рода "золотым стандартом". Однако все методы, основанные на измерении степени уменьшения просвета сосуда, ограничены диагностикой той ранней стадии развития заболевания, для которой характерно утолщение стенки сосуда при нормальном его просвете (см. Glagov S., Zarins С.К., Quantitating atherosclerosis, Clinical Diagnosis of Atherosclerosis. Quantitative Methods of Evaluation, под ред. Bond M.G., Insull W., Glagov S., Chandler А.В., Cornhill J.F., изд-во Springer Verlag, New York 1983, cc.11-35). Другим методом, позволяющим в диагностических целях оценить состояние стенки сосуда и его просвет, является внутрисосудистое или чрескожное ультразвуковое исследование.
Томография, основанная на методе ядерного магнитного резонанса (ЯМР-томография или МРТ), является современным, неинвазивным радиологическим методом, позволяющим с исключительно высоким пространственным и временным разрешением визуализировать физиологические и патофизиологические структуры. Применение же при подобной томографии особых контрастных веществ, способных селективно накапливаться в определенных тканях и органах, позволяет существенно повысить ее ценность как метода диагностического исследования. Очевидно, что композиции на основе контрастных веществ, способных селективно накапливаться в атеросклеротических бляшках, позволили бы определять в более ранний момент времени местонахождение очага заболевания и степень его развития и тем самым обеспечили бы возможность целенаправленного лечения и профилактики того или иного заболевания, и поэтому поиск пригодных для этой цели контрастных веществ ведется уже достаточно давно.
Так, например, в патенте US 4577636 было предложено использовать гематопорфириновые производные в качестве контрастных веществ для выявления атеросклеротических бляшек. В качестве методов исследования в указанном патенте названы сцинтиграфия, рентгенография, основанные на флюоресценции методы, а для парамагнитных металлопорфиринов - также ЯМР-спектрометрия. В качестве парамагнитных ионов в указанной публикации упомянуты Gd, Cr, Co, Ni, Ag и Eu. Недостаток всех этих соединений состоит в том, что порфирины откладываются в коже и изменяют ее цвет, каковой эффект может сохраняться в течение нескольких недель. Помимо этого такие соединения вызывают фотосенсибилизацию. Кроме того, при длительном нахождении этих соединений in vivo существует опасность "потери" металла металлопорфирином.
В заявке WO 95/09856 описаны металлопорфирины (дейтеропорфирины), предназначенные для диагностики и терапии бляшек. В качестве диагностического метода в этой публикации упомянута МРТ. Однако и относящиеся к этому типу порфирины также изменяют цвет кожи.
В заявке WO 95/09013 описаны конъюгаты из специфически связывающихся полипептидов и комплексов металлов. Согласно указанной заявке эти соединения должны также связываться с бляшками и тем самым обеспечивать возможность их диагностики и терапии. В качестве диагностических методов в этой публикации упомянуты сцинтиграфия, компьютерная томография и МРТ. В этой заявке экспериментально подтвержденные данные приведены только для сцинтиграфии, тогда как для МРТ какие-либо данные отсутствуют.
В патенте US 5807536 описаны меченые фикоцианины, предназначенные для применения в качестве контрастных веществ для визуализации бляшек. В качестве диагностических методов в этой публикации упомянуты рентгенография, компьютерная томография, сцинтиграфия, однофотонная эмиссионная компьютерная томография (ОФЭКТ) и МРТ. Экспериментально подтвержденные данные приведены в указанном патенте только для сцинтиграфии.
Из литературы известны многочисленные контрастные вещества для визуализации инфарктов и некрозов. Попытки повысить эффективность локализации, т.е. определения местонахождения, инфарктов и некрозов за счет применения контрастных веществ при неинвазивных методах, таких как сцинтиграфия или ЯМР-томография, предпринимались уже достаточно давно. При этом большое число опубликованных работ посвящено экспериментальным исследованиям по использованию порфиринов для визуализации некрозов. Однако полученные в ходе подобных исследований результаты носят противоречивый характер. Так, в частности, в работе Winkelman и Hoyes, опубликованной в Nature, 200 (1967), с.903, говорится о селективном накоплении марганец-5,10,15,20-тетракис(4-сульфонатофенил)порфирина (ТФПС) в некротической области опухоли.
В отличие от этого в работе Lyon и др. (Magn. Res. Med. 4 (1987), с.24) говорится о том наблюдавшемся этими авторами эффекте, что марганец-ТФПС распределяется по существу по всему организму, а именно, накапливается в почках, печени, опухоли и лишь незначительно в мышечных тканях. Особый интерес при этом представляет тот факт, что концентрация указанного вещества в опухоли достигает максимума только на 4-й день после введения, и то лишь после повышения дозы с 0,12 ммолей/кг до 0,2 ммолей/кг. Поэтому авторами делается также вывод о неспецифическом накоплении ТФПС в опухолевой ткани. В работе Bockhurst и др., опубликованной в Acta Neurochir. 60 (1994, дополн.), с.347, вновь говорится о селективном связывании Mn-ТФПС с опухолевыми клетками.
В свою очередь по результатам исследований, проводившихся Foster и др. (J. Nucl. Med. 26 (1985), с.756), было установлено, что 11In-5,10,15,20-тетракис(4-N-метилпиридиний)порфирин (ТМПиП) накапливается не в некротической области, а в окружающих ее живых краевых слоях. На основании этого можно было бы сделать очевидный вывод о наличии взаимодействия между порфирином и тканью, что, однако, не обязательно соответствует действительности.
В работе Ni и др., опубликованной в Circulation, т.90, №4, часть 2, с.1468, Реферат №2512 (1994), сообщалось о возможности визуализации затронутых инфарктом областей с помощью марганец-тетрафенилпорфирина (Mn-ТФП) и гадолиний-мезопорфирина (Gd-МП). Согласно заявке WO 95/31219 оба этих вещества использовались для визуализации инфарктов и некрозов. В этой заявке, авторами которой являются Marchal и Ni, говорится (см. пример 3), что при использовании соединения Gd-МП содержание металла в пораженной инфарктом почке находилось на том же уровне, что и в неинфарцированном органе, тогда как в миокарде содержание металла в инфарцированной ткани (см. пример 1) в девять раз превышало его содержание в неинфарцированной ткани. Неожиданным является при этом тот факт, что при МРТ соотношение между интенсивностью сигнала, формируемого инфарцированной тканью, и интенсивностью сигнала, формируемого здоровой тканью, в обоих случаях находилось на сравнительно высоком уровне и составляло 2,10 и 2,19 соответственно. Другие металлопорфирины описаны в заявке DE 19835082 (на имя Schering AG).
Порфирины обладают тенденцией накапливаться в коже, что приводит к ее фотосенсибилизации. Подобная сенсибилизация может сохраняться в течение нескольких дней, а иногда и в течение нескольких недель. В этом заключается нежелательный побочный эффект, проявляющийся при применение порфиринов в качестве диагностикумов. Помимо этого порфирины имеют лишь исключительно низкий терапевтический индекс, поскольку, например, в случае Mn-ТФПС его действие проявляется только при его использовании в дозе 0,2 ммоля/кг, тогда как его летальная доза ЛД50 составляет уже 0,5 ммоля/кг.
Другие контрастные вещества, не являющиеся производными порфиринового каркаса и предназначенные для визуализации некрозов и инфарктов, описаны в заявках DE 19744003 (на имя Schering AG), DE 19744004 (на имя Schering AG) и WO 99/17809 (на имя EPIX).
Так, в частности, в заявке DE 19744003 описаны олигомерные соединения, состоящие из ядра, с которым связано от 1 до 3 комплексов металлов.
В заявке DE 19744004 описаны липофильные комплексы металлов для визуализации некрозов и инфарктов. К таким соединениям относятся металлические комплексы полиаминополикарбоновых кислот, полиаминополифосфоновых кислот, порфиринов, тексафиринов, сапфиринов, пептидов.
В поданной на имя EPIX заявке WO 99/17809 описано применение производных ДТПК (диэтилентриаминпентауксусной кислоты) для визуализации некрозов. Наиболее значимым соединением при этом является гадолиниевый комплекс фосфодиэфира гидроксиметил-ДТПК (MS-325).
Известно также применение перфторалкилсодержащих комплексов металлов в качестве контрастных веществ в МР-томографии. Так, в частности, в заявках WO 97/26017 (на имя Schering) и WO 99/01161 (на имя Schering) описано применение перфторалкилсодержащих комплексов металлов в качестве контрастных веществ в лимфографии. В заявке WO 99/01161 говорится, кроме того, о пригодности этих соединений для визуализации внутрисосудистой полости (контрастные вещества для визуализации пулов крови).
В литературе описано также применение контрастных веществ для индивидуальной визуализации опухолей и некрозов с помощью МР-томографии.
Так, в частности, в заявке ЕР 417870 А1 описаны соединения, предназначенные для диагностики и терапии опухолей. В этой заявке говорится также о возможности визуализации инфарктов и ишемий. Однако в указанной заявке не представлено никаких экспериментально полученных данных, которые подтверждали бы подобную возможность. Описанные в этой заявке соединения представляют собой хелатные комплексы типов N2S2 и N3S с радиоизотопами. В качестве диагностического метода в этой заявке упомянута сцинтиграфия.
Сцинтиграфия используется в качестве диагностического метода и в заявке DE 19646762. В этой публикации описаны хелатные комплексы металлов, применяемые в качестве радиосенсибилизаторов для терапии обусловленных гипоксией опухолей и для диагностики обусловленных гипоксией состояний и некрозов. В описательной части этой заявки в качестве диагностических методов упоминаются ЯМР-диагностика, рентгенодиагностика и радионуклидная диагностика.
В заявке DE 19824653 описаны порфирины в качестве обладающих аффинностью по отношению к некрозам веществ, предназначенные для терапии опухолей. В этой заявке говорится, в частности, что эти соединения накапливаются в некротических и гипоксических областях опухолей. Такие соединения могут применяться в диагностических целях в виде их металлических производных с парамагнитными ионами, соответственно радиоизотопами.
Общим для обеих указанных заявок - DE 19646762 и DE 19824653 - является тот факт, что в них не предусмотрена возможность визуализации некрозов независимо от визуализации опухолей (или наоборот), а возможна только визуализация некроза как части опухоли.
В основу настоящего изобретения была положена задача предложить пригодные для МР-томографии контрастные вещества, которые позволяли бы не только визуализировать бляшки, лимфатические узлы, инфарцированную и некротическую ткань, но и позволяли бы визуализировать некрозы независимо от визуализации опухолей (или наоборот).
При создании изобретения неожиданно было установлено, что перфторалкилсодержащие комплексы металлов, характеризующиеся критической концентрацией мицеллообразования менее 10-3 молей/л, гидродинамическим диаметром мицелл (2Rh) более 1 нм и релаксационностью протонов в плазме (R1) более 10 л/ммоль-с, в высшей степени пригодны для применения в качестве контрастных веществ в МР-томографии для визуализации бляшек. Помимо этого такие соединения могут использоваться также для визуализации лимфатических узлов, инфарцированной и некротической ткани, а также для независимой визуализации некротической и опухолевой тканей.
Под пригодными для предусмотренного изобретением применения перфторалкилсодержащими комплексами металлов подразумеваются амфифильные соединения, в молекуле которых в качестве неполярного фрагмента имеется перфторалкильная боковая цепь, которая необязательно связана со всей молекулой липофильным линкером. Полярный фрагмент предлагаемых в изобретении соединений образован одним или несколькими металлическими комплексами и необязательно присутствующими другими полярными группами.
В водных системах подобные амфифильные молекулы проявляют характерные для традиционных ПАВ (таких, например, как додецилсульфат натрия, ДСН) свойства. Так, например, эти молекулы снижают поверхностное натяжение воды. С помощью тензиометрии можно определить так называемую критическую концентрацию мицеллообразования (ККМ, в молях/л). С этой целью определяют поверхностное натяжение в зависимости от концентрации анализируемого вещества. ККМ можно вычислить на основании характеристики изменения полученной функции поверхностного натяжения (с). Критическая концентрация мицеллообразования у предлагаемых в изобретении соединений должна быть меньше 10-3 молей/л, предпочтительно меньше 10-4 молей /л.
Предлагаемые в изобретении амфифильные соединения ассоциированы в растворе и представлены в виде агрегатов. Размер (2Rh) подобных агрегатов (имеющих, например, форму мицелл, палочек, облаток и т.п.) можно определять с помощью фотонно-корреляционной спектроскопии (ФКС).
В соответствии с этим вторым критерием является гидродинамический диаметр мицелл 2Rh, который должен быть больше 1 нм. Более предпочтительными являются согласно изобретению те перфторалкилсодержащие комплексы металлов, величина 2Rh которых равна или превышает 3 нм, наиболее предпочтительно превышает 4 нм.
Методика определения ККМ, а также фотонно-корреляционная спектроскопия описаны у H.-D. Dörfler, "Grenzflächen- und Kolloidchemie", изд-во VSH, Weinheim, New York, Basel, Cambridge, Tokyo, 1994.
Третьим критерием служит релаксационность протонов в плазме (R1) при 40°С и напряженности поля 0,47 тесла. Релаксационность, выражаемая в [л/ммоль-с], является количественной мерой, характеризующей уменьшение времени релаксации T1 протонов. Для предусмотренного изобретением применения такая релаксационность должна быть предельно высокой и должна составлять более 10 л/ммоль-с, предпочтительно более 13 л/ммоль-с, наиболее предпочтительно более 15 л/ммоль-с.
Релаксационность R1 [л/ммоль-с] предлагаемых в изобретении контрастных веществ для МР-томографии определяли с помощью прибора Minispec P 20 фирмы Bruker. Измерения проводили при 40°С и напряженности поля 0,47 тесла. Для каждой T1-последовательности: 180°-TI-90°, режим "инверсия-восстановление", измерения проводили в 8 точках. В качестве среды при измерениях использовали бычью плазму, поставляемую фирмой Kraeber. Концентрация контрастного вещества в анализируемых смесях составляла от 0,30 до 1,16 ммолей/л.
В одном из вариантов осуществления настоящего изобретения предпочтительными для применения являются соединения общей формулы I согласно п.п.8-11 формулы изобретения. При этом речь идет об известных соединениях, описанных в заявке WO 97/26017. Способ получения таких соединений также описан в этой заявке. Неожиданно было установлено, что эти соединения пригодны и для применения в качестве контрастных веществ при МРТ для визуализации бляшек. Наиболее предпочтительно при этом применять соединения, представляющие собой металлические комплексы I-IV, VI и XI-XIII (см. также таблицу 1).
В другом варианте осуществления настоящего изобретения предпочтительными для применения являются соединения общей формулы Ia согласно п.п.12-21. Эти соединения известны и описаны в заявке WO 99/01161. Однако возможность применения таких соединений в качестве контрастных веществ при МРТ для визуализации бляшек до настоящего времени в литературе описано не было. Среди этих соединений особенно предпочтительно применять металлический комплекс XIV (см. таблицу 1).
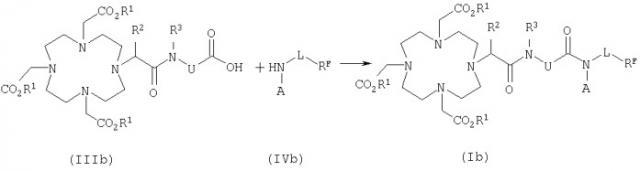
Согласно еще одному предпочтительному варианту осуществления изобретения можно применять макроциклические перфторалкильные соединения общей формулы Ib
в которой
К представляет собой комплексообразователь или металлический комплекс общей формулы IIb
где
R1 обозначает атом водорода или эквивалент иона металла с порядковым номером 23-29, 42-46 или 58-70,
R2 и R3 обозначают атом водорода, С1-С7алкильную группу, бензильную группу, фенильную группу, -СН2ОН или -СН2-ОСН3 и
U2 представляет собой остаток L1, при этом L1 и U2 независимо друг от друга могут иметь идентичные или различные значения,
А1 представляет собой атом водорода, линейную или разветвленную С1-С30алкильную группу, которая необязательно прервана 1-15 атомами кислорода и/или необязательно замещена 1-10 гидроксигруппами, 1-2 СООН-группами, фенильной группой, бензильной группой и/или 1-5-ORg-группами, где Rg обозначает атом водорода либо С1-С7алкильный остаток, или -L1-RF,
L1 представляет собой линейную или разветвленную С1-С30алкиленовую группу, которая необязательно прервана 1-10 атомами кислорода, 1-5 -NH-CO-группами, 1-5 -CO-NH-группами, необязательно замещенной СООН-группой фениленовой группой, 1-3 атомами серы, 1-2 -N(B1)-SO2-группами и/или 1-2 -SO2-N(B1)-группами, где В1 имеет указанные для А1 значения или обозначает NHCO-группу, CONH-группу, N(B1)-SO2-группу либо -SO2-N(B1)-группу и/или необязательно замещена остатком RF, и
RF представляет собой линейный или разветвленный перфорированный алкильный остаток формулы СnF2nЕ, где
n обозначает числа от 4 до 30, а
Е обозначает концевой атом фтора, хлора, брома, йода или водорода, при этом необязательно присутствующие кислотные группы при определенных условиях могут быть представлены в виде солей органических и/или неорганических оснований или аминокислот либо амидов аминокислот.
Поскольку предлагаемые в изобретении соединения предназначены для их применения при ЯМР-диагностике, ион металла формирующей сигнал группы должен быть парамагнитным. К подобным ионам относятся прежде всего двух- и трехвалентные ионы элементов порядковых номеров 23-29, 42-46 и 58-70. В качестве примера пригодных для применения в указанных целях ионов можно назвать ионы хрома(III), железа(II), кобальта(II), никеля(II), меди(II), празеодима(III), неодима(III), самария(III) и иттербия(III). Наиболее предпочтительны при этом с учетом их высокого магнитного момента ионы гадолиния(III), тербия(III), диспрозия(III), гольмия(III), эрбия(III), железа(III) и марганца(II).
Предпочтительны ионы марганца(II), железа(II), железа(III), празеодима(III), неодима(III), самария(III), гадолиния(III) и иттербия(III), прежде всего диспрозия(III).
Алкильные группы, указанные в качестве значений для R2, R3, Rg, могут иметь прямую или разветвленную цепь. В качестве примеров таких групп можно назвать метил, этил, пропил, изопропил, н-бутил, 1-метилпропил, 2-метилпропил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил и 1,2-диметилпропил.
Предпочтительными значениями R2, R3, и Rg являются водород и С1-С4алкильные группы, а наиболее предпочтительными являются водород и метильная группа.
Бензильная и фенильная группа, указанные в качестве значений для R2, A1 и В1, могут быть замещены в фенильном кольце. В качестве заместителя при этом рассматривается СООН-группа.
Если в соединении формулы Ib одновременно присутствуют остатки L1 и U2, то каждый из этих остатков L1 и U2 может иметь значение, отличное от значения другого остатка.
С1-С30алкиленовые группы, указанные в качестве значений для U2, могут иметь прямую или разветвленную цепь. В качестве примера таких групп можно назвать метилен, этилен, пропилен, изопропилен, н-бутилен, 1-метилпропилен, 2-метилпропилен, н-пентилен, 1-метилбутилен, 2-метилбутилен, 3-метилбутилен и 1,2-диметилпропилен.
Предпочтительными значениями для U2, когда он представляет собой алкилен, являются C1-С10алкиленовые группы, наиболее предпочтительно С1-С4алкиленовые группы.
С1-С30алкильные группы, указанные в качестве значений для А1, могут иметь прямую или разветвленную цепь. В качестве примера таких групп можно назвать метил, этил, пропил, изопропил, н-бутил, 1-метилпропил, 2-метилпропил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,2-диметилпропил и н-гексил.
Помимо этого С1-С30алкильные группы, указанные в качестве значений для А1, могут быть прерваны 1-15 атомами кислорода и/или могут быть замещены 1-10 гидроксигруппами, 1-5 алкоксигруппами или 1-2 СООН-группами, и в соответствии с этим могут прдставлять собой, например С2Н4-O-СН3, С3Н6-O-СН3, С2Н4-O-(С2Н4-O)t-С2Н4-ОН, С2Н4-O-(С2Н4-O)t-С2Н4-ОСН3, где t=0-13, С2Н4OH, С3Н6ОН, C4H8OH, С3Н10ОН, C6H12OH, C7H14OH, а также их разветвленные изомеры, СН(ОН)СН2OH, СН(ОН)СН(ОН)СН2OH, СН2[СН(ОН)]u1СН2OH, где u1=1-10, СН[СН2(ОН)]СН(ОН)СН2OH, С2Н4СН(ОН)СН2OH, (CH2)sCOOH, где s=1-15, С2Н4-O-(С2Н4-O)t-СН2СООН, где t=0-13, С2Н4-O-(С2Н4-O)t-С2Н4-СnF2nЕ, где t=0-13, n=4-20, а Е обозначает атом фтора, водорода, хлора, брома или йода.
Предпочтительными значениями А1 являются водород, C1-С10алкил, С2Н4-O-СН3, С3Н6-O-СН3, С2Н4-O-(С2Н4-O)х-С2Н4-ОН, С2Н4-O-(С2Н4O)х-С2Н4-ОСН3, где х=0-5, С2Н4OH, С3Н6ОН, СН2[СН(ОН)]уСН2OH, где y=1-6, СН[СН2(ОН)]СН(ОН)СН2OH, (CH2)wCOOH, где w=1-10, С2Н4-O-(С2Н4-O)х-СН2СООН, где х=0-5, C2H4-O-(C2H4-O)x-C2H4-CnF2nE, где х=0-5, n=4-15, а Е обозначает атом фтора.
Если в соединении общей формулы Ib присутствуют два остатка L1-RF, то они могут иметь различные, не зависящие друг от друга значения.
В качестве примера значения остатка L можно назвать следующие, при этом α обозначает связь с атомом азота, а β обозначает связь с остатком RF:
α-(СН2)s-β, где s=1-15, α-СН2-СН2-(O-СН2-СН2-)у-β, где y=1-6,
α-СН2-(O-СН2-СН2-)у-β, где y=1-6, α-CH2-NH-CO-β, α-CH2-CH2-NH-SO2-β,
α-CH2-NH-CO-CH2-N(CH2COOH)-SO2-β, α-CH2-NH-CO-CH2-N(C2H5)-SO2-β,
α-CH2-NH-CO-CH2-N(C10Н21)-SO2-β, α-CH2-NH-CO-CH2-N(C6H13)-SO2-β,
α-CH2-NH-CO-(CH2)10-N(C2H5 )-SO2-β, α-CH2-NH-CO-CH2-N(-CH2-C6H5)-SO2-β,
α-CH2-NH-CO-CH2-N(-CH2-CH2-OH)SO2-β, α-CH2-NHCO-(CH2)10-S-CH2CH2-β,
α-СН2NHCOCH2-O-СН2СН2-β, α-СН2-СН2NHCOCH2-O-СН2СН2-β,
α-СН2-(СН2-СН2-O)у-(СН2)3NHCO-СН2-O-СН2СН2-β, где y=1-6,
α-CH2NHCO(CH2)10-O-CH2CH2-β, α-CH2CH2NHCO(CH2)10-O-CH2CH2-β,
α-СН2-С6Н4-O-СН2СН2-β, при этом фениленовая группа присоединена в положении 1,4 или 1,3, α-СН2-O-СН2-С(СН2-ОСН2СН2-С6F13)2-СН2-ОСН2-СН2-β,
α-CH2-NHCOCH2CH2CON-CH2CH2NHCOCH2N(C2H5)SO2C8F17-β,
α-CH2-CH2NHCOCH2N(C2H5)-SO2-β,
α-CH2-O-CH2-CH(OC10Н21)-CH2-O-CH2CH2-β, α-(CH2NHCO)4-CH2O-CH2CH2-β,
α-(СН2NHCO)3-СН2O-СН2СН2-β, α-СН2-ОСН2С(СН2OH)2-СН2-O-СН2СН2-β,
α-CH2NHCOCH2N(C6H5)-SO2-β, α-NHCO-CH2-CH2-β, α-NHCO-CH2-O-CH2CH2-β,
α-NH-CO-β, α-NH-CO-CH2-N(CH2COOH)-SO2-β, α-NH-CO-CH2-N(C2H5)-SO2-β,
α-NH-CO-CH2-N(C10Н21)-SO2-β, α-NH-CO-CH2-N(C6H13)-SO2-β,
α-NH-CO-(CH2)10-N(C2H5)-SO2-β, α-NH-CO-CH2-N(-CH2-C6H5)-SO2-β,
α-NH-CO-CH2-N(-CH2-CH2-OH)SO2-β, α-NH-CO-CH2-β,
α-СН2-O-С6Н4-O-СН2-СН2-β, α-СН2-С6Н4-O-СН2-СН2-β, α-N(С2Н5)-SO2-β,
α-N(C6H5)-SO2-β, α-N(C10Н21)-SO2-β, α-N(C6H13)-SO2-β, α-N(C2H4OH)-SO2-β,
α-N(CH2COOH)-SO2-β, α-N(CH2C6H5)-SO2-β, α-N-[CH(CH2OH)2]-SO2-β,
α-N-[CH(CH2OH)CH(OH)(CH2OH)]-SO2-β.
Предпочтительны, в частности, следующие остатки: α-СН2-О-СН2СН2-β,
α-СН2-СН2-(O-СН2-СН2-)у-β, где y=1-6, α-СН2-(O-СН2-СН2-)у-β, где y=1-6,
α-CH2-CH2-NH-SO2-β, α-CH2NHCOCH2-O-CH2CH2-β,
α-CH2-CH2NHCOCH2-O-CH2CH2-β,
α-СН2-(СН2-СН2-O)у-(СН2)3NHCO-СН2-O-СН2СН2-β, где y=1-6,
α-CH2NHCO(CH2)10-O-CH2CH2-β, α-CH2CH2NHCO(CH2)10-O-CH2CH2-β,
α-СН2-O-СН2-СН(ОС10Н21)-СН2-O-СН2СН2-β, α-СН2-O-С6Н4-O-СН2-СН2-β,
α-СН2-С6Н4-O-СН2-СН2-β.
Согласно изобретению наиболее предпочтительны остатки L1, указанные в приведенных ниже примерах соединений.
К значениям U2 относятся приведенные выше остатки в качестве значений L1 и указанные как предпочтительные и наиболее предпочтительные остатки, а также приведенные выше для значения "алкилен" и при определенных условиях указанные в качестве предпочтительных и наиболее предпочтительных остатки, при условии, что в α-положении не должен присутствовать атом азота, а в концевом положении (β-положении) не должна присутствовать SO2- или СО-группа.
Предпочтительными значениями остатка В1 являются водород, линейные или разветвленные С1-С10алкильные остатки, которые необязательно прерваны 1-5 атомами кислорода и/или необязательно замещены 1-5 гидроксигруппами, 1-2 СООН-группами, необязательно замещенной СООН-группой, фенильной группой, бензильной группой и/или 1-5 -ORg-группами, где Rg представляет собой атом водорода или С1-С3алкильный остаток.
Предпочтительными значениями остатка RF являются линейные или разветвленные перфторированные алкильные остатки формулы CnF2nE, в которой n обозначает числа от 4 до 15, а Е представляет собой концевой атом фтора.
Предлагаемые в изобретении соединения общей формулы Ib
в которой К представляет собой комплексообразователь или комплекс металла общей формулы IIb
можно получать рассмотренными ниже методами.
Метод А
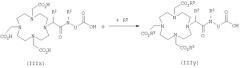
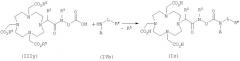
Карбоновая кислота формулы IIIb уже содержит эквивалент иона металла R1.
Необязательно активированную in situ карбоновую кислоту формулы IIIb, в которой R1 представляет собой эквивалент иона металла, подвергают взаимодействию в условиях реакции сочетания с амином формулы IVb с получением амида формулы Ib.
Этот метод получения металлических комплексов амидов карбоновых кислот известен из DE 19652386.
Используемую в реакции сочетания смесь, состоящую из металлического комплекса карбоновой кислоты IIIb, присутствующие в которой при определенных условиях карбокси- и/или гидроксигруппы представлены в защищенной форме, и по меньшей мере одного способствующего растворению вещества в количестве до 5, предпочтительно от 0,5 до 2, молярных эквивалентов в пересчете на металлический комплекс карбоновой кислоты, либо можно получать на предшествующей реакционной стадии, выделять (например, путем упаривания, сублимационной сушки или распылительной сушки водного или смешивающегося с водой раствора компонентов или же путем осаждения из подобного раствора органическим растворителем) и затем подвергать взаимодействию в ДМСО с дегидратирующим реагентом (осушителем) и необязательно со вспомогательным агентом сочетания, либо можно получать in situ необязательно за счет добавления к суспензии металлического комплекса карбоновой кислоты в ДМСО способствующего(-их) растворению вещества(веществ), дегидратирующего реагента и необязательно вспомогательного агента сочетания.
Полученный одним из этих методов реакционный раствор для его предварительной обработки (активирования кислоты) в течение 1-24 ч, предпочтительно 3-12 ч, выдерживают при температуре от 0 до 50°С, предпочтительно при комнатной температуре.
После этого в реакционный раствор добавляют амин общей формулы IVb
в которой остатки R3, L1, RF и А1 имеют указанные выше значения, который используют без растворителя или в растворенном виде, например в диметилсульфоксиде, спиртах, таких как метанол, этанол, изопропанол или их смеси, формамид, диметилформамид, вода либо смеси указанных растворителей, предпочтительно в диметилсульфоксиде, в воде или в смешанных с водой растворителях. Затем для образования амида полученный таким путем реакционный раствор выдерживают для проведения реакции сочетания при температуре от 0 до 70°С, предпочтительно от 30 до 60°С, в течение 1-48 ч, предпочтительно 8-24 ч.
В некоторых случаях, как было установлено, амин предпочтительно использовать в реакции в виде его соли, например в виде гидробромида или гидрохлорида. Для высвобождения амина добавляют основание, такое, например, как триэтиламин, диизопропилэтиламин, N-метилморфолин, пиридин, трипропиламин, трибутиламин, гидроксид лития, карбонат лития, гидроксид натрия или карбонат натрия.
После этого все еще присутствующие при определенных условиях защитные группы отщепляют.
Реакционный продукт выделяют известными методами, предпочтительно осаждением органическими растворителями, предпочтительно ацетоном, 2-бутаноном, диэтиловым эфиром, этиловым эфиром уксусной кислоты, метил-трет-бутиловым эфиром, изопропанолом или их смесями. Последующую очистку можно проводить, например, путем хроматографии, кристаллизации или ультрафильтрации.
Для применения в качестве способоствующих растворению веществ пригодны соли щелочных металлов, соли щелочноземельных металлов, соли триалкиламмония, соли тетраалкиламмония, мочевины, N-гидроксиимиды, гидроксиарилтриазолы, замещенные фенолы и соли гетероциклических аминов. При этом в качестве конкретных примеров можно назвать хлорид лития, бромид лития, йодид лития, бромид натрия, йодид натрия, метансульфонат лития, метансульфонат натрия, n-толуолсульфонат лития, n-толуолсульфонат натрия, бромид калия, йодид калия, хлорид натрия, бромид магния, хлорид магния, йодид магния, n-толуолсульфонат тетраэтиламмония, n-толуолсульфонат тетраметиламмония, n-толуолсульфонат пиридиния, n-толуолсульфонат триэтиламмония, 2-морфолиноэтилсульфоновую кислоту, 4-нитрофенол, 3,5-динитрофенол, 2,4-дихлорфенол, N-гидроксисукцинимид, N-гидроксифталимид, мочевину, тетраметилмочевину, N-метилпирролидон, формамид, а также циклические мочевины, при этом среди указанных выше пять первых из них предпочтительны.
В качестве дегидратирующих реагентов можно использовать все известные специалистам средства. При этом в качестве примера можно назвать карбодиимиды и ониевые реагенты, такие как дициклогексилкарбодиимид (ДЦКД), 1-этил-3-(3-диметиламинопропил)карбодиимидгидроксихлорид (ЭДК), гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (БОФ) и гексафторфосфат O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония (ГБТУ), предпочтительно ДЦКД.
Ниже в качестве примера представлены литературные источники, в которых описаны приемлемые методы;
- активирование карбоновых кислот: обзорная информация в Houben-Weyl, Methoden der Organischen Chemie, том XV/2, изд-во Georg Thieme Verlag Stuttgart, 1974 (и J. Chem. Research (S) 1996, с.302);
- активирование карбодиимидами: R.Schwyzer и Н.Kappeler, Helv. 46 (1963), с.1550;
- E.Wünsch и др., В. 100 (1967), с.173;
- активирование карбодиимидами/гидроксисукцинимидом: J. Am. Chem. Soc. 86 (1964), с.1839, а также J. Org. Chem. 53 (1988), с.3583, Synthesis 453 (1972);
- ангидридный метод, 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин: В.Belleau и др., J. Am. Chem. Soc., 90 (1986), с.1651, Н.Kunz и др., Int. J.Pept. Prot. Res., 26 (1985), с.493, и J.R.Voughn, Am. Soc. 73 (1951), с.3547;
- имидазолидный метод: B.F.Gisin, R.B.Menifield, D.C.Tosteon, Am. Soc. 91 (1969), с.2691;
- методы с хлорангидридами кислот, тионилхлорид: Helv., 42 (1959), с.1653;
- оксалилхлорид: J. Org. Chem., 29 (1964), с.843.
Для применения в качестве необязательно используемых вспомогательных агентов сочетания пригодны все известные специалистам агенты (Houben-Weyl, Methoden der organischen Chemie, т. XV/2, изд-во Georg Thieme Verlag, Stuttgart, 1974). В качестве примера при этом можно назвать 4-нитрофенол, N-гидроксисукцинимид, 1-гидроксибензотриазол, 1-гидрокси-7-азабензотриазол, 3,5-динитрофенол и пентафторфенол. Среди этих соединений предпочтительны 4-нитрофенол и N-гидроксисукцинимид, а наиболее предпочтительным является первый из указанных агентов.
Защитные группы отщепляют по известным методам, например путем гидролиза, гидрогенолиза, щелочного омыления сложных эфиров щелочью в водно-спиртовом растворе при температуре от 0 до 50°С, кислотного омыления минеральными кислотами или - в случае, например, сложных трет-бутиловых эфиров - с помощью трифторуксусной кислоты [Protective Groups in Organic Synthesis, 2-е изд., T.W.Greene и P.G.M.Wuts, изд-во John Wiley and Sons, Inc. New York, 1991], а в случае простых бензиловых эфиров - с помощью водорода в присутствии палладия на угле.
Способ получения ис