Хиноновое терапевтическое средство для лечения заболевания печени
Иллюстрации
Показать всеИзобретение относится к медицине. Описано лекарственное средство для лечения заболевания печени путем предотвращения начала инвазии воротной вены (ИВВ), где указанным средством является эффективное средство для лечения/предупреждения заболевания печени, содержащее менатетренон в качестве активного ингредиента. Указанное средство для лечения/предупреждения заболевания печени является эффективным против рака печени, а в частности, против DCP (дес-γ-карбоксипротромбин)-позитивного рака печени. Средство для лечения/предупреждения заболевания печени, содержащее менатетренон в качестве активного ингредиента, значительно улучшает прогноз после проведения противораковой терапии, а также обладает превосходным эффектом, направленным на предотвращение рецидивов рака печени. 4 н.п. ф-лы, 2 табл., 10 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к средству для лечения заболеваний печени, а более конкретно к средству, улучшающему прогноз рака печени и содержащему менатетренон в качестве активного ингредиента.
Предшествующий уровень техники
Известно, что у пациентов с гепатоцеллюлярной карциномой (называемой далее «ГЦК») наблюдается высокий уровень инвазии воротной вены (обозначаемой далее «ИВВ»), и после ИВВ прогноз становится очень плохим. Известно, что высокий уровень дес-γ-карбоксипротромбина (называемого далее "DCP") у пациентов с ГЦК тесно связан с последующим развитием ИВВ (см. Koike Y., Cancer 2001, 91:561-9). DCP также обозначается PIVKA-II (белок, индуцированный отсутствием витамина К, или антагонистом II). DCP представляет собой протромбин, который не обладает нормальной коагулирующей активностью, при этом известно, что в случае дефицита витамина К (называемого далее "VK"), его уровень возрастает; таким образом, DCP представляет собой белок, используемый в качестве маркера дефицита VK или нарушения абсорбции VK.
Кроме того, сообщалось, что после введения VK пациентам с ГЦК, имеющим высокий уровень DCP, уровень DCP в сыворотке снижался (см. Cancer 1992, 69:31-8), а после введения витамина К-II (далее называемого "VK-II") в DCP-продуцирующие клеточные линии ГЦК in vitro наблюдалось ингибирование пролиферации клеток (см. Hepatology, 1995, 22:876-82).
Однако до сих пор не было получено каких-либо клинических данных, указывающих на возможность предотвращения ИВВ и рецидивов гепатоцеллюлярной карциномы путем введения VK-II пациентам после проведения курса лечения ГЦК, где такое введение приводило бы к улучшению прогноза данного заболевания.
В соответствии с вышеуказанным, целью настоящего изобретения является получение высокоэффективного средства для лечения или предупреждения заболеваний печени.
Описание изобретения
В основу настоящего изобретения было положено, главным образом, обнаружение авторами того факта, что пероральное введение препарата VK-II пациентам, страдающим ГЦК с продуцированием DCP, приводит к ингибированию ИВВ после проведения лечения ГЦК и к улучшению прогноза данного заболевания, а также к подавлению рецидива рака печени после проведения лечения.
Вышеуказанная цель достигается путем использования средства для лечения или предупреждения заболеваний печени, содержащего менатетренон в качестве активного ингредиента.
В соответствии с предпочтительным аспектом настоящего изобретения, вышеуказанное средство используется в том случае, когда указанным заболеванием печени является рак печени.
В соответствии с предпочтительным аспектом настоящего изобретения, вышеуказанное средство используется в том случае, когда указанным раком печени является рак печени, при котором продуцируется дес-γ-карбоксипротромбин (DCP).
В соответствии с предпочтительным аспектом настоящего изобретения, вышеуказанное средство улучшает прогноз рака печени после его лечения.
В соответствии с предпочтительным аспектом настоящего изобретения, вышеуказанным средством является средство, которое предотвращает инвазию воротной вены (ИВВ).
Кроме того, вышеуказанная цель достигается с использованием средства для предотвращения инвазии воротной вены (ИВВ), где указанное средство содержит менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается с использованием средства для увеличения выживаемости пациента после лечения рака печени, где указанное средство содержит менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается с использованием средства для предотвращения рецидивов гепатоцеллюлярной карциномы, содержащего менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается с использованием средства, снижающего уровень DCP и содержащего менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается путем применения способа предотвращения инвазии воротной вены (ИВВ), включающего введение пациенту эффективной дозы лекарственного препарата, содержащего менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается путем применения способа предотвращения рецидивов гепатоцеллюлярной карциномы, включающего введение пациенту эффективной дозы лекарственного препарата, содержащего менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается путем применения способа регуляции уровня DCP в крови пациента, включающего введение пациенту эффективной дозы лекарственного препарата, содержащего менатетренон в качестве активного ингредиента.
Кроме того, вышеуказанная цель достигается с использованием менатетренона в целях получения средства для предотвращения ИВВ.
Кроме того, вышеуказанная цель достигается с использованием менатетренона в целях предотвращения рецидивов гепатоцеллюлярной карциномы.
Кроме того, вышеуказанная цель достигается с использованием средства для лечения или предотвращения заболевания печени, где указанное средство содержит витамин К в качестве активного ингредиента.
Средство, содержащее менатетренон, для лечения заболеваний печени в соответствии с настоящим изобретением обладает высокоэффективным действием, предупреждающим ИВВ при заболевании печени, а в частности, DCP-позитивного рака печени, и, кроме того, обладает высокоэффективным действием, улучшающим прогноз после лечения рака печени. Кроме того, средство, содержащее менатетренон, для лечения заболеваний печени в соответствии с настоящим изобретением является наиболее подходящим для предотвращения рака печени после лечения.
Краткое описание графического материала
На фиг.1 представлена блок-схема, иллюстрирующая отбор пациентов.
На фиг.2 представлен график, иллюстрирующий изменение уровня DCP в сыворотке.
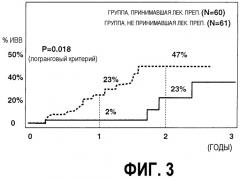
На фиг.3 представлен график, иллюстрирующий изменение частоты случаев ИВВ.
На фиг.4 представлен график, иллюстрирующий изменения выживаемости.
На фиг.5 представлен график, иллюстрирующий ингибирующее действие введения VK-II, направленное на предотвращение рецидивов рака печени (50% рецидивов).
На фиг.6 представлен график, иллюстрирующий результаты только в случае HCV-инфекций при испытаниях, проводимых в целях подтверждения ингибирующего действия введения VK-II, направленного на предотвращение рецидивов рака печени (50% рецидивов).
На фиг.7 представлен график, иллюстрирующий результаты в случае исключения появления локальных рецидивов в испытаниях, проводимых в целях подтверждения ингибирующего действия введения VK-II, направленного на предотвращение рецидивов рака печени (50% рецидивов).
На фиг.8 представлен график, иллюстрирующий результаты в случае исключения появления рецидивов в течение 6 месяцев в испытаниях, проводимых в целях подтверждения ингибирующего действия введения VK-II, направленного на предотвращение рецидивов рака печени (50% рецидивов).
На фиг.9 представлена диаграмма, иллюстрирующая результаты оценки относительного риска (RR) возникновения рецидивов с использованием модели пропорционального риска Кокса и
На фиг.10 представлен график, иллюстрирующий результаты анализов на уровень DCP перед проведением лечения и после возникновения рецидивов.
Наилучшие варианты осуществления настоящего изобретения
Ниже приводится более подробное описание настоящего изобретения со ссылками на примеры, которые, однако, не должны рассматриваться как ограничивающие изобретение.
Рак печени часто возникает у пациентов с хроническим гепатитом и циррозом печени, на лечение которых направлено настоящее изобретение, и после проведения курсов такого лечения очень часто наблюдаются его рецидивы. Так, например, гепатит типа С или гепатит типа В приводит к циррозу печени, и после вырезания опухолей возникают рецидивы. С использованием средства настоящего изобретения для лечения заболевания печени прогноз после такого лечения рака печени может быть значительно улучшен (то есть рецидивы могут быть предотвращены или удалены). Кроме того, с помощью указанного средства может быть с успехом предотвращена инвазия воротной вены (ИВВ), которая является одной из форм рецидивов рака печени с плохим прогнозом.
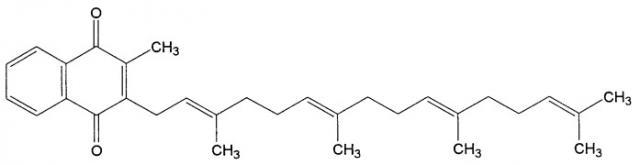
Менатетренон, используемый в настоящем изобретении, имеет химическое название 2-метил-3-тетрапренил-1,4-нафтохинон, и его структурная формула представлена ниже.
Менатетренон представляет собой желтое кристаллическое или маслянистое вещество, не имеющее ни вкуса, ни запаха и легко разлагающееся под действием света. Кроме того, менатетренон почти не растворяется в воде. Менатетренон также называется витамином К-II (VK-II), а что касается его фармакологического действия, то в процессе белкового синтеза факторов свертывания крови (протромбина VII, IX и Х) менатетренон участвует в реакции карбоксилирования, где остатки глутаминовой кислоты превращаются в физиологически активную γ-карбоксиглутаминовую кислоту, а также стимулирует синтез нормального протромбина в печени и т.п. и активирует механизм гемостаза в живом организме, то есть способствует осуществлению гемостаза в организме.
Менатетренон, который является активным ингредиентом в лекарственном препарате настоящего изобретения, может присутствовать в форме ангидрида или гидрата. Кроме того, менатетренон имеет кристаллические полиморфы, но не ограничивается ими; при этом менатетренон может присутствовать в любых кристаллических формах, которыми являются, но не ограничиваются ими, кристаллические формы или смеси. Кроме того, метаболит, продуцируемый посредством менатетренона настоящего изобретения и разлагаемый в живом организме, также входит в объем притязаний настоящего изобретения.
Менатетренон, используемый в настоящем изобретении, может быть легко продуцирован хорошо известным методом, и репрезентативным примером способа его получения является способ, описанный в выложенной заявке на патент Японии № 49-55650; либо, альтернативно, такой менатетренон может быть закуплен у производителей химической продукции. Кроме того, менатетренон может быть закуплен как фармацевтический препарат в виде капсулы или препарата для инъекции. Что касается лекарственного препарата настоящего изобретения, то менатетренон может быть использован в чистом виде, либо он может быть приготовлен стандартным методом в виде фармацевтического препарата путем смешивания с ингредиентами, которые обычно используются в качестве исходных материалов для получения лекарственных препаратов, таких как хорошо известные фармацевтически приемлемые носители и т.п. (например, наполнители, связующие средства, дезинтеграторы, смазывающие агенты, красители, корригенты, стабилизаторы, эмульгаторы, стимуляторы абсорбции, поверхностно-активные вещества, регуляторы рН, консерванты, антиоксиданты и т.д.). Кроме того, если это необходимо, то могут быть смешаны и другие ингредиенты, такие как витамины и аминокислоты. Примерами форм фармацевтических препаратов являются таблетки, порошки, гранулы, капсулы, сиропы, суппозитории, препараты для инъекций, мази, припарки и т.п.
Кроме того, по настоящему изобретению, способ введения менатетренона не имеет конкретных ограничений, хотя предпочтительным является пероральное введение. При этом менатетренонсодержащие капсулы могут быть закуплены в виде капсул под названием «капсулы Kaytwo» (запатентованное название, данное Eisai Co., Ltd.) и в виде капсул под названием «капсулы Glakay» (запатентованное название, данное Eisai Co., Ltd.), менатетренонсодержащий сироп может быть закуплен в виде сиропа под названием «сироп Kaytwo» (запатентованное название, данное Eisai Co., Ltd.), а препарат для инъекций может быть закуплен в виде препарата под названием «Kaytwo N» (запатентованное название, данное Eisai Co., Ltd.).
Менатетренонсодержащий лекарственный препарат настоящего изобретения может быть использован для лечения или предупреждения заболевания печени. Предпочтительная доза менатетренона составляет, в основном, 10-200 мг/день, более предпочтительно 30-135 мг/день.
Примеры
Ниже представлены примеры испытаний настоящего изобретения, однако эти примеры приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничивающие настоящее изобретение. Каждый специалист может реализовать настоящее изобретение не только в соответствии с нижеприведенными примерами испытаний, но он может также внести различные модификации, не выходящие за рамки объема формулы изобретения, и такие модификации также входят в объем притязаний настоящего изобретения.
Пример испытания I
Клинические испытания (рандомизированные проспективные контролируемые испытания) проводили следующим образом.
В это испытание были включены пациенты с гепатоцеллюлярной карциномой, имеющие уровень DCP выше 60 МЕ/л (DCP-позитивный рак печени). С другой стороны, из данного испытания были исключены пациенты с инвазией воротной вены и пациенты, у которых уже наблюдался метаболизм VK в результате введения VK или средства-антагониста VK. Подробное описание испытаний приводится в таблице 1.
Таблица 1
Индивидуумы, участвующие в испытании:
В испытание были включены следующие индивидуумы:
1. Пациенты с раком печени.
2. Пациенты, у которых уровень DCP в сыворотке составлял ≥ 60 МЕ/л.
Из испытаний были исключены следующие индивидуумы:
1. Индивидуумы с инвазией воротной вены.
2. Индивидуумы с метастазами рака печени в периферические органы.
3. Индивидуумы с нерегулируемым продуцированием асцита.
4. Индивидуумы с уровнем билирубина > 3,0 мг/дл.
5. Индивидуумы, принимавшие препарат витамина К, варфарин.
Группы, которым вводили VK-II:
Пациенты, которые принимали 45 мг витамина K-II (Glakay) три раза после проведения лечения рака печени.
Группы, которым не вводили K-II:
Пациенты, прошедшие только курс лечения рака печени.
Критерии оценки:
1. Возникновение инвазии воротной вены.
2. Смерть.
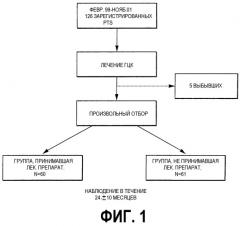
На фиг.1 представлена блок-схема, иллюстрирующая отбор пациентов. 126 пациентов с раком печени проходили лечение с февраля 1999 до ноября 2001. Лечение рака печени заключалось в проведении терапии против ГЦК путем чрескожной каутеризации (RFA и/или PEIT); проведении лечения через кровеносные сосуды (ТАЕ или TAI); или в проведении хирургической операции. Из данного испытания было исключено 5 пациентов.
Затем остальные (121 пациент) были произвольно разделены на группу пациентов, которые принимали VK-II (n = 60), и группу пациентов (контрольную группу), которые не принимали VK-II (n = 61). Группа, которая принимала препарат VK-II, перорально получала 45 мг/день VK-II (запатентованное название Glakay, данное Eisai Co., Ltd.) после лечения рака печени, а контрольная группа не получала VK-II.
После проведения лечения рака печени проводили наблюдение за пациентами. Такое наблюдение пациентов заключалось в проведении ультразвукового исследования через каждые 3 месяца (абдоминальной эхографии), компьютерной томографии через каждые 6 месяцев и оценки уровней опухолевых маркеров, альфа-фетопротеина и DCP, через каждый месяц.
В таблице 1 представлены клинические данные для исследуемых пациентов. Каких-либо значимых отличий между клиническими параметрами для группы, принимавшей рассматриваемый препарат, и для группы, не принимавшей такого препарата, не наблюдалось.
| Таблица 1Описание клинических данных для пациентов | |||
| Группа, принимавшая рассматриваемый препарат(n = 60) | Группа, не принимавшая рассматриваемый препарат(n = 61) | P | |
| Возраст | 66,9 ± 7,0 | 67,3 ± 7,5 | 0,8 |
| Пол (мужской/женский) | 36/24 | 45/16 | 0,12 |
| Вирус (HCV/не HCV) | 50/10 | 52/9 | 0,81 |
| Размер опухоли (мм) | 32 ± 11 | 35 ± 18 | 0,27 |
| Число опухолей | 4,0 ± 3,2 | 4,3 ± 3,5 | 0,66 |
| Детский гепатит, класс (А/В или С) | 18/42 | 27/34 | 0,13 |
| Альбумин (г/дл) | 3,4 ± 0,5 | 3,5 ± 0,5 | 0,3 |
| Билирубин (мг/дл) | 1,2 ± 0,7 | 1,1 ± 0,9 | 0,4 |
| ALT (МЕ/л) | 55 ± 38 | 61 ± 47 | 0,47 |
| Протромбин (%) | 78 ± 16 | 78 ± 14 | 0,99 |
| Тромбоциты крови (104/мм3) | 10,8 ± 6,0 | 11,5 ± 6,6 | 0,52 |
| AFP (нг/л) | 2668 ± 7666 | 1539 ± 7036 | 0,42 |
| DCP (МЕ/л) | 985 ± 2639 | 1178 ± 5108 | 0,80 |
| РТА с приемом/без приема лекарственного средства | 48/12 | 41/20 | 0,15 |
| среднее ± ср. кв. от. (медиана) |
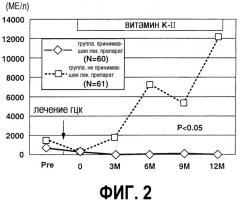
На фиг.2 представлен график, иллюстрирующий изменения уровня DCP в сыворотке. Сплошная линия означает группу, принимавшую лекарственный препарат, а пунктирная линия означает группу, не принимавшую такой препарат. Для обеих групп, после проведения лечения рака печени, уровень DCP после снижался. Затем уровень DCP у группы, принимавшей лекарственный препарат, оставался приблизительно постоянным в течение 12 месяцев, тогда как уровень DCP у группы, не принимавшей такой препарат, постепенно увеличивался.
На фиг.3 представлен график, иллюстрирующий изменения частоты случаев ИВВ. Как показано на фиг.3, у группы, принимавшей рассматриваемый препарат, число случаев ИВВ составляло 2% через 1 год, и 23% через 2 года. С другой стороны, у группы, принимавшей рассматриваемый препарат, число случаев ИВВ составляло 23% через 1 год, и 47% через 2 года (Р=0,018).
На фиг.4 представлен график, иллюстрирующий изменение выживаемости. Как показано на фиг.4, выживаемость пациентов в группе, принимавшей рассматриваемый препарат, составляла 66% через 2 года, тогда как выживаемость пациентов в группе, не принимавшей данный рассматриваемый препарат, составляла 28% (Р=0,044).
Был проведен статистический анализ на частоту случаев ИВВ и выживаемость пациентов указанных двух групп. То есть вычисления проводили с использованием модели пропорционального риска Кокса, и этот тест осуществляли с использованием логрангового критерия. Средний период наблюдения составлял 12 ± 8 месяцев.
Исходя из вышеуказанных результатов, было сделано предположение, что при пероральном введении препарата VK-II наблюдалось очень резкое снижение числа случаев ИВВ у пациентов с DCP-позитивной ГЦК, и, кроме того, выживаемость у этих пациентов значительно возрастала, и, следовательно, значительно улучшался прогноз после лечения рака печени.
Пример испытаний 2
Испытание проводили, как описано ниже, в целях исследования ингибирующего действия VK-II, направленного на предотвращение рецидивов гепатоцеллюлярной карциномы после ее лечения, и его безопасности.
За период времени с марта 1999 до марта 2001 был составлен список, в который были включены 61 пациент с диагностированной гепатоцеллюлярной карциномой и с последующим полным некрозом после лечения (или хирургической операции), на что указывала контрастная компьютерная томография; и пациентов, которые были внесены в данный список, разделяли на две группы, а именно, на группу, которая принимала VK-II и в которой конечное число ID пациентов было нечетным, и группу, которая не получала VK-II (контрольная группа) и в которой конечное число ID пациентов было четным; при этом пациентам VK-II-группы перорально вводили VK-II (запатентованное название Glakay, данное Eisai Co., Ltd.) в дозе 45 мг/день. Затем через каждые 3 месяца проводили контрастную компьютерную томографию или ЯМР-томографию, а также проводили статистический анализ периода времени до появления рецидивов. В частности, было проведено сравнение с использованием критерия Каплана-Майера (логранговый критерий) и оценка относительного риска появления рецидивов с использованием модели пропорционального риска Кокса.
Как показано в таблице 2, средний период наблюдения за 61 участником испытаний (32 пациента в группе, принимавшей VK-II, и 29 пациентов в группе, не принимавшей VK-II) составлял 19,6 месяцев (7-32).
| Таблица 2 | ||
| Индивидуумы | Группа, принимавшая VK-II (32 случая) | Контрольная группа (29 случаев) |
| Возраст | 63,3±7,5(48-75) | 64,5±67(45-74) |
| Пол (мужской/женский) | 23/9 | 18/11 |
| Фактор, вызывающий заболевание (типа С/типа В/типа В+С) | 28/3/1 | 26/2/1 |
| Предыстория употребления алкоголя (алкоголик/не алкоголик) | 10/22 | 3/26 |
| Первичная опухоль/рецидивы | 15/17 | 14/15 |
| Размер опухоли (мм) | 17,7±5,1(10-30) | 19,4±6,9(10-38) |
| Число опухолей | 1,50±0,88(1-4) | 1,48±0,74(1-3) |
| Log AFP (нг/мл) | 1,47±0,61(0,60-3,09) | 1,72±0,91(0,48-3,88) |
| PIVKA-II (мАЕ/мл) | 41,8±65,4(8-346) | 70,3±104,1(7-417) |
| Функция печени (LD A/В/C) | 15/16/1 | 13/15/1 |
| Метод лечения (хирургический/нехирургический) | 1/31 | 3/26 |
| Средний период наблюдения (месяцы) | 24,3±7,1(13-37) | 24,2±8,3(12-37) |
После подсчета общего числа случаев рецидивов было установлено, что число рецидивов через 1 год после лечения у пациентов группы, принимавшей VK-II, составляло 12,5%, а у пациентов контрольной группы - 55,2%, при этом число рецидивов через 2 года после лечения у пациентов группы, принимавшей VK-II, составляло 39,6%, а у пациентов контрольной группы - 85,5%. Исходя из этих результатов, было установлено, что по сравнению с контрольной группой у группы, принимавшей VK-II, наблюдалось статистически значимое снижение общего числа случаев рецидивов рака печени.
На фиг.5 представлен график, иллюстрирующий эффект введения VK-II, направленный на предотвращение рецидивов рака печени (50% рецидивов). Как показано на фиг.5, период времени до появления рецидивов рака печени (50% рецидивов) у группы, которая принимала VK-II, составлял 26 месяцев, а у контрольной группы он составлял 10 месяцев.
Более того, после подсчета общего числа случаев рецидивов с учетом только HCV-случаев (случаи гепатита С) было установлено, что появление рецидивов через 1 год после лечения у пациентов группы, принимавшей VK-II, составляло 7,1%, а у пациентов контрольной группы - 61,5%, а появление рецидивов через 2 года после лечения у пациентов группы, принимавшей VK-II, составляло 37,8%, а у пациентов контрольной группы - 87,2%. Исходя из этих результатов, было установлено, что по сравнению с контрольной группой у группы, которая принимала VK-II, наблюдалось статистически значимое снижение общей частоты рецидивов рака печени при рассмотрении только HCV-случаев.
На фиг.6 представлен график, иллюстрирующий результаты, полученные в испытаниях только для HCV-случаев, проводимых в целях подтверждения ингибирующего действия введения VK-II, направленного на предотвращение рецидивов рака печени (50% рецидивов). Как показано на фиг.6, период времени до появления рецидивов рака печени (50% рецидивов) у группы, которая принимала VK-II, составлял 26 месяцев, а у контрольной группы он составлял 10 месяцев.
На фиг.9 представлена диаграмма, иллюстрирующая результаты оценки относительного риска (RR) появления рецидивов с использованием модели пропорционального риска Кокса. Как показано на фиг.9, если принять величину относительного риска для контрольной группы за 1, то относительный риск для группы, принимавшей VK-II, составлял приблизительно одну треть, то есть 0,329; в частности, для HCV-случаев относительный риск составлял 0,210, то есть для группы, принимавшей VK-II, этот риск снижался в пять раз.
На фиг.7 представлен график, иллюстрирующий результаты для случаев исключения локальных рецидивов в испытаниях, проводимых в целях подтверждения ингибирующего эффекта введения VK-II, направленного на предотвращение рецидивов рака печени (50% рецидивов) (группа, принимавшая VK-II: 29 пациентов; группа, не принимавшая VK-II: 22 пациента). Кроме того, на фиг.8 представлен график, иллюстрирующий результаты в случае исключения появления рецидивов в течение 6 месяцев при испытаниях, проводимых в целях подтверждения ингибирующего действия введения VK-II, направленного на предотвращение рецидивов рака печени (50% рецидивов) (группа, принимавшая VK-II: 31 пациент; группа, не принимавшая VK-II: 22 пациента). Как показано на фиг.7 и 8, в этих случаях снова было установлено, что у группы, которая принимала VK-II, наблюдалось статистически значимое снижение общей частоты рецидивов рака печени по сравнению с контрольной группой.
На фиг.10 представлен график, иллюстрирующий результаты анализов на уровень DCP перед проведением лечения и после появления рецидивов. Как показано на фиг.10, во всех случаях появления рецидивов у пациентов группы, получавшей VK-II, DCP не был обнаружен, и, кроме того, не наблюдалось побочных эффектов и случаев выбывания из испытаний.
Действие VK-II настоящего изобретения на развитие инвазии/метастазов клеток рака печени было исследовано in vitro. Способность к воздействию на инвазию исследовали с помощью анализа на инвазию с использованием клеток НерG2 и камеры Matrigel. Полученные результаты показали, что число клеток, прошедших через камеру Matrigel, снижалось при добавлении VK-II, причем это снижение зависело от концентрации VK-II. Способность к воздействию на метастазы исследовали по влиянию VK-II на экспрессию металлопротеиназ межклеточного матрикса (ММР) методом Вестерн-блот-анализа. После исследования на экспрессию белков ММР-1 и ММР-3 при добавлении VK-II в клетки рака печени было обнаружено, что в этом случае экспрессия ингибировалась. Исходя из этих результатов, хотя они и были получены in vitro, можно предположить, что VK-II ингибирует инвазию/метастазы клеток рака печени.
Промышленное применение
Как описано выше, менатетренонсодержащее средство, используемое для лечения или предупреждения заболеваний печени в соответствии с настоящим изобретением, обладает превосходным ингибирующим действием на ИВВ при заболевании печени, а в частности, на DCP-позитивный рак печени, и, кроме того, он обладает превосходным действием с точки зрения прогноза после лечения рака печени.
Кроме того, менатетренонсодержащее средство, используемое для лечения или предупреждения заболеваний печени в соответствии с настоящим изобретением, является очень эффективным для предупреждения рецидивов рака печени после лечения.
1. Средство для ингибирования рецидивов гепатоцеллюлярной карциномы после лечения рака печени, содержащее менатетренон в качестве активного ингредиента.
2. Средство, снижающее уровень дес-γ-карбоксипротромбина и содержащее менатетренон в качестве активного ингредиента.
3. Способ ингибирования рецидивов гепатоцеллюлярной карциномы, включающий введение пациенту после лечения рака печени, эффективной дозы лекарственного препарата, содержащего менатетренон в качестве активного ингредиента.
4. Способ модуляции уровня дес-γ-карбоксипротромбина в крови пациента, включающий введение указанному пациенту эффективной дозы лекарственного препарата, содержащего менатетренон в качестве активного ингредиента.