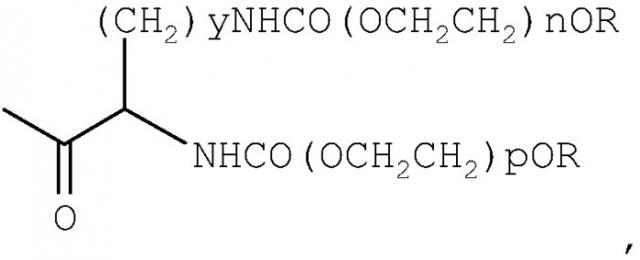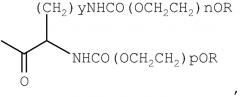Содержащие пэг конъюгаты hgf-nk4
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтичекой промышленности и касается конъюгата, содержащего N-концевой фрагмент гепатоцитарного фактора роста (HGF/SF), который состоит из "шпилькообразного" домена и четырех кринглообразных областей α-цепи, и одной полиэтиленгликольной группы с общей молекулярной массой примерно 20-40 кДа и формулы
-CO-(CH2)x-(OCH2CH2)mOR или
и -СО-группа образует амидную связь с одной из аминогрупп N-концевого фрагмента гепатоцитарного фактора роста, где Х обозначает 2 или 3; или у означает 1-10; m имеет значение от примерно 450 до примерно 950; или n и р вместе имеют значение от примерно от 450 до 950; R обозначает C1-С6алкил; который обладает улучшенными свойствами и который можно применять в качестве терапевтического агента для лечения рака и метастазирования опухолевых клеток. 5 н. и 2 з.п. ф-лы, 4 ил, 1 табл.
Реферат
Настоящее изобретение относится к конъюгатам N-концевого содержащего 4 кринглообразные области (NK4) фрагмента гепатоцитарного фактора роста и полиэтиленгликоля (ПЭГ), их фармацевтическим композициям, способам их получения и способам их применения.
Предпосылки создания изобретения
Гепатоцитарный фактор роста (HGF/SF) представляет собой полипептид, идентифицированный и очищенный Nakamura Т. и др., Biochem. Biophys. Res. Commun. 22 (1984) сс.1450-1459. Далее было установлено, что гепатоцитарный фактор роста идентичен фактору рассеяния (SF), описанному у Weidner К.М. и др., Proc. Natl. Acad. Sci. USA 88 (1991) сс.7001-7005. HGF представляет собой гликопротеин с молекулярной массой примерно 100 кДа, который принимает участие в развитии нескольких клеточных фенотипов, включая пролиферацию, митогенез, образование разветвленных трубочек и, в случае опухолевых клеток, в инвазии и метастазировании. Обобщение данных случае опухолевых клеток, в инвазии и метастазировании. Обобщение данных см. у Stuart K.A. и др., International Journal of Experimental Pathology 81 (2000) сс.17-30. Были секвенированы и клонированы как HGF мыши, так и HGF человека (Miyazawa К. и др., Biochem. Biophys. Res. Comm. 163 (1989) сс.967-973; Nakamura Т. и др., Nature 342 (1989) сс.440-443; Seki T. и др., Biochem. and Biophys. Res. Comm. 172 (1990) сс.321-327; Tashiro К. и др., Proc. Natl. Acad. Sci. USA 87 (1990) сс.3200-3204; Okajima А. и др., Eur. J. Biochem. 193 (1990) сс.375-381). Фармакокинетические и фармакологические свойства HGF, лишенного первых пяти N-концевых аминокислот (dHGF), изучены Uematsu Y. и др., J.Pharm. Sciences 88 (1999) сс.131-135. Установлено, что концентрация dHGF в сыворотке быстро снижалась и вследствие этого в качестве пути его введения инфузия может являться более предпочтительной, чем инъекция в виде болюса.
В патенте US №5977310 описан модифицированный с помощью ПЭГ HGF. Такой модифицированный ПЭГ HGF имеет пролонгированный клиренс in vivo и обладает такой же физиологической активностью, что и HGF. Однако согласно данным патента US №5977310 он обладает способностью удлинять время полужизни HGF лишь с 59,2 мин до 76,7 мин или 95,6 мин соответственно (см. пример 5 патента US №5977310). В указанном патенте высказано также предположение о том, что можно применять молярное количество реагента ПЭГ, превышающее в 5-100 раз молекулярную массу HGF. В случае модификации аминогруппы лизина или N-конца протеина предпочтительно молярное количество реагента ПЭГ в 10-25 раз превышает молекулярную массу HGF. Молекулярная масса присоединенной цепи ПЭГ составляла примерно 10 кДа. Методы синтеза конъюгатов ПЭГ и полипептидов, таких как HGF, описаны также в WO 94/13322. Эти компоненты конъюгатов связывают друг с другом в предварительно определенных положениях, поскольку по данным авторов описанных выше публикаций произвольная конъюгация приводит к введению в домены молекулы полимерных фрагментов, что изменяет требуемую терапевтическую активность или эффективность диагностики. Таким образом, можно удлинять время полужизни молекул in vivo и в случае гетерологичных протеинов они могут иметь пониженную иммуногенность, но при этом в значительной степени или полностью терять требуемые (1991) сс.4310-4315 и Mait, P.K. и др., Int. J.Cancer Suppl. 3 (1988) сс.17-22). Например, ПЭГилированный IFN-α обладает, например, только 7%-й активностью по сравнению с неПЭГилированным IFN-α (Bailon Р., Bioconjgate Chem. 12 (2001) сс.195-202).
Было установлено также, что HGF/SF-фрагмент, обозначенный как NK4, состоит из N-концевого «шпилькообразного» домена и четырех кринглообразных областей HGF/SF, обладает фармакологическими свойствами, полностью отличными от свойств HGF/SF, и является антагонистом воздействия HGF/SF на подвижность и инвазию раковых клеток ободочной кишки и помимо этого является ингибитором ангиогенеза, подавляющим рост и метастазирование опухоли (WO 93/23541; Parr С. и др., Int. J.Cancer 85 (2000) cc.563-570; Kuba К. и др., Cancer Res. 60 (2000) сс.6737-6743; Date К. и др., FEBS Letters 420 (1997) сс.1-6; Date К. и др., Oncogene 17 (1989) сс.3045-3054; Tomioka D. и др., Cancer Res. 61 (2001) сс.7518-7524).
По данным экспериментов на животных, проведенных с целью выявления воздействия NK4 на метастазы в легкое, которые описаны у Kuba К. и др., Cancer Res. 60 (2000) сс.6737-6743, NK4 следует вводить путем инфузии постоянно в течение двух недель.
Известно, что присоединение полимеров к определенным полипептидам может удлинять время полужизни в сыворотке таких полипептидов. Это установлено, например, для ПЭГилированного интерлейкина-6 (ЕР 0442724) или интерлейкина-2 (WO 90/07938) и эритропоэтина (WO 01/02017). Однако присоединение полиэтиленгликоля и других полимеров не обязательно приводит к пролонгированию их времени полужизни в плазме. Известно, например, что конъюгация различных полиэтиленгликолей с интерлейкином-8, G-CSF и другими интерлейкинами приводит к получению молекул с ухудшенными свойствами (Mehvar R., J. Pharm. Pharm. Sci. 3 (1) (2000) сс.125-136). Таким образом, результат ПЭГилирования полипептида является совершенно непредсказуемым. Gaertner H.F. и Offord R.E., Bioconjugate Chem. 7 (1996) сс.38-44 описали сайтспецифическое присоединение ПЭГ к N-концу протеинов. Gaertner и др. обнаружили (как уже отмечалось в WO 94/13222, см. выше), что ПЭГилирование создает большую проблему, если сайты присоединения нельзя точно контролировать, большую проблему, если сайты присоединения нельзя точно контролировать, поскольку может оказывать важные воздействия на стабильность и функцию протеинов.
У Francis G.E. и др., Int. J. Hematol. 68 (1998) cc.1-18 представлены данные о ПЭГилировании цитокинов и других терапевтических протеинов. Francis и др. установили, что при применении большинства методов ПЭГилирования происходит значительное снижение биологической активности (как правило, на 20-95%). Согласно данным Francis и др. ПЭГилирование протеинов всегда основано на методе проб и ошибок, и фактически все параметры такого ПЭГилирования могут оказывать неожиданное и очень сильное воздействие на функцию продукта. Tsutsumi Y. и др., Thromb. Haemost. 77 (1997) cc.168-173 описали ПЭГилирование интерлейкина-6. Tsutsumi и др. осуществили сшивание примерно 54% аминогрупп лизина IL-6 с ПЭГ, имеющим молекулярную массу 5 кДа на ПЭГ-группу. Tsutsumi и др. в Proc. Natl. Acad. Sci. USA 97 (2000) cc.8548-8553 описали химическую модификацию иммунотоксина с помощью ПЭГ. С учетом того, что произвольное ПЭГилирование сопровождалось заметной потерей специфической цитотоксической активности, Tsutsumi осуществлял сайтспецифическое ПЭГилирование с помощью мутантного иммунотоксина, несущего один или два дополнительных цистеина, которые использовали для сшивания с ПЭГ Heinzerling L. и др., Dermatol. 201 (2000) cc.154-157 описали сшивание интерферона-α с ПЭГ, имеющим молекулярную массу 5 кДа. Tsutsumi Y. и др. в J. Pharmacol. Exp. Ther. 278 (1996) cc.1006-1011 описали модификацию TNF-α с помощью ПЭГ, при этом молекулярная масса применяемых ПЭГ-групп и в этом случае составляла 5 кДа. Поскольку примененный ПЭГилированный TNF-α имел молекулярную массу по меньшей мере 84 кДа (с учетом молекулярной массы TNF-α, равной 17 кДа), то по меньшей мере 13 ПЭГ-групп с молекулярной массой 5 кДа было связано с TNF-α.
ПЭГилирование протеинов и его фармакологические действия обобщены также у Reddy K.R., Ann. Pharmacotherapy 34 (2000) cc.915-923. И в этом обзоре подтверждается, что ПЭГилирование терапевтических протеинов необходимо тщательно контролировать. По данным Reddy и др. для каждого отдельного протеина требуется различная оптимизация химических методов и поэтому воздействие ПЭГилирования нельзя предсказать.
Таким образом, задачей настоящего изобретения было создание обладающих улучшенными характеристиками полипептидов с NK4-активностью и их фармацевтических композиций, которые можно вводить всего лишь в виде нескольких болюсов в неделю и/или в очень низких дозах и которые обладают способностью подавлять рост, ангиогенез и метастазирование опухолей.
Краткое изложение сущности изобретения
Настоящее изобретение относится к конъюгатам NK4, которые содержат NK4, ковалентно связанный с одной полиэтиленгликольной (ПЭГ) группой с молекулярной массой примерно 20-40 кДа (моноПЭГилированный NK4), предпочтительно через ε-аминогруппу лизина или N-концевую аминогруппу NK4. Наиболее предпочтительно NK4 произвольно ПЭГилирован на одной аминогруппе, выбранной из ряда, включающего ε-аминогруппы лизина и N-концевую аминогруппу NK4. При создании изобретения неожиданно было установлено, что моноПЭГилированный NK4 по изобретению обладает улучшенными свойствами с точки зрения терапевтической применимости по сравнению с NK4 или иным путем ПЭГилированным NK4.
Изобретение относится также к способу получения моноПЭГилированного NK4 по изобретению.
Кроме того, изобретение относится к фармацевтическим композициям, содержащим моноПЭГилированный NK4.
Изобретение относится также к способам получения фармацевтических композиций, содержащих моноПЭГилированный NK4.
Изобретение относится также к способам лечения рака у человека (например, рака молочной железы, легкого, предстательной железы, поджелудочной железы или ободочной кишки), которые заключаются в том, что фармацевтически эффективное количество моноПЭГилированного NK4 вводят пациенту, который нуждается в таком лечении, в виде 1-7 болюсов в неделю.
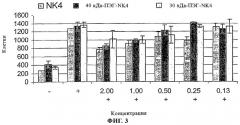
При создании изобретения неожиданно было установлено, что общее количество произвольно ПЭГилированного NK4 по изобретению, необходимого для введения в процессе лечения, значительно ниже количества неПЭГилированного NK4. Так, количество ПЭГилированного NK4, применяемого для фармацевтического лечения, составляет примерно 50% или менее, предпочтительно примерно 20% или менее и наиболее предпочтительно примерно 10% или менее от требуемого количества неПЭГилированного NK4.
Подробное описание изобретения
Человеческий HGF представляет собой связанный с помощью дисульфидного мостика гетеродимер, который может быть расщеплен на α-субъединице, состоящей из 463 аминокислот, и β-субъединице, состоящей из 234 аминокислот, путем расщепления между аминокислотами R494 и V495. Перед N-концом α-цепи расположена 31 аминокислота, начиная с группы метионина. Этот сегмент включает сигнальную последовательность, состоящую из 31 аминокислоты. α-Цепь начинается на аминокислоте 32 и содержит 4 кринглообразные области. Так называемый «шпилькообразный» домен состоит из аминокислот 70-96. Кринглообразная область 1 состоит из аминокислот 128-206. Кринглообразная область 2 состоит из аминокислот 211-288, Кринглообразная область 3 состоит из аминокислот 305-383 и кринглообразная область 4 состоит из аминокислот 391-469 α-цепи соответственно. Известны варианты этих последовательностей, прежде всего, не оказывающие воздействия на биологические свойства NK4 (прежде всего, не влияющие на его антагонистическое воздействие на HGF и его антиангиогенные свойства), эти вариации описаны, например, в WO 93/23541. Кроме того, длина NK4 может изменяться на несколько аминокислот, что не оказывает воздействия на его биологические свойства.
NK4 состоит из N-концевых 447 аминокислот α-цепи HGF/SF, и он включает указанный выше «шпилькообразный» домен и 4 кринглообразные области. Его можно создавать рекомбинантно либо путем получения рекомбинантного человеческого HGF/SF и расщепления эластазой (Date К., FEBS Letters 420 (1997) сс.1-6), либо путем рекомбинантной экспрессии кодирующей NK4 нуклеиновой кислоты в соответствующих клетках-хозяевах, как это будет описано ниже. Гликопротеин NK4 имеет молекулярную массу примерно 57 кДа (при этом молекулярная масса только полипептидной части составляет 52 кДа) и обладает биологической полипептидной части составляет 52 кДа) и обладает биологической активностью in vivo, приводящей к ингибированию роста, ангиогенеза и/или метастазирования опухоли.
В контексте настоящего описания понятие "моноПЭГилированный NK4" обозначает, что NK4 ковалентно связан с одной полиэтиленгликольной группой с молекулярной массой 20-40 кДа. Группа может быть присоединена, предпочтительно произвольно, к различным сайтам молекулы NK4, однако предпочтительно к наиболее реактивным сайтам, например, боковым цепям лизина и N-концевой аминогруппе. На долю моноПЭГилированного NK4 (который, следовательно, предпочтительно представляет собой смесь моноПЭГилированных молекул NK4, которые ПЭГилированы в различных сайтах, представляющих собой ε-аминогруппы лизина NK4 и N-концевую аминогруппу) приходится по меньшей мере 90% препарата и наиболее предпочтительно на долю моноПЭГилированного NK4 приходится 92% или более препарата. Таким образом, препараты моноПЭГилированного NK4 по изобретению являются практически гомогенными в той степени, чтобы проявлять свойственные гомогенным препаратам преимущества, например, при фармацевтическом применении.
В контексте настоящего описание понятие "практически гомогенный" обозначает, что получают, включают или используют только такие молекулы конъюгата ПЭГ-NK4, которые содержат в качестве присоединенной одну ПЭГ-группу. Препарат может содержать непрореагировавший (т.е. не содержащий ПЭГ-группы) протеин. Ниже приведен один из примеров препарата, который по данным пептидного картирования и N-коцевого секвенирования содержит по меньшей мере 90% конъюгата моноПЭГ-МК4 и максимум 2% непрореагировавшего протеина.
Молекулы полимера ПЭГ по изобретению имеют молекулярную массу примерно 20-40 кДа, причем предпочтительными являются ПЭГ-полимеры с молекулярной массой примерно 20, 30 или 40 кДа (под "молекулярной массой" в контексте настоящего описания следует понимать среднюю молекулярную массу ПЭГ; понятие "примерно" обозначает, что в этих содержащих ПЭГ препаратах некоторые молекулы могут иметь несколько большую или меньшую молекулярную массу относительно указанной молекулярной массы).
"ПЭГ" или "ПЭГ-группа" по изобретению обозначает фрагмент, содержащий поли(этиленгликоль) в качестве основной части. Такой ПЭГ может содержать дополнительные химические группы, которые необходимы для реакций связывания; они могут быть получены в результате химического синтеза молекулы; или представлять собой спейсер для оптимального разделения частей молекулы. Кроме того, такой ПЭГ может содержать одну или несколько боковых цепей ПЭГ, связанных вместе. ПЭГ, несущие более одной ПЭГ-цепи, называют многоплечевыми или разветвленными ПЭГ. Разветвленные ПЭГи можно получать, например, путем добавления полиэтиленоксида к различным полиолам, таким как глицерин, пентаэритриол и сорбит. Например, имеющий четыре плеча разветвленный ПЭГ можно получать из пентаэритриола и этиленоксида. Разветвленный ПЭГ описан, например, в ЕР-А 0473084 и в патенте US №5932462. Особенно предпочтительными являются ПЭГ с двумя боковыми цепями ПЭГ (ПЭГ2), связанными через первичные аминогруппы лизина (Monfardini С. и др., Bioconjugate Chem. 6 (1995) сс.62-69). В качестве ПЭГ-полимеров с молекулярной массой 20-30 кДа предпочтительными являются линейные молекулы ПЭГ, а в качестве ПЭГ-полимеров с молекулярной массой более 30 кДа, прежде всего с молекулярной массой 40 кДа, предпочтительными являются разветвленные ПЭГ. В качестве ПЭГ с молекулярной массой 40 кДа особенно предпочтительным является ПЭГ с двумя плечами (ПЭГ2).
Одним из объектов изобретения является способ получения практически гомогенного моноПЭГилированного NK4. ПЭГилирование NK4 можно осуществлять согласно методам, известным в данной области, например, путем взаимодействия NK4 с электрофильно активированными ПЭГ (поставщик: фирма Shearwater Corp., США, www.shearwatercorp.com). Предпочтительными реагентами ПЭГ являются, например, N-гидроксисукцинимидилпропионаты (ПЭГ-SPA) или -бутаноаты (ПЭГ-SBA) или разветвленные N-гидроксисукцинимиды, такие как мПЭГ2-NHS (Monfardini С. и др., Bioconjugate Chem. 6 (1995) сс.62-69). Такие методы позволяют получать полипептид NK4, произвольно ПЭГилированный на ε-аминогруппе лизина NK4 или на N-концевой аминогруппе. Целенаправленно ПЭГилированный на N-конце NK4 можно получать согласно методу, описанному в WO 94/01451.
Согласно предпочтительному варианту осуществления изобретения такой NK4 ковалентно связан с одной поли(этиленгликольной) группой формулы
-CO-(CH2)x-(OCH2CH2)m-OR
при этом -СО (т.е. карбонил) поли(этиленгликольной) группы образует амидную связь с одной из аминогрупп NK4; R обозначает (низш.) алкил; х обозначает 2 или 3; m имеет значение от примерно 450 до примерно 950; и n и m выбирают так, чтобы молекулярная масса конъюгата минус протеина NK4 составляла примерно от 20 до 40 кДа. В качестве аминогруппы NK4 ε-аминогруппа лизина NK4 представляет собой доступную (свободную) аминогруппу.
Более конкретно вышеописанные конъюгаты можно описать формулой
где Р представляет собой группу протеина NK4, как она обозначена в настоящем описании (т.е. без аминогруппы или аминогрупп, которые образуют амидную связь с карбонилом, как показано в формуле (I)); и где R обозначает (низш.) алкил; х обозначает 2 или 3; m имеет значение от примерно 450 до примерно 950; и n и m выбирают так, чтобы молекулярная масса конъюгата минус протеина NK4 составляла примерно от 20 до 40 кДа. В контексте настоящего описания указанный диапазон значений "m" дан лишь приблизительно. Диапазоны "m" определяют в каждом конкретном случае с учетом данных о точной молекулярной массе ПЭГ-группы.
Согласно еще одному предпочтительному варианту осуществления изобретения указанный NK4 ковалентно связывают с одной поли(этиленгликольной) группой формулы
где у обозначает 1-4, предпочтительно 4, n и р вместе выбирают так, чтобы молекулярная масса конъюгата минус протеина NK4 составляла примерно от 20 до 40 кДа, предпочтительно 40 кДа, и n и р различаются не более чем на 25%, предпочтительно не более чем на 10% и наиболее предпочтительно являются идентичными, и R обозначает (низш.) алкил.
В контексте настоящего описания "(низш.) алкил" обозначает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода (C1-С6алкил). Примеры (низш.) алкильных групп включают метил, этил и изопропил. Согласно настоящему изобретению R обозначает любой (низш.) алкил. Предпочтительными являются конъюгаты, в которых R обозначает метил.
Символ "m" обозначает количество этиленоксидных групп (ОСН2СН2) в поли(этиленоксидной) группе. Одна ПЭГ-субъединица этиленоксида имеет молекулярную массу примерно 44 Да. Таким образом, молекулярная масса конъюгата (без молекулярной массы NK4) зависит от значения "m". В конъюгатах по настоящему изобретению "m" имеет значение от примерно 450 до примерно 950 (что соответствует молекулярной массе от примерно 20 до примерно 40 кДа); и n и m выбирают так, чтобы молекулярная масса конъюгата минус протеина NK4 составляла примерно от 20 до 40 кДа. Значение "m" выбирают так, чтобы полученный конъюгат по изобретению имел физиологическую активность, сопоставимую с активностью немодифицированного NK4, т.е. его активность может быть такой же, более высокой или представлять собой часть соответствующей активности немодифицированного NK4. Понятие "примерно" применительно к определенной величине молекулярной массы обозначает, что она находится в приемлемом диапазоне величины при оценке с помощью соответствующих аналитических методов. Значение "m" выбирают так, чтобы молекулярная масса каждой поли(этиленгликольной) группы, ковалентно связанной с протеином NK4, составляла от примерно 20 до примерно 40 кДа.
Соединение формулы (I) можно получать, например, из известного активированного полимерного материала:
где R и m имеют указанные выше значения, путем конденсации соединения формулы (II) с протеином NK4. Соединения формулы (II), в которых х обозначает 3, представляют собой сукцинимидиловые эфиры альфа-(низш.) алкоксимасляной кислоты и поли(этиленгликоля) [(низш.) алкокси-ПЭГ-SBA]. Соединения формулы (II), в которых х обозначает 2, представляют собой сукцинимидиловые эфиры альфа-(низш.) алкоксипропионовой кислоты и поли(этиленгликоля) [(низш.) алкокси-ПЭГ-SPA]. Можно применять любой приемлемый метод взаимодействия активированного сложного эфира с амином с получением амида. В описанной выше реакции приведенный в качестве примера сукцинимидиловый эфир представляет собой уходящую группу, приводящую к образованию амида. Применение сукцинимидиловых эфиров, таких как соединения формулы (II) для получения конъюгатов с протеинами описано в патенте US №5672662, выданном 30 сентября 1997 г. (Harris и др.).
Человеческий NK4 содержит 30 свободных ε-аминогрупп 30 остатков лизина. Когда ПЭГилирующий реагент объединяли с SBA-производным формулы II, было установлено, что если концентрация протеина составляла примерно 5-10 мг/мл при рН примерно 7,0-8,0, соотношение протеин:ПЭГ составляло примерно 1:3 и температура реакции составляла 20-25°С, то получали смесь, содержащую моно-, диПЭГилированных продуктов и следовые количества триПЭГилированного продукта. Когда соотношение протеин:ПЭГ составляло примерно 1:1 или 1:2 (например, предпочтительно примерно 1:2 для 30 кДа ПЭГ-SBA и примерно 1:5 для 40 кДа ПЭГ2-NHS), то получали главным образом моноПЭГилированные продукты. Изменяя условия реакции (например, соотношение реагентов, значение рН, температуру, концентрацию протеина, продолжительность реакции и т.д.), можно оптимизировать относительные количества различных моноПЭГилированных продуктов. Как правило (но не ограничиваясь ими), условия соответствуют следующим: примерно 8-14 мг/мл NK4, 0,3М фосфат калия, рН 8, 25°С, продолжительность реакции 1 ч. В указанных условиях, используя 30 кДа ПЭГ-SBA (1:2, протеин: ПЭГ), получали примерно 38% моноПЭГилированного NK4.
МоноПЭГилированный NK4 можно также получать согласно методам, описанным в WO 94/01451. В WO 94/01451 описан метод получения рекомбинантного полипептида с модифицированной альфа-углеродной реактивной группой концевой аминокислоты. Стадии осуществления метода включали получение рекомбинантного полипептида и защиту его с помощью добавленных биологическим путем одной или нескольких защитных групп на N-концевой альфа-амин и С-концевой альфа-карбоксил. Затем полипептид можно подвергать взаимодействию с химическим защитным агентом с целью избирательной защиты реактивных групп боковых цепей, препятствуя тем самым модификации боковых цепей. Затем полипептид расщепляют с помощью расщепляющего реагента, специфичного для биологических защитных групп, с получением незащищенной альфа-углеродной реактивной группы концевой аминокислоты. Незащищенную альфа-углеродную реактивную группу концевой аминокислоты модифицируют химическим модифицирующим агентом. Затем у однокопийного полипептида, модифицированного на конце в результате защиты боковых цепей, удаляют защитные группы боковых цепей с получением модифицированного на конце рекомбинантного однокопийного полипептида. Количество и последовательность стадий метода может варьироваться для достижения избирательной модификации N- и/или С-концевой аминокислоты полипептида.
Другие предпочтительные конъюгаты по изобретению содержат протеин NK4, ковалентно связанный с (низш.) алкоксиполи(этиленгликольной) группой через линкер формулы -C(O)-X-S-Y-, где С(O) обозначает группу линкера, формирующую амидную связь с аминоггруппой NK4 (как указано выше, доступной является ε-аминогруппа остатков лизина), Х обозначает -(CH2)k- или -CH2(O-CH2-CH2)k-, k обозначает 1-10, Y обозначает
средняя молекулярная масса поли(этиленгликольного) фрагмента составляет от примерно 20 до примерно 40 кДа и молекулярная масса конъюгата составляет от примерно 72 до примерно 92 кДа при использовании полипептида NK4 с молекулярной массой 52 кДа, или от примерно 77 до примерно 97 кДа при использовании гликопротеина NK4 с молекулярной массой 57 кДа.
Указанные виды NK4 могут быть представлены формулой (III)
где R может представлять собой любой (низш.) алкил, т.е. линейную или разветвленную алкильную группу, несущую 1-6 атомов углерода, такую как метил, этил, изопропил и т.д. Предпочтительный алкил представляет собой метил. Х может обозначать -(СН2]k- или -СН2(O-СН2-СН2)k-, где k имеет значения от 1 до примерно 10. Предпочтительно k имеет значения от 1 до примерно 4, более предпочтительно k обозначает 1 или 2. Наиболее предпочтительно Х обозначает -(СН2).
В формуле (III) Y обозначает
,
предпочтительно
более предпочтительно
В формуле (III) значение m выбирают таким образом, чтобы образовавшийся конъюгат формулы (III) обладал биологической активностью, сопоставимой с активностью немодифицированного NK4, причем активность может быть аналогичной, превышать или составлять лишь часть соответствующей активности немодифицированного NK4. Символ m обозначает число этиленоксидных цепей в единице ПЭГ. Одна субъединица ПЭГ, т.е. -(ОСН2СН2)-, имеет молекулярную массу примерно 44 Да. Таким образом, молекулярная масса конъюгата (без учета молекулярной массы NK4) зависит от значения m. Понятие "примерно" применительно к молекулярной массе обозначает, что указанная величина молекулярной массы находится в приемлемом диапазоне величин, определенного с помощью общепринятых аналитических методов. Таким образом, m обозначает целое число, составляющее от примерно 450 до примерно 950 (что соответствует молекулярной массе примерно 20-40 кДа).
Предпочтительные протеины NK4 формулы (III) представлены формулами:
Наиболее предпочтительные протеиновые продукты NK4 представлены формулой:
Эти протеины NK4 можно получать путем
(а) ковалентного взаимодействия свободной аминогруппы, предпочтительно ε-аминогруппы аминокислоты лизина протеина NK4 или N-концевой аминогруппы, представленной формулой P-NH2, с бифункциональным реагентом, представленным формулой Z-CO-X-S-Q, с получением промежуточного продукта с амидной связью, представленного формулой:
P-NH-CO-X-S-Q
где Р обозначает протеин NK4 без аминогруппы, которая формирует амидную связь; Z обозначает реактивную группу, например карбоновый-NHS-эфир; Х обозначает -(CH2)k- или -СН2(O-СН2-СН2)k-, где k имеет значения от 1 до примерно 10; и Q обозначает защитную группу типа алканоила, например ацетил;
(б) ковалентного взаимодействия полученного на стадии (а) промежуточного продукта с амидной связью с активированным полиэтиленгликольным производным, представленным формулой [OCH2CH2]m-OR, с получением протеинового продукта NK4, представленного формулой:
где W обозначает сульфгидрильную реактивную форму Y; m обозначает целое число от примерно 450 до примерно 950; R обозначает (низш.) алкил; и Y имеет указанные выше значения.
Согласно этому варианту осуществления изобретения бифункциональный реагент предпочтительно представляет собой N-сукцинимидил-S-ацетилтиопропионат или N-сукцинимидил-S-ацетилтиоацет, Z предпочтительно обозначает N-гидроксисукцинимид и активированное полиэтиленгликольное производное W-[OCH2CH2]m-OR предпочтительно выбирают из группы, включающей йодацетилметокси-ПЭГ, метокси-ПЭГ-винилсульфон и метокси-ПЭГ-малеимид. В целом, протеины NK4 формулы (III) можно получать путем ковалентного связывания тиольной группы с NK4 ("активация") и сочетания образовавшегося активированного NK4 с поли(этиленгликольным) (ПЭГ) производным. Первая стадия получения моноПЭГилированного NK4 по настоящему изобретению предусматривает ковалентное связывание тиольной группы через NH2-группы NK4. Эту активацию NK4 осуществляют с помощью бифункциональных реагентов, несущих защищенную тиольную группу и дополнительную реактивную группу, таких как активные сложные эфиры (например, сложный сукцинимидиловый эфир), ангидриды, эфиры сульфоновых кислот, галогениды карбоновых кислот и сульфоновых кислот соответственно. Тиольную группу защищают с помощью известных в данной области групп, например ацетильных групп. Эти бифункциональные реагенты обладают способностью взаимодействовать с аминогруппами путем формирования амидной связи.
Согласно предпочтительному варианту осуществления изобретения активацию аминогрупп осуществляют путем взаимодействия с бифункциональными реагентами, несущими сукцинимидильный фрагмент. Бифункциональные реагенты могут содержать различные виды спейсеров, например, -(CH2)k- или -СН2-(O-СН2-СН2-)k-фрагменты, где k имеет значения от 1 до примерно 10, предпочтительно от 1 до примерно 4 и более предпочтительно 1 или 2 и наиболее предпочтительно 1. Примерами этих реагентов является N-сукцинимидил-S-ацетилтиопропионат (SATP) и N-сукциминидил-S-ацетилтиоацетат (SATA).
где k имеет указанные выше значения.
Получение бифункциональных реагентов известно в данной области. Предшественники 2-(ацетилтио)(этокси)k-уксусной кислоты-NHS-эфиров описаны в DE-3924705, а дериватизация ацетилтиопроизводных описана у March J., Advanced Organic Chemistry (1977) cc.375-376. SATA поступает в продажу (фирма Molecular Probes, Эуген, штат Орегон, США и фирма Pierce, Рокфорд, штат Иллинойс).
Добавление только одной тиольной группы к молекуле NK4 можно осуществлять, регулируя параметры реакции, т.е. концентрацию протеина (NK4) и соотношение протеин/бифункциональный реагент.
Реакцию осуществляют, например, в водном буферном растворе с рН 6,5-8,0, например, в 10 или 100 мМ фосфате калия, с добавлением 300 мМ NaCl, рН 7,3 или без него. Бифункциональный реагент можно добавлять в ДМСО. После завершения реакции предпочтительно через 30 мин, реакцию прекращают, добавляя лизин. Избыток бифункционального реагента можно отделять с помощью известных в данной области методов, например, путем диализа или фильтрации на колонках. Среднее количество тиольных групп, добавленных к NK4, можно определять фотометрическими методами, описанными, например, у Grasetti D.R, и Murray J.F. в J. Appl. Biochem. Biotechnol. 119 (1967) cc.41-49.
После описанной выше реакции осуществляют ковалентное связывание активированного полиэтиленгликольного (ПЭГ) производного. Приемлемые производные ПЭГ представляют собой активированные молекулы ПЭГ со средней молекулярной массой от примерно 20 до примерно 40 кДа.
Активированные производные ПЭГ известны в данной области и описаны (например, у Morpurgo М., и др. в J. Bioconj. Chem. 7 (1996) с.363 и далее) для ПЭГ-винилсульфона. Для получения соединений формулы (I) можно применять виды ПЭГ с линейной и разветвленной цепью. Примерами реактивных ПЭГ-реагентов являются йодоацетилметокси-ПЭГ и метокси-ПЭГ-винилсульфон:
Применение этих активированных йодом соединений известно в данной 15 области и описано, например, у Hermanson G.T. в Bioconjugate Techniques, Academic Press, San Diego (1996) cc.147-148.
Наиболее предпочтительно виды ПЭГ активируют с помощью малеимида (алкокси-ПЭГ-малеимид), например, они представляют собой метокси-ПЭГ-малеимид (ММ 20000-40000; фирма Shearwater Polymers, Inc.). Алкокси-ПЭГ-малеимид имеет следующую структуру:
где R и m имеют указанные выше значения, предпочтительно
Реакция сочетания с алкокси-ПЭГ-малеимидом происходит после расщепления in situ тиольной защитной группы в водном буферном растворе, например, 10 мМ фосфате калия, 300 мМ NaCl, 2 мМ ЭДТК, рН 6,2. Отщепление защитной группы можно осуществлять, например, с помощью гидроксиламина в ДМСО при 25°С, рН 6,2 в течение примерно 90 мин. Для ПЭГ-модификации молярное соотношение активированного NK-4/алкокси-ПЭГ-малеимида должно составлять от примерно 1:1 до примерно 1:6. Реакцию можно прекращать путем добавления цистеина и взаимодействия оставшихся тиольных (-SH) групп с N-метилмалеимидом или другими приемлемыми соединениями, которые обладают способностью образовывать дисульфидные мостики. В результате взаимодействия любых оставшихся активных тиольных групп с защитной группой, такой как N-метилмалеимид или другая приемлемая защитная группа, протеины NK4 в конъюгатах по изобретению могут содержать такие защитные группы. Как правило, описанный выше процесс должен привести к получению смеси молекул, несущих различные количества тиольных групп, защищенных различными количествами защитных групп, в зависимости от количества активированных тиольных групп на протеине, неконъюгированном с ПЭГ-малеимидом.
В то время как N-метилмалеимид формирует один и тот же тип ковалентной связи при использовании для блокирования оставшихся тиольных групп на ПЭГилированном протеине, дисульфидные соединения в результате внутримолекулярной реакции обмена сульфид/дисульфид должны привести к сочетанию со связанным дисульфидным мостиком блокирующим реагентом. Предпочтительными блокирующими реагентами для реакции блокирования этого типа являются оксиленный глутатион (GSSG), цистеин и цистамин. В то время как при использовании цистеина в ПЭГилированный протеин не вносится никакой дополнительный чистый заряд, применение блокирующих реагентов GSSG или цистамина приводит к внесению дополнительного отрицательного или положительного заряда.
Дополнительную очистку соединений формулы (III), включая отделение моно- от ди-, три- и мультиПЭГилированных видов NK4, можно осуществлять с помощью известных в данной области методов, например хроматографии на колонках. Процентное содержание моноПЭГ-конъюгатов можно контролировать путем объединения более широких фракций, расположенных вокруг пика элюирования, с целью снижения процентного содержания моноПЭГ или путем объединения более узких фракций с целью увеличения процентного содержания моноПЭГ в композиции. Наличие примерно 90% моноПЭГ-конъюгатов обеспечивает хороший баланс между выходом и активностью. Предпочтительными являются композиции, в которых, например, по меньшей мере 92% или по меньшей мере 96% конъюгатов представляют собой виды моно-ПЭГ. Согласно варианту осуществления настоящего изобретения процентное содержание моно-ПЭГ-конъюгатов составляет от 90 до 96%.
Фармацевтические композиции
На основе соединений по настоящему изобретению можно приготавливать фармацевтические композиции с помощью методов, хорошо известных специалистам в данной области. Для получения таких композиций моноПЭГилированный NK4 по изобретению объединяют с фрамацевтически приемлемым носителем. Такие приемлемые носители описаны, например, в Remington's Pharmaceutical Sciences, 18-oe изд., 1990, Mack Publishing Company, под ред. Oslo и др. (например, cc.1435-1712). Стандартные композиции содержат эффективное количество субстанции по изобретению, например, примерно 0,1-100 мг/мл, в сочетании с приемлемым количеством носителя. Композиции можно вводить парентерально.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим конъюгаты по изобретению, в которых процентное содержание моно-ПЭГ-конъюгатов предпочтительно составляет по меньшей мере 90%, более предпочтительно по меньшей мере 92%.
Фармацевтические композиции по изобретению можно получать с помощью методов, известных в данной области. Как правило, растворы моноПЭГилированного NK4 подвергают диализу в противотоке буфера, предназначенного для использования в фармацевтической композиции и требуемую конечную концентрацию протеина регулируют путем концентрирования или разбавления.
Такие фармацевтические композиции можно применять для введения в виде инъекции, и они содержат эффективное количество моноПЭГилированного NK4 в сочетании с фармацевтически приемлемыми разбавителями, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями. Такие композиции включают разбавители на основе различных по содержанию (например, аргининовый, ацетатный, фосфатный), значению рН и ионной силе буферов, добавки, такие как поверхностно-активные вещества (детергенты) и солюбилизирующие агенты (например, Твин 80/полисорбат, pluronic F68, хлорид натрия, сульфат натрия), антиоксиданты (например, аскорбиновая кислота, L-метионин), консерванты (Timersol, бензиловый спирт) и наполнители (например, сахароза, маннит), они могут предусматривать включение материала в конкретные препараты полимерных соединений, таких как полимолочная кислота, полигликоли