Ингибиторы металлопротеиназ, их применение и фармацевтические композиции на их основе
Иллюстрации
Показать всеОписывается соединение формулы I
где Х представляет собой NR1; Y1 и Y2 представляют собой О; Z выбран из SO2N(R6), N(R7)SO2; m равно 1 или 2; А выбран из прямой связи, (С1-6)алкила; R1 представляет собой Н; R2 и R3, каждый независимо, выбран из Н, алкила, арила, алкиларила, арилалкила; каждый R4 независимо выбран из Н, (С1-3)алкила; R6 выбран из Н, алкила, арила, гетероарила, алкиларила, алкилгетероарила, арилалкила, гетероарилалкила; R2 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R3 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R4 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов; R5 представляет собой моноциклическую, бициклическую или трициклическую группу, содержащую одну или две кольцевые структуры, каждая из которых содержит вплоть до 7 кольцевых атомов, независимо выбранные из циклоалкила, арила, гетероциклоалкила или гетероарила, возможно замещенные; когда R5 представляет собой бициклическую группу, каждая кольцевая структура соединена со следующей кольцевой структурой через прямую связь, через -O-, через (С1-6)алкил или конденсирована с этой следующей кольцевой структурой; R7 выбран из (С1-6)алкила. Описывается также соединение формулы II, фармацевтические композиции и применение соединения формулы I или формулы II в изготовлении лекарства для применения в лечении заболевания или состояния, опосредованного одним или более чем одним ферментом, представляющим собой металлопротеиназу. Представленные соединения полезны в качестве ингибиторов металлопротеиназ, особенно в качестве ингибиторов ММР12. 5 н. и 15 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к соединениям, полезным при ингибировании металлопротеиназ и, в частности, к фармацевтическим композициям, содержащим эти соединения, а также к их применению.
Соединения по данному изобретению являются ингибиторами одного или более чем одного фермента, представляющего собой металлопротеиназу. Металлопротеиназы представляют собой надсемейство протеиназ (ферментов), число которых в последние годы резко возросло. По структурным и функциональным соображениям эти ферменты разделены на семейства и подсемейства, как описано в N.М.Hooper (1994) FEBS Letters 354: 1-6. Примерами металлопротеиназ являются матриксные металлопротеиназы (MMPs), такие как коллагеназы (ММР1, ММР8, ММР13), желатиназы (ММР2, ММР9), стромелизины (ММРЗ, ММР10, ММР11), матрилизин (ММР7), металлоэластаза (ММР12), энамелизин (ММР19), МТ-ММР (ММР14, ММР15, ММР16, ММР17); репролизин или адамализин или семейство MDC, которое включает в себя секретазы и шеддазы, такие как TNF-конвертирующие ферменты (ADAM10 и ТАСЕ); семейство астацинов, которое включает в себя такие ферменты, как протеиназа процессинга проколлагена (РСР), а также другие металлопротеиназы, такие как аггриканаза, семейство эндотелин-конвертирующих ферментов и семейство ангиотензин-конвертирующих ферментов.
Считается, что металлопротеиназы имеют важное значение при многих физиологических болезненных процессах, в которые вовлечено ремоделирование тканей, такое как развитие эмбриона, костеобразование и маточное ремоделирование во время менструации. В основе этого лежит способность металлопротеиназ расщеплять целый ряд матриксных субстратов, таких как коллаген, протеогликан и фибронектин. Считается также, что металлопротеиназы играют важную роль в процессинге, или секреции, биологически значимых клеточных медиаторов, таких как фактор некроза опухоли (TNF), и в посттрансляционном протеолитическом процессинге, или шеддинге, биологически значимых мембранных белков, таких как IgE рецептор CD23 низкой аффинности (более полный перечень смотри в N.М.Hooper et al., (1997) Biochem. J. 321: 265-279).
Металлопротеиназы связаны со многими заболеваниями или состояниями. Ингибирование активности одной или более чем одной металлопротеиназы может принести большую пользу при этих заболеваниях или состояниях, например при различных воспалительных и аллергических заболеваниях, таких как воспаление сустава (особенно ревматоидный артрит, остеоартрит и подагра), воспаление желудочно-кишечного тракта (особенно воспалительное кишечное заболевание, неспецифический язвенный колит и гастрит), воспаление кожи (особенно псориаз, экзема, дерматит); при метастазировании или инвазии опухоли; при заболевании, связанном с неконтролируемым разрушением внеклеточного матрикса, таком как остеоартрит; при заболевании, связанном с резорбцией кости (таком как остеопороз и болезнь Педжета); при заболеваниях, связанных с аберрантным ангиогенезом; при усиленном ремоделировании коллагена, связанном с диабетом, заболеванием периодонта (таким как гингивит), изъязвлением роговицы, изъязвлением кожи, послеоперационными состояниями (такими как кишечный анастомоз) и заживлением кожных ран; при заболеваниях, связанных с демиелинизацией центральной и периферической нервных систем (таких как рассеянный склероз); при болезни Альцгеймера; при ремоделировании внеклеточного матрикса, которое наблюдается при сердечно-сосудистых заболеваниях, таких как рестеноз и атеросклероз; при астме; при рините и при хронических обструктивных болезнях легких (ХОБЛ).
ММР12, известная также как макрофагальная эластаза или металлоэластаза, первоначально была клонирована в мыши исследователями Shapiro et al. [1992, Journal of Biological Chemistry 267:4664] и в человеке той же группой исследователей в 1995 году. ММР12 преимущественно экспрессируется в активированных макрофагах, и было показано, что она секретируется из альвеолярных макрофагов курящих людей [Shapiro et al., 1993, Journal of Biological Chemistry 268:23824], а также в пенистых клетках в атеросклеротических повреждениях [Matsumoto et al., 1998, Am J Pathol 153:109]. Мышиная модель ХОБЛ основана на провокации мышей сигаретным дымом в течение шести месяцев, две сигареты в сутки шесть суток в неделю. После такой обработки у мышей дикого типа развивалась легочная эмфизема. Когда в данной модели тестировали мышей, нокаутированных по ММР12, у них не развивалась значительная эмфизема, что четко указывает на то, что ММР12 является ключевым ферментом в патогенезе ХОБЛ. Роль ММР, таких как ММР 12, при ХОБЛ (эмфиземе и бронхите) обсуждалась в Anderson and Shinagawa, 1999, Current Opinion in Anti-inflammatory and Immunomodulatory Investigational Drugs 1(1):29-38. Недавно было обнаружено, что курение усиливает инфильтрацию макрофагов и экспрессию ММР12 макрофагального происхождения в бляшках Кангавари сонной артерии человека [Matetzky S., Fishbein МС et al., Circulation 102(18). 36-39 Suppl. S, Oct 31, 2000].
ММР13, или коллагеназа 3, первоначально была клонирована из библиотеки кДНК, полученной из опухоли молочной железы [J. M. P. Freije et al. (1994) Journal of Biological Chemistry 269 (24): 16766-16773]. ПЦР-РНК анализ РНК из различных тканей показал, что экспрессия ММР13 ограничивается карциномами молочной железы, так как она не была обнаружена в фиброаденомах молочной железы, в нормальной или покоящейся молочной железе, в плаценте, печени, яичнике, матке, простате или околоушной железе, или в клеточных линиях рака молочной железы (T47-D, MCF-7 и ZR75-1). После этого наблюдения ММР13 была обнаружена в трансформированных эпидермальных кератиноцитах [N. Johansson et al. (1997) Cell Growth Differ. 8(2):243-250], плоскоклеточных карциномах [N. Johansson et al. (1997) Am. J. Pathol. 151(2):499-508] и эпидермальных опухолях [К.Airola et al. (1997) J. Invest. Dermatol. 109(2):225-231]. Эти результаты говорят о том, что ММР13 секретируется трансформированными эпителиальными клетками и может быть вовлечена в разрушение внеклеточного матрикса и во взаимодействие клетка-матрикс, связанное с метастазированием, в частности, как это было обнаружено при инвазивных повреждениях раковой опухолью молочной железы и при злокачественном эпителиальном росте при онкогенезе кожи.
Из недавно опубликованных данных вытекает, что ММР13 играет роль в обновлении других соединительных тканей. Например, была выдвинута гипотеза, согласующаяся с субстратной специфичностью ММР13 и предпочтительным разрушением коллагена типа II [Р. G. Mitchell et at. (1996) J. Clin. Invest. 97(3):761-768; V.Knauper et al., (1996) The Biochemical Journal 271:1544-1550], о том, что ММР13 выполняет определенную роль в процессе первичного окостенения и скелетного ремоделирования [М. Stahle-Backdahl et al. (1997) Lab. Invest. 76(5):717-728; N. Johansson et al. (1997) Dev. Dyn. 208(3):387-397], в деструктивных заболеваниях суставов, таких как ревматоидный артрит и остеоартрит [D. Wernicke et al. (1996) J. Pheumatol. 23:590-595; P.G.Mitchell et al., (1996) J.Clin. Invest. 97(3):761-768; О.Lindy et al., (1997) Arthritis Rheum 40(8):1391-1399], и при асептическом ослаблении заменителей тазобедренного сустава [S.Imai et al. (1998) J. Bone Joint Surg. Br. 80(4):701-710]. MMP13 также вовлечена в хронический периодонтит взрослых, так как она локализуется в эпителии хронически воспаленной слизистой оболочки ткани десен человека [V.J.Uitto et al. (1998) Am.J.Pathol. 152(6):1489-1499], и в ремоделирование коллагенового матрикса в застарелых ранах [М. Vaalamo et al. (1997) J.Invest. Dermatol. 109(1):96-101].
ММР9 (желатиназа В; коллагеназа типа IV 92 кДа; желатиназа 92 кДа) представляет собой секретируемый белок, который впервые был очищен, а затем клонирован и секвенирован в 1989 году [S.М.Wilhelm et at. (1989) J.Biol. Chem. 264(29):17213-17221; опечатки опубликованы в J.Biol. Chem. (1990) 265(36):22570]. Недавно опубликованный обзор по ММР9 [Т.Н.Vu & Z. Werb (1998) (In: Matrix Metalloproteases, 1998. Edited by W.C.Parks & R.P.Mecnam. pp 115-148. Academic Press. ISBN 0-12-545090-7] является отличным источником подробной информации и ссылок по этой протеазе. Из указанного обзора Т.Н. Vu & Z. Werb (1998) вытекает следующее.
Экспрессия ММР9 в норме ограничена несколькими типами клеток, в том числе трофобластами, остеокластами, нейтрофилами и макрофагами. Однако ее экспрессия может быть индуцирована в этих клетках и в клетках других типов несколькими медиаторами, включая воздействие на эти клетки факторов роста или цитокинов. Они представляют собой те самые медиаторы, которые, как правило, вовлечены в инициирование воспалительной реакции. Как и другие секретируемые ММР, ММР9 высвобождается в виде неактивного профермента (Pro-), который впоследствии расщепляется с образованием ферментативно активного фермента. Протеазы, необходимые для этой активации in vivo, неизвестны. Баланс активной ММР9 в сравнении с неактивным ферментом дополнительно регулируется in vivo взаимодействием с природным белком TIMP-1 (тканевый ингибитор металлопротеаз-1). TIMP-1 связывается с С-концевым участком ММР9, что приводит к ингибированию каталитического домена ММР9. Сочетание баланса индуцированной экспрессии РгоММР9, расщепления Pro- до активной ММР9 и присутствия TIMP-1 определяет количество каталитически активной ММР9, присутствующей в сайте локализации. Протеолитически активная ММР9 атакует субстраты, которые включают в себя желатин, эластин и природные коллагены типа IV и типа V; она не обладает активностью против нативного коллагена типа I, протеогликанов или ламининов.
Возрастает масса сведений о роли ММР9 в различных физиологических и патологических процессах. Физиологические роли включают в себя инвазию эмбриональных трофобластов через эпителий матки на ранних стадиях эмбриональной имплантации, определенное участие в росте и развитии костей и миграцию воспалительных клеток из сосудистой сети в ткани.
Высвобождение ММР9, измеренное с применением иммуноферментного анализа, было значительно более высоким в жидкостях и в AM супернатантах от не подвергавшихся лечению астматиков по сравнению с другими популяциями [Am.J.Resp. Cell & Mol. Biol., Nov 1997, 17(5):583-591]. Повышенную экспрессию ММР9 наблюдали также при некоторых других патологических состояниях, и эти наблюдения свидетельствуют о том, что ММР9 вовлечена в такие болезненные процессы, как ХОБЛ, артрит, метастазирование опухолей, болезнь Альцгеймера, рассеянный склероз и перфорация бляшек при атеросклерозе, приводящая к острым коронарным состояниям, таким как инфаркт миокарда.
ММР8 (коллагеназа-2, нейтрофильная коллагеназа) представляет собой фермент 53 кД семейства матриксных металлопротеаз, которые преимущественно экспрессируются в нейтрофилах. Последние исследования указывают на то, что ММР-8 экспрессируется также в других клетках, таких как остеоартритные хондроциты [Shlopov et al., 1997, Arthritis Rheum, 40:2065]. ММР, продуцируемые нейтрофилами, могут вызывать ремоделирование тканей. Следовательно, блокирование ММР-8 может оказывать положительный эффект при фиброзных заболеваниях, например, легкого, и при дегенеративных заболеваниях, подобных эмфиземе легких. Обнаружена также положительная регуляция ММР-8 при остеоартрите, указывающая на то, что блокирование ММР8 также может быть полезным при этом заболевании.
ММР3 (стромелизин-1) представляет собой фермент 53 кД семейства матриксных металлопротеаз. Активность ММР-3 была продемонстрирована в фибробластах, выделенных из воспаленной десны [Uitto V.J. et al., 1981, J.Periodontal Res., 16:417-424], и было показано, что уровни фермента коррелируют с тяжестью заболевания десны [Overall С.М. et al., 1987, J.Periodontal Res., 22:81-88]. ММР-3 продуцируется также базальными кератиноцитами при различных хронических язвах [Saarialho-Kere U.К. et al., 1994, J. Clin. invest. 94:79-88]. мРНК и белок ММР-3 были обнаружены в базальных кератиноцитах рядом с краем раны, но дистально от него, где, вероятно, имеются сайты пролиферирующего эпидермиса. Таким образом, ММР-3 может препятствовать заживлению эпидермиса. Несколько исследователей продемонстрировали стойкое повышение ММР3 в синовиальных жидкостях пациентов с ревматоидным и остеоартритом по сравнению с контролями [Walakovits L.A. et al., 1992, Arthritis Rheum., 35:35-42, Zafarullah M. et al., 1993, J. Rheumatol. 20:693-697]. Эти исследования дают основание полагать, что ингибитор ММР-3 будет лечить заболевания, в которые вовлечено разрушение внеклеточного матрикса, приводящее к воспалению вследствие инфильтрации лимфоцитов или к потере структурной целостности, необходимой для функционирования органа.
Известно множество ингибиторов металлопротеиназ (см., например, обзор по ингибиторам ММР Beckett R. P. and Whittaker M., 1998, Exp. Opin. Ther. Patents, 8(3):259-282). Разные классы соединений могут иметь разные степени эффективности и избирательности в отношении ингибирования различных металлопротеиназ.
Whittaker M. et al. [1999, Chemical Reviews 99(9):2735-2776] рассматривают целый ряд известных соединений-ингибиторов ММР. Они утверждают, что эффективному ингибитору ММР необходима связывающая цинк группа (ZBG) (функциональная группа, способная хелатировать ион цинка(II) в активном сайте), по меньшей мере одна функциональная группа, которая обеспечивает взаимодействие водородной связи с основной цепью фермента, и одна или более чем одна боковая цепь, которая подвергается эффективным Ван-дер-Ваальсовым взаимодействиям с подсайтами фермента. В известных ингибиторах ММР связывающие цинк группы включают карбоновокислотные группы, гидроксамовокислотные группы, сульфгидрильные или меркаптогруппы и т.д. Например, Whittaker M. et al. обсуждают следующие ингибиторы ММР.
Приведенное выше соединение вошло в стадию клинической разработки. Оно имеет меркаптоацильную связывающую цинк группу, триметилгидантоинилэтильную группу в положении Р1 и лейцинил-трет-бутилглициниловую основную цепь.
Приведенное выше соединение имеет меркаптоацильную связывающую цинк группу и имидную группу в положении Р1.
Приведенное выше соединение разработано для лечения артрита. Оно имеет непептидную сукцинилгидроксаматную связывающую цинк группу и триметилгидантоинилэтильную группу в положении Р1.
Приведенное выше соединение представляет собой фталимидопроизводное, которое ингибирует коллагеназы. Оно имеет непептидную сукцинилгидроксаматную связывающую цинк группу и циклическую имидную группу в положении Р1.
Whittaker M. et al. также обсуждают другие ингибиторы ММР, имеющие Р1 циклическую имидогруппу и различные связывающие цинк группы (сукцинилгидроксаматную, карбоновокислотную, тиоловую группу, группу на основе фосфора).
Приведенные выше соединения представляются хорошими ингибиторами ММР8 и ММР9 (международные заявки WO 9858925, WO 9858915). Они имеют пиримидин-2,3,4-трионовую связывающую цинк группу.
Указанные ниже соединения не известны как ингибиторы ММР: Lora-Tamayo M. et al. (1968, An. Quim 64(6): 591-606) описывают синтез указанных ниже соединений как потенциальных противораковых агентов:
В патентах Чехии №№151744 (19731119) и 152617 (1974022) описаны синтез и противосудорожная активность следующих соединений:
R=4-NO2, 4-ОМе, 2-NO2.
В патенте США №3529019 (19700915) описаны указанные ниже соединения, используемые в качестве промежуточных соединений:
В международной заявке WO 00/09103 описаны соединения, полезные для лечения расстройства зрения, в том числе следующие (соединения 81 и 83, таблица А, с.47):
Теперь авторы изобретения открыли новый класс соединений, которые действуют как ингибиторы металлопротеиназ и представляют особый интерес при ингибировании ММР, таких как ММР12. Эти соединения являются ингибиторами металлопротеиназ, имеющими связывающую металл группу, которой нет в известных ингибиторах металлопротеиназ. В частности, авторы изобретения открыли соединения, которые являются эффективными ингибиторами ММР12 и обладают желательными профилями активности.
Соединения по данному изобретению обладают благоприятными эффективностью, избирательностью и/или фармакокинетическими свойствами.
Соединения по данному изобретению, представляющие собой ингибиторы металлопротеиназ, содержат связывающую металл группу и одну или более чем одну функциональную группу или боковую цепь, отличаются тем, что связывающая металл группа имеет формулу (k)
где Х выбран из NR1, О, S;
Y1 и Y2 независимо выбраны из О, S;
R1 выбран из Н, алкила, галогеноалкила;
любые алкильные группы, упомянутые выше, могут быть прямоцепочечными или разветвленными; любая алкильная группа, упомянутая выше, предпочтительно представляет собой (С1-7)алкил и наиболее предпочтительно (С1-6) алкил.
Соединение, представляющее собой ингибитор металлопротеиназ, является соединением, которое ингибирует активность фермента, представляющего собой металлопротеиназу (например ММР). В качестве неограничивающего примера соединение-ингибитор может показывать IC50 in vitro в диапазоне 0,1-10000 наномоль, предпочтительно 0,1-1000 наномоль.
Связывающая металл группа представляет собой функциональную группу, способную связывать ион металла в активном сайте фермента. Например, связывающая металл группа будет представлять собой связывающую цинк группу в ингибиторах ММР, связывающую ион цинка(II) в активном сайте. Связывающая металл группа формулы (k) основана на пятичленной кольцевой структуре и предпочтительно представляет собой гидантоиновую группу, наиболее предпочтительно 5-замещенный 1-Н,3-Н-имидазолидин-2,4-дион.
Таким образом, в первом аспекте изобретения предложены соединения формулы I
где X выбран из NR1, О, S;
Y1 и Y2 независимо выбраны из О, S;
Z выбран из SO2N(R6), N(R7)SO2, N(R7)SO2N(R6);
m равно 1 или 2;
А выбран из прямой связи, (С1-6)алкила, (С1-6)галогеноалкила или (С1-6)гетероалкила, содержащего гетерогруппу, выбранную из N, О, S, SO, SO2, или содержащего две гетерогруппы, выбранные из N, О, S, SO, SO2 и разделенные по меньшей мере двумя атомами углерода; R1 выбран из H, (С1-3)алкила, галогеноалкила; R2 и R3, каждый независимо, выбран из H, галогена (предпочтительно фтора), алкила, гетероалкила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкиларила, алкилгетероарила, гетероалкиларила, гетероалкилгетероарила, арилалкила, арилгетероалкила, гетероарилалкила, гетероарилгетероалкила, ариларила, арилгетероарила, гетероариларила, гетероарилгетероарила, циклоалкилалкила, гетероциклоалкилалкила;
каждый R4 независимо выбран из H, галогена (предпочтительно фтора), (С1-3)алкила или галогеноалкила;
R6 выбран из H, алкила, гетероалкила, гетероциклоалкила, арила, гетероарила, алкиларила, алкилгетероарила, гетероалкиларила, гетероалкилгетероарила, арилалкила, арилгетероалкила, гетероарилалкила, гетероарилгетероалкила, ариларила, арилгетероарила, гетероариларила, гетероарилгетероарила;
каждый из радикалов R2, R3 и R6 независимо возможно может быть замещен одной или более (предпочтительно одной) группой, выбранной из алкила, гетероалкила, арила, гетероарила, галогено, галогеноалкила, гидрокси, алкокси, галогеноалкокси, тиола, алкилтиола, арилтиола, алкилсульфона, галогеноалкилсульфона, арилсульфона, аминосульфона, N-алкиламиносульфона, N,N-диалкиламиносульфона, ариламиносульфона, амино, N-алкиламино, N,N-диалкиламино, амидо, N-алкиламидо, N,N-диалкиламидо, циано, сульфонамино, алкилсульфонамино, арилсульфонамино, амидино, N-аминосульфонамидино, гуанидино, N-цианогуанидино, тиогуанидино, 2-нитро-этен-1,1-диамина, карбокси, алкилкарбокси, нитро;
R2 и R3 возможно могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R2 и R4 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R2 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R3 и R4 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R3 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R4 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов;
R5 представляет собой моноциклическую, бициклическую или трициклическую группу, содержащую одну, две или три кольцевые структуры, каждая из которых содержит вплоть до 7 кольцевых атомов, независимо выбранных из циклоалкила, арила, гетероциклоалкила или гетероарила, причем каждая кольцевая структура независимо возможно замещена одним или более чем одним заместителем, независимо выбранным из галогена, гидрокси, алкила, алкокси, галогеноалкокси, амино, N-алкиламино, N,N-диалкиламино, алкилсульфонамино, алкилкарбоксиамино, циано, нитро, тиола, алкилтиола, алкилсульфонила, галогеноалкилсульфонила, алкиламиносульфонила, карбоксилата, алкилкарбоксилата, аминокарбокси, N-алкиламинокарбокси, N,N-диалкиламинокарбокси, где любой алкильный радикал в пределах любого заместителя сам возможно может быть замещен одной или более чем одной группой, выбранной из галогена, гидрокси, алкокси, галогеноалкокси, амино, N-алкиламино, N,N-диалкиламино, N-алкилсульфонамино, N-алкилкарбоксиамино, циано, нитро, тиола, алкилтиола, алкилсульфонила, N-алкиламиносульфонила, карбоксилата, алкилкарбокси, аминокарбокси, N-алкиламинокарбокси, N,N-диалкиламинокарбокси;
когда R5 представляет собой бициклическую или трициклическую группу, каждая кольцевая структура соединена со следующей кольцевой структурой через прямую связь, через -О-, через (С1-6)алкил, через (С1-6)галогеноалкил, через (С1-6)гетероалкил, через (С1-6)алкенил, через (С1-6)алкинил, через сульфон или конденсирована с этой следующей кольцевой структурой;
R7 выбран из (С1-6)алкила, (С3-7)циклоалкила, (С2-6)гетероалкила, (С2-6) циклогетероалкила;
любая гетероалкильная группа, упомянутая выше, представляет собой замещенный гетероатомом алкил, содержащий одну или более чем одну гетерогруппу, независимо выбранную из N, О, S, SO, SO2 (причем гетерогруппа представляет собой гетероатом или группу атомов);
любая гетероциклоалкильная или гетероарильная группа, упомянутая выше, содержит одну или более чем одну гетерогруппу, независимо выбранную из N, О, S, SO, SO2;
любая алкильная, алкенильная или алкинильная группа, упомянутая выше, может быть прямоцепочечной или разветвленной; если не указано иное, любая алкильная группа, упомянутая выше, предпочтительно представляет собой (С1-7)алкил и наиболее предпочтительно (С1-6)алкил;
при условии, что
когда Х представляет собой NR1, R1 представляет собой Н, Y1 представляет собой О, Y2 представляет собой О, Z представляет собой SO2N(R6), R6 представляет собой Н, R2 представляет собой Н, m равно 1, R3 представляет собой Н, R4 представляет собой Н и А представляет собой прямую связь, тогда R5 не представляет собой фенил, пара-нитрофенил, пара-этоксифенил или мета-метилфенил;
когда Х представляет собой S или NR1 и R1 представляет собой Н, Y1 представляет собой О, Y2 представляет собой О, Z представляет собой SO2N(R6), R6 представляет собой алкил, R2 представляет собой Н, m равно 1, один из R3 и R4 представляет собой Н, а другой представляет собой алкил, R3 и R6 или R4 и R6 соединены с образованием 5-членного кольца и А представляет собой прямую связь, тогда R5 не представляет собой фенил.
Предпочтительными соединениями формулы I являются те, к которым применимо одно или более чем одно из указанного ниже:
Х представляет собой NR1;
Z представляет собой SO2N(R6), особенно когда атом S группы Z присоединен к группе А в соединении формулы I;
по меньшей мере один из Y1 и Y2 представляет собой О, особенно предпочтительно и Y1, и Y2 представляет собой О;
m равно 1;
R1 представляет собой Н, (С1-3)алкил, (С1-3)галогеноалкил, особенно предпочтительно R1 представляет собой Н;
R2 представляет собой Н, алкил, гидроксиалкил, аминоалкил, циклоалкилалкил, алкилциклоалкил, арилалкил, алкиларил, гетероалкил, гетероциклоалкилалкил, алкилгетероциклоалкил, гетероарилалкил, гетероалкиларил, особенно предпочтительно R2 представляет собой алкил, аминоалкил или гетероарилалкил;
R3 и/или R4 представляют собой Н;
R3 и/или R4 представляют собой метил;
R3 и R4 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо) или R3 и R6 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо), или R4 и R6 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо); особенно предпочтительно R3 и R6 образуют 5- или 6-членное кольцо, наиболее предпочтительно 5-членное кольцо;
R2 и R3 образуют 5-членное кольцо или R2 и R6 образуют 5-членное кольцо;
R5 содержит возможно замещенные арильные или гетероарильные 5-или 6-членные кольца в количестве одного, двух или трех;
R5 представляет собой бициклическую или трициклическую группу, содержащую две или три возможно замещенные кольцевые структуры;
R3 и R6 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо), или R4 и R6 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо), и R5 представляет собой бициклическую или трициклическую группу, содержащую две или три возможно замещенные кольцевые структуры.
Особенно предпочтительными соединениями формулы I являются те, где R5 представляет собой бициклическую или трициклическую группу, содержащую две или три возможно замещенные кольцевые структуры.
Например, конкретными соединениями формулы I являются те, где Y1 представляет собой О, Y2 представляет собой О, Х представляет собой NR1, R1 представляет собой Н, R2 представляет собой Н, m равно 1, R3 представляет собой Н, R4 представляет собой Н, Z представляет собой SO2N(R6), R6 представляет собой Н, (С1-4)алкил, метилбензил или метилпиридил, А представляет собой прямую связь и R5 представляет собой бициклическую или трициклическую группу, содержащую две или три возможно замещенные кольцевые структуры. Некоторые такие соединения описаны в примерах 1 и 2.
Другими конкретными соединениями формулы I являются те, где Y1 представляет собой О, Y2 представляет собой О, Х представляет собой NR1, R1 представляет собой Н, R2 представляет собой Н, метил или бензил, m равно 1, R3 представляет собой Н или метил, R4 представляет собой Н, Z представляет собой SO2N(R6), R6 представляет собой Н, А представляет собой прямую связь и R5 представляет собой бициклическую или трициклическую группу, содержащую две или три возможно замещенные кольцевые структуры. Некоторые из таких соединений описаны в примере 3.
Далее, согласно изобретению предложены соединения формулы II
где каждый из G1 и G2 представляет собой моноциклическую кольцевую структуру, каждая из которых содержит вплоть до 7 кольцевых атомов, независимо выбранную из циклоалкила, арила, гетероциклоалкила или гетероарила, причем каждая кольцевая структура независимо возможно замещена одним или двумя заместителями, независимо выбранными из галогена, гидрокси, галогеноалкокси, амино, N-алкиламино, N,N-диалкиламино, циано, нитро, алкила, алкокси, алкилсульфона, галогеноалкилсульфона, алкилкарбамата, алкиламида, где любой алкильный радикал в пределах любого заместителя сам может быть возможно замещен одной или более чем одной группой, выбранной из галогена, гидрокси, амино, N-алкиламино, N,N-диалкиламино, циано, нитро, алкокси, галогеноалкокси;
Z представляет собой SO2N(R6);
В выбран из прямой связи, О, (С1-6)алкила, (С1-6)гетероалкила;
R2 выбран из Н, (С1-6)алкила, галогеноалкила, гидроксиалкила, алкоксиалкила, аминоалкила, (N-алкиламино)алкила, (N,N-диалкиламино)алкила, амидоалкила, тиоалкила или R2 представляет собой группу формулы III
С и D независимо выбраны из прямой связи, Н, (С1-6)алкила, (С1-6)галогеноалкила или (С1-6)гетероалкила, содержащего один или два гетероатома, выбранных из N, О или S, так что, когда присутствуют два гетероатома, они разделены по меньшей мере двумя атомами углерода;
G3 представляет собой моноциклическую кольцевую структуру, содержащую вплоть до 7 кольцевых атомов, независимо выбранную из циклоалкила, арила, гетероциклоалкила или гетероарила, возможно замещенную одним или двумя заместителями, независимо выбранными из галогена, гидрокси, амино, N-алкиламино, N,N-диалкиламино, циано, нитро, алкила, алкокси, алкилсульфона, галогеноалкилсульфона или алкила, замещенного одной или более чем одной группой, выбранной из галогена, гидрокси, амино, N-алкиламино, N,N-диалкиламино, циано, нитро, алкокси, галогеноалкокси;
R2 возможно замещен галогено, галогеноалкилом, гидрокси, алкокси, галогеноалкокси, амино, аминоалкилом, N-алкиламино, N,N-диалкиламино, (N-алкиламино)алкилом, (N,N-диалкиламино)алкилом, алкилсульфоном, аминосульфоном, N-алкиламиносульфоном, N,N-диалкиламиносульфоном, амидо, N-алкиламидо, N,N-диалкиламидо, циано, сульфонамино, алкилсульфонамино, амидино, N-аминосульфонамидино, гуанидино, N-цианогуанидино, тиогуанидино, 2-нитрогуанидино, 2-нитроэтен-1,1-диамино, карбокси, алкилкарбокси;
R3 и R4 независимо выбраны из Н или (С1-3)алкила;
R6 выбран из Н, (С1-3)алкиламино или R6 представляет собой (С1-3) алкил, возможно замещенный арилом, гетероарилом, гетероциклоалкилом;
R2 и R3 возможно могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R2 и R4 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов, либо R2 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов; либо R3 и R4 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов; либо R3 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов; либо R4 и R6 могут соединяться с образованием кольца, содержащего вплоть до 7 кольцевых атомов;
любая гетероалкильная группа, упомянутая выше, представляет собой замещенный гетероатомом алкил, содержащий одну или более чем одну гетерогруппу, независимо выбранную из N, О, S, SO, SO2 (причем гетерогруппа представляет собой гетероатом или группу атомов); любая гетероциклоалкильная или гетероарильная группа, упомянутая выше, содержит одну или более чем одну гетерогруппу, независимо выбранную из N, О, S,SO, SO2;
любая алкильная, алкенильная или алкинильная группа, упомянутая выше, может быть прямоцепочечной или разветвленной; если не указано иное, любая алкильная группа, упомянутая выше, предпочтительно представляет собой (С1-7)алкил и наиболее предпочтительно (С1-6)алкил.
Предпочтительными соединениями формулы II являются те, к которым применимо одно или более чем одно из указанного ниже:
Z представляет собой SO2N(R6) и атом S группы Z присоединен к кольцу G2;
В представляет собой прямую связь или О;
R2 не является возможно замещенным, или R2 выбран из Н, (С1-6)алкила, арил-(С1-6)алкила или гетероарил-(С1-6)алкила, возможно замещенных галогено, галогеноалкилом, гидрокси, алкокси, галогеноалкокси, амино, аминоалкилом, N-алкиламино, N,N-диалкиламино, (N-алкиламино)алкилом, (N,N-диалкиламино)алкилом, алкилсульфоном, аминосульфоном, N-алкиламиносульфоном, N,N-диалкиламиносульфоном, амидо, N-алкиламидо, N,N-диалкиламидо, циано, сульфонамино, алкилсульфонамино, амидино, N-аминосульфонамидино, гуанидино, N-цианогуанидино, тиогуанидино, 2-нитрогуанидино, 2-нитроэтен-1,1-диамино, карбокси, алкилкарбокси;
каждый из R3 и R4 представляет собой Н;
R6 представляет собой Н, бензил или метиленпиридин;
G1 и G2, каждый, выбраны из арила или гетероарила;
R3 и R4 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо), или R3 и R6 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо), или R4 и R6 образуют 5- или 6-членное кольцо (предпочтительно 5-членное кольцо); особенно предпочтительно R3 и R6 образуют 5- или 6-членное кольцо, наиболее предпочтительно 5-членное кольцо;
R2 и R3 образуют 5-членное кольцо или R2 и R6 образуют 5-членное кольцо.
Особенно предпочтительными соединениями формулы II являются те, где Z представляет собой SO2N(R6) и атом S группы Z присоединен к кольцу G2.
Например, конкретные соединения по изобретению включают соединения формулы II, где
(а) В представляет собой прямую связь или О;
Z представляет собой SO2N(R6) и R2 выбран из Н, (С1-6)алкила, арил-(С1-6)алкила или гетероарил-(С1-6)алкила, возможно замещенных галогено, галогеноалкилом, гидрокси, алкокси, галогеноалкокси, амино, аминоалкилом, N-алкиламино, N,N-диалкиламино, (N-алкиламино)алкилом, (N,N-диалкиламино)алкилом, алкилсульфонилом, аминосульфонилом, N-алкиламиносульфонилом, N,N-диалкиламиносульфонилом, амидо, N-алкиламидо, N,N-диалкиламидо, циано, сульфонамино, алкилсульфонамино, амидино, N-аминосульфонамидино, гуанидино, N-цианогуанидино, тиогуанидино, 2-нитрогуанидино, 2-нитроэтен-1,1-диамино, карбокси, алкилкарбокси; каждый из R3 и R4 представляет собой Н и R6 представляет собой Н, бензил или метиленпиридин, или
(б) Z представляет собой SO2N(R6) и R3 представляет собой Н, и R4 представляет собой Н (соединения формулы II'), где R2 не является возможно замещенным; предпочтительно G1 и G2, каждый, выбраны из арила или гетероарила
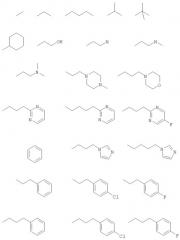
Подходящие значения для R2 включают указанные ниже:
Подходящие значения для R5 включают указанные ниже:
X'=связь, О, СН2, CHF, CF2;
R=F, Cl, Br, CF3, CF3О, CH3О, ОН, CF3CH2,
Должно быть понятно, что конкретные заместители и количество заместителей в соединениях по изобретению выбраны таким образом, чтобы избежать стерически нежелательных комбинаций.
Каждое проиллюстрированное примером соединение представляет собой конкретный и независимый аспект изобретения.
Если в соединениях по изобретению имеются оптически активные центры, авторы изобретения раскрывают все индивидуальные оптически активные формы и их комбинации как индивидуальные конкретные воплощения изобретения, также как и их соответствующие рацематы. Рацематы могут быть разделены на индивидуальные оптически активные формы с использованием известных методик (см. Advanced Organic Chemistry: 3rd Edition: author J March, p 104-107), включая, например, образование диастереомерных производных, имеющих подходящие оптически активные вспомогательные группы, с последующим разделением, а затем отщеплением этих вспомогательных групп.
Должно быть понятно, что соединения по изобретению могут содержать один или более чем один асимметрически замещенный атом углерода. Наличие одного или более чем одного из таких асимметрических центров (хиральных центров) в соединении формулы I способно давать стереоизомеры, и в каждом случае следует иметь в виду, что изобретение распространяется на все такие стереоизомеры, включая энантиомеры и диастереомеры, а также их смеси, включая их рацемические смеси.
В тех случаях, когда существуют таутомеры соединений по изобретению, авторы изобретения раскрывают все индивидуальные таутомерные формы и их комбинации как индивидуальные конкретные воплощения изобретения.
Как упомянуто выше, соединения по изобретению являются ингибиторами металлопротеиназ, в частности они являются ингибиторами ММР12. Каждое из перечисленных выше показаний для соединений формулы I представляет собой независимое и конкретное воплощение изобретения.
Некоторые соединения по изобретению имеют особенно применимые в качестве ингибиторов ММР13 и/или ММР9, и/или ММР8, и/или ММР3.
Соединения по изобретению проявляют благоприятный профиль селективности. Хотя авторы изобретения не желают быть связанными теоретическими соображениями, они считают, что соединения по изобретению проявляют селективное ингибирование в отношении любого из перечисленных выше показаний по сравнению с любой ингибиторной активностью в отношении ММР1, в качестве неограничивающего примера они могут проявлять 100-1000-кратную селективность по сравнению с ингибиторной активностью в отношении ММР1.
Соединения по изобретению могут быть предоставлены в виде фармацевтически приемлемых солей. Эти соли включают соли присоединения кислот, такие как гидрохлорид, гидробромид, цитрат и малеат, и соли, образованные с фосфорной кислотой и серной кислотой. В другом аспекте подходящими солями являются соли оснований, такие как соль щелочного металла, например натрия или калия, соль щелочноземельного металла, например кальция или магния, или соль органического амина, например триэтиламина.
Они также могут быть предоставлены в виде i