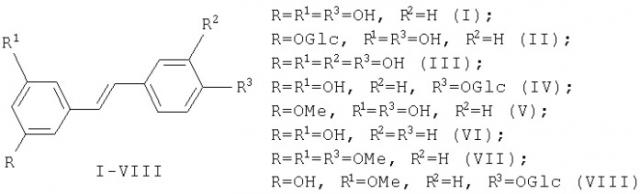Способ получения резвератрола из растительного сырья
Иллюстрации
Показать всеИзобретение относится к получению биологически активных соединений, в частности к получению резвератрола формулы (1)
из растительного сырья, в качестве которого используют кору кедра сибирского. При осуществлении способа кору кедра сибирского экстрагируют сначала петролейным эфиром 3 раза по 3 ч при температуре 70-80°С для отделения терпеновых соединений, затем извлекают стильбеновые соединения последовательной экстракцией метилтретбутиловым эфиром и этанолом в таких же условиях. Стильбеновые соединения очищают колоночной хроматографией на силикагеле с последующим дегликозилированием полученной суммы стильбеновых гликозидов с использованием тиоэтилата лития при температуре 150°С в токе аргона и с последующим O-деметилированием полученного монометилового эфира резвератрола действием трехбромистого бора в токе аргона. Технический результат - использование доступного сырья и высокий выход конечного продукта.
Реферат
Изобретение относится к химико-фармацевтической промышленности, а именно к получению низкомолекулярных биологически активных соединений, в частности транс-резвератрола, из растительного сырья.
Транс-Резвератрол (Е)-5-[2-4(гидроксифенил)этенил]-1,3-дигидроксибензол формулы (I) - природный фитоалексин, относящийся к ряду стильбенов, обнаружен в земляном орехе, винограде и других растениях [1].
Резвератрол впервые был выделен в 1940 г. из корней чемерицы (Veratrum grandiflorum О. Loes), а затем из растений рода горцов, семейства гречишных Polygonum cuspidatum, используемых в традиционной китайской и японской медицине под названием "Кайокон" для лечения дерматитов, гонореи и гиперлипемии [2-5]. Толчком к интенсивному изучению резвератрола (I) послужил так называемый "французский парадокс", когда в результате длительных эпидемиологических наблюдений обнаружили обратную зависимость между потреблением красного вина и жирной пищи и частотой сердечно-сосудистых заболеваний [6, 7]. Содержание резвератрола в свежих плодах винограда составляет 50-100 мкг/г, а концентрация в вине находится в пределах от 0.2 мг/л до 7.7 мг/л [8]. Были выявлены следующие лечебные свойства резвератрола: кардиопротекторные [9], антибактериальные (включая ингибирование различных штаммов Helicobacter pylori [10, 11], антивирусные [12], ингибирование синтеза эйкозаноидов [13], моноаминооксидазы головного мозга крыс, H+, К+-АТФазы клеток слизистой желудка, а также протеинтирозинкиназы и протеинкиназы С [14]; подавление агрегации тромбоцитов, противовоспалительные свойства, вазорелаксирующая [15], антиоксидантная [16] и противоопухолевая активность [17]. Подробно механизмы терапевтического действия резвератрола рассматриваются в обзорах [18-20].
Способы получения резвератрола (I) базируются на методах полного синтеза, а также методах извлечения из растительного сырья. В патенте [21] описаны подходы к синтезу резвератрола из 3,4-дигидрокси-бензальдегида с использованием на ключевой стадии реакции Арбузова (7 стадий, общий выход 28-36%) или реакции Хека (4 стадии, общий выход 40%). Недостатком синтетических методов является использование дорогостоящих методов и реагентов, а также многостадийность синтеза и трудоемкие методы очистки.
Более распространенные способы получения резвератрола базируются на извлечении из растительного сырья.
Так известный способ получения соединения (I) из кожицы ягод винограда [22] заключается в экстрагировании водным этанолом (соотношение 20:80 v/v, 60°C, 30 мин) и последующем отделении от цис- и транс-пицеида (II) с помощью ВЭЖХ. Недостатком способа является сложность технологии, большая трудоемкость и энергоемкость процесса.
Более доступным и богатым источником резвератрола является горец Polygonum cuspidatum. Способ получения стильбена (I) из Polygonum cuspidatum [23, 24] заключается в экстракции корней этилацетатом и последующем отделении (I) от сопутствующих стильбеновых гликозидов - пицеатаннола (III), резвератролозида (IV) и изомеров пицеида (II) путем колоночной хроматографии и затем полупрепаративной ВЭЖХ. Выход резвератрола составляет 2.18% на используемое сырье. Основными недостатками метода являются ограниченность сырьевого источника, а также использование дорогостоящих методов выделения и разделения продуктов.
Задачей изобретения является создание технологичного и экономичного способа получения резвератрола (I) из доступного растительного сырья, позволяющего снизить энерго- и трудозатраты и получать продукт улучшенного качества.
Поставленная задача решается способом получения резвератрола из коры кедра сибирского Pinus sibirica R.Mayr. путем экстракции суммы стильбеновых соединений и последующих химических трансформаций их в резвератрол (I).
По данным работ [25, 26] кора кедра сибирского является богатым источником стильбенов. Так последовательность операций
- исчерпывающая экстракция коры водным метанолом;
- извлечение стильбеновых соединений с помощью экстракции диэтиловым эфиром;
- последующая очистка и разделение экстракта путем последовательной колоночной хроматографии на импрегнированном силикагеле, а затем окиси алюминия
привела к выделению образцов резвератрола (I), пиностильбена (V), пиносильвина (VI), триметилового эфира резвератрола (VII), а также гликозилированных стильбенов - резвератролозида (IV) и пиностильбенозида (VIII). Выход резвератрола при этом составил 0.3% от веса абсолютно сухой коры кедра [25].
Предлагаемый способ получения резвератрола (I) включает дробную экстракцию коры кедра сибирского, последующее дегликозилирование стильбеновых гликозидов с использованием органического основания - тиоэтилата лития и O-деметилирование полученных соединений действием трехбромистого бора.
Измельченную кору (размер частиц 0,5-5 мм) последовательно экстрагируют петролейным эфиром (ПЭ), метилтретбутиловым эфиром (МТБ) и этанолом (2-3 раза при температуре 30-80°С). Суммарное время экстракции составляет 20-27 ч в зависимости от степени помола, применяемого растворителя, температуры. По данным ВЭЖХ и ЯМР 1H спектров экстракцией коры с помощью ПЭ отделяют терпеновые соединения (выход 3.6-6.1%). Последующей экстракцией с помощью МТБ выделяют основное количество содержащихся в коре резвератрола (I) и пиностильбена (V), а экстракцией этанолом выделяют оставшееся количество стильбенов (I) и (V), а также стильбеновые гликозиды (IV) и (VIII). Содержание и выход стильбеновых соединений в экстрактах приведены в табл.1.
С целью оценки пригодности сырья для получения стильбеновых соединений, исследована динамика накопления стильбеновых соединений в коре кедра в зависимости от времени года (табл.1).
Как видно из данных табл.1, суммарное содержание стильбенов в коре кедра составляет 5.5-7.2%, причем в осенний период содержание стильбенов выше, чем в весенний период. Содержание резвератрола (I) составляет 1.26-1.44%. Основными стильбенами коры кедра являются резвератролозид (IV) и пиностильбенозид (VIII).
| Таблица 1 | |||||||||
| Сезонная динамика накопления основных стильбеновых соединений коры кедра (по данным ВЭЖХ, колонка ProntoSIL-120-5-C18 AQ 2×75 мм, dp=5 мкм, УФ детектор). | |||||||||
| № п.п. | Время сбора сырья | Растворитель для экстракции | Выход экстракта, % | Сод-ние стильбенов % от веса сырья | Содержание стильбенов, % от экстракта | ||||
| Резвератрол (I) | Пиностильбен (V) | Резвератролозид (IV) | Пиностильбенозид (VIII) | Другие стильбены | |||||
| 1 | 03.2004 | МТБ | 0.7 | 0.55 | 12.1 | 38.2 | 2.1 | 9.1 | 10.1 |
| -""- | этанол | 10.7 | 6.09 | 2.1 | 6.5 | 12.7 | 30.9 | 5.9 | |
| Суммарное содержание | 6.64 | ||||||||
| 2 | 04.2005 | МТБ | 0.6 | 0.54 | 16.0 | 35.1 | 2.1 | 10.3 | 13.3 |
| -""- | этанол | 9.4 | 5.16 | 3.4 | 7.1 | 11.3 | 35.8 | 5.8 | |
| Суммарное содержание | 5.70 | ||||||||
| 3 | 07.2005 | МТБ | 0.7 | 0.38 | 27.8 | 30.1 | 2.3 | 16.2 | 10.1 |
| -""- | этанол | 8.0 | 6.76 | 7.2 | 9.7 | 26.7 | 33.6 | 8.6 | |
| Суммарное содержание | 7.14 | ||||||||
| 4 | 09.2003 | МТБ | 0.7 | 0.54 | 13.7 | 38.3 | 2.1 | 10.9 | 9.9 |
| -""- | этанол | 8.7 | 6.54 | 6.8 | 13.2 | 23.9 | 30.6 | 5.0 | |
| Суммарное содержание | 7.08 | ||||||||
| 5 | 10.2004 | МТБ | 0.7 | 0.44 | 10.9 | 30.3 | 1.4 | 10.8 | 11.8 |
| -""- | этанол | 9.8 | 6.74 | 6.0 | 9.0 | 19.9 | 31.5 | 4.6 | |
| Суммарное содержание | 7.18 |
Известно, что дегликозилирование стильбенов не является простой задачей. Как кислотный [27], так и щелочной гидролиз [28] дают низкий выход стильбенов вследствие протекания побочных реакций. Предлагается новый метод дегликозилирования стильбенов (IV) и (VIII) с использованием органического основания тиоэтилата лития - LiSEt [29]. Этот реагент успешно применяется в синтетической органической химии для расщепления арилметиловых эфиров [30], однако для дегликозилирования ранее не применялся.
В результате обработки индивидуальных стильбенов (IV), (VIII) или суммарного спиртового экстракта действием 8-10 экв. LiSEt в ДМФА образуются стильбены (I) (выход 70%), (V) (выход 75%) или смесь (I, V) (выход 71%).
Последующее O-деметилирование монометилового эфира (V) действием BBr3 [31] приводит к резвератролу (I) (выход 68%). Продукт выделяют колоночной хроматографией на силикагеле. Суммарный выход резвератрола (I) по данной методике достигает 3.5% от веса сухой коры.
К отличительным признакам способа следует отнести следующее.
1. Получение резвератрола сочетанием методов экстракции суммы стильбенов из растительного сырья и последующих химических превращений - дегликозилирования стильбеновых гликозидов и O-деметилирования метилового эфира резвератрола.
2. Использование доступного отечественного сырья коры кедра сибирского.
3. Использование дробной экстракции растительного сырья, позволяющей отделить примеси терпеноидного типа.
4. Разработка нового метода дегликозилирования стильбенов с использованием органического основания.
Данное изобретение иллюстрируется примерами.
Пример 1. Экстракция коры кедра. Идентификация стильбеновых соединений. 220 г измельченной (0.5-5.0 мм) коры кедра сибирского Pinus sibirica R.Mayr. заливают 300 мл петролейного эфира. После выдерживания при нагревании с обратным холодильником на водяной бане в течение 3 ч (70-80°С) экстрагент сливают. Операцию повторяют 3 раза. Получают 6.1-12.6 г экстракта (фракция терпеновых соединений, выход 3.6-6.1% от веса воздушно-сухой коры). Остаток коры последовательно экстрагируют МТБ и этанолом в указанных условиях. После упаривания экстрактов получают фракции стильбеновых соединений. Вес экстрактов, извлекаемых МТБ - 1.35-1.45 г (выход 0.6-0.7% от веса воздушно-сухой коры). Вес экстрактов, извлекаемых этанолом - 15.7-23.2 г (выход 7.7-11.1% от веса воздушно-сухой коры). Содержание стильбеновых компонентов по фракциям приведено в таблице 1. Идентификацию индивидуальных соединений проводят путем выделения с помощью колоночной хроматографии на силикагеле и сравнением физико-химических характеристик с литературными данными. Разделение МТБ экстракта. Колоночной хроматографией на силикагеле (1.05 г вещества, 30 г SiO2, элюент хлороформ:этанол 10:0→10:2) последовательно собирают 6 фракций, из которых кристаллизацией из соответствующего растворителя выделяют 0.18 г пиностильбена (V) [т.пл. 115-116°С (хлороформ-эфир)] {лит.данные: т.пл. 117-118°С (хлороформ-метанол) [32]}, 0.08 г резвератрола (I) [т.пл. 250-253°С (хлороформ-этанол)] {лит.данные: т.пл. 263°С (6%-ная СН3CO2Н) [33], т.пл. 246°С (хлороформ-метанол) [32]} и 0.125 г порошка, представляющего смесь стильбенов (I, IV, VIII). Разделение этанольного экстракта. Хроматографированием на силикагеле 2.5 г этанольного экстракта образца №1 (элюент - хлороформ: метанол 10:0.2→10:5) получают последовательно 6 фракций, из них фракции 3-5 содержат стильбеновые соединения (по данным ВЭЖХ). Из 3-ей фракции (0.55 г) выделяют 0.08 г смеси пиностильбена (V) и резвератрола (I), из 4-ой (0.4 г) - 0.25 г чистого пиностильбенозида (VIII) {[α]20 D - 52°(с 2.2, ацетон), т.пл. 180-182°С (хлороформ-эфир)} {лит. данные: т.пл. 182-183°С (хлороформ-метанол) [25]} и 0.10 г резвератролозида (IV) {[α]20 D - 52° (с 0.7, ацетон), т.пл. 238-240°С (хлороформ-эфир)} {лит.данные: т.пл. 240°С (хлороформ-метанол) [25]}. После рехроматографирования фракции 5 (0.45 г) на силикагеле с последующим добавлением к остатку после удаления растворителя диэтилового эфира выделяют 0.28 г смеси (IV) и (VIII) (соотношение ˜1:1.5 по данным ВЭЖХ).
Спектральные данные выделенных соединений. Резвератрол (I), спектр ЯМР 1H (CD3CD, 400.13 МГц, δ, м.д., J/Гц): 6.21 (дд, 1Н, Н(4), J=1.9); 6.48, 6.49 (оба д, 2Н, Н (2,6) J=1.9); 6.79 (д, 2Н, Н(3',5'), J=8.7); 6.84 (д, 1Н, H(α), J=16.2); 6.97 (д, 1H, Н(β), J=16.2); 7.39 (д, 2 Н, Н (2',6'), J=8.7). Значения химических сдвигов сигналов (в пределах изменения от влияния растворителя и концентрации) совпадают с данными, приведенными в [34]. Спектр ЯМР 13С (δс, м. д.): 102.7 (С4), 105.6 (С2,6), 116.4 (С3',5'), 126.8 (Сα), 128.7 (С2',6'), 129.1 (Сβ), 129.9 (С1), 140.8 (С1'), 158.2 (С4'), 159.6 (С3,5). Пиностильбен (V), спектр ЯМР 1H (CD3OD, 400.13 МГц, δ, м. д., J/Гц): 3.78 (с, 3Н, ОСН3), 6.29 (дд, 1Н, Н(4), J=2.0); 6.62, 6.65 (оба д, 2Н, Н (2,6), J=2.0); 6.89 (д, 2Н, Н(3',5'), J=8.5); 6.94 (д, 1Н, H(α), J=16.3); 6.99 (д, 1Н, H(β), J=16.3); 7.40 (д, 2 Н, Н (2',6'), J=8.5). Спектр ЯМР 13С (δс, м. д.): 55.6 (СН3), 102.7 (С4), 105.2, 106.8 (С2,6), 117.1 (С3',5'), 127.9 (Сα), 128.7 (С2',6'), 128.9 (Сβ), 130.2 (С1'), 140.9 (С1), 158.2 (С4'), 159.4 (С3), 162.1 (С5). Резвератролозид (IV), спектр ЯМР 1H (CD3OD, 400.13 МГц, δ, м. д., J/Гц): 3.4-3.55 (м, 4Н, Н2'',3'',4'',5''); 3.71 (дд, 1Н, H(6''b), J=11.6, 5.3); 3.91 (дд, 1Н, H(6''a), J=11.6, 2.1); 4.94 (дд, 1Н, Н(1''), J=7.6, 7.1); 6.21 (д, 1H, H(4), J=2.0); 6.48, 6.49 (оба д, 2Н, Н (2,6), J=2.0); 6.99 (д, 2Н, Н(3',5'), J=8.7); 6.88 (д, 1H, H(α), J=16.2); 7.01 (д, 1H, H(β), J=16.2); 7.47 (д, 2Н, Н (2',6'), J=8.7). Спектр ЯМР 13С (δс, м.д.): 62.6 (С6''), 71.5 (С4''), 75.0 (С2''), 78.1 (С5''), 78.2 (С3''), 102.3 (С1''), 103.0 (С4), 106.0 (С2,6), 118.0 (С3',5'), 128.5 (Сα), 128.8 (С2',6'), 128.9 (Сβ) 133.3 (С1'), 141.0 (С1), 158.7 (С4'), 159.7 (С3,5). Пиностильбенозид (VIII), спектр ЯМР 1H (СО3)2СО, 400.13 МГц, δ, м. д., J/Гц): 3.42-3.55 (м, 4Н, Н2''',3''',4''',5'''); 3.70 (дд, 1H, H(6''b), J=11.5, 5.6); 3.76 (с, 3Н, ОСН3); 3.87 (дд, 1H, H(6''а), J=11.5, 2.2); 4.46 (y.c 1H-OH при С4''); 4.52 (у.с 1Н-ОН при С2''); 4.74 (у.с 1Н-ОН при С3''); 4.97 (дд, 1Н, Н(1''), J=7.5, 7.3); 6.31 (дд, 1Н, Н(4), J=2.0); 6.63, 6.64 (оба д, 2Н, Н (2,6), J=2.0); 7.05 (д, 2Н, Н(3',5'), J=8.8); 6.98 (д, 1Н, Н(α), J=16.1); 7.11 (д, 1Н, Н(β), J=16.1); 7.49 (д, 2Н, Н (2',6'), J=8.8); 8.0 с (ОН); 8.6 с (ОН). Спектр ЯМР 13С (δC, м.д.): 55.7 (СН3), 62.5 (С6''), 71.3 (С4''), 74.9 (С2''), 77.9 (С5''), 78.1 (С3''), 101.7 (С1''), 102.2 (С4), 104.6 (С6), 106.8 (С2), 117.9 (С3',5'), 128.4 (Сα), 128.6 (С2',6'), 129.2 (Сβ), 133.1 (С1'), 141.0 (С1), 158.7 (С4'), 159.7 (С3), 162.5 (С5).
Пример 2. Получение резвератрола (I) из резвератролозида (IV). К раствору 100 мг (250 ммоль) резвератролозида (IV) в 15 мл ДМФА добавляют 67 мг (990 ммоль) LiSEt. Реакционную массу нагревают при 150°С 2 ч, затем после охлаждения в токе аргона добавляют 2 мл 1М водн. раствора HCl и 50 мл этилацетата. Образовавшийся раствор переносят в делительную воронку и тщательно промывают насыщенным раствором аммония хлористого (3×20 мл) и водой (2×10 мл). Органический слой сушат над сульфатом магния и упаривают. К остатку добавляют хлороформ, отфильтровывают образовавшийся осадок. Получают 43 мг (70%) стильбена (I).
Пример 3. Получение пиностильбена (V) из пиностильбенозида (VIII). К раствору 500 мг (1.23 моль) пиностильбенозида (VIII) в 35 мл ДМФА добавляют 670 мг (9.85 моль) LiSEt. Реакционную массу нагревают при 150°С 2 ч, затем после охлаждения в токе аргона добавляют 2 мл 1М водн. раствора HCl и 50 мл этилацетата. Образовавшийся раствор переносят в делительную воронку и тщательно промывают насыщенным раствором аммония хлористого (3×30 мл) и водой (2×20 мл). Органический слой сушат над сульфатом магния и упаривают. Остаток (300 мг) хроматографируют на силикагеле (элюент - хлороформ:этанол 10:0→10:2). Выделяют 240 мг (75%) пиностильбена (V).
Пример 4. Получение смеси резвератрола (I) и пиностильбена (V) из суммы стильбеновых гликозидов. К раствору 210 мг смеси гликозидов (IV) и (VIII) (˜0.5 моль) в 25 мл ДМФА добавляют 470 мг (4.77 моль) LiSEt. Реакционную массу нагревают при 150°С 2 ч, затем после охлаждения в токе аргона добавляют 2 мл 1 М водн. раствора HCl и 50 мл этилацетата. Образовавшийся раствор переносят в делительную воронку и тщательно промывают насыщенным раствором аммония хлористого (3×30 мл) и водой (2×10 мл). Органический слой сушат над сульфатом магния и упаривают. Остаток 118 мг (˜71%) по данным ВЭЖХ представляет собой смесь резвератрола (I), пиностильбена (V) и стильбенозида (IV) и пиностильбенозида (VIII) (содержание 29.9%, 58.6%, 2.2% и 6.7% соответственно).
Пример 5. Получение резвератрола (I). Раствор трибромборана (1.08 ммоль) в 10 мл CH2Cl2 прикалывают к раствору 256 мг (1 ммоль) пиностильбена (V) в 100 мл CH2Cl2 в токе аргона при -78°С. Реакционную смесь перемешивают при комнатной температуре 2 ч, охлаждают до -20°С и обрабатывают 10%-ным раствором аммиака (15 мл). Через 30 мин температуру поднимают до комнатной, реакционную смесь нейтрализуют добавлением 5%-ной HCl и экстрагируют этилацетатом. Объединенные органические экстракты последовательно промывают рассолом, водой, сушат над сульфатом магния и упаривают. Остаток (200 мг) очищают колоночной хроматографией на силикагеле (элюент хлороформ-этанол, 5:1). Остаток после упаривания элюата растирают с эфиром, отфильтровывают 170 мг (68%) резвератрола (I), т.пл. 250-252°С.
Таким образом, предлагаемый способ получения резвератрола (I) обладает следующими преимуществами.
- Использование доступного сырья - коры кедра сибирского Pinus sibirica R.Mayr.
- Применение нового метода дегликозилирования, позволяющего существенно повысить выход целевого продукта (до 3.5%) от сырья.
Источники информации
1. А.М.Rimando, W.Kalt, J.B.Magee, J.Dewey, J.R.Ballington, J.Agric. Food Chem., 2004, 52, 4713.
2. M.J.Takaoka, J.Faculty Sci Hokkaido Imperial, 1940, U 3, 1-16.
3. B.C.Vastano, Y.Chen, N.Zhu, C.T.Ho, Z.Zhou, R.T.Rosen, J.Agric. Food Chew., 2000, 48, 253.
4. S.K.Lee, Z.H.Mbwambo, H.Chung, L.Luyengi, E.J.Gamez, R.G.Mehta, A.D.Kinghorn, J.M.Pezzuto, Comb. Chem. High Throughput Screen, 1998, 7, 35.
5. R.H.Cichewich, S.A.Kouzi, J. Nat. Prod. Chem., 2002, 26, 507.
6. P.Kopp, Eur. J.Endocrinol, 1998, 138, 619.
7. A.Y.Sun, A.Simonyi, G.Y.Sun, Free Radic. Biol. Med, 2002, 32, 314.
8. L.L.Creasy, M.Coffee, J. Am. Soc. Hort. Sci., 1988, 113, 230.
9. L.M.Hung, J.K.Chen, S.S.Huang, R.S.Lee, M.J.Su, Cardiovasc. Res., 2000, 47, 549.
10. M.M.Chan, Biochem. Pharmacol., 2002, 63, 99.
11. G.B.Mahady, S.L.Pendland, L.R.Chadwick, Am. J. Gastroenterol., 2003, 98, 1440.
12. J.J.Docherty, J.S.Smith, M.M.Fu, T.Stoner, T.Booth, Antiviral Res., 2004, 61, 19.
13. Pace-Asciak С., Hahn S., Diamndis E., Soleas G., Goldberg D., Clin. Chem. Acta, 1995, 235, 207.
14. Jayatilake G., Jayasuriya H., Lee E., KoonchaNOK п., Geahlen R., Ashendel C., McLaughlin J., Chang C., J.Nat. Prod., 1993, 56, 1805.
15. K.P.L. Bhat, J.W.Kosmeder, J.M.Pezzuto, Antioxid. Redox Signal., 2001, 3, 1041.
16. Goldberg D., Clin. Chem., 1996, 42, 113.
17. J.Gusman, H.Malonne, G.Atassi, Carcinogenesis., 2001, 22, 1111.
18. F.Wolter, J.Stein, Drug Future, 2002, 27, 949.
19. B.B.Aggarwal, A.Bhardwaj, R.S.Aggarwal, N.P.Seeram, S.Shishodia, Y.Takada, J.Anticancer Res., 2004, 24, 713.
20. В.А.Тутельян, M.M.Гаппаров, Л.Ю.Телегин, В.М.Девиченский, Л.А.Певницкий, Бюллетень экспериментальной биологии и медицины, 2003, 136 (12), 604.
21. Andrus M., Meredith E., World Patent Application WO 2001 060774; C.A, 2001 135 180660.
22. Romero-Peres A.I., Lamuela-Raventos R.M., Andres-Lacueva R.M., J. Agric. Food Chem., 2001, 49, 210.
23. Vastano B.C., Chen Y., Zhu N., Ho C.-T., Zhou Z., Rosen R.T., J. Agric. Food Chem., 2000, 48, 253.
24. Chen L., Han Y., Yang F., Zhang Т., J. Chromatography, A, 2001, 907, 343.
25. А.С.Громова, Н.А.Тюкавкина, В.И.Луцкий, Г.А.Калабин, Д.Ф.Кушнарев, Химия природных соединений, 1975, №6, с.677.
26. А.С.Громова, В.И.Луцкий, Н.А.Тюкавкина, Химия природных соединений, 1977, №2, с.275.
27. Atta-ur-Rahman, H.Naz, Fadimatou, Т.Makhmoor, A.Yasin, N.Fatima, F.N.Ngounou, S.F.Kimbi, B.L.Sondengam, M.I.Choudhary, J.Nat. Prod., 2005, 68, 189.
28. A. De Munno, В.Vincenzo, P.Nevio, I. Francesca, P. Marco, Heterocycles, 1996, 43, 1893.
29. К.Е.Polunin, I.A.Polunina, H.-G.Schmalz, Mendeleev Communications, 2002, 12 (5), 178-180.
30. Y.Kashiwada, G.Nonaka, I.Nishioka, Chem. Pharm. Bull., 1984, 32, 3501.
31. Т.Suga, S.Ohta, K.Munesada, N.Ide, M. Kurokawa, M, Shimizu, E.Ohta, Phytochemistry, 1993, 33 (6) 1395.
32. Н.А.Тюкавкина, А.С.Громова, В.И.Луцкий, В.К.Воронов. Химия природных соединений, 1972, №6, с.600.
33. S.Nonomura, H.Kanagawa, A.Makimoto, Yakugaku Zasshi, 1963, 13, 988; C.A, 1964, 604240.
34. Г.А.Калабин, Д.Ф.Кушнарев, Н.А.Тюкавкина, А.С.Громова, В.И.Луцкий. Химия природных соединений, 1976, №1, с.3.
Способ получения резвератрола формулы (1)
из растительного сырья, отличающийся тем, что в качестве растительного сырья используют кору кедра сибирского, а получение целевого продукта осуществляют следующим образом: кору кедра сибирского экстрагируют сначала петролейным эфиром 3 раза по 3 ч при температуре 70-80°С для отделения терпеновых соединений, затем извлекают стильбеновые соединения последовательной экстракцией метилтретбутиловым эфиром и этанолом в таких же условиях, стильбеновые соединения очищают колоночной хроматографией на силикагеле (элюент хлороформ-этанол) с последующим дегликозилированием полученной суммы стильбеновых гликозидов с использованием органического основания - тиоэтилата лития при температуре 150°С в токе аргона и O-деметилированием полученного монометилового эфира резвератрола действием трехбромистого бора в токе аргона с последующим перемешиванием при комнатной температуре.