Фрагменты антитела, специфичные в отношении человеческого раково-эмбрионального антигена (cea)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может найти применение в медицине для иммунотерапии опухолей. Изобретение касается моновалентных и двухвалентных одноцепочечных (ди-антитело) Fv-фрагментов (scFv) антител, полученных с использованием РНК, экстрагированной и продуцирующей Mab CB/ior-CEA.1 гибридомы. Фрагменты антител по изобретению имеют установленную аминокислотную последовательность (приведена в перечне последовательностей), специфичны в отношении человеческого СЕА, имеют константу аффинности к СЕА, составляющую для моновалентного фрагмента (5,0±0,4)х109 л·моль-1 и (2,8±0,3)х1010 л·моль-1 для ди-антитела. Показана возможность их использования в составе фармацевтических композиций для лечения СЕА-экспрессирующих человеческих опухолей и определения in vivo локализации опухоли. Описана генетически модифицированная клетка, экспрессирующая указанный фрагмент антитела, а также многоклеточный генетический модифицированный организм, в частности трансгенное растение. Описан плазмидный вектор, содержащий нуклеотидную последовательность, кодирующую указанный фрагмент антитела. Фрагменты scFv моновалентного антитела и ди-антитела не имеют Fc-доменов и имеют меньший размер молекулы, чем мышиное Mab, что дает возможность фрагментам лучше проникать в ткани in vivo и оказывать меньшее иммуногенное действие при использовании на живом организме. 9 н. и 3 з.п. ф-лы, 6 ил., 8 табл.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к области иммунологии, а в частности к фрагментам одноцепочечного антитела типа Fv, к его моновалентным и двухвалентным (ди-антитело) формам, полученным методами рекомбинантных ДНК из мышиного моноклонального антитела с подтвержденной клинической эффективностью, которое является специфичным в отношении человеческого раково-эмбрионального антигена.
Предшествующий уровень техники
Раково-эмбриональный антиген (СЕА) представляет собой гликопротеин размером 180 кДа, секретируемый преимущественно клетками опухолей желудочно-кишечного тракта человека и клетками других карцином, но он может также обнаруживаться и в некоторых незлокачественных тканях, таких как слизистая толстой кишки. Физиологическая роль этого антигена полностью не выяснена, и до настоящего времени считалось, что этот антиген в определенной степени ассоциирован с процессами клеточной адгезии (Gold P., Freedman S.O. Journal of Experimental Medicine 122: 467; 1965; Zimmermann W. et al. PNAS USA 84: 2960-2964; 1987; Paxton R.J. et al., PNAS USA 84:920-924, 1987; Beauchemin N. et al. Molec. Cellular Biol. 7:3221-3230, 1987; Gold P., Goldenberg N.A. MJM 3:46-66, 1997).
CEA является членом суперсемейства иммуноглобулинов, что обусловлено его структурой, характеризующейся наличием повторяющихся доменов (Oikawa S. et al., BBRC 144:634-642, 1987; Thompson J., Zimmermann W. Tumor Biology 9:63-83, 1988; Hammarstrom S. Seminars in Cancer Biology 67-81, 1999). СЕА имеет высокую степень гомологии с другими молекулами этого суперсемейства, такими как NCA, мекониевый антиген, билиарный гликопротеин типа А и гликопротеин b, ассоциированный с беременностью (von Kleist S. Burtin P. Immunodiagnosis of Cancer. Marcel Dekker. 322-341, 1979; Buchegger F. et al. Int. J. Cancer 33, 643-649, 1984; Matsuoka Y. et al. Cancer Res. 42:2012-2018, 1982; Svenberg T. Int. J. Cancer 17:588-596, 1976).
Поскольку уже многие годы считается, что увеличение уровней СЕА в кровотоке является одним из наилучших показателей возможных рецидивов и/или метастазов, то пациентов с первичными опухолями толстой и прямой кишки, экспрессирующими этот антиген, направляли на хирургическую операцию (Gold P., Goldenberg N.A. MJM 3:46-66, 1997). Измерение уровней СЕА в кровотоке также получило распространение в качестве метода наблюдения за развитием карцином у человека (молочной железы, легких) в случаях, когда перед операцией были выявлены значительные уровни этого опухолевого маркера (Gold P., Goldenberg N.A. MJM 3:46-66, 1997).
Со времени разработки метода продуцирования моноклональных антител (Mab; Kohler G, Milstein C. Nature 256:52-53, 1975) специфичность иммуноанализов для измерения уровней СЕА в кровотоке заметно повысилась и использование этих анализов получило широкое распространение.
В течение уже многих лет проводятся исследования СЕА как возможной "клеточной мишени" для специфического нацеливания на нее радиоактивных изотопов в целях in vivo - диагностики (Goldenberg D.M. Int. J. of Biol. Markers 7, 183-188, 1992) и проведения in situ лучевой терапии (Ledermann et al., Int. J. Cancer 47:659-664, 1991). Было высказано предположение, что этот антиген может быть также использован для нацеливания токсинов, лекарственных средств и других биоактивных продуктов на опухолевые клетки (Bagshawe K.D. Drug Dev. Res. 34:220-230, 1995).
Анти-СЕА-антитела являются главными носителями, используемыми в этих целях, начиная с поликлональных препаратов и кончая полученными позже мышиными Mab, их Fab-фрагментами, фрагментами антител, продуцированными из мышиного Mab методами генной инженерии и совсем недавно полученными из библиотек мышиных и человеческих антител, представленных в нитчатом фаге (Hammarstrom S. et al., Cancer Res. 49, 4852-4858, 1989; Hudson P.J. Curr. Opinion Immunology 11:548-557, 1999; Griffiths A.D. et al., EMBO J. 12, 1993; 725-734; Griffiths A.D. et al., EMBO J. 13, 3245-3260, 1994; WO 93/11236; Chester K. et al., 1995, WO 95/15341; Allen D.J. et al. 1996, US5872215).
Способы экспрессии антител и фрагментов антител в прокариотических клетках, таких как E.coli, и в других микроорганизмах хорошо известны специалистам (Pluckthun A. Bio/Technology 9:545-551, 1991; Gavilondo J, Larrick J.W. Biotechniques 29:128-132, 134-136, 2000). Способы экспрессии антител и фрагментов антител в высших эукариотических клетках в культуре также известны специалистам (Reff M.E. Curr Opinion Biotech. 4:573-576, 1993; Trill J.J. et al., Curr. Opinion Biotech 6:553-560, 1995).
Мышиное Mab, имеющее общее название СВ-СЕА.1 или ior-CEA.1 (и далее обозначаемое СВ/ior-CEA.1), известно специалистам. Это Mab обладает высокой специфичностью в отношении человеческого СЕА, но при этом оно не вызывает нежелательных перекрестных реакций с такими молекулами, как NCA, и не распознает нормальные ткани, за исключением клеток эпителия нормальной толстой кишки, где СЕА может в основном наблюдаться в поляризованной форме (Tormo B. et al., APMIS 97:1073-1080, 1989). Это Mab обладает очень высокой аффинностью к СЕА (Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996). Такое Mab, меченное 99mTc, было с успехом использовано для диагностики опухолей толстой и прямой кишки у человека и для наблюдения за этими опухолями. Клинические исследования по радиоиммунодетекции показали, что указанное антитело обладает 91,3%-ной чувствительностью, 77,1%-ной специфичностью и 82,8%-м положительным прогностическим значением (Oliva J.P. et al., Rev. Esp. Med. Nucl. 13:4-10, 1994). Отсюда очевидно, что его эффективность превосходит лишь эффективность другого моноклонального анти-СЕА-антитела, используемого в аналогичных целях в современных клиниках всего мира, а именно антитела СЕА-Scan (99mTc-Arcitumomab) от Immunomedics (Morris Plains, NJ, USA).
В 1992 году (Ayala M. et al., Biotechniques 13:790-799, 1992) сообщалось о получении одноцепочечного Fv-фрагмента антитела (scFv), генерированного посредством полимеразной цепной реакции (ПЦР) из РНК, экстрагированной из гибридомы, продуцирующей указанное Mab CB/ior-CEA.1. В соответствии с экспериментальной стратегией, амплификация вариабельных доменов CB/ior-CEA.1 была осуществлена с использованием вырожденных олигонуклеотидов для каркасных областей обоих вариабельных доменов. scFv был продуцирован в E.coli и распознавал СЕА в анализе ELISA и в цитохимических исследованиях, но при этом его аффинность по отношению к иммобилизованному антигену была в 200 раз ниже аффинности Fab, продуцируемого естественным образом (Perez L. et al. Applied Biochem. Biotechnol. 24:79-82, 1996). Этот scFv-фрагмент был клонирован, экспрессирован и продуцирован в Pichia pastoris (Freyre F.M. et al., J. Biotechnol. 76(2-3):157-163, 2000), но при этом он не обладал какой-либо повышенной аффинностью по отношению к человеческому СЕА, а исследования, проводимые на экспериментальных животных с использованием радиоактивно меченного фрагмента, указывали на аномальное биораспределение этого фрагмента (Pimentel G.J. et al. Nucl. Med. Commun. 22:1089-94, 2001), что явилось причиной прекращения его дальнейшего исследования.
Сущность изобретения
Настоящее изобретение относится к одноцепочечным Fv-фрагментам (scFv) антитела, к его моновалентным и двухвалентным (ди-антитело) формам, полученным методами рекомбинантных ДНК из мышиного моноклонального антитела против раково-эмбрионального антигена (СЕА) CB/ior-CEA.1 (Tormo B. et al., APMIS 97:1073-1080, 1989). Это Mab обладает очень высокой аффинностью в отношении СЕА (Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996), и оно было с успехом использовано для диагностики опухолей толстой и прямой кишки у человека и для наблюдения за этими опухолями (Oliva J.P. et al., Rev. Esp. Med. Nucl. 13:4-10, 1994). Фрагменты scFv моновалентного антитела и ди-антитела, описанные в настоящем изобретении, могут быть продуцированы посредством их экспрессии в рекомбинантных микроорганизмах, таких как бактерии и дрожжи. Как и исходное Mab, моновалентные и двухвалентные фрагменты (ди-антитело) scFv являются специфичными в отношении эпитопа человеческого СЕА, в зависимости от степени сохранения углеводов и от степени аффинности к этому антигену. По своей способности к распознаванию in vitro нормальных и опухолевых клеток и тканей человека фрагменты scFv моновалентного антитела и ди-антитела аналогичны исходному Mab, и, также как и Mab, после их радиоактивного мечения они обладают способностью идентифицировать опухолевые клетки, которые экспрессируют повышенные уровни человеческого СЕА у бестимусных мышей с врожденной мутацией по гену "nude". Фрагменты scFv моновалентного антитела и ди-антитела не имеют Fc-доменов и имеют меньший размер молекулы, чем мышиное Mab, что дает им возможность лучше проникать в ткани in vivo и оказывать меньшее иммуногенное действие при введении человеку в диагностических или терапевтических целях.
По сравнению с другими scFv, полученными ранее из того же самого Mab, фрагменты scFv моновалентного антитела и ди-антитела, описанные в настоящем изобретении, имеют важные отличия в аминокислотном составе вариабельных доменов тяжелой цепи (VH) и легкой цепи (VL) и обладают более высокой аффинностью к СЕА, лучшей способностью распознавать клетки и ткани и более высокой эффективностью в определении локализации опухолей, которые продуцируют повышенные уровни человеческого СЕА у мышей in vivo.
Рекомбинантные моновалентные и двухвалентные фрагменты (ди-антитело) scFv, описанные в настоящем изобретении, были получены посредством ПЦР и методами клонирования и экспрессии в рекомбинантных микроорганизмах исходя из РНК, экстрагированной из гибридомы CB/ior-CEA.1. Для амплификации и выделения нуклеотидных последовательностей, кодирующих домены VH и VL Mab, были использованы наборы олигонуклеотидов, отличающихся от тех олигонуклеотидов, которые были использованы для получения уже известных scFv (Ayala M. et al., Biotechniques 13:790-799, 1992). В настоящем изобретении показано, что, по сравнению с уже полученным ранее scFv, новые фрагменты scFv моновалентного антитела и ди-антитела имеют важные отличия в аминокислотных последовательностях доменов VH и VL и что, в отличие от уже известных scFv, они состоят из 16 аминокислот в каркасных участках 1 (FR1) и 3 (FR3) и в гипервариабельной области 2 (CDR2) домена VH и содержат 3 аминокислоты между FR1 и FR3 доменов VL, в отличие от уже полученного ранее scFv. Это указывает на то, что такие домены имеют другое клональное происхождение по сравнению с доменами, описанными Ayala et al. (Biotechniques 13:790-799, 1992). В случае ди-антитела этот домен также отличается от уже полученного ранее scFv по размеру и по аминокислотному составу связующего сегмента (линкера), который используется для конструирования молекулы типа scFv.
Эти отличия неожиданно отразились на биохимических и биологических свойствах новых фрагментов и сообщали им поведение, очень схожее с поведением Mab CB/ior-CEA.1, но при этом свойства этих новых фрагментов были значительно лучше, чем свойства уже известного scFv. Новый моновалентный фрагмент scFv, имеющий линкер, идентичный линкеру уже известного scFv (Ayala M. et al., Biotechniques 13:790-799, 1992), но при этом имеющий вышеупомянутые изменения аминокислотного состава в вариабельных доменах, обладает гораздо более высокой константой аффинности по отношению к человеческому СЕА, чем уже известный scFv. Кроме того, по своей константе аффинности по отношению к человеческому СЕА ди-антитело превосходит моновалентные формы scFv. Два новых моновалентных и двухвалентных фрагмента scFv сохраняют свойства исходного Mab, такие как специфичность в отношении распознавания СЕА, идентификация опухолевых клеток и тканей, отсутствие перекрестной реактивности с NCA и способность к селективной аккумуляции в опухоли, которая продуцирует человеческий СЕА при ее трансплантации мышам, и при этом все указанные фрагменты обладают значительно более высокой эффективностью, чем уже известный scFv.
Указанные два новых моновалентных и двухвалентных фрагмента scFv имеют размер молекулы, по меньшей мере в 5 и 2,5 раз меньше, чем исходное Mab, соответственно, поэтому они лучше проникают в ткани и оказывают меньшее иммуногенное действие на организм человека, что делает их все более привлекательными и, предположительно, более эффективными, чем исходное Mab CB/ior-CEA.1, для нацеливания радиоизотопов, лекарственных средств, токсинов и других биологически активных элементов на опухоли, экспрессирующие человеческий СЕА.
В настоящем изобретении показан возможный способ ПЦР-амплификации доменов VH и VL Mab CB/ior-CEA.1 с использованием синтетических олигонуклеотидов, которые гибридизуются с нуклеотидными последовательностями, кодирующими сигнальные пептиды и константные домены СН1 и Ск. Были также продемонстрированы возможность сборки амплифицированных доменов VH и VL в указанном порядке с помощью ПЦР и получение различных форм фрагментов scFv с изменением размеров линкера, соединяющего эти домены. Ди-антитело типа scFv получали с использованием 14 аминокислот исходной моновалентной формы scFv, где это число аминокислот снижали до пяти.
В настоящем изобретении было продемонстрировано, что экспрессия моновалентных и двухвалентных фрагментов scFv может быть осуществлена в бактериях E.coli и в дрожжах Pichia pastoris и что эти фрагменты in vitro распознают человеческий СЕА, специфически связанный или не связанный с опухолевыми клетками. В настоящем изобретении было также продемонстрировано, что радиоактивно меченный моновалентный и двухвалентный scFv позволяет идентифицировать опухолевые клетки in vivo, которые экспрессируют человеческий СЕА и которые образуют опухоли у мышей; причем поведение указанных scFv в высокой степени аналогично поведению Mab CB/ior-CEA.1, а их свойства значительно превосходят свойства полученного ранее scFv. В настоящем изобретении также описаны способы очистки и свойства новых моновалентных и двухвалентных фрагментов scFv.
Фрагменты антител, описанные в настоящем изобретении, могут быть использованы для диагностики и лечения рака, при этом их преимущества заключаются в том, что они происходят от Mab с подтвержденной клинической эффективностью, имеют меньший размер и не содержат домена Fc, что способствует их лучшему проникновению в ткани, и благодаря своей низкой способности к индукции ответа с выработкой человеческих антител против мышиных иммуноглобулинов они могут быть использованы в повторных курсах лечения (HAMA; Schroff et al., Cancer Res. 45:879-885, 1985; DeJager et al. Proc. Am. Assoc. Cancer Res. 29:377, 1988). НАМА-ответы являются нежелательными для лечения из-за нейтрализации биологического эффекта вводимого антитела, что приводит к необходимости снижать дозу, а также из-за возможности продуцирования аллергических реакций, возникновения "сывороточной" болезни и поражения почек.
Терминология
Антитела и их специфические фрагменты
Эти термины описывают иммуноглобулин и его части, обладающие антигенной специфичностью и встречающиеся в природе или продуцируемые, полностью или частично, синтетическими способами. Эти термины также охватывают любой полипептид или белок, имеющий связывающий домен, который может представлять собой сайт связывания антитела или его гомолога. Эти полипептиды или белки могут быть продуцированы естественным образом, либо они могут быть частично или полностью синтезированы. Примерами антител являются иммуноглобулины различных классов и подклассов и их фрагменты, содержащие один или несколько антигенсвязывающих сайтов, такие как Fab, scFv, Fv и ди-антитела.
Антителами и фрагментами антител являются любые полипептиды, которые содержат связывающий домен иммуноглобулина и которые могут быть продуцированы естественным образом, либо они могут быть частично или полностью синтезированы; и химерные молекулы, которые содержат связывающий домен иммуноглобулина или его эквивалент, присоединенный к другому полипептиду.
Было показано, что фрагменты целого антитела могут выполнять функцию связывания с антигеном. Примерами таких связывающих фрагментов являются (i) Fab-фрагмент, который включает в себя домены VL, VH, CL и СН1 иммуноглобулина; (ii) Fd-фрагмент, состоящий из доменов VH и СН1; (iii) Fv-фрагмент, состоящий из доменов VL и VH данного антитела; (iv) scFv-фрагмент, где домены VH и VL указанного антитела соединены пептидным линкером, что позволяет этим двум доменам ассоциироваться друг с другом и образовывать антигенсвязывающий сайт (Bird et al., Science 242: 423-426, 1988; Huston et al., PNAS USA 85:5879-5883, 1988); (v) "ди-антитела", мультивалентные или мультиспецифические фрагменты, сконструированные так же, как и scFv, но лишь с тем отличием, что в указанных фрагментах небольшой размер линкера не позволяет доменам VH и VL одной и той же молекулы scFv ассоциироваться друг с другом, а антигенсвязывающие сайты образуются путем ассоциации двух или нескольких scFv (WO 94/13804; Holliger P. et al. PNAS USA 90, 6444-6448, 1993); (vi) другие фрагменты, такие как dAb (Ward S.E. et al., Nature 341:544-546, 1989), выделенные области CDR, F(ab')2-фрагменты и биспецифические димеры scFv (РСТ/US92/09965; Holliger P. Winter G. Current Opinion Biotechnol. 4:446-449, 1993; de Haard H. et al., Adv. Drug. Delivery Rev. 31:5-31, 1998).
Ди-антитела и scFv могут быть сконструированы без Fc-областей, с использованием лишь вариабельных доменов, что дает возможность минимизировать эффекты антиизотипических реакций при введении человеку. Они также являются особенно подходящими благодаря возможности их продуцирования в E.coli и в рекомбинантных дрожжах. Их размер меньше размера полного иммуноглобулина, а поэтому они обладают большей способностью проникать в ткани.
Антигенсвязывающий сайт
Этот термин означает часть антитела, содержащего область, которая специфически взаимодействует со всем антигеном или с его частью. Если такой антиген является крупным, то антитело может связываться только с конкретной частью этого антигена, называемой эпитопом. Антигенсвязывающий сайт может обеспечиваться одним или несколькими вариабельными доменами антитела. Предпочтительно, чтобы антигенсвязывающий сайт содержал вариабельную область (или домен) легкой цепи (VL) и вариабельную область (или домен) тяжелой цепи (VH) антитела.
Специфичность
Этот термин используется в случае, когда антитело или его фрагменты не обнаруживают заметного связывания с другими молекулами, отличающимися от их партнера связывания. Этот термин также применяется в случае, когда антигенсвязывающий сайт является специфическим по отношению к конкретному эпитопу, который присутствует в ряде родственных или неродственных антигенов, то есть в этом случае связывающий сайт должен обладать способностью связываться с определенным антигеном, несущим этот эпитоп.
Подробное описание изобретения
В соответствии с настоящим изобретением, были получены специфические полипептидные молекулы, образованные одним или несколькими антигенсвязывающими сайтами, происходящими от мышиного Mab, которое является специфическим по отношению к человеческому СЕА. Антигенсвязывающий сайт может быть собран в виде моновалентного, двухвалентного и других форм фрагментов антитела в зависимости от способа конструирования полипептидной молекулы.
Полипептидная молекула в форме моновалентного scFv-фрагмента, специфичного в отношении человеческого СЕА, имеет константу аффинности к этому антигену, составляющую (5,0 ± 0,4) х 109 л·моль-1, и содержит домены VH и VL, связанные в указанном порядке посредством 14-аминокислотного связующего сегмента (линкера), с аминокислотной последовательностью, представленной SEQ ID NO:16.
Полипептидная молекула в форме двухвалентного scFv-фрагмента (ди-антитела), специфичного в отношении человеческого СЕА, имеет константу аффинности к этому антигену, составляющую (2,8 ± 0,3) х 1010 л·моль-1, и содержит пару из двух идентичных молекул, каждая из которых образована доменами VH и VL, связанными в указанном порядке посредством 5-аминокислотного связующего сегмента (линкера), с аминокислотной последовательностью, представленной SEQ ID NO:17.
В другом аспекте настоящего изобретения моновалентные и двухвалентные фрагменты scFv не связываются или слабо связываются с нормальными тканями или клетками, происходящими от нормальных тканей печени, почек, легких, яичек, крови, селезенки и поджелудочной железы. В случае слизистой толстой кишки моновалентные и двухвалентные фрагменты scFv реагируют исключительно с продуктами люминальной секреции и в апикальных зонах или в некоторых железах. Отсутствие способности моновалентных и двухвалентных фрагментов scFv реагировать с нормальными лимфоцитами и нейтрофилами указывает на отсутствие какого-либо значительного уровня перекрестной реактивности с антигеном NCA (von Kleist S, Burtin P. Immunodiagnosis of Cancer. Marcel Dekker. 322-341, 1979; Buchegger F. et al. Int. J. Cancer 33, 643-649, 1984).
Моновалентные и двухвалентные фрагменты scFv могут связываться с растворимым СЕА, с СЕА, абсорбированным на твердых поверхностях, или с СЕА, ассоциированным с клетками, продуцирующими этот антиген, а также с опухолевыми тканями, которыми могут быть аденокарциномы толстой и прямой кишки, молочной железы, легких, поджелудочной железы и желудка человека. Моновалентные и двухвалентные фрагменты scFv и Mab CB/ior-CEA.1 связываются с растворимым СЕА и с СЕА, связанным с твердой поверхностью, в форме, которая зависит от сохранения характера гликозилирования человеческого СЕА, в результате чего можно предположить, что углеводы этого антигена играют определенную роль в таком распознавании.
Полипептидные молекулы, происходящие от моновалентных и двухвалентных фрагментов scFv, описанных в настоящем изобретении, которые сохраняют способность связывания с СЕА, свою аффинность, способность к специфическому распознаванию эпитопа и аналогичные и эквивалентные биологические и биохимические свойства этих фрагментов, описанных в настоящем изобретении, рассматриваются как эквивалентные вариантные формы и входят в объем настоящего изобретения. Эти полипептидные молекулы могут присутствовать в форме других рекомбинантных фрагментов антител, таких как scFv, где за доменом VL следует VH, либо в форме Fab, Fab', F(ab')2, Fabc, Facb, тримерные и тетрамерные scFv и т.п. (Winter G, Milstein C. Nature 349: 293-299, 1991; WO 94/13804; de Haard H. et al., Adv. Drug. Delivery Rev. 31:5-31, 1998), и других связующих сегментов (линкеров), известных специалистам. Они могут также присутствовать в форме биспецифических молекул антител, где одна часть такой молекулы сохраняет специфичность к СЕА, а другая часть имеет другую специфичность.
Настоящее изобретение в равной степени относится к вариантным формам моновалентных и двухвалентных фрагментов scFv, которые имеют свойства, описанные в предыдущих разделах, и которые должны быть получены в результате так называемой "гуманизации для снижения иммуногенности", где эпитопы В- и Т-клеток, присутствующие в вариабельных доменах, модифицируют так, чтобы способность к распознаванию антигена не изменялась, но чтобы при этом снижалась иммуногенность полученной молекулы при ее введении человеку, например, как описано у Carr F.J. et al., 2000, EP 983303A1 и Rodriguez Perez R. et al., US 5712120-A. В настоящем изобретении также рассматриваются вариантные формы, продуцируемые посредством так называемой "трансплантации CDR", где последовательности CDR первого антитела помещают внутри рамки считывания последовательностей, которые не происходят от данного антитела, например, как описано в ЕР-В-0239400, ЕР-А-184187, GB 2188638A или ЕР-А-239400, и сохраняют способность связываться в СЕА с аналогичной аффинностью, способность к конкурентному связыванию, способность к распознаванию конкретного эпитопа и биологические и биохимические свойства, аналогичные и эквивалентные свойствам моновалентных и двухвалентных фрагментов scFv, описанных в настоящем изобретении.
Помимо последовательностей антител, полипептидные молекулы, описанные в настоящем изобретении, могут содержать и другие аминокислоты, которые образуют пептид или полипептид или наделяют данную молекулу функциональными свойствами, не относящимися к связыванию с антигеном СЕА, например, добавляют метку для очистки или идентификации, фермент или его фрагмент, модификатор биологического ответа, токсин или лекарственное средство и т.п.
В соответствии с настоящим изобретением, моновалентные и двухвалентные фрагменты scFv могут быть введены в выделенной или очищенной форме.
Настоящее изобретение относится к использованию некоторых из вышеописанных полипептидных молекул в качестве диагностического реагента для выявления форм рака, при которых экспрессируется СЕА, например, аденокарциномы толстой кишки, легких, молочной железы или т.п.
СЕА-специфические полипептидные молекулы, описанные выше, могут быть радиоактивно меченными и могут быть использованы в качестве агентов для получения изображений в целях специфической идентификации присутствия и локализации опухолей, экспрессирующих СЕА у человека. Настоящее изобретение относится к способу определения присутствия клетки или опухоли, экспрессирующей СЕА, где указанный способ предусматривает контактирование указанных клеток с полипептидными молекулами, описанными выше, и определяет их связывание с клетками. Этот способ может быть осуществлен in vivo или в образце клеток, взятых из живого организма, in vitro или ex vivo.
Настоящее изобретение относится к способу связывания полипептидной молекулы, описанной выше, с человеческим СЕА. Такое связывание может происходить in vitro, ex vivo или in vivo. При связывании in vivo указанный способ может предусматривать введение полипептидной молекулы одному или нескольким млекопитающим. Как было экспериментально продемонстрировано в настоящем описании, моновалентные и двухвалентные фрагменты scFv согласно изобретению связываются с человеческим СЕА, экспрессируемым опухолевыми клетками трансфицированной мыши, которые в результате своего роста после их трансплантации мышам образуют опухоль, а следовательно, представляют собой подходящую экспериментальную модель для изучения, исследования и получения молекул, способных к специфическому связыванию, и изучения их свойств.
Реакционная способность антител на клеточных образцах может быть детектирована любым подходящим способом. Одним из таких способов может быть мечение отдельными репортерными молекулами. Репортерные молекулы могут генерировать сигналы, которые могут быть детектированы прямыми или непрямыми способами, а предпочтительно они могут быть измерены. Присоединение репортерных молекул может быть прямым или опосредованным, ковалентным или нековалентным. Связывание посредством пептидной связи может быть осуществлено путем рекомбинантной экспрессии гибридного гена, который кодирует антитело и связанную с ним репортерную молекулу. Способ определения связывания не играет решающей роли для осуществления настоящего изобретения, и каждым специалистом может быть выбрана адекватная модель по его желанию и в соответствии с имеющейся у него конкретной информацией.
В случае использования радионуклидов, таких как 125I, 111In или 99mTc, для мечения моновалентных и двухвалентных фрагментов scFv и их эквивалентных форм и в случае, если эти радионуклиды предпочтительно локализуются в опухолях, а не в нормальных тканях, присутствие радионуклидной метки в опухолевой ткани может быть детектировано и количественно оценено с использованием гамма-камеры. Качество полученного изображения прямо пропорционально коррелирует с отношением "радиосигнал : шум" (Goldenberg D.M. Int. J. of Biol. Markers 1992, 7, 183-188). В настоящем описании проиллюстрирован эксперимент с использованием 125I.
Настоящее изобретение также относится к элементам, в сочетании с которыми моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты, описанные выше, могут быть использованы в качестве терапевтического реагента, например, путем их объединения, конъюгирования или связывания с молекулами, обладающими терапевтической эффективностью, или путем их продуцирования в виде рекомбинантного гибридного белка. Моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты согласно изобретению могут быть использованы для нацеливания токсина, радиоактивной метки, Т- и NK-клеток или других молекул на опухоли, которые экспрессируют СЕА, либо они могут быть использованы для индуцирования ответа в данном организме в виде выработки антиидиотипических антител, которые могут обеспечивать желаемый терапевтический эффект. В соответствии с этим, в другом своем аспекте, настоящее изобретение относится к элементам, используемым в методах лечения, предусматривающих введение моновалентных и двухвалентных фрагментов scFv или их эквивалентных вариантов в качестве лекарственных средств или фармацевтических композиций.
В соответствии с настоящим изобретением, указанные композиции могут быть введены индивидуумам, предпочтительно в "терапевтически эффективном количестве", достаточном для ослабления у пациента по меньшей мере одного симптома. Конкретное количество вводимого лекарственного средства, частота и интервалы его введения зависят от природы и тяжести заболевания, подвергаемого лечению, и назначение конкретного курса лечения может быть осуществлено специалистами-медиками и лечащими врачами. Подходящие дозы антитела хорошо известны специалистам (Ledermann J.A. et al. Int. J. Cancer 47:659-664, 1991; Bagshawe K.D. et al. Antibody, Immunoconjugates and Radiopharmaceuticals 4:915-922, 1991).
Композиция может быть введена отдельно или в комбинации с другими терапевтическими средствами, либо одновременно, либо последовательно, в зависимости от заболевания, подвергаемого лечению.
Фармацевтические композиции согласно изобретению и их применение в соответствии с настоящим изобретением могут содержать, помимо активного ингредиента, наполнитель, буфер, стабилизатор или фармацевтически приемлемый носитель, или другие материалы, хорошо известные специалистам. Эти материалы не должны быть токсичными, не должны негативно влиять на эффективность активного ингредиента и их конкретная природа зависит от способа введения, которое может быть осуществлено перорально или путем инъекции, например, внутривенной.
Моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты согласно изобретению могут быть получены посредством экспрессии кодирующей нуклеиновой кислоты. Нуклеиновая кислота, которая кодирует любую из полипептидных молекул, описанных выше, является частью настоящего изобретения, также как и способ экспрессии такой нуклеиновой кислоты. В другом варианте осуществления изобретения указанная нуклеиновая кислота может кодировать аминокислотные последовательности, представленные в SEQ ID NO:16 и 17.
Для рекомбинантной экспрессии моновалентного и двухвалентного scFv и его эквивалентных вариантов могут быть выбраны или сконструированы подходящие векторы, содержащие адекватные регуляторные последовательности, включая промотор, терминатор, энхансер, последовательность полиаденилирования, маркерные гены и другие подходящие последовательности. Такими векторами могут быть плазмиды. Многие известные протоколы и методы модификации нуклеиновых кислот, например получение конструкций нуклеиновых кислот, полимеразная цепная реакция, мутагенез, секвенирование, введение ДНК в клетки, экспрессия генов, анализ белка и т.п., подробно описаны в нескольких руководствах, таких, например, как, Molecular Cloning: A Laboratory Manual: 2nd edition, Sambrook et al., Cold Spring Harbor Laboratory Press, 1989, или Short Protocols in Molecular Biology, Second edition, Ausubel et al., eds. John Wiley & Sons, 1992 или Erlich HA PCR Technology, Stockton Press, 1989. Соответствующая информация включена в настоящее описание посредством ссылки.
В другом своем аспекте настоящее изобретение относится к клетке-хозяину, содержащей чужеродную нуклеиновую кислоту, и к способам введения такой нуклеиновой кислоты в клетки-хозяева. Это введение может быть осуществлено любым способом, применяемым для этих целей. Для бактериальных и дрожжевых клеток таким способом может быть электропорация. Указанное введение может быть осуществлено путем стимуляции или создания условий для экспрессии нуклеиновой кислоты, например, путем культивирования клеток-хозяев в условиях, благоприятных для экспрессии гена. В одном из вариантов осуществления изобретения нуклеиновая кислота согласно изобретению интегрируется в геном клеток-хозяев.
После их продуцирования моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты могут быть использованы в любой из описанных здесь форм, таких как препарат, изготовленный на основе композиции, такой как фармацевтический или диагностический продукт, содержащийся в наборе реагентов, который, помимо специфически связывающегося агента, включает в себя один или несколько реагентов для определения уровня связывания указанного агента с клетками или с СЕА, не связанного с клетками, как обсуждалось выше.
Другие аспекты настоящего изобретения и способы их осуществления очевидны каждому специалисту. Для лучшего понимания настоящего изобретения ниже приводятся примеры, которые не должны рассматриваться как ограничение его притязаний и объема. В настоящем описании приводятся ссылки на описанный ниже графический материал.
Краткое описание графического материала
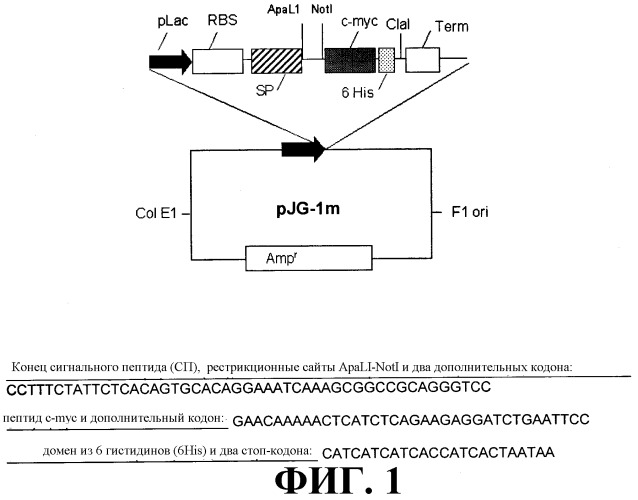
На фиг. 1 схематически представлен вектор pJG-1m, используемый для экспрессии моновалентного scFv и ди-антитела в E.coli. В соответствии с векторной областью, обозначенной жирной горизонтальной линией, показаны нуклеотидные последовательности сайта клонирующего фрагмента, пептида с-myc, домена из 6 гистидиновых остатков и некоторых областей, расположенных внутри и вне доменов (SEQ ID NO:13).
На фиг. 2 проиллюстрировано выравнивание аминокислотных последовательностей (представленных однобуквенным кодом), выведенных из нуклеотидных последовательностей для (1) моновалентного фрагмента scFv (SEQ ID NO:16) и (2) двухвалентного фрагмента (ди-антитела)(SEQ ID NO:17). Домены обеих конструкций расположены в указанном порядке: VH - линкерный сегмент - VL. Аминокислоты линкерных сегментов, используемые в каждой из двух молекул, отмечены жирным шрифтом.
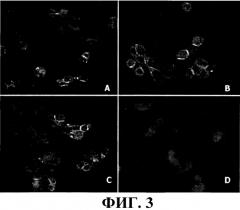
На фиг. 3 проиллюстрировано распознавание СЕА, экспрессируемого в культуре опухолевых клеток AsPC-1 (АТСС CRL-1682), (А) антителом Mab CB/ior-CEA.1, (В) моновалентным scFv и (С) ди-антителом в непрямом иммунофлуоресцентном анализе. В А, В и С видна характерная флуоресценция мембраны, а рядом - цитоплазмы. Увеличение - 200х.
На фиг. 4 показан хроматографический профиль протеолитического гидролиза ди-антитела и положения, присвоенные триптическим пептидам и полученные с помощью масс-спектрометрии. Вверху: Хроматографический профиль триптического гидролиза ди-антитела. Внизу: Систематизированная таблица положений, присвоенных триптическим пептидам. М/z ехр: экспериментальная масса; теоретическое m/z: теоретическая масса; Z: заряд. В полученных спектрах сигналы, соответствующие "неправильно" присоединенным линкерным цистеинам, не детектировались.
На фиг. 5 в упрощенном виде показано подтверждение аминокислотной последовательности ди-антитела (SEQ ID NO:21). Области последовательности белка, которые были подтверждены с помощью масс-спектрометрии, показаны жирным шрифтом, а области последовательности, которые не были выявлены после гидролиза трипсином, показаны курсивом. Области, показанные жирным шрифтом, полностью совпадают с аминокислотной последовательностью, выведенной из нуклеотидной последовательности ди-антитела. Последовательность пептида с-myc и конечных 6 гистидинов в векторе pJG-1m (фиг. 1) также видна в С-концевой части.
На фиг. 6 приводится процент инъецированной дозы на грамм ткани через 24 часа (незаштрихованные столбцы) и 48 часов (заштрихованные столбцы) после инокуляции мышей, несущих опухоли, экспрессирующие человеческий СЕА со следующими молекулами, радиоактивно меченными 125I: слева направо, и в группах из четырех двойных полос: (а) ди-антитело, (b) scFv, (с) F3 и (d) Mab CB/ior-CEA.1. Каждый столбец представляет собой среднее значение из величин, полученных для органов, взятых у 12 мышей. За период времени от 24 до 48 часов после инъекции результаты показали следующий уровень радиоактивности в опухоли: радиоактивность в крови сохранялась на высоком уровне для ди-антитела, scFv и Mab, где последнее имело наиболее высокие значения, а за ним следовали значения для димерной молекулы. F3 обнаруживало очень низкие значения, при этом его поведение in vivo было неадекватным, что может быть обусловлено снижением аффинности к СЕА.
Все упомянутые здесь документы вводятся в настоящее описание посредством ссылки.
Примеры
1. ПЦР-амплификация, клонирование и секвенирование вариабельных доменов Mab CB/ior-CEA.1.
2. Сборка scFv и ди-антитела, экспрессия в E.coli и демонстрация распознавания ими человеческого СЕА.
3. Экспрессия scFv и ди-антитела в Pichia pastoris и демонстрация распознавания ими человеческого СЕА.
4. Очистка scFv и ди-антитела, продуцированных в бактериях.
5. Характеризация указанного ди-антитела с помощью протеолитического расщепления и масс-спектрометрии.
6. Исследование распознавания дегликозилированного СЕА.
7. Иммуноцитологическое и гистохимическое исследование нормальных и опухолевых тканей.
8. Определение константы аффинности.
9. Определени