Композиция с замедленным высвобождением для перорального введения лекарственных средств
Иллюстрации
Показать всеКомпозиция с замедленным высвобождением для перорального введения лекарственного средства содержит лекарственное вещество, носитель для замедленного высвобождения лекарственного вещества и ускоритель гидратации геля. Носитель является смесью альгината натрия и ксантановой камеди при весовом соотношении указанных компонентов 1:0,1˜10. Ускоритель гидратации геля является смесью гидроксипропилметилцеллюлозы и альгината пропиленгликоля при весовом соотношении указанных компонентов 1:0,05˜20. Весовое соотношение лекарственного вещества, указанного носителя и указанного ускорителя гидратации геля находится в интервале 1:3˜45:0,1˜15. Скорость высвобождения лекарственного вещества следует кинетике нулевого порядка и не изменяется значительно соответственно моторике желудочно-кишечного тракта. Композиция способна поддерживать постоянный уровень лекарственного вещества в крови в течение 24 часов и более. 4 з.п. ф-лы, 8 ил., 3 табл.
Реферат
Данное изобретение относится к композиции с замедленным высвобождением для перорального введения лекарственного средства, содержащей лекарственное средство, носитель для замедленного высвобождения лекарственного вещества и ускоритель гидратации геля, которая способна поддерживать постоянный уровень лекарственного вещества в крови в течение 24 часов или более.
После инъекции действие лекарственного вещества in vivo продолжается в течение непродолжительного периода времени и по этой причине необходимо повторное введение лекарственного средства для долговременного лечения. Например, для лечения гипертензии, такие лекарственные средства, как нифедипин, необходимо вводить более 3 раз в день.
Соответственно предпринимались многочисленные попытки по разработке лекарственной формы с замедленным высвобождением, которая может поддерживать эффективный уровень лекарственного вещества in vivo в течение более 24 часов. Например, в японской патентной публикации №6001716 А (1994.1.11) описана твердая дисперсионная лекарственная форма на основе гидроксипропилцеллюлозной матрицы, а в европейской патентной публикации №521310 А (1993.1.7) лекарственная форма на основе смеси гидроксипропилцеллюлозы и гидроксипропилметилцеллюлозы, вторая является водорастворимым полимерным гелеобразующим средством. Кроме того, в японской патентной публикации №62077335 А (1987.4.9) описана гелеобразная лекарственная форма на основе карбоксивинилового полимера; в японской патентной публикации №03169814 А (1991.7.23) лекарственная форма имеет в основе смеси водорастворимого полимера, такого как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон и метилцеллюлоза, и нерастворимый в воде полимер, такой как микрокристаллическая целлюлоза; и в европейском патенте №274176 В (1992.5.27) лекарственная форма с замедленным высвобождением имеет в основе поливинилпирролидон. Однако недостаток этих лекарственных форм проявляется в том, что постоянная скорость высвобождения лекарственного вещества не может сохраняться в течение более 24 часов из-за образования гелевой пленки на наружной стороне оболочки лекарственной формы, оставляя ядро нежелированным.
Кроме того, в патентах США №№4765989 А, 5208037 А и 5019397 А сообщается об осмотических лекарственных формах с регулируемым высвобождением, у которых проявляется постоянная скорость высвобождения лекарственного вещества, следуя кинетике нулевого порядка. Однако способ производства таких лекарственных форм является очень сложным и дорогим, кроме того, лекарственное вещество, содержащееся в нем, не полностью биодоступно (John S. Grundy and Robert T. Foster, Clin. Pharmacokinet., 30(1):28-51(1996).
Ранее сообщалось, что препарат лекарственного вещества, изготовленный с использованием носителя из моноглицеридного геля, высвобождает лекарственное вещество с постоянной скоростью, которая следует кинетике нулевого порядка в течение 24 часов, когда приводится в контакт с гидрофильной матрицей или водорастворимой матрицей (корейский патент №10-0216624 (1999.5.31)). Однако этот препарат относится к препаратам, вызывающим эрозию и легкую деградацию сократительных движений в органах желудочно-кишечного тракта.
Соответственно объектом данного изобретения является предоставление композиции с замедленным высвобождением для перорального введения лекарственного средства, которая при введении in vivo способна к высвобождению лекарственного вещества с постоянной скоростью по кинетике нулевого порядка в течение 24 часов и более, причем на эту скорость мало влияет степень моторики желудочно-кишечного тракта.
В соответствии с одним из аспектов данного изобретения представлена композиция с замедленным высвобождением для перорального введения лекарственного вещества, содержащая лекарственное вещество, носитель с замедленным высвобождением лекарственного вещества и ускоритель гидратации геля.
Представленные выше и другие объекты и признаки данного изобретения станут очевидными из следующего описания изобретения в сочетании со следующими сопровождающими рисунками, которые соответственно представляют:
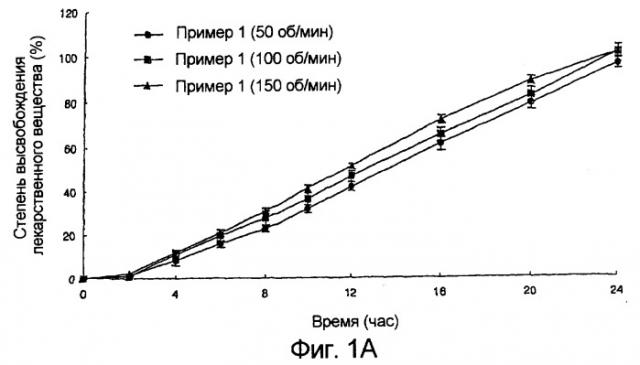
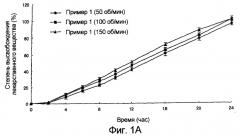
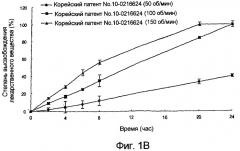
фиг.1А и 1В: зависящие от времени изменения количества лекарственного вещества, освобожденного in vitro (А: препарат данного изобретения; и В: препарат корейского патента №10-0216624);
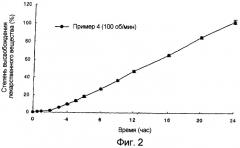
фиг.2: зависящие от времени изменения количества лекарственного вещества, освобожденного in vitro препаратом данного изобретения;
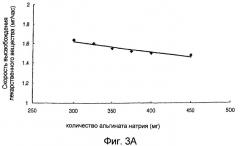
фиг.3А и 3В: зависимость скорости высвобождения лекарственного вещества и времени задержки высвобождения лекарственного вещества от количества альгината натрия;
фиг.4А и 4В: зависимость скорости высвобождения лекарственного вещества и времени задержки высвобождения лекарственного вещества от количества ксантановой камеди;
фиг.5А и 5В: зависимость скорости высвобождения лекарственного вещества и времени задержки высвобождения лекарственного вещества от количества сложного эфира пропиленгликоля;
фиг.6А и 6В: изменения скорости высвобождения лекарственного вещества с помощью определенного количества носителя для длительного высвобождения (А: препарат, изготовленный в примере 18; и В: препарат, изготовленный в примере 19);
фиг.7А и 7В: изменения скорости высвобождения лекарственного вещества, наблюдаемые, когда к носителю добавляют камедь рожкового дерева (А: препарат, изготовленный в примере 20; и В: препарат, изготовленный в примере 21); и
фиг.8А по 8D: зависящие от времени изменения количества лекарственного вещества, освобожденного in vitro препаратом с длительным высвобождением данного изобретения в сравнении с показателями для сопоставляемых препаратов (А: Сравнительный пример 1; B: Сравнительный пример 2; С: Сравнительный пример 3 и D: Сравнительный пример 4).
Композиция с замедленным высвобождением для перорального введения лекарственного средства содержит лекарственное средство, носитель для замедленного высвобождения лекарственного вещества и ускоритель гидратации геля.
Носитель предпочтительно представляет собой смесь альгината натрия и ксантановой камеди, а ускоритель гидратации геля является смесью гидроксипропилметилцеллюлозы и альгината пропиленгликоля.
Композиция с длительным высвобождением данного изобретения может поддерживать постоянный уровень лекарственного вещества в крови в течение 24 часов или более, благодаря тому факту, что скорость высвобождения лекарственного вещества следует кинетике нулевого порядка и не изменяется в значительной степени от степени моторики желудочно-кишечного тракта благодаря быстрой гидратации геля без образования нежелированного ядра.
Компоненты композиции данного изобретения подробно описаны ниже.
(1) Фармакологически активный ингредиент (лекарственное вещество)
Фармакологически активный ингредиент композиции данного изобретения является любым одним из тех лекарственных веществ, которые пригодны для использования в препаратах с замедленным высвобождением лекарственного вещества. Примеры лекарственных веществ включают антигипертензивные средства, такие как нифедипин, доксазоцин, амосулралол, фелодипин, лекранидипин, лацидипин, никардипин, фосиноприл, имидаприл, клизаприл, периндоприл, лизиноприл, лозартан, ирвесартан и кандесартан; лекарственные средства для лечения сердечно-сосудистых заболеваний, такие как исрадипин; лекарственные средства для лечения гиперлипемии, такие как ловастатин и симвастатин; нестероидные противоспалительные средства; средства для лечения астмы; противодиабетические средства, такие как гликлазид, глимепирид и глипизид; успокоительные; антибиотики; противосудорожные и стероиды, предпочтительно нифедипин.
(2) Носитель для длительного высвобождения
Носитель для длительного высвобождения в композиции данного изобретения предпочтительно является смесью альгината натрия и ксантановой камеди с отношением в смеси (весовым) в интервале 1:0,1˜10, предпочтительно 1:0,2˜0,6, чтобы снизить первоначальное залповое высвобождение и изменение в высвобождаемом количестве лекарственного вещества.
Кроме того, чтобы повысить структурную целостность данной лекарственной формы, носитель данного изобретения дополнительно может содержать камедь рожкового дерева, причем весовое отношение альгината натрия: ксантановой камеди: камеди рожкового дерева находится в интервале 1:0,2˜10:0,1-5, предпочтительно 1:1-5:0,5-3.
(3) Ускоритель гидратации геля
Ускоритель гидратации геля, используемый в данном изобретении, играет решающую роль в формировании гомогенного желированного ядра, не оставляя нежелированной части, когда лекарственная форма приводится в контакт с водной средой. Ускоритель гидратации геля в композиции данного изобретения предпочтительно представляет собой смесь гидроксипропилметилцеллюлозы и альгината пропиленгликоля с соотношением в смеси (весовым) в интервале 1:0,05˜20, предпочтительно 1:0,1˜10. Гидроксипропилметилцеллюлоза, используемая здесь, предпочтительно имеет вязкость, находящуюся в интервале от 4000 до 100000 сП.
В соответствии с композицией данного изобретения, весовое отношение лекарственного вещества, носителя для длительного высвобождения и ускорителя гидратации геля находится в интервале 1:3˜30:0,1˜15, предпочтительно 1:5˜25:0,5˜10.
Фармацевтическая композиция данного изобретения может быть изготовлена для перорального введения. Композиции для перорального введения придают разные формы, такие как таблетки, пилюли, порошок, саше, эликсир, суспензия, эмульсия, раствор, сироп, гранулы, мягкие и твердые желатиновые капсулы и тому подобное, которые могут содержать обычные добавки, такие как разбавитель (например, лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза и/или глицин), улучшающее скольжение вещество (например, двуокись кремния, тальк, стеариновая кислота или ее цинковая, магниевая и кальциевая соли и/или полиэтиленгликоль). В таблеточной форме композиция, кроме того, может содержать связывающее вещество (например, алюмосиликат магния, крахмальную пасту, желатин, трагакант, метилцеллюлозу, натрийкарбоксиметилцеллюлозу и/или поливинилпирролидин, гидроксипропилцеллюлозу и/или кофобидон (коллидон VA64®, BASF, германия) и необязательно дезинтегрант (например, крахмал, агар и альгиновую кислоту или ее натриевую соль), газированную воду и/или абсорбент, краситель, улучшающее вкус и запах средство и подсластитель.
Композиции могут дополнительно включать наполнители, консерванты, антиоксиданты, стабилизаторы, пигменты, противоагглютинирующие вещества, улучшающие скольжение вещества, улучшающие смачивание вещества, улучшающие вкус и запах вещества, эмульгаторы и тому подобное.
Фармацевтическую композицию данного изобретения можно вводить ежедневно. Обычная суточная доза активного ингредиента находится в интервале от примерно 0,15 до 2 мг/кг, предпочтительно от 0,5 до 1,5 мг/кг, и ее можно вводить в виде единственной дозы или в виде дробных доз. Однако должно быть понятно, что количество действительно вводимого активного ингредиента должно быть определено в свете разных значимых факторов, включая патологическое состояние, которое нужно лечить, выбранный путь введения, возраст и вес конкретного пациента и тяжесть симптоматики у пациента; и поэтому дозировка, предложенная выше, не должна истолковываться как ограничивающая объем данного изобретения каким-либо образом.
Следующие примеры и примеры испытания предназначены для дополнительной иллюстрации данного изобретения без ограничения его объема.
Кроме того, проценты, представляемые ниже, для смеси твердых веществ, жидкости в жидкости, твердого вещества в жидкости представлены в весовом, объемном и весообъемном выражении соответственно, если особо не указано иначе.
Примеры 1-21: Изготовление таблеток
Нифедипин (Unique Chemicals, Индия), исрадипин (Sun Pharm., Индия), ловастатин (CKD Pharm., Корея), глипизид (Sun Pharm., Индия), альгинат натрия (Keltone® HVCR, Keltoen® LVF, Kelcosol®, Kelset, ISP США), ксантановую камедь (Keltrol® F, Kelco, США), камедь рожкового дерева (Cesagum® LN1, LR200, Cesalpinia, Италия), альгинат пропиленгликоля (Kelcoloid HVF, LVF, ISP, США), гидроксипропилметилцеллюлозу (Meltose 90SH, 4000SR, 100000SR, Shin-Etsu, Япония) и коповидон (Kollidon VA64, BASF, Германия) смешивали, как показано в таблице 1, в течение 30 минут, туда же добавляли стеарат магния и светлую безводную кремниевую кислоту (порошок более тонкий, чем меш 30) и смешивали в течение 5 минут. Затем полученную смесь таблетировали с использованием обычного пресса в соответствии с методом изготовления таблеток для получения таблеточного препарата.
| Таблица 1 | |||||||||||
| Лекарственное в-во | Альгинат натрия | Ксантановая камедь | Камедь рожкового дерева | Альгинат пропиленгликоля | Гидроксипропилметилцеллюлоза | Коповидон | Светлая безводная кремниевая кислота | Стеарат магния | |||
| Вид | К-во | Вязкость (сП) | К-во | ||||||||
| 1 | Нифедипин | 33 | 500 | 125 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 2 | Нифедипин | 33 | 400 | 100 | - | 20 | 4000 | 40 | 10 | 7 | 2 |
| 3 | Исрадипин | 10 | 300 | 100 | - | 5 | 100000 | 30 | 20 | 5 | 2 |
| 4 | Ловастатин | 60 | 550 | 140 | - | 5 | 100000 | 40 | 30 | 7 | 2 |
| 5 | Глипизид | 10 | 400 | 50 | - | 5 | 100000 | 40 | 25 | 7 | 2 |
| 6 | Нифедипин | 33 | 300 | 50 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 7 | Нифедипин | 33 | 325 | 50 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 8 | Нифедипин | 33 | 350 | 50 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 9 | Нифедипин | 33 | 375 | 50 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 10 | Нифедипин | 33 | 400 | 50 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 11 | Нифедипин | 33 | 450 | 50 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 12 | Нифедипин | 33 | 350 | 100 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 13 | Нифедипин | 33 | 350 | 125 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 14 | Нифедипин | 33 | 350 | 200 | - | 10 | 100000 | 45 | 25 | 7 | 2 |
| 15 | Нифедипин | 33 | 375 | 75 | - | 25 | 100000 | 45 | 25 | 7 | 2 |
| 16 | Нифедипин | 33 | 375 | 50 | - | 50 | 100000 | 45 | 25 | 7 | 2 |
| 17 | Нифедипин | 33 | 375 | 75 | - | 75 | 100000 | 45 | 25 | 7 | 2 |
| 18 | Нифедипин | 33 | 455,2 | 113,8 | - | 9,1 | 100000 | 41 | 22,8 | 6,4 | 1,8 |
| 19 | Нифедипин | 33 | 420,2 | 105 | - | 8,4 | 100000 | 37,8 | 21 | 5,9 | 1,7 |
| 20 | Нифедипин | 33 | 60 | 180 | 60 | 125 | 100000 | 25 | 25 | 10 | 2 |
| 21 | Нифедипин | 33 | 60 | 180 | 60 | 140,0 | 100000 | 25 | 25 | 10 | 2 |
Сравнительные примеры с 1 по 4: Изготовление таблеток
Сравниваемые таблетки изготавливали способом согласно примеру 1, за исключением того, что использовали ингредиенты, перечисленные в таблице 2.
| Таблица 2 | |||||||||||
| Лекарственное в-во | Альгинат натрия | Ксантановая камедь | Камедь рожкового дерева | Альгинат пропиленгликоля | Гидроксипропилметилцеллюлоза | Коповидон | Светлая безводная кремниевая кислота | Стеарат магния | |||
| Вид | К-во | Вязкость (сП) | К-во | ||||||||
| 1 | Нифедипин | 33 | 60 | 180 | 60 | - | 100000 | - | 25 | 10 | 2 |
| 2 | Нифедипин | 10 | 10 | 200 | 90 | 100 | 100000 | 100 | 25 | 10 | 2 |
| 3 | Исрадипин | 33 | 30 | 450 | - | 125 | 100000 | 25 | 25 | 10 | 2 |
| 4 | Ловастатин | 33 | 60 | 180 | 60 | 150 | 100000 | 5 | 25 | 10 | 2 |
Пример испытания 1: Испытание на высвобождение in vitro
Таблетку, изготовленную в примере 1 и препарат, описанный в корейском патенте №10-0216624, подвергали испытанию на высвобождение in vitro в соответствии с методом высвобождения in vitro, описанном в Фармакопее Кореи (метод с лопастной мешалкой). Количество высвобожденного нифедипина из каждой из таблеток во время испытания по высвобождению in vitro, проводимого при следующих условиях, определяли количественно жидкостной хроматографией. Чтобы избежать разрушения лекарственного вещества, представленные выше испытания производили при длинных длинах волн (λ>420 нм).
- система для испытания на высвобождение: Erweka DT 80
- раствор для высвобождения: первое испытание на высвобождение с использованием 500 мл искусственного желудочного сока (рН 1,2) в течение 2 часов и второе испытание на высвобождение с использованием 400 мл 0,235 М NaHPO4, содержащий 2,25% лаурилсульфата натрия (ЛСН) в течение 22 часов (весь раствор для высвобождения: рН 6,8, 1% ЛСН)
- температура раствора для высвобождения: 37±0,5°С
- скорость перемешивания: 50, 100 и 150 об/мин
- колонка: μ-Bondapak C18® (Waters)
- подвижная фаза: ацетонитрил:вода (55:45 об/об)
- скорость потока: 1,2 мл/мин
- детектор: ультрафиолетовый спектрофотометр (350 нм)
- объем инжекции: 20 мкл
- подсчет высвобожденного количества: совокупное высвобожденное количество
Зависящие от времени изменения количества высвобожденного нифедипина показаны на фиг.1 (А: препарат данного изобретения и В: препарат корейского патента №10-0216624). Как показано на фиг.1, зависящие от времени изменения картины высвобождения in vitro из препарата данного изобретения отличаются от картины для препарата из корейского патента №10-0216624, проявляя характер устойчивого высвобождения, которое не изменяется значительно с изменением степени моторики желудочно-кишечного тракта.
Пример испытания 2: Испытание на высвобождение in vitro
Испытание на высвобождение in vitro проводили, используя препарат, изготовленный в примере 1 в соответствии с методом из примера испытания 1. Результат на фиг.2 показывает, что препарат ловастатина высвобождает лекарственное вещество с постоянной скоростью высвобождения, следуя кинетике нулевого порядка в течение 24 часов.
Пример испытания 3: Испытание на высвобождение in vitro
Чтобы оценить, зависит ли скорость высвобождения лекарственного вещества от количества альгината натрия в носителе, проводили испытание на высвобождение in vitro, используя препараты, изготовленные в примерах с 6 по 11 в соответствии со способом из примера испытания 1. Результат на фиг.3 (А: скорость высвобождения лекарственного вещества и В: время задержки высвобождения лекарственного вещества) показывает, что скорость высвобождения лекарственного вещества становится пропорционально медленнее, а время задержки высвобождения длительнее с данным количеством альгината натрия.
Пример испытания 4: Испытание на высвобождение in vitro Также, чтобы оценить, зависит ли скорость высвобождения лекарственного вещества от количества ксантановой камеди в носителе, проводили испытание на высвобождение in vitro, используя препараты, изготовленные в примерах с 12 по 14 в соответствии со способом из примера испытания 1. Результат на фиг.4 (А: скорость высвобождения лекарственного вещества и В: время задержки высвобождения лекарственного вещества) показывает, что скорость высвобождения лекарственного вещества становится пропорционально медленнее, а время задержки высвобождения длительнее с данным количеством ксантановой камеди.
Пример испытания 5: Испытание на высвобождение in vitro
Чтобы оценить, зависит ли скорость высвобождения лекарственного вещества от количества альгината пропиленгликоля, ускорителя гидратации геля, проводили испытание на высвобождение in vitro, используя препараты, изготовленные в примерах с 15 по 17 в соответствии со способом из примера испытания 1. Результат на фиг.5 (А: скорость высвобождения лекарственного вещества и В: время задержки высвобождения лекарственного вещества) показывает, что скорость высвобождения лекарственного вещества становится пропорционально выше, а время задержки высвобождения короче с данным количеством альгината пропиленгликоля.
Пример испытания 6: Испытание на высвобождение in vitro
Чтобы оценить, зависит ли скорость высвобождения лекарственного вещества от количества носителя, проводили испытание на высвобождение in vitro, используя препараты, изготовленные в примерах с 18 по 19 в соответствии со способом из примера испытания 1. Результат на фиг.6А и 6В (А: препарат из примера 18 и В: препарат из примера 19) показывает, что скорость высвобождения лекарственного вещества следует кинетике нулевого порядка, которая не зависит от количества носителя. То есть препараты высвобождают лекарственное вещество более или менее с постоянной скоростью, когда отношение соединений носителя в смеси остается неизменным.
Пример испытания 7: Испытание на высвобождение in vitro
Чтобы оценить, изменяется ли скорость высвобождения лекарственного вещества, когда к носителю добавляют камедь рожкового дерева, проводили испытание на высвобождение in vitro, используя препараты, изготовленные в примерах с 20 по 21 в соответствии со способом из примера испытания 1. Результат на фиг.7А и 7В (А: препарат из примера 20 и В: препарат из примера 21) показывает, что препарат с использованием смеси альгината натрия, ксантановой камеди и камеди рожкового дерева в качестве носителя дает превосходное длительное высвобождение.
Пример испытания 8: Испытание на высвобождение in vitro и количественное определение скорости образования нежелированного ядра и желированного ядра
Чтобы сравнить скорость высвобождения препаратами данного изобретения и другими препаратами, проводили испытание на высвобождение in vitro, используя препараты, изготовленные в примере 20 и сравнительных примерах с 1 по 4, в соответствии с методом испытания из примера 1. Результаты на фиг. с 8А по 8D (А: сравнительный пример 1; В: сравнительный пример 2; С: сравнительный пример 3 и D: сравнительный пример 4) показывают, что зависимые от времени изменения в картине высвобождения in vitro из препаратов, изготовленных в сравнительных примерах с 1 по 4, отличаются от картины высвобождения из препарата данного изобретения. То есть сравнительные препараты не проявляли кинетики нулевого порядка.
Кроме того, на 4 день испытания исследовали сечения таблеток, чтобы определить величину желированного ядра и нежелированного ядра в соответствии с методом К.N.Park et al. (Controlled Drug Delivery, 18-23 (2000)). Результаты показаны в таблице 3.
| Таблица 3 | |||
| Нежелированное ядро | Желированное ядро | Желированное ядро/нежелированное ядро | |
| Пример 20 | 0,09±0,04 см | 0,73±0,03 см | 8,11±0,45 |
| Сравнительный пример 1 | 0,39±0,03 см | 0,36±0,04 см | 0,92±0,13 |
| Сравнительный пример 2 | 0,30±0,03 см | 0,54±0,02 см | 1,85±0,14 |
| Сравнительный пример 3 | 0,32±0,02 см | 0,46±0,03 см | 1,44±0,05 |
| Сравнительный пример 4 | 0,20±0,01 см | 0,54±0,03 см | 2,72±0,14 |
Как показано в таблице 3, степень желирования ядра намного более интенсивна для препарата данного изобретения, чем у препаратов, изготовленных в сравнительных примерах с 1 по 4.
Хотя данное изобретение было описано относительно представленных выше конкретных воплощений, нужно осознать, что могут быть произведены различные модификации и изменения и они также попадают в объем данного изобретения, который определен формулой изобретения, которая следует далее.
1. Композиция с замедленным высвобождением для перорального введения лекарственного средства, содержащая лекарственное вещество, носитель для замедленного высвобождения лекарственного вещества и ускоритель гидратации геля, в которой весовое отношение лекарственного вещества, носителя замедленного высвобождения лекарственного вещества и ускорителя гидратации геля находится в интервале 1:3˜45:0,1˜15, носитель является смесью альгината натрия и ксантановой камеди, имеющей весовое отношение 1:0,1˜10, и ускоритель гидратации геля является смесью гидроксипропилметилцеллюлозы и альгината пропиленгликоля, имеющей весовое отношение 1:0,05˜20.
2. Композиция по п.1, в которой носитель дополнительно содержит камедь рожкового дерева в качестве основы (носителя) для замедленного высвобождения лекарственного вещества.
3. Композиция по п.2, в которой весовое отношение альгината натрия, ксантановой камеди и камеди рожкового дерева находится в интервале 1:0,2˜10:0,1˜5.
4. Композиция по п.1, в которой лекарственное вещество выбрано из группы, состоящей из антигипертензивного средства, лекарственных средств для лечения сердечно-сосудистых заболеваний, лекарственных средств для лечения гиперлипидемии, нестероидных противовоспалительных лекарственных средств, лекарственных средств для лечения астмы, противодиабетических лекарственных средств, успокоительного средства, антибиотика, противосудорожного средства, стероидов и их смеси.
5. Композиция по п.1, в которой лекарственное средство выбрано из группы, состоящей из нифедипина, исрадипина, ловастатина и глипизида.