Производные бензотиазола в качестве лигандов рецептора аденозина и лекарственное средство
Иллюстрации
Показать всеИзобретение относится к производным бензотиазола общей формулы (I) и их фармацевтически приемлемым кислотно-аддитивным солям в качестве лигандов рецептора аденозина и к лекарственному средству на их основе. Соединения могут найти применение для лечения и профилактики заболеваний, опосредованных рецепторами аденозина А2A и A1, например болезни Альцгеймера, некоторых депрессивных состояний, токсикомании, болезни Паркинсона. В общей формуле (I)
R означает фенил, пиридин-2-ил, -С(O)-O-(низш.)алкил, -С(O)-(низш.)алкил, -С(O)-морфолинил, -C(O)-NR'2, -(CH2)n-NR'2 или -(СН2)n-O-(низш.)алкил, а R' означает водород или (низш.)алкил. 2 н. и 13 з.п. ф-лы.
Реферат
Настоящее изобретение относится к соединениям общей формулы
где
R означает фенил, пиридин-2-ил, -С(O)-O-(низш.)алкил, -С(O)-(низш.)алкил, -С(O)-морфолинил, -C(O)-NR'2, -(CH2)n-NR'2 или -(СН2)n-O-(низш.)алкил, а R' означает водород или (низш.)алкил,
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Неожиданно было установлено, что соединения общей формулы I являются лигандами рецептора аденозина. Более подробно соединения по настоящему изобретению обладают высоким сродством к рецептору A2А и высокой селективностью к рецепторам A1 и A3 и, кроме того, эти соединения хорошо растворимы в воде.
Аденозин модулирует широкий спектр физиологических функций благодаря взаимодействию с поверхностными рецепторами специфических клеток. Возможность использования рецепторов аденозина в качестве мишеней лекарственных средств впервые была описана в 1982 г. В структурном и метаболическом отношении аденозин близок биоактивным нуклеотидам: аденозинтрифосфату (АТФ), аденозиндифосфату (АДФ), аденозинмонофосфату (АМФ) и циклическому аденозинмонофосфату (цАМФ), биохимическому метилирующему агенту S-аденозил-L-метионину (S-AM), а в структурном отношении близок коферментам НАД, ФАД и коферменту А, а также РНК. Аденозин и указанные родственные соединения выполняют важные функции в регуляции многих аспектов клеточного метаболизма и в модуляции различных типов активности ЦНС.
Рецепторы аденозина подразделяются на рецепторы A1, A2А, А2B и A3, принадлежащие к семейству рецепторов, сопряженных с G-белками. Активация рецепторов аденозина инициирует механизм передачи сигнала. Эти механизмы зависят от G-белка, ассоциированного с рецептором. Каждый из подвидов аденозиновых рецепторов, как правило, характеризуется аденилатциклазной эффекторной системой, использующей в качестве вторичного мессенджера цАМФ. Рецепторы A1 и A3, сопряженные с Gi-белками, ингибируют аденилатциклазу, что приводит к снижению внутриклеточного уровня цАМФ, в то время как рецепторы A2А и А2B сопряжены с Gs-белками и активируют аденилатциклазу, что приводит к повышению внутриклеточного уровня цАМФ. Установлено, что система рецептора A1 включает активацию фосфолипазы С и модуляцию ионных калиевых и кальциевых каналов. Подвид рецептора A3, кроме связывания с аденилатциклазой, стимулирует также фосфолипазу С и таким образом активирует ионные кальциевые каналы.
В настоящее время клонирован рецептор A1 (326-328 аминокислотных остатков) многих видов (псовых, человека, крысы, собаки, цыпленка, крупного рогатого скота, морских свинок), причем 90-95% аминокислотной последовательности оказались идентичными у многих видов млекопитающих. Кроме того, клонирован рецептор A2А (409-412 аминокислотных остатков) псовых, крысы, человека, морских свинок и мыши. Клонирован также рецептор А2B (332 аминокислотных остатка) человека и мыши, причем рецептор А2B человека на 45% гомологичен рецепторам A1 и A2А человека. Клонирован также рецептор А3 (317-320 аминокислотных остатков) человека, крысы, собаки, кролика и овцы.
Предполагается, что подвиды рецептора A1 и A2А играют комплементарные роли в регуляции аденозином процесса выработки энергии. Аденозин, который является продуктом метаболической трансформации АТФ, диффундирует из клетки и действует на местном уровне, активируя аденозиновые рецепторы, которые стимулируют снижение потребности в кислороде (A1) или увеличение обеспечения кислородом (А2A) и, таким образом регулируя равновесие между выработкой энергии и энергетической потребностью тканей. Результатом действия обоих подвидов рецепторов является увеличение количества кислорода, доступного тканям, и защита клеток от повреждения, вызванного кратковременным дисбалансом в поступлении кислорода. Одной из важных функций эндогенного аденозина является предупреждение повреждения во время травм, таких как гипоксия, ишемия, гипотензия и эпилептический припадок.
Кроме того, установлено, что связывание агониста аденозинового рецептора с тучными клетками, экспрессирующими рецептор A3 крысы, приводит к увеличению концентраций инозиттрифосфата и внутриклеточного кальция, что вызывает антигениндуцированную секрецию медиаторов воспалительного процесса. Следовательно, рецептор А3 принимает участие в опосредовании приступов астмы и других аллергических ответных реакций.
Аденозин является нейромодулятором, способным модулировать многие аспекты физиологической функции мозга. Эндогенный аденозин, центральное связующее звено между метаболизмом энергии и нейронной активностью, изменяется в зависимости от поведенческого статуса и (пато)физиологических состояний. В условиях повышенной потребности и ограниченного поступления энергии (таких, как гипоксия, гипогликемия и/или избыточная нейронная активность) аденозин обеспечивает эффективный защитный механизм обратной связи. Взаимодействие с аденозиновыми рецепторами представляет собой перспективную мишень для терапевтического вмешательства при ряде неврологических и психиатрических заболеваний, таких как эпилепсия, нарушения сна, нарушение опорно-двигательного аппарата (болезнь Паркинсона или Гентингтона), болезнь Альцгеймера, депрессия, шизофрения или наркомания. Увеличение высвобождения нейромедиаторов происходит при травмах, таких как гипоксия, ишемия и эпилептические припадки. Наконец, эти нейромедиаторы отвечают за дегенерацию нервной ткани и гибель нейронов, что приводит к повреждению мозга или летальному исходу. Следовательно, агонисты рецептора A1, которые имитируют ингибирующее действие аденозина на клетки центральной нервной системы, могут применяться в качестве нейропротективных агентов. Предполагается, что аденозин является эндогенным противосудорожным агентом, ингибирующим высвобождение глутамата из возбужденных нейронов и ингибирующим воспаление нейронов. Следовательно, агонисты аденозина можно использовать в качестве противоэпилептических агентов. Антагонисты аденозина стимулируют активность ЦНС и являются эффективными в качестве усилителей познавательной способности. Селективные антагонисты А2А обладают терапевтическим действием при лечении различных форм слабоумия, например болезни Альцгеймера, и нейродегенеративных состояний, например инсульта. Антагонисты аденозинового рецептора А2A модулируют активность стриарных ГАБАергических нейронов и управляют спокойными и координированными движениями, открывая таким образом возможность лечения симптомов болезни Паркинсона. Кроме того, аденозин принимает участие в ряде физиологических процессов, включающих воздействие седативного средства, гипноз, шизофрению, тревогу, боль, дыхание, депрессию и привыкание к наркотическим средствам (амфетамину, кокаину, опиоидам, этанолу, никотину, каннабиноидам). Следовательно, лекарственные средства, действующие на аденозиновые рецепторы, также обладают лечебным действием в качестве седативных средств, мышечных релаксантов, антипсихотических средств, транквилизаторов, анальгетиков, стимуляторов дыхания, антидепрессантов и средств для лечения токсикомании. Кроме того, они могут использоваться при лечении ADHD (гиперактивное состояние в связи с недостаточностью внимания).
Важной функцией аденозина в сердечно-сосудистой системе является его кардиопротективное действие. Уровень эндогенного аденозина увеличивается в ответ на ишемию и гипоксию, а также обеспечивает защиту сердечной ткани во время и после травмы (предварительная обработка). При воздействии на рецептор A1 агонисты рецептора A1 могут защитить от повреждения, вызванного ишемией миокарда и реперфузией. Модулирующее влияние рецепторов А2А на адренергическую функцию может иметь значение для множества нарушений, таких как ишемическая болезнь сердца и сердечная недостаточность. Антагонисты рецептора A2A могут оказывать лечебное действие в случаях, при которых требуется усиленный антиадренергический ответ, таких как острый приступ ишемии миокарда. Селективные антагонисты рецептора А2А могут также повысить эффективность аденозина при подавлении суправентрикулярной экстрасистолии.
Аденозин модулирует многие аспекты функции почек, включая высвобождение ренина, скорость гломерулярной фильтрации и почечный кровоток. Соединения, которые являются антагонистами почечного действия аденозина, можно использовать в качестве почечных защитных агентов. Кроме того, антагонисты А3 и/или А2B могут применяться при лечении астмы и других аллергических ответных реакций или при лечении сахарного диабета и ожирения.
Современная информация об аденозиновых рецепторах приводится, например, в следующих публикациях:
Bioorganic & Medicinal Chemistry, 6, 619-641 (1998),
Bioorganic & Medicinal Chemistry, 6, 707-719 (1998),
J. Med. Chem., 41, 2835-2845 (1998),
J. Med. Chem., 41, 3186-3201 (1998),
J. Med. Chem., 41, 2126-2133 (1998),
J. Med. Chem., 42, 706-721 (1999),
J. Med. Chem., 39, 1164-1171 (1996),
Arch. Pharm. Med. Chem., 332, 39-41 (1999),
Am. J. Physiol., 276, H1113-1116 (1999) или
Naunyn Schmied, Arch. Pharmacol., 362, 375-381 (2000).
Объектами настоящего изобретения являются соединения формулы I, применение соединений формулы I и их фармацевтически приемлемых солей для получения лекарственных средств, предназначенных для лечения заболеваний, опосредованных рецептором аденозина A2, способы получения указанных соединений, лекарственные средства на основе соединений по изобретению и их получение, а также применение соединений формулы I для лечения или профилактики заболеваний, связанных с модуляцией аденозиновой системы, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, нейрозащитное действие, шизофрения, тревога, боль, нарушения дыхания, депрессия, привыкание к наркотическим средствам (таким, как амфетамин, кокаин, опиоиды, этанол, никотин, каннабиноиды), астма, аллергические ответные реакции, гипоксия, ишемия, эпилептический припадок и токсикомания. Кроме того, соединения по настоящему изобретению могут применяться в качестве седативных средств, мышечных релаксантов, антипсихотических средств, противоэпилептических средств, противосудорожных средств и кардиопротективных агентов при таких заболеваниях, как ишемическая болезнь сердца и сердечная недостаточность. Наиболее предпочтительными показаниями по настоящему изобретению являются показания, основанные на антагонистическом действии на рецептор аденозина A2А и включающие нарушения центральной нервной системы, например лечение или профилактика болезни Альцгеймера, некоторых депрессивных состояний, токсикомании, нейрозащитное действие, болезнь Паркинсона и ADHD.
Термин «(низш.)алкил», используемый в тексте заявки, означает насыщенную алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.п. Предпочтительными (низш.)алкильными группами являются группы, содержащие 1-4 атома углерода.
Термин "фармацевтически приемлемые кислотно-аддитивные соли" означает соли неорганических и органических кислот, таких как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п.
Предпочтительными соединениями по настоящему изобретению являются соединения, в которых R означает фенил, пиридин-2-ил, -С(O)-O-СН2СН3, -С(O)-СН2СН3, -С(O)-морфолинил или -С(O)-N(СН3)2, например следующие соединения:
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-бензил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты,
этиловый эфир [4-(4-метокси-7-морфолин-4-илбензотиазол-2-илкарбамоил)-2-оксо-2Н-пиридин-1-ил]уксусной кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-оксо-1-(2-оксобутил)-1,2-дигидропиридин-4-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-оксо-1-пиридин-2-илметил-1,2-дигидропиридин-4-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-(2-морфолин-4-ил-2-оксоэтил)-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты или
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-диметилкарбамоилметил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты.
Указанные соединения формулы I и их фармацевтически приемлемые соли получают известными методами, например описанным ниже способом, который включает
а) взаимодействие соединения формулы
с соединением формулы
с образованием соединения формулы
где R означает фенил, пиридил, -С(O)O-(низш.)алкил или -С(O)-(низш.)алкил, или
б) взаимодействие соединения формулы
с соединением формулы
или
с образованием соединения формулы
где R означает -С(O)-морфолинил, -(СН2)n-O-(низш.)алкил, -(CH2)nNR'2 или -C(O)NR'2, и
при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
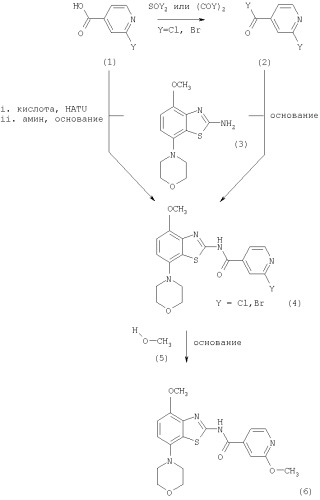
Получение соединений формулы I, где R означает фенил, пиридил, -С(O)O-(низш.)алкил или -С(O)-(низш.)алкил
В первом способе соединения формулы I, где R означает фенил, пиридил, -С(O)O-(низш.)алкил или -С(O)-(низш.)алкил, получают из промежуточного соединения 2-метоксиизоникотинамида формулы (6), как показано ниже на схемах 1 и 2.
Схема 1
На схеме 1 используются следующие сокращения:
HATU означает гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилмочевины
Схема 2
На схеме 2 R означает фенил, пиридил, -С(O)O-(низш.)алкил или -С(O)-(низш.)алкил.
Получение соединений формулы (2)
Исходные соединения, 2-хлоризоникотиновая кислота или 2-бромизоникотиновая кислота формулы (1), являются коммерческими препаратами (например, поставляются фирмой Maybridge Chemicals) или их можно получить известными методами.
Из 2-галогенизоникотиновой кислоты формулы (1) можно получить соответствующее производное ацилгалогенида формулы (2) при взаимодействии соединения формулы (1) с избытком галогенирующего агента, такого как оксалилхлорид или оксалилбромид, или тионилхлорид или тионилбромид, в присутствии катализатора, такого как N,N-диметилформамид или пиридин, в органическом растворителе, предпочтительно в дихлорметане или дихлорэтане, при комнатной температуре в течение 2-16 ч, предпочтительно в течение 16 ч. Продукт формулы (2) выделяют известными способами и предпочтительно используют на следующей стадии без дополнительной очистки.
Получение соединений формулы (4)
Исходное соединение, 2-аминобензотиазол формулы (3), можно получить по методам, описанным в ЕР 00113219.0.
Соединения формулы (4) получают при взаимодействии 2-аминобензотиазола формулы (3) с небольшим избытком ацилгалогенида формулы (2) в апротонном органическом растворителе, предпочтительно в смеси дихлометана и тетрагидрофурана, содержащей основание, предпочтительно N-этилдиизопропиламин или триэтиламин, при комнатной температуре в течение 2-24 ч, предпочтительно в течение 24 ч. Продукт формулы (4) выделяют известными способами и предпочтительно очищают хроматографией или перекристаллизацией.
Альтернативные способы получения соединений формулы (4)
Соединения формулы (4) можно также получить непосредственно из соединений формулы (1). В этом случае соединение формулы (1) обрабатывают стехиометрическим количеством конденсирующего агента (используемого в химии пептидов), предпочтительно гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилмочевины (HATU), в эфирном растворителе, предпочтительно в тетрагидрофуране, содержащем основание, предпочтительно N-этилдиизопропиламин, при комнатной температуре в течение 30-90 мин. Затем полученную смесь обрабатывают 2-аминобензотиазолом формулы (3) в смеси растворителей, предпочтительно в смеси тетрагидрофурана, диоксана и N,N-диметилформамида, при комнатной температуре в течение 16-24 ч, предпочтительно 24 ч. Продукт формулы (4) выделяют известными способами и предпочтительно очищают хроматографией или перекристаллизацией.
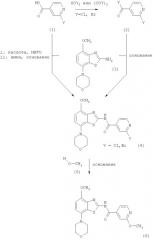
Получение соединений формулы (6)
Первым способом получения соединений формулы (6) является взаимодействие соединения формулы (4) с избытком метанола в присутствии гидрида металла, предпочтительно гидрида натрия или гидрида калия. Указанные реакции проводят в эфирном растворителе, таком как диоксан, тетрагидрофуран или 1,2-диметоксиэтан, предпочтительно диоксан, необязательно содержащем сорастворитель, такой как N,N-диметилформамид, при температуре от комнатной температуры до температуры кипения растворителя, предпочтительно приблизительно при 100°С, в течение 2-72 ч, предпочтительно в течение 16 ч. Продукт формулы (6) выделяют известными способами и предпочтительно очищают хроматографией или перекристаллизацией.
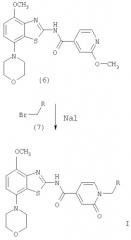
Соединения формулы (6) обрабатывают избытком алкилбромида формулы (7), который является коммерческим препаратом или его можно получить известными методами по методике, описанной в Synthetic. Commun., 29, 4051-4059 (1999). Указанные реакции проводят в полярном органическом растворителе, таком как ацетонитрил или N,N-диметилформамид, предпочтительно в N,N-диметилформамиде, при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение 2-18 ч, предпочтительно в течение 16 ч. Продукт формулы I, где R означает фенил, пиридил, -С(O)O-(низш.)алкил или -С(O)-(низш.)алкил, выделяют известными способами и предпочтительно очищают хроматографией или перекристаллизацией.
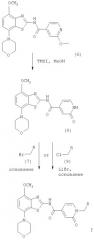
Получение соединений формулы I, где R означает -С(O)-морфолинил, -(CH2)n-NR'2, -(СН2)n-О-(низш.)алкил или -C(O)NR'2.
Соединения формулы I, где R означает -С(O)-морфолинил, -(CH2)n-NR'2, -(СН2)n-O-(низш.)алкил или -C(O)NR'2, получают из промежуточного соединения, амида 2-оксо-1,2-дигидропиридин-4-карбоновой кислоты формулы (8), получение которого показано ниже на схеме 3.
Схема 3
На схеме 3 R означает -С(O)-морфолинил, -(CH2)n-NR'2, -(CH2)n-O-(низш.)алкил или -C(O)NR'2, a TMSI означает иодтриметилсилан.
Получение соединений формулы (8)
Соединение формулы (6) обрабатывают избытком иодтриметилсилана в галогенированном органическом растворителе, предпочтительно в хлороформе, при комнатной или более высокой температуре, предпочтительно при температуре кипения растворителя, в течение 2-16 ч, предпочтительно в течение приблизительно 8 ч. Затем реакционную смесь обрабатывают спиртом, предпочтительно метанолом, при комнатной или более высокой температуре, предпочтительно при температуре кипения смеси растворителей, в течение 2-18 ч, предпочтительно в течение 16 ч. Продукт формулы (8) выделяют известными способами и предпочтительно очищают хроматографией или перекристаллизацией.
Получение соединений формулы I, где R означает -С(O)-морфолинил, -(CH2)n-NR'2, -(СН2)n-O-(низш.)алкил или -C(O)NR'2
Соединение формулы (8) обрабатывают избытком алкилбромида формулы (7) или алкилхлорида формулы (9), которые являются коммерческими препаратами или их можно получить известными методами. При использовании алкилхлорида формулы (9) реакцию проводят в присутствии стехиометрического количества бромида лития. Указанные реакции проводят в полярном органическом растворителе, таком как диоксан или N,N-диметилформамид, предпочтительно в смеси N,N-диметилформамид/диоксан, при температуре от комнатной температуры до температуры кипения растворителя в течение 2-18 ч, предпочтительно в течение 16 ч. Продукт формулы I выделяют известными способами и предпочтительно очищают хроматографией или перекристаллизацией.
Выделение и очистка полученных продуктов
Выделение и очистку описанных выше соединений и промежуточных продуктов проводят при необходимости по любым пригодным методикам выделения или очистки, таким, например, как фильтрация, экстракция, кристаллизация, хроматография на колонке, хроматография в тонком и толстом слое сорбента, препаративная жидкостная хроматография при низком или высоком давлении или комбинация указанных методик. Конкретные иллюстрации пригодных методик разделения и выделения приводятся ниже в разделе Примеры. Однако можно также использовать и другие равноценные методики разделения или выделения веществ.
Соли соединений формулы I
Соединения формулы I являются основаниями, например, если остаток R содержит основную группу, такую как алифатический или ароматический амин. В таких случаях соединения формулы I можно превратить в соответствующую кислотно-аддитивную соль.
Получение солей проводят обработкой по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органическая кислота, такая как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в том же растворителе. Температуру поддерживают от 0 до 50°С. Полученная соль выпадает в осадок или ее можно высадить из раствора добавлением менее полярного растворителя.
Кислотно-аддитивные соли оснований соединений формул I можно превратить в соответствующие свободные основания обработкой по меньшей мере стехиометрическим количеством сооответствующего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. Конкретно было установлено, что соединения по настоящему изобретению являются лигандами аденозинового рецептора, обладают высоким сродством к аденозиновому рецептору A2А и высокой селективностью в отношении рецептора A1.
Биологическую активность соединений определяли по следующим методикам.
Связывание с аденозиновым рецептором А1 человека
Аденозиновый рецептор A1 человека рекомбинантно экспрессировали в яйцеклетках китайского хомячка (СНО) при использовании системы экспрессии вируса леса Семлики. Клетки собирали, дважды промывали центрифугированием, гомогенизировали и вторично промывали центрифугированием. Промытый осадок, содержащий мембранную фракцию, суспендировали в буферном растворе трис (50 мМ, рН 7,4), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (буферный раствор А). Анализ связывания [3H]-DPCPX (0,6 нМ) ([пропил-3Н]-8-циклопентил-1,3-дипропилксантин) проводили в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг гранул SPA, покрытых Ysi-поли-L-лизином и 0,1 ед. аденозиндеаминазы в конечном объеме 200 мкл буфера А. Неспецифическое связывание определяли в присутствии родственного соединения ксантинамина (ХАС, 2 мкМ). Связывание анализируемых соединений определяли при 10 концентрациях от 10 мкМ до 0,3 нМ. Все анализы выполняли в повторных экспериментах, которые повторяли по меньшей мере дважды. Аналитические планшеты инкубировали при комнатной температуре в течение 1 ч, центрифугировали и определяли количество связанного лиганда, содержащего радиоактивную метку, на сцинтилляционном счетчике (Packard Topcount). Величины IC50 рассчитывали по нелинейной кривой с использованием программного обеспечения, а значения Кi рассчитывали по уравнению Cheng-Prussoff.
Связывание с аденозиновым рецептором А2A человека
Аденозиновый рецептор A2А человека рекомбинантно экспрессировали в яйцеклетках китайского хомячка (СНО) при использовании системы экспрессии вируса леса Семлики. Клетки собирали, дважды промывали центрифугированием, гомогенизировали и вторично промывали центрифугированием. Промытый осадок, содержащий мембранную фракцию, суспендировали в буферном растворе трис (50 мМ, рН 7,4), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (буферный раствор А). Анализ связывания [3H]-SCH-58261 (1 нМ) (Dionisotti и др. Br. J. Pharmacol., 121, 353 (1997)) проводили в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг гранул SPA, покрытых Ysi-поли-L-лизином и 0,1 ед. аденозиндеаминазы в конечном объеме 200 мкл буфера А. Неспецифическое связывание определяли в присутствии родственного соединения ксантинамина (ХАС, 2 мкМ). Связывание анализируемых соединений определяли при 10 концентрациях от 10 мкМ до 0,3 нМ. Все анализы выполняли в повторных экспериментах, которые повторяли по меньшей мере дважды. Аналитические планшеты инкубировали при комнатной температуре в течение 1 ч, центрифугировали и определяли количество связанного лиганда, содержащего радиоактивную метку, на сцинтилляционном счетчике (Packard Topcount). Величины IC50 рассчитывали по нелинейной кривой с использованием программного обеспечения, а значения Кi рассчитывали по уравнению Cheng-Prussoff.
Установлено, что соединения формулы I обладают высоким сродством к рецептору A2A и высокой селективностью в отношении рецептора А1.
Как показано ниже, у предпочтительных соединений величины рКi составляют >7,2.
| Пример № | hA1 (pKi) | hA2 (pKi) |
| 1 | 5,90 | 8,67 |
| 2 | 5,18 | 8,19 |
| 3 | 5,18 | 8,24 |
| 4 | 5,18 | 8,10 |
| 5 | 5,18 | 7,23 |
| 6 | 5,18 | 7,30 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I можно использовать в качестве лекарственных средств, например в форме фармацевтических препаратов. Фармацевтические препараты можно вводить пероральным способом, например в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным является также введение ректальным способом, например в форме суппозиториев, или парентеральным способом, например в форме инъекционных растворов.
Для получения фармацевтических препаратов соединения формулы I можно перерабатывать в смеси с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей при получении таблеток, таблеток в оболочке, драже и твердых желатиновых капсул используются, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в случае мягких желатиновых капсул в зависимости от природы активного соединения обычно не требуется никакого носителя. Пригодными носителями при получении растворов и сиропов являются, например, вода, полиолы, глицерин, растительные масла и т.п. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные вещества.
Лекарственные средства, содержащие соединения формулы I или их фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом настоящего изобретения. Объектом изобретения является также способ получения указанных лекарственных средств, включающий переработку одного или более соединений формулы I и/или их фармацевтически приемлемых кислотно-аддитивных солей и при необходимости одного или более других терапевтически ценных веществ в смеси с одним или более терапевтически инертных носителей в готовую галеновую форму.
Соединения формулы I по настоящему изобретению, а также их фармацевтически приемлемые соли благодаря антагонистическому действию на аденозиновый рецептор применяются для лечения или профилактики заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, нейрозащитное действие, шизофрения, тревога, боль, нарушения дыхания, депрессия, астма, аллергические ответные реакции, гипоксия, ишемия, эпилептический припадок и токсикомания. Кроме того, соединения по настоящему изобретению могут применяться в качестве седативных средств, мышечных релаксантов, антипсихотических средств, противоэпилептических средств, противосудорожных средств и кардиопротективных агентов, а также для получения соответствующих лекарственных средств.
Наиболее предпочтительными показаниями по настоящему изобретению являются показания, которые включают нарушение ЦНС, например лечение или профилактику некоторых депрессивных состояний, нейрозащитное действие и болезнь Паркинсона.
Дозы могут изменяться в широких пределах и должны соответствовать индивидуальным требованиям в каждом конкретном случае. В общем случае при пероральном введении взрослым пациентам суточная доза изменяется от приблизительно 0,01 мг до приблизительно 1000 мг соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза вводится в виде однократной дозы и разделенными дозами и, кроме того, в случае соответствующих показаний верхний предел можно превысить.
Состав таблеток (влажное гранулирование)
| Ингредиенты № | мг в одной таблетке | |||
| 5 мг | 25 мг | 100 мг | 500 мг | |
| 1. Соединение формулы I | 5 | 25 | 100 | 500 |
| 2. Лактоза безводная DTG | 125 | 105 | 30 | 150 |
| 3. Sta-Rx 1500 | 6 | 6 | 6 | 30 |
| 4. Микрокристаллическая целлюлоза | 30 | 30 | 30 | 150 |
| 5. Стеарат магния | 1 | 1 | 1 | 1 |
| Общая масса | 167 | 167 | 167 | 831 |
Методика получения
1. Компоненты 1, 2, 3 и 4 смешивают и гранулируют при добавлении очищенной воды.
2. Гранулы высушивают при температуре 50°С.
3. Гранулы измельчают на соответствующей мельнице.
4. Добавляют компонент 5 и перемешивают в течение 3 мин; затем прессуют таблетки на соответствующем таблетирующем оборудовании.
Состав капсул
| Ингредиенты № | мг в одной капсуле | |||
| 5 мг | 25 мг | 100 мг | 500 мг | |
| 1. Соединение формулы I | 5 | 25 | 100 | 500 |
| 2. Гидратированная лактоза | 59 | 123 | 148 | - |
| 3. Кукурузный крахмал | 25 | 35 | 40 | 70 |
| 4. Тальк | 10 | 15 | 10 | 25 |
| 5. Стеарат магния | 1 | 2 | 2 | 5 |
| Общая масса | 200 | 200 | 300 | 600 |
Методика получения
1. Компоненты 1, 2, 3 смешивают в соответствующем смесителе в течение 30 мин.
2. Добавляют компоненты 4 и 5 и перемешивают в течение 3 мин.
3. Смесью заполняют соответствующие капсулы.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-бензил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты
К раствору 85 мг (0,21 ммоля) 2-метокси-N-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)изоникотинамида в 2 мл ацетонитрила при перемешивании добавляли 73 мг (0,43 ммоля) иодида натрия, 0,05 мл (0,43 ммоля) бензилбромида и смесь кипятили с обратным холодильником в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и последовательно промывали водой и солевым раствором. Органическую фазу сушили над сульфатом натрия и концентировали в вакууме. Продукт очищали экспресс-хроматографией (элюент: этилацетат/толуол, 2:1), при этом получали 32 мг (32%) (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амида 1-бензил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты в виде кристаллов желтого цвета. МС (ES): m/e (%) 499 (М+Na+, 14), 477 (M+H+, 100).
Следующие соединения получали аналогично тому, как описано в примере 1.
Пример 2
Этиловый эфир [4-(4-метокси-7-морфолин-4-илбензотиазол-2-илкарбамоил)-2-оксо-2Н-пиридин-1-ил]уксусной кислоты
Указанное соединение получали при взаимодействии 2-метокси-N-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)изоникотинамида с иодидом натрия и этиловым эфиром бромуксусной кислоты в ДМФА. МС (ES): m/e (%) 495 (M+Na+, 25), 473 (M+H+, 100).
Пример 3
(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-оксо-1-(2-оксобутил)-1,2-дигидропиридин-4-карбоновой кислоты
Указанное соединение получали при взаимодействии 2-метокси-N-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)изоникотинамида с иодидом натрия и 1-бром-2-бутаноном в ДМФА. МС (ES): m/e (%) 479 (M+Na+, 32), 457 (M+H+, 100).
Пример 4
(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-оксо-1-пиридин-2-илметил-1,2-дигидропиридин-4-карбоновой кислоты
Указанное соединение получали при взаимодействии 2-метокси-N-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)изоникотинамида с иодидом натрия и гидробромидом 2-(бромэтил)пиридина в ДМФА. МС (ES): m/e (%) 500 (M+Na, 30), 478 (M+H+, 100).
Пример 5
(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-(2-морфолин-4-ил-2-оксоэтил)-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты
К раствору 200 мг (0,52 ммоля) (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амида 2-оксо-1,2-дигидропиридин-4-карбоновой кислоты в 1 мл ДМФА и 4 мл 1,2-диметоксиэтана при перемешивании добавляли 44 мг (1,04 ммоля) гидрида натрия (60% дисперсия в минеральном масле). После перемешивания при комнатной температуре в течение 15 мин добавляли 90 мг (1,04 ммоля) бромида лития и перемешивали в течение еще 15 мин. Затем добавляли 95 мг (0,58 ммоля) 4-(2-хлорацетил)морфолина и смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли этилацетатом и последовательно промывали 0,5 М соляной кислотой, насыщенным раствором бикарбоната натрия и солевым раствором. Объединенную водную фазу фильтровали, осадок на фильтре промывали эфиром, ресуспендировали в толуоле и концентрировали в вакууме. Продукт очищали экспресс-хроматографией (элюент: MeOH/CH2Cl2) и растирали в этилацетате, при этом получали 83 мг (31%) (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-(2-морфолин-4-ил-2-оксоэтил)-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты в виде кристаллов желтого цвета. МС (ES): m/e (%) 536 (M+Na+, 25), 514 (М+Н+, 100).
Следующее соединение получали аналогично тому, как описано в примере 5.
Пример 6
(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-диметилкарбамоилметил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты
Указанное соединение получали при взаимодействии (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амида 2-оксо-1,2-дигидропиридин-4-карбоновой кислоты с гидридом натрия, бромидом лития и 2-хлор-N,N-диметилацетамидом в 1,2-диметоксиэтане и ДМФА. МС (ES): m/e (%) 494 (M+Na+, 22), 472 (M+H+, 100).
1. Соединения общей формулы
где R означает фенил, пиридин-2-ил, -С(O)-O-(низш.)алкил, -С(O)-(низш.)алкил, -С(O)-морфолинил, -C(O)-NR'2, a R' означает водород или (низш.)алкил, и их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединения формулы I по п.1, где R означает фенил.
3. Соединения формулы I по п.2, где соединение означает (4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-бензил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты.
4. Соединения по п.1, где R означает -С(O)O-(низш.)алкил.
5. Соединения по п.4, где соединение означает этиловый эфир [4-(4-метокси-7-морфолин-4-илбензотиазол-2-илкарбамоил)-2-оксо-2Н-пиридин-1-ил]уксусной кислоты.
6. Соединения по п.1, где R озна