Фармацевтическая композиция, включающая ингибитор липазы и глюкоманнан
Иллюстрации
Показать всеИзобретение относится к фармакологии, в частности к композициям и способам лечения ожирения. Особенно изобретение относится к композиции, включающей ингибитор липазы, а именно орлистат и кониак или глюкоманнан, и фамацевтически приемлемые эксципиенты. Изобретение обеспечивает снижение проявлений желудочно-кишечных расстройств при использовании ингибитора липазы-орлистата. 10 н. и 25 з.п. ф-лы, 3 ил.
Реферат
Настоящее изобретение относится к фармацевтическим композициям и способам профилактики и лечения ожирения. Более конкретно, настоящее изобретение относится к композиции, содержащей ингибитор липазы, предпочтительно соединение формулы I (орлистат),
и глюкоманнан, а также один или несколько фармацевтически приемлемых эксципиентов.
Побочными эффектами, которые иногда наблюдаются у пациентов, подвергающихся лечению ингибиторами липазы, являются анальное истечение масла (масляный споттинг) и недержание кала. Масляный споттинг является результатом физического разделения некоторых съеденных пищевых жиров, но не абсорбированных из фекальной массы толстой кишки.
В US 5447953 было показано, что абсорбция жира может быть повышена за счет комбинации ингибитора липазы с относительно большим количеством нерастворимых в воде грубых волокон. В WO 00/09123 продемонстрировано, что за счет комбинирования ингибитора липазы, такого как орлистат, с небольшими количествами хитозана, его производного или соли, проявление анального истечения жира может быть существенно понижено.
Обсуждались различные подходы к уменьшению истечения жира. Среди рассматривавшихся стратегий следующие: 1) применение поверхностно-активного вещества для стабилизации пограничного слоя жир/вода с целью предупреждения коалесценции жировой эмульсии в толстой кишке, 2) повышение водной вязкости в прямой кишке для снижения как интенсивности, так и частоты взаимодействия между каплями и, за счет этого, понижение возможности коалесценции, 3) физическая абсорбция жира липофильным веществом или 4) увеличение естественной каловой массы за счет стимулирования бактериального роста в толстой кишке. Последний подход может быть осуществлен либо за счет использования пребиотического материала (например, лактобацилл), либо за счет потребления ферментируемых волокон, действующих как субстрат для бактериального роста.
Неожиданно было обнаружено, что кониак, например, мука из кониака, и, особенно, глюкоманнан активно понижают проявления желудочно-кишечных расстройств (GI-AE - gastro-intestinal adverse events - желудочно-кишечные расстройства), которые обычно наблюдаются после применения такого ингибитора липазы, как орлистат, или после употребления искусственных заменителей природных жиров.
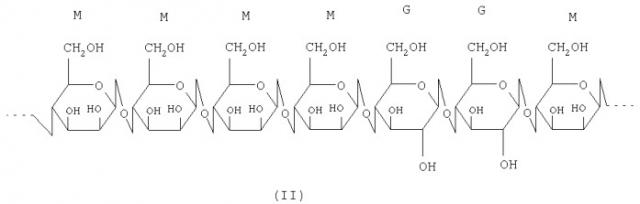
Кониак (Amorphophallus konjac) - растение, из клубней которого делают хорошо известный в Китае и Японии пищевой продукт - муку из кониака. Эта мука, благодаря присутствию в ней глюкоманнана и водорастворимых крахмалов, при взаимодействии с водой золь высокой вязкости. Глюкоманнан (формула II) - основной растворимый компонент, он является полисахаридом, состоящим из D-глюкозы и D-маннозы. Глюкоманнан входит в качестве ингредиента в состав многих пищевых продуктов, а также находит промышленное применение при производстве пленок, жидкостей для очистки от жиров и красок.
М=D-манноза, G=D-глюкоза
Настоящее изобретение относится к композиции, содержащей ингибитор липазы и глюкоманнан.
Во избежание неправильного толкования далее приводятся определения для того, чтобы проиллюстрировать и определить значение и область охвата разных понятий, использовавшихся в описании настоящего изобретения.
Понятие "ингибитор липазы" применяется по отношению к соединениям, способным ингибировать действие липаз, например, желудочных и панкреатических. Мощными ингибиторами липаз являются, например, орлистат и липстатин, как описано в US 4598089. Липстатин - природный продукт микробного происхождения, орлистат образуется в результате гидрирования липстатина. Среди других ингибиторов липаз есть класс соединений, обычно известных как панклицины. Панклицины являются аналогами орлистата (Mutoh и др. в J. Antibiot., 47, 1994, ее. 1369-1375). Понятие "ингибитор липазы" также относится к ингибиторам липаз, связанным с полимером, как, например, описано в WO 99/34786 (фирма Geltex Pharmaceuticals Inc.). Эти полимеры характеризуются тем, что они замещены одной группой или более, которые ингибируют липазы. Понятие "ингибитор липазы" также относится к 2-окси-4Н-3,1-бензоксазин-4-онам, которые описаны в WO 00/40569 (фирма Alizyme Therapeutics Ltd.), например, 2-децилокси-6-метил-4Н-3,1-бензоксазин-4-он, 6-метил-2-тетрадецилокси-4Н-3,1-бензоксазин-4-он, 2-гексадецилокси-6-метил-4Н-3,1-бензоксазин-4-он и другие оксетаноны, описанные, например, в WO 01/32616, WO 01/32669 и WO 01/32670. Наиболее предпочтительно под понятием "ингибитор липазы" подразумевать орлистат.
Орлистат - известное соединение, используемое для лечения или профилактики ожирения и гиперлипидемии. В US 4598089, опубликованном 1 июля 1986 г., также описан способ получения орлистата; в US 6004996 описываются приемлемые фармацевтические композиции. Пригодные фармацевтические композиции также описаны, например, в WO 00/09122 и WO 00/09123. Другие способы получения орлистата описаны в ЕР-А 185359, ЕР-А 189577, ЕР-А 443449 и ЕР-А 524495.
Предпочтительно орлистат вводится орально в дозе от 60 до 720 мг в сутки в два или три приема. Предпочтительным является применение ингибитора липазы в количестве от 180 до 360 мг, более предпочтительно - 360 мг в сутки, предпочтительно чтобы эта доза была поделена и принималась субъектом за два, особенно за три раза в сутки. Субъектами преимущественно являются тучные люди или люди с лишним весом, например те, у кого индекс массы тела равен 25 или больше. Обычно предпочтительным является применение ингибитора липазы в связи с потреблением жирной пищи и по времени примерно должно быть в пределах одного-двух часов относительно времени потребления пищи.
Орлистат может вводиться людям в обычных оральных композициях, таких как таблетки, таблетки с покрытием, твердые и мягкие желатиновые капсулы, эмульсии или суспензии. Примерами носителей, которые могут быть использованы для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул, являются лактоза, другие сахара и сахарные спирты, такие как сорбит, маннит, мальтодекстрин или другие наполнители; поверхностно активные вещества, такие как лаурилсульфат натрия, Brij 96 или Tween 80; такие разрыхлители, как натриевая соль гликолята крахмала, кукурузный крахмал или их производные; такие полимеры, как повидон и кросповидон; тальк; стеариновая кислота или ее соли и т.п. Приемлемыми носителями для мягких желатиновых капсул являются, например, растительные масла, воска, жиры, полутвердые и жидкие полиолы и т.п. Кроме того, фармацевтические препараты могут содержать консервирующие агенты, растворители, стабилизирующие агенты, увлажнители, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, покровные агенты и антиоксиданты. Они также могут содержать другие терапевтически ценные соединения. Составы могут быть традиционно представлены в форме разовой дозы и могут быть приготовлены любым из способов, известных в фармакологии. Предпочтительно орлистат применяется в составах, показанных в примерах настоящего изобретения и в US 6004996.
Понятие "мука кониака" относится гидроколлоидному полисахариду, полученному из клубней Amorphophallus konjac. Многолетние клубни этого растения встречаются в Азии и специально культивируются в Японии. Мука из кониака - это высокомолекулярный неионный глюкоманнан, состоящий преимущественно из молекул маннозы и глюкозы в мольном соотношении 1,6:1,0. Это слаборазветвленный полисахарид, соединенный бета-1-4 связями, молекулярный вес которого варьирует от 200000 до 2000000 дальтон. Ацетильные группы по цепи глюкоманнана обеспечивают его растворимость, они встречаются в среднем с частотой одна группа на 9-19 мономеров сахара. Очищенная мука кониака хорошо растворима в холодной воде с образованием высоковязкого раствора с рН от 4,0 до 7,0. Внесение слабощелочного раствора приводит к образованию термостойкого геля, который устойчив к плавлению даже в условиях длительного нагревания. Процесс очистки муки кониака проводится на крупномасштабных экстракционных заводах. Клубни кониака сначала измельчают и затем полученные частицы глюкоманнана шлифуют для того, чтобы выбить и удалить вредные материалы, сцепленные с ними. В результате этого получают очищенную муку кониака высокой степени чистоты, что улучшает растворимость, стабильность и общую функциональность продукта. Частицы очищенной муки кониака белого цвета, без вкуса и запаха.
Мука кониака и глюкоманнан (продукты PROPOL® и RHEOLEX®) являются коммерчески доступными (фирмы Kyoei Konnyaku, Inc., Behr, Wunderlich & Co., Provisco, FMC Biopolymers, Naturland, SiberHegner and Co. Ltd). Приготовление и применение описано, например, в US 3767424, US 3973007, US 4588589, US 5486364, US 5486364, US 5733593, US 5536521, US 6126906 etc.
Применяемое в настоящем изобретении понятие "фармацевтически приемлемый" означает соединения, приемлемые с точки зрения их токсичности.
Точнее настоящее изобретение относится к фармацевтической композиции, содержащей ингибитор липазы и глюкоманнан. Оптимально данная композиция может содержать один или более фармацевтически приемлемых эксципиентов. Глюкоманнан может использоваться в форме кониака. Предпочтительно кониак содержит не менее 80% глюкоманнана, более предпочтительно - не менее 90% глюкоманнана. Глюкоманнан из кониака может быть использован в форме порошка кониака, например, муки кониака. Предпочтительным ингибитором липазы является орлистат.
Фармацевтические композиции, содержащие как соединение - ингибитор липазы, так и глюкоманнан, являются важными воплощениями настоящего изобретения. Такие фармацевтические композиции содержат фармацевтически эффективные количества каждого из соединений. Каждая дозовая единица может содержать суточные дозы обоих соединений или часть их суточных доз, например треть. Кроме того, каждая дозовая единица может содержать целую дозу одного из соединений и часть дозы другого соединения. В этом случае пациенту следует в сутки принимать одну из комбинированных дозовых единиц и одну или несколько единиц, содержащих только другой компонент.
В предпочтительном варианте осуществления настоящего изобретения композиция содержит а) от 0,1 до 20 мас.% ингибитора липазы, б) от 10 до 75 мас.% кониака и в) от 0,1 до 90 мас.% одного или более фармацевтически приемлемых эксципиентов. Более предпочтительно композиция может содержать а) от 0,1 до 10 мас.% ингибитора липазы, б) от 20 до 75 мас.% глюкоманнана и в) от 0,1 до 90 мас.% одного или более фармацевтически приемлемых эксципиентов. Предпочтительно количество одного или более фармацевтически приемлемых эксципиентов составляет от 5 до 50%, более предпочтительно от 5 до 20%. Точнее, композиция может содержать а) примерно от 5 до 1000 мг ингибитора липазы, например орлистата, примерно от 10 до 500 мг ингибитора липазы, предпочтительно примерно от 20 до 100 мг ингибитора липазы, например примерно от 10 до 360 мг орлистата, более предпочтительно примерно от 30 до 120 мг орлистата, более предпочтительно примерно от 40 до 80 мг орлистата и б) примерно от 0,5 до 10 г глюкоманнана, предпочтительно примерно от 0,5 до 8 г глюкоманнана, более предпочтительно примерно от 0,5 до 6 г глюкоманнана.
Фармацевтически приемлемые эксципиенты могут быть выбраны из группы, содержащей наполнители, поверхностно-активные вещества, разрыхлители, связующие вещества, смазывающие вещества, усилители скорости выпрессовки, подсластители, красители, например, композиция может включать а) примерно от 5 до 1000 мг ингибитора липазы; б) примерно от 0,5 до 10 г глюкоманнана; и дополнительно фармацевтически приемлемые эксципиенты, выбранные из группы и представляющие собой примерно от 0,1 до 10 г наполнителей, примерно от 0,05 до 5,0 г поверхностно-активных веществ, примерно от 0,05 до 2,0 г разрыхлителей, примерно от 0,02 до 5,0 г связующего вещества, примерно от 0,001 до 1,0 г смазывающих веществ, примерно от 0,1 до 5,0 г усилителей скорости выпрессовки, примерно от 0,01 до 4,0 г подсластителей и примерно от 0,001 до 0,5 г красителей.
Фармацевтически приемлемые эксципиенты могут быть выбраны из группы, содержащей наполнители, например сахара и/или сахарные спирты, например лактозу, сорбит, маннит, мальтодекстрин, и др.; поверхностно-активные вещества, например лаурилсульфат натрия, TPGS, Brij 96 или Tween 80; разрыхлители, например натриевую соль гликолята крахмала, кукурузный крахмал или их производные; связующие вещества, например повидон, кросповидон, поливиниловые спирты, гидроксипропилметилцеллюлозу; смазывающие вещества, например стеариновую кислоту или ее соли; усилители выпрессовки, например диоксид кремния; подсластители, например аспартам; и/или красители, например β-каротин.
В предпочтительном воплощении настоящего изобретения композиция включает а) примерно от 0,1 до 20% (масс./масс.) ингибитора липазы; б) от 10 до, примерно, 75% (масс./масс.) глюкоманнана; дополнительно выбраны из группы фармацевтически приемлемые эксципиенты: примерно от 0,1 до 20% (масс./масс.) наполнителей, примерно от 0,1 до 10% (масс./масс.) разрыхлителей, примерно от 0,1 до 10% (масс./масс.) связывающих веществ, примерно от 0,1 до 10% (масс./масс.) смазывающих веществ, примерно от 0,1 до 10% (масс./масс.) ускорителей выпрессовки, примерно от 0,1 до 10% (масс./масс.) подсластителей и примерно от 0,1 до 5% (масс./масс.) красителей.
Более подробно композиция может содержать а) примерно от 5 до 1000 мг ингибитора липазы, например, орлистата, в количестве, например, примерно от 10 до 500 мг ингибитора липазы, предпочтительно примерно от 20 до 100 мг ингибитора липазы, например, примерно от 10 до 360 мг орлистата, более предпочтительно примерно от 30 до 120 мг орлистата, более предпочтительно примерно от 40 до 80 мг орлистата и б) примерно от 0,5 до 10 г глюкоманнана, предпочтительно примерно от 0,5 до 8 г глюкоманнана, и более предпочтительно примерно от 0,5 до 6 г глюкоманнана.
Дозовые формы для орального применения являются предпочтительными композициями для применения по настоящему изобретению и известны фармацевтические формы для такого применения, например таблетки, капсулы, пластинки, саше, гранулы, сиропы и водные или масляные суспензии. Фармацевтически приемлемые эксципиенты (растворители и носители), известные в фармацевтике. Таблетки могут быть получены из смеси активных компонентов с наполнителями, например с фосфатом кальция; разрыхлителями, например кукурузным крахмалом, смазывающими агентами, например стеаратом магния; связывающими веществами, например микрокристаллической целлюлозой или поливинилпирролидоном, и другими дополнительными ингредиентами, известными в данной области техники, для таблетирования смеси известными способами. Сходным образом, например, известными способами могут быть приготовлены жесткие или мягкие желатиновые капсулы, содержащие активное соединение с или без добавления эксципиентов. Содержимое капсул может быть с помощью известных способов составлено таким образом, чтобы получить длительное высвобождение активного соединения. Например, что удобно, каждая таблетка и капсула могут содержать количества ингибитора липазы и глюкоманнана, как описано выше.
Другие дозовые формы для орального применения включают, например, водные суспензии, содержащие активные соединения в водной среде в присутствии нетоксичного суспендирующего агента, такого как натриевая форма карбоксиметилцеллюлозы, и масляные суспензии, содержащие активные соединения в пригодном для этой цели растительном масле, например арахисовом, оливковом или в myritol 318. Активные соединения могут содержаться в гранулах, содержащих или не содержащих дополнительных эксципиентов. Гранулы могут непосредственно проглатываться пациентом или предварительно они могут быть внесены в подходящий жидкий носитель (например, в воду). Гранулы могут содержать разрыхлители, например, пару соединений, кислоту и карбонат или бикарбонат, для получения шипучего напитка и более легкого диспергирования в жидкой среде.
В композициях по настоящему изобретению активные соединения могут, при необходимости, быть ассоциированы с другими приемлемыми фармакологически активными ингредиентами. Дополнительно с соединениями по настоящему изобретению могут применяться витамины.
Оба соединения, ингибитор липазы и глюкоманнан, могут применяться одновременно, раздельно или последовательно (например, орлистат, как показано выше, а глюкоманнан вечером). Предпочтительно соединения или композиции, принимают вместе с пищей или в течение 1-2 часов до или после еды. Лечащий врач принимает решение о количестве глюкоманнана, которое следует принять пациенту, учитывая ряд факторов, в том числе возраст пациента, тяжесть состояния и анамнез.
Настоящее изобретение также относится к композициям, как описано выше, применяемым для лечения и профилактики ожирения, и к способу приготовления композиций, как описано выше, заключающемуся в смешении ингибитора липазы с глюкоманнаном и, дополнительно, одним или несколькими фармацевтически приемлемыми эксципиентами.
Настоящее изобретение также относится к набору для лечения ожирения, который включает а) первый компонент - ингибитор липазы и б) второй компонент - глюкоманнан, как описано выше, например, в общей дозовой форме для орального применения, предпочтительно содержащей а) от 1 до 100 дозовых единиц орлистата и б) от 1 до 100 дозовых единиц глюкоманнана.
Другим вариантом осуществления настоящего изобретения является набор для лечения ожирения, который включает а) первый компонент - ингибитор липазы и б) второй компонент - глюкоманнан в оральных единичных дозовых формах.
Настоящее изобретение также относится к применению композиции, как указано выше, при получении лекарственных средств, предназначенных для лечения и профилактики ожирения и для применения ингибитора липазы, при получении лекарственного средства для лечения и профилактики ожирения у пациентов, которые также принимают глюкоманнан. Применение глюкоманнана и ингибитора липазы касается одновременного, раздельного или последовательного применения для лечения и профилактики ожирения. Далее настоящее изобретение относится к способу лечения ожирения у людей при необходимости такого лечения, которое заключается в применении терапевтически эффективного количества ингибитора липазы и терапевтически эффективного количества глюкоманнана, как описано выше. Способ относится к одновременному, раздельному или последовательному применению этих соединений. Другое воплощение настоящего изобретения - ингибитор липазы и глюкоманнан или кониак, как указано выше, в виде комбинированного препарата для одновременного, раздельного или последовательного применения с целью лечения и профилактики ожирения. Настоящее изобретение также относится к применению глюкоманнана или кониака, как описано выше, для получения лекарственных средств, полезных для лечения и профилактики желудочно-кишечных побочных эффектов, выбранных из группы, в которую входят масляный споттинг, жировой/масляный стул, частые позывы к дефекации, повышенная дефекация и непроизвольный стул, а также к способу лечения или профилактики желудочно-кишечных побочных эффектов, выбранных из группы, в которую входят масляный споттинг, жировой/масляный стул, частые позывы к дефекации, повышенная дефекация и непроизвольный стул, предназначенному для людей, нуждающихся в таком лечении, и заключающемуся в применении терапевтически эффективного количества кониака или глюкоманнана, как указано выше. Также настоящее изобретение относится к ингибитору липазы и глюкоманнану или каниаку, как указано выше, для одновременного, раздельного или последовательного применения для лечения и профилактики ожирения.
Изобретение будет понято лучше, если рассмотреть ссылки на следующие примеры, которые иллюстрируют, но не ограничивают, описываемое настоящее изобретение.
ЧЕРТЕЖИ
На фиг.1 показана тестируемая эмульсия кониака после центрифугирования при 3100 g в течение t=1 мин (а) и t=300 мин (б) соответственно. После центрифугирования в течение t=300 мин слабая стабилизация наблюдалась только в эмульсиях, содержащих кониак в концентрациях, превышающих 1,5% (масс./масс.).
Фиг.2 показывает тестируемые эмульсии кониака после центрифугирования при 3100 g в течение t=1 мин (а) и t=300 мин (б) соответственно. Эмульсии содержат 1,0% (масс./масс.) кониака и отличаются разными значениями рН. После центрифугирования в течение t=300 мин небольшая стабилизация наблюдалась в эмульсиях, имеющих рН 6 и 7 соответственно. Во всех других эмульсиях наблюдалась коалесценция.
Фиг.3 показывает эффект действия разных типов глюкоманнана, выраженный в проценте к контролю, на снижение свободного масла (представлены средние данные ±SE*).
* стандартное отклонение оценки
ПРИМЕРЫ
ПРИМЕР 1: исследования in vitro
Неожиданно было обнаружено, что глюкоманнан снижает проявление желудочно-кишечных побочных эффектов (GI-AE), обычно наблюдаемых после применения такого ингибитора липазы, как орлистат.
Взаимодействие кониака (источника глюкоманнана) с маслом и водой исследовали с помощью абсорбционного теста. Образцы соединений были приведены в соприкосновение либо с соевым маслом, либо с искусственной кишечной жидкостью (simulated intestinal fluid - SIF - фосфатный буфер без панкреатина), и инкубировали 24 часа при 37°С. Оставшуюся жидкость отделяли от твердого материала центрифугированием (3×5 мин при 3100 g). В SIF наблюдали значительное набухание полимера, в соевом масле набухания не было. Абсорбционная способность кониака в SIF и соевом масле была определена как 4,8 и 0,5 г/г соответственно. Кониак обладает низкой липофильностью, поскольку связывает небольшое количество масла.
Способность эмульсий, стабилизированных кониаком, к коалесценции исследовали с помощью метода центрифугирования. С помощью этого метода, проводимого in vitro, исследовали стабильность эмульсии в зависимости от концентрации и рН. Результаты исследований стабильности приведены в таблицах 1 и 2. При концентрации кониака менее 0,5% (масс./масс.) эмульсии были крайне нестабильными, что выражалось в быстром разделении на фазы масло/вода (табл. 1). Даже при концентрации кониака 1,0% (масс./масс.) эмульсии остаются довольно нестабильными и после 10 мин центрифугирования четко делятся на фазы. Только эмульсии, содержащие более 1,0% (масс./масс.) кониака, после центрифугирования, длящегося до t=300 мин, показали среднюю стабильность, но эмульсия была частично нарушена (Фиг.1).
| Таблица 1 | |||||||||
| Стабильность экспериментальных эмульсий с кониаком в зависимости от концентрации (с) и времени центрифугирования (t) | |||||||||
| Концентрация с (%, масс./масс.) | Стабильность эмульсий с кониаком (t/min) | ||||||||
| 1 | 10 | 40 | 70 | 100 | 130 | 160 | 220 | 300 | |
| 0,01 | н* | н | н | н | н | н | н | н | н |
| 0,1 | н | н | н | н | н | н | н | н | н |
| 0,5 | н | н | н | н | н | н | н | н | н |
| 1,0 | с | с | н | н | н | н | н | н | н |
| 1.5 | в | с | с | с | с | с | с | с | с |
| Концентрация с (%, масс./масс.) | Стабильность эмульсий с кониаком (t/min) | ||||||||
| 1 | 10 | 40 | 70 | 100 | 130 | 160 | 220 | 300 | |
| 2,0 | в | с | с | с | с | с | с | с | с |
*н=низкая стабильность: масло и вода образуют две четко разделенные фазы; с=средняя стабильность: эмульсия частично нарушена; в=высокая стабильность: нет признаков коалесценции, оптически непрозрачная стабильная эмульсия.
Фиг.1 показывает состояние экспериментальных эмульсий кониака после центрифугирования при 3100 g в течение 1 мин (а) и 300 мин (б) соответственно. После центрифугирования в течение 300 мин только в эмульсиях, содержащих кониак в концентрациях выше 1,5% (масс./масс.), наблюдалась слабовыраженная стабильность.
Для того чтобы исследовать стабильность эмульсии при разных значениях рН, изучали эмульсии с постоянной концентрацией кониака (с=1,0%, масс./масс.) при разных значениях рН от 4 до 9 (табл. 2). При обоих крайних значениях рН (4 и 9) наблюдали очень слабое эмульгирование экспериментальных эмульсий, что выражалось в мгновенном появлении масляной фазы. При рН=8 и времени центрифугирования не более 30 мин также наблюдалось полное разрушение эмульсии, эмульсия при рН=5 оказалась немного более стабильной. В данном эксперименте коалесценция происходила при длительности центрифугирования более 60 мин. С точки зрения стабильности эмульсии оптимальным является рН от слабокислого до нейтрального (рН 6-7).
| Таблица 2Стабильность экспериментальных эмульсий с кониаком в зависимости от значений рН и длительности центрифугирования (t) | |||||
| рН | Стабильность эмульсий с кониаком (t/мин) | ||||
| 1 | 30 | 60 | 120 | 300 | |
| 4 | н* | н | н | н | н |
| 5 | с | с | с | н | н |
| 6 | с | с | с | с | с |
| 7 | с | с | с | с | с |
| 8 | с | н | н | н | н |
| 9 | н | н | н | н | н |
*н=низкая стабильность: масло и вода образуют две четко разделенные фазы; с=средняя стабильность: эмульсия частично нарушена; в=высокая стабильность: нет признаков коалесценции, оптически непрозрачная стабильная эмульсия.
Фиг.2 показывает состояние эмульсий с кониаком после центрифугирования при 3100 g в течение 1 мин (а) и 300 мин (б) соответственно. Эмульсии содержали 1,0% (масс./масс.) кониака при разных значениях рН. После центрифугирования при t=300 мин слабая стабильность эмульсий наблюдалась при рН 6 и 7 соответственно. Во всех остальных эмульсиях наблюдалось интенсивная коалесценция.
Приготавливали растворы кониака с концентрациями 0,01%, 0,1%, 0,5%, 1,0%, 1,5% и 2,0% (масс./масс.) в искусственной кишечной жидкости (SIF) без панкреатина по способу, изложенному в USP XXII, с.1789 (рН=7,5, буфер на основе однозамещенного фосфорнокислого калия). К 18 г такого раствора добавляли 2 г соевого масла (каталог фирмы FLUKA, 85471) и в итоге получали содержание соевого масла по отношению к водной фазе, равное 10% (масс./масс.). Соевое масло не очищали. Затем приготавливали эмульсии, используя аппараты для микрогомогенизации (28000 оборотов/мин) (уровень Е), время гомогенизации составляло 1 мин. Следует отметить, что смеси соевого масла и воды приготавливали без добавления поверхностно активного вещества. Окрашивание эмульсии красителем нильским красным и последующий анализ с помощью оптического микроскопа выявили, что эмульсии были типа масло-вводе. Сразу после приготовления эмульсий замеряли с помощью прибора Galai CIS-1 средние размеры капель; они обычно составляли 20-30 мкм. Стеклянные капилляры высотой 95 мм и диаметром 1,7 мм (толщина стекла 0,8 мм) с помощью шприца наполняли приготовленной суспензией на высоту 6,5 см и центрифугировали при максимальной скорости 5000 оборотов/мин (фирма Eppendorf, центрифуга 5403, ротор №16А4-44), которая соответствовала центробежной силе 3100 g (применительно ко дну стеклянного капилляра). Для того чтобы зафиксировать процесс разрушения эмульсии, центрифугирование прерывали через определенные интервалы (t=1, 10, 40, 70, 100, 130, 160, 220, 300 мин) и капилляры помещали на оптический сканер, действующий по трансмиссионному типу (прибор Bio-Rad GS-700 Imaging Densitometer).
Расстояние между капиллярами поддерживали постоянным с помощью самодельного штатива. Все измерения проводили при комнатной температуре.
ПРИМЕР 2: 1 исследование in vivo
Для выявления соединений, которые могут при лечении орлистатом уменьшить побочные эффекты, связанные с маслом, была разработана модель проведения острых опытов на людях.
Здоровые добровольцы получали на протяжении 3 последовательных приемов пищи только орлистат, или орлистат в комбинации с испытуемым соединением (тест трех приемов пищи). Модифицированные композиции орлистата, использовавшиеся в тесте трех приемов пищи, вызывали выведение 70-80% жира. Добровольцам были розданы анкеты для записи побочных эффектов. Наиболее тяжелым побочным эффектом, связанным с маслом, был масляный споттинг (неконтролируемое выделение масла). Этот побочный эффект трудно оценить количественно в острых опытах, однако у некоторых добровольцев наблюдалось спонтанное отделение жира от каловых масс. Этот жир, названный свободным маслом (преимущественно содержащим триглицериды), был выделен и взвешен.
Количество свободного масла было использовано в качестве суррогатного маркера для масляного споттинга, поскольку было расценено, что оно необходимо для появления масляного споттинга.
Для изучения модифицирующего эффекта различных соединений по отношению к нарушениям работы желудочно-кишечного тракта было проведено два клинических исследования. Оказалось, что добровольцы обладают разной индивидуальной чувствительностью по отношению к побочным эффектам, вызванным орлистатом и проявляющимся на желудочно-кишечном тракте. По этой причине для каждого добровольца был собственный контроль (применение только одного орлистата). Добровольцы, показавшие слабую чувствительность к побочным эффектам, вызванным орлистатом, не учитывались. Для добровольцев соединение оценивалось как действующее положительно, когда количество свободного масла снижалось по меньшей мере на 50% по сравнению с контролем (прием только одного орлистата).
Глюкоманнан тестировали в виде порошка кониака. Порошок кониака получают из корней дерева ((Amorphophallus konjac), являющегося природным источником глюкоманнана. Это соединение тестировали на модели острых побочных эффектов в дозе 4 г/прием пищи. Среди пяти исследованных добровольцев у четырех на 50% понизилось количество свободного масла по сравнению с экспериментами, в которых не использовали глюкоманнан (см. табл. 3). У добровольцев, принимавших глюкоманнан/орлистат, не наблюдалось снижения экскреции жира (по сравнению с добровольцами, которые принимали только один орлистат, данные не приводятся), что подтверждает отсутствие взаимосвязи глюкоманнана с орлистатом. Сообщений о существенных побочных эффектах, связанных с приемом глюкоманнана, не было.
| Таблица 3 | ||
| Результаты изучения влияния кониака (глюкоманнана) | ||
| Глюкоманнан (кониак, 4 г/прием пищи) | Образование свободного масла (г/неделю) | |
| Орлистат | Орлистат + кониак | |
| Исследование 1 | 11 | 8 |
| 9 | 0 | |
| 39 | 16 | |
| Исследование 2 | 17 | 8 |
| 40 | 6 | |
| Положительный результат / всего (50%<контроля) | 4/5 |
ПРИМЕР 3: II исследование in vivo
Результаты экспериментов in vitro в дальнейшем были подкреплены исследованиями, выполненными in vivo на мышах как модельном объекте. Данный эксперимент базировался на наблюдении, заключавшемся в том, что при содержании мышей на богатом жирами рационе с внесением орлистата или другого ингибитора липазы, во время груминга животные распределяют выделяющееся свободное масло по меху. Исследовали несколько типов и составов глюкоманнана с целью проверить их способность уменьшить или элиминировать выделение свободного масла. Полученные результаты представлены на фиг.3.
ПРИМЕР 4: фармацевтические композиции орлистата
А)
| Ингредиенты | Количество(мг/капсулу) |
| Орлистат | 120,00 |
| Микрокристаллическая целлюлоза (AVICEL РН-101) | 93,60 |
| Натриевая соль гликолята крахмала PRIMOJEL) | 7,20 |
| Лаурилсульфат натрия | 7,20 |
| Ингредиенты | Количество (мг/капсулу) |
| Поливинилпирролидон (Povidone K-30) | 12,00 |
| Тальк | 0,24 |
| Всего | 240,24 мг |
Методика.
1. Смешать в подходящем миксере орлистат, микрокристаллическую целлюлозу и натриевую соль гликолята крахмала.
2. Гранулировать с раствором поливинилпирролидона и лаурилсульфата натрия в очищенной воде.
3. Пропустить гранулят через экструдер и затем полученный экструдат пропустить через формовщик для получения сферических пеллет.
4. Высушить пеллеты при температуре 30°С.
5. Добавить тальк и перемешать.
6. Поместить в твердые желатиновые капсулы.
Б)
| Ингредиенты | Количество мг/капсулу |
| Орлистат | 60 |
| Микрокристаллическая целлюлоза | 46,8 |
| Натриевая соль гликолята крахмала | 3,6 |
| Лаурилсульфат натрия | 3,6 |
| Поливинилпирролидон | 6,0 |
| Тальк | 0,12 |
| Всего | 120,12 мг |
Методика.
1. Смешать в подходящем миксере орлистат, микрокристаллическую целлюлозу и натриевую соль гликолята крахмала.
2. Гранулировать с раствором поливинилпирролидона и лаурилсульфата натрия в очищенной воде.
3. Пропустить гранулят через экструдер и затем полученный экструдат пропустить через формовщик для получения сферических пеллет.
4. Высушить пеллеты при температуре 30°С.
5. Добавить тальк и перемешать.
6. Поместить в твердые желатиновые капсулы.
В)
| Ингредиенты | Количество (мг/капсулу) | |
| Орлистат | 60 | 120 |
| Лактоза | 40 | 80 |
| Микрокристаллическая целлюлоза | 60 | 120 |
| Лаурилсульфат натрия | 5,7 | 11,4 |
| Натриевая соль гликолята крахмала | 20 | 40 |
| Поливинилпирролидон | 10 | 20 |
| Тальк | 0,2 | 0,4 |
| Всего | 195,9 мг | 391,8 мг |
Методика.
1. Смешать в подходящем миксере орлистат, лактозу, микрокристаллическую целлюлозу и натриевую соль гликолята крахмала.
2. Гранулировать с раствором поливинилпирролидона и лаурилсульфата натрия в очищенной воде.
3. Пропустить гранулят через экструдер и затем полученный экструдат пропустить через формовщик для получения сферических пеллет.
4. Высушить пеллеты при температуре 30°С.
5. Добавить тальк и перемешать.
6. Поместить в твердые желатиновые капсулы.
ПРИМЕР 5: фармацевтические композиции глюкоманнана
Композиция:
| Ингредиенты | Количество (г/жевательную таблетку) |
| Глюкоманнан | 1,5 |
| Сорбит | 1,1 |
| Безводная лактоза | 0,376 |
| Тальк | 0,16 |
| Стеарилфумарат натрия | 0,064 |
| Всего | 3,2 |
Методика.
1. Смешать в подходящем миксере глюкоманнан, сорбит и лактозу.
2. Пропустить полученный порошок через сито.
3. Добавить тальк, стеарилфумарат натрия и перемешать.
4. Сразу прессовать порошковую смесь в жевательные таблетки.
ПРИМЕР 6: фармацевтические композиции глюкоманнана
Композиция:
| Ингредиенты | Количество (г/саше) |
| Глюкоманнан | 4 |
| Аспартам | 0,5 |
| Бета-каротин | 0,001 |
| Всего | 4,501 |
Методика.
1. Подходящий миксер заполнить глюкоманнаном.
2. Гранулировать с раствором/коллоидной суспензией аспартам и бета-каротин в очищенной воде.
3. Высушить гранулы при температуре 60°С.
4. Пропустить гранулят через сито.
5. Поместить в саше.
ПРИМЕР 7: фармацевтические композиции глюкоманнана
Композиция:
| Ингредиенты | Количество (г/жевательную таблетку) |
| Глюкоманнан | 0,5 |
| Лактоза | 0,5 |
| Микрокристаллическая целлюлоза | 1,31 |
| Лаурилсульфат натрия | 0,09 |
| Натриевая соль гликолята крахмала | 0,3 |
| Поливинилпирролидон | 0,15 |
| Тальк | 0,15 |
| Всего | 3,0 |
Методика.
1. Смешать в подходящем миксере глюкоманнан, лактозу, микрокристаллическую целлюлозу и натриевую соль гликолята крахмала.
2. В очищенной воде растворить лаурилсульфат натрия и поливинилпирролидон.
3. Гранулировать с полученным раствором.
4. Пропустить гранулят через экструдер и затем полученный экструдат пропустить через формовщик для получения округлых пеллет.
5. Высушить пеллеты при 65°С.
6. Добавить тальк и смешать.
7. Спрессовать пеллеты в жевательные таблетки.
ПРИМЕР 8: фармацевтические композиции орлистата/глюкоманнана
Композиция:
| Ингредиенты | Количество (г/жевательную таблетку) |
| Орлистат | 0,06 |
| Глюкоманнан | 0,75 |
| Лактоза | 0,5 |
| Микрокристаллическая целлюлоза | 1,31 |
| Лаурилсульфат натрия | 0,09 |
| Натриевая соль гликолята крахмала | 0,3 |
| Поливинилпирр |