Фармацевтическое применение бисфосфонатов
Иллюстрации
Показать всеИзобретение относится к медицине, онкологии и касается применения N-бисфосфоната для приготовления лекарственного средства для лечения остеобластных (остеосклеротических) метастазов, связанных с раком предстательной железы. Изобретение обеспечивает ингибирование аномальной пролиферации остеобластов за счет ранее неизвестных свойств N-бисфосфонатов воздействовать на данный тип метастазов. 4 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к бисфосфонатам, в частности к новому применению бисфосфонатов в фармацевтических целях.
Бисфосфонаты широко используют для подавления остеокластной активности при разнообразных как доброкачественных, так и злокачественных заболеваниях, которые вызывают избыточную или неподходящую костную резорбцию. Эти аналоги пирофосфатов не только уменьшают возникновение явлений, связанных с изменениями в костях скелета, но также приносят клиническую пользу больным и улучшают выживание. Бисфосфонаты способны предотвращать костную резорбцию in vivo; терапевтическая эффективность бисфосфонатов была продемонстрирована при лечении остеопороза, нарушения остеогенеза, болезни Педжета, вызванной опухолью гиперкальциемии (TIH) и, как недавно было показано, при лечении метастазов в кости (ВМ) и множественной миеломы (ММ) (см. обзор Fleisch Н. 1997. Bisphosphonates clinical. В сборнике "Bisphosphonates in Bone Disease. From the Laboratory to the Patient." Изд-во: The Parthenon Publishing Group, Нью-Йорк/Лондон, стр. 68-163).
Механизмы, с помощью которых бисфосфонаты подавляют костную резорбцию, еще не полностью ясны и, похоже, меняются в зависимости от исследуемых бисфосфонатов. Было показано, что бисфосфонаты крепко связываются с гидроксиапатитными кристаллами кости, уменьшают изгибы костей и резорбцию, понижают уровни оксипролина или щелочной фосфатазы в крови и, кроме того, тормозят образование, восстановление, активирование и активность остеокластов.
Множественная миелома является злокачественным заболеванием клеток плазмы, характеризующимся пролиферацией и накоплением злокачественных клеток плазмы в костном мозге. Главными клиническими последствиями являются связанные с лизисом повреждения костей, сопровождающиеся патологическими переломами и болью в костях. Эти повреждения являются результатом избыточной костной резорбции, часто приводящей к гиперкальциемии. Бисфосфонаты применяли для продолжительного лечения множественной миеломы в комбинации с общепринятой химиотерапией. Недавно было показано, что бисфосфонаты, как, например, клодронат и памидронат могут уменьшать возникновение явлений, связанных с изменениями в костях скелета, как, например, связанные с лизисом повреждения костей и патологические переломы, и могут облегчить ассоциированную с этим боль в костях и улучшить качество жизни больных (Laktinen и др.. Lancet 1992, 340,1049-1052; McCloskey и др., B.J. HaemotoL, 1998, 100, 317-325, и Berenson и др., N. Eng. J. Med. 1996, том 334, №8, 488-493). О похожих эффектах сообщалось в случае больных раком молочной железы, подвергавшихся лечению бисфосфонатами (Hortobagyi G.N. и др., "Эффективность памидроната в уменьшении скелетных осложнений у больных раком молочной железы и больных с литическими костными метастазами", протокол 19 группы Aredia по изучению рака молочной железы, New England Journal of Medicine, 1996; 335:1785-91; Kanis J.A. и др., "Понижение клодронатом частоты скелетных метастазов у женщин с раком молочной железы". Bone, 1996; 19: 663-7).
Таким образом, бисфосфонаты являются эффективными ингибиторами остеокластной костной резорбции и демонстрируют терапевтическую эффективность при лечении гиперкальциемии при злокачественном заболевании, при лечение связанного с лизисом заболевания костей, вызванного множественной миеломой, и при лечении смешанных литических и бластических костных метастазов, вызванных раком молочной железы. Однако другие злокачественные новообразования, как, например, рак предстательной железы, сопровождаются скелетными метастазами, которые по своей природе преобладающе являются остеобластическими (остеосклеротическими) и остается неясным, реагируют ли подобным же образом метастазы этих последних злокачественных заболеваний на лечение бисфосфонатами.
Недавно сообщалось, что применение бисфосфонатов (клодроната, этидроната, алендроната и памидроната) оказывает благоприятный эффект на боль в костях у больных с метастатическим раком предстательной железы (Silvio Adami, Cancer, 1997; 80: 1674-79). Недавно также сообщалось, что бисфосфонаты подавляют адгезию клеток рака молочной железы и клеток рака предстательной железы с костями in vitro (Boissier и др., Cancer Res; 3890-3894, 1997) и, кроме того, такая предварительная обработка клеток рака молочной железы и рака предстательной железы бисфосфонатами тормозила инвазию опухолевых клеток путем прямого воздействия на опухолевые клетки. Однако совсем недавно сообщалось, что in vitro обработка линий клеток рака предстательной железы золедроновой кислотой значительно уменьшала рост клеточных линий (Brown и др., Воздействие золедроната на клетки рака предстательной железы, ASBMR, 2000; Lee и др.. Обработка бисфосфонатами тормозит рост клеток рака предстательной железы. Cancer Research, 2000/2001); в то же время не обнаруживали существенного уменьшения объема опухоли в случае подкожных опухолей, вызванных линиями клеток рака предстательной железы, обработанных золедроновой кислотой (Согеу и др.. Воздействие золендроновой кислоты на рак предстательной железы in vitro и in vivo, Amer. Assoc. Cancer Res., представлено в октябре 2000).
До настоящего времени, однако, не было сообщений о том, что какой-либо бисфосфонат проявлял клиническую эффективность при лечении рака предстательной железы или костных метастазов, связанных с раком предстательной железы. Было показано при клиническом исследовании в двойном слепом опыте под контролем плацебо, что золедроновая кислота (ZOMETA®, Novartis Pharma) проявляет статистически значимый полезный эффект по сравнению с плацебо при лечении костных метастазов у больных раком предстательной железы.
Соответственно, данное изобретение предоставляет способ лечения рака предстательной железы у больных при необходимости такого лечения, который включает введение больному эффективного количества N-бисфосфоната.
Изобретение также обеспечивает применение N-бисфосфоната для приготовления лекарственного средства для лечения рака предстательной железы.
Способ и применение по изобретению могут использованы для непосредственного лечения самого рака предстательной железы. Так, считают, что N-бисфосфонаты, применяемые в настоящем изобретении, могут оказывать прямое воздействие in vivo на рост, пролиферацию или жизнеспособность клеток рака предстательной железы, например, в качестве ингибиторов роста или деления клеток рака предстательной железы или в качестве промоторов гибели клеток рака предстательной железы (например, в качестве активирующих апоптоз средств). Также изобретение с пользой может быть применено для лечения вторичных эффектов от рака предстательной железы, включая метастазы, как метастазы в мягкие ткани, так и метастазы в кости.
По существу, кроме того, считают, что изобретение может быть применено в более широком плане для лечения остеобластических (остеосклеротических) метастазов, в частности, остеобластических костных метастазов, например, остеобластических метастазов, вызванных раком предстательной железы и похожими злокачественными заболеваниями.
Таким образом, изобретение, кроме того, обеспечивает применение N-бисфосфоната для лечения остеобластических метастазов, вызванных злокачественными заболеваниями или состояниями у млекопитающих.
В предпочтительных вариантах осуществления изобретение обеспечивает:
(i) применение N-бисфосфоната для лечения метастазов, обусловленных раком предстательной железы;
(ii) способ лечения метастазов, обусловленных раком предстательной железы, у больного при необходимости такого лечения, способ включает введение больному эффективного количества N-бисфосфоната и
(iii) применение N-бисфосфоната при приготовлении лекарственного средства для лечения метастазов, обусловленных раком предстательной железы.
Эффективность лечения N-бисфосфонатом остеобластических метастазов или метастазов рака предстательной железы согласно изобретению может быть продемонстрирована путем мониторинга возникновения явлений, связанных с изменениями в костях скелета (SRE), у больных, подвергшихся лечению N-бисфосфонатом, и сравнения полученных результатов с таковыми для группы, получавшей плацебо; например, как далее представлено в "Описании клинических испытаний".
Явления, связанные с изменениями в костях скелета (SRE), далее определены в "Описании клинических испытаний".
В особенно предпочтительном варианте осуществления изобретение обеспечивает:
(i) применение N-бисфосфоната для уменьшения явлений, связанных с изменениями в костях скелета, обусловленных метастатическим раком предстательной железы;
(ii) способ уменьшения явлений, связанных с изменениями в костях скелета, обусловленных метастатическим раком предстательной железы, у больного раком предстательной железы, способ, который включает введение больному эффективного количества N-бисфосфоната, и
(iii) применение N-бисфосфоната при приготовлении лекарственного средства для уменьшения явлений, связанных с изменениями в костях скелета, обусловленных метастатическим раком предстательной железы.
В настоящем описании термины "лечение" или "подвергать лечению" относятся как к профилактическому или превентивному лечению, так и к лечению заболевания или модифицирующему заболевание лечению, включая лечение больных при риске развития метастазов или явлений, связанных с изменениями в костях скелета, или больных с подозрением на развитие заболевания, например, рака предстательной железы, а также пациентов, которые больны, или которым поставлен диагноз как страдающим заболеванием или болезненным состоянием, например, раком предстательной железы.
Для целей по настоящему описанию N-бисфосфонат означает соединение, которое в дополнение к характерной геминальной бисфосфатной составляющей включает азотсодержащую боковую цепь, например, соединение формулы I,
где X означает водород, гидроксил, аминогруппу, алканоил или аминогруппу, замещенную (С1-С4)алкилом или алканоилом;
R означает водород или (С1-С4)алкил и
Rx означает боковую цепь, которая содержит необязательно замещенную аминогруппу, или азотсодержащий гетероцикл (включая ароматические азот-содержащие гетероциклы),
или его фармацевтически приемлемые соли или любой его гидрат.
Так, например, подходящие N-бисфосфонаты для применения по изобретению могут включать следующие соединения или их фармацевтически приемлемые соли, или любой их гидрат: 3-амино-1-гидроксипропан-1,1-дифосфоновую кислоту (памидроновая кислота), например, памидронат (APD); 3-(N,N-диметиламино)-1-гидроксипропан-1,1-дифосфоновую кислоту, например, диметил-APD; 4-амино-1-гидроксибутан-1,1-дифосфоновую кислоту (алендроновая кислота), например, алендронат; 1-гидрокси-3-(метилпентиламино)пропилиденбисфосфоновую кислоту (ибандроновая кислота), например, ибандронат; 6-амино-1-гидроксигексан-1,1-дифосфоновую кислоту, например, аминогексил-ВР; 3-(N-метил-N-н-пентиламино)-1-гидроксипропан-1,1-дифосфоновую кислоту, например, метилпентил-APD(=ВМ 21.0955); 1-гидрокси-2-(имидазол-1-ил)этан-1,1-дифосфоновую кислоту, например, золедроновая кислота; 1-гидрокси-2-(3-пиридил)этан-1,1-дифосфоновую кислоту (ризедроновая кислота), например, ризедронат, включая ее N-метилпиридиниевые соли, например, иодиды N-метилпиридиния, как, например, NE-10244 или NE-10446; 3-[N-(2-фенилтиоэтил)-N-метиламино]-1-гидроксипропан-1,1-дифосфоновую кислоту; 1-гидрокси-3-(пирролидин-1-ил)пропан-1,1-дифосфоновую кислоту, например, ЕВ 1053 (Leo); 1-(N-фениламинотиокарбонил)метан-1,1-дифосфоновую кислоту, например, FR 78844 (Fujisawa); тетраэтиловый эфир 5-бензоил-3,4-дигидро-2Н-пиразол-3,3-дифосфоновой кислоты, например, U 81581 (Upjohn); и 1-гидрокси-2-(имидазо[1,2-а]пиридин-3-ил)этан-1,1-дифосфоновую кислоту, например, YM 529.
По одному из вариантов осуществления изобретения особо предпочтительный N-бисфосфонат для применения по изобретению включает соединение формулы II,
где Het означает имидазольный, оксазольный, изоксазольный, оксадиазольный, тиазольный, тиадиазольный, пиридиновый, 1,2,3-триазольный, 1,2,4-триазольный или бензимидазольный радикал, который необязательно замещен алкилом, алкоксилом, галогеном, гидроксилом, карбоксилом, аминогруппой, необязательно замещенной алкильным или алканоильным радикалами, или бензильным радикалом, необязательно замещенным алкилом, нитрогруппой, аминогруппой или аминоалкилом;
А означает насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 8 атомов углерода;
X' означает атом водорода, необязательно замещенный алканоилом, или аминогруппу, необязательно замещенную алкильным или алканоильным радикалами, и
R означает атом водорода или алкильный радикал, и его фармакологически приемлемые соли.
В другом варианте осуществления изобретения особенно предпочтительный бисфосфонат для применения по изобретению включает соединение формулы III,
где Het' означает замещенное или незамещенное гетероароматическое 5-членное кольцо, выбранное из группы, состоящей из имидазолила, имидазолинила, изоксазолила, оксазолила, оксазолинила, тиазолила, тиазолинила, триазолила, оксадиазолила и тиадиазолила, где упомянутое кольцо может быть частично прогидрировано и где упомянутые заместители выбираются из, как минимум, одной из групп, состоящей из (С1-С4)алкила, (C1-С4)алкоксила, фенила, циклогексила, циклогексилметила, галогена и аминогруппы, и где два соседних алкильных заместителя в Het могут вместе образовывать второе кольцо;
Y означает водород или (С1-С4)алкил;
X" означает водород, гидроксил, аминогруппу или аминогруппу, замещенную (С1-С4)алкилом, и R означает водород или (С1-С4)алкил;
а также его фармакологически приемлемые соли и изомеры.
Еще в другом варианте осуществления изобретения особенно предпочтительный бисфосфонат для применения по изобретению включает соединение формулы IV,
где Het''' означает имидазолильный, 2Н-1,2,3-, 1H-1,2,4- или 4Н-1,2,4-триазолильный, тетразолильный, оксазолильный, изоксазолильный, оксадиазолильный, тиазолильный или тиадиазолильный радикал, который не замещен или является моно- или дизамещенным по атому углерода низшим алкилом, (низш.)алкоксилом, фенилом, который, в свою очередь, может быть моно- или дизамещен низшим алкилом, (низш.)алкоксилом и/или галогеном, гидроксилом, ди(низш.)алкиламиногруппой, (низш.)алкилтиогруппой и/или галогеном, и замещен по способному иметь заместитель атому азота низшим алкилом или фенил(низш.)алкилом, который, в свою очередь, может быть моно- или ди-замещен по фенильному остатку низшим алкилом, (низш.)алкоксилом и/или галогеном, и
R2 означает водород, гидроксил, аминогруппу, (низш.)алкилтиогруппу или галоген, низшие радикалы, содержащие до 7 углеродных атомов включительно, или его фармакологически приемлемую соль.
Примерами особенно предпочтительных N-бисфосфонатов для применения по изобретению являются:
2-(1-метилимидазол-2-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота;
2-(1-бензилимидазол-2-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота;
2-(1-метилимидазол-4-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота;
1-амино-2-(1-метилимидазол-4-ил)этан-1,1-дифосфоновая кислота;
1-амино-2-(1-бензилимидазол-4-ил)этан-1,1-дифосфоновая кислота;
2-(1-метилимидазол-2-ил)этан-1,1-дифосфоновая кислота;
2-(1-бензилимидазол-2-ил)этан-1,1-дифосфоновая кислота;
2-(имидазол-1-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота;
2-(имидазол-1-ил)этан-1,1-дифосфоновая кислота;
2-(4Н-1,2,4-триазол-4-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота;
2-(тиазол-2-ил)этан-1,1-дифосфоновая кислота;
2-(имидазол-2-ил)этан-1,1-дифосфоновая кислота;
2-(2-метилимидазол-4(5)-ил)этан-1,1-дифосфоновая кислота;
2-(2-фенилимидазол-4(5)-ил)этан-1,1-дифосфоновая кислота;
2-(4,5-диметилимидазол-1-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота и
2-(2-метилимидазол-4(5)-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота и их фармакологически приемлемые соли.
Наиболее предпочтительным N-бисфосфонатом для применения по изобретению является 2-(имидазол-1-ил)-1-гидроксиэтан-1,1-дифосфоновая кислота (золедроновая кислота) или ее фармакологически приемлемая соль.
Фармакологически приемлемыми солями предпочтительно являются соли с основаниями, годятся соли металлов, входящих в группы Ia, Ib, IIa и IIb Периодической Системы Элементов, включая соли щелочных металлов, например, калия, и особенно натриевые соли, или соли щелочноземельных металлов, предпочтительно кальциевые или магниевые соли, а также аммонийные соли с аммиаком или органическими аминами.
Особо предпочтительными фармацевтически приемлемыми солями являются такие, где один, два, три или четыре, в частности, один или два, из кислотных атомов водорода бисфосфоновой кислоты замещены фармацевтически приемлемым катионом, в особенности, натрием, калием или аммонием, в первую очередь натрием.
Очень предпочтительная группа фармацевтически приемлемых солей характеризуется наличием одного кислотного атома водорода и одного фармацевтически приемлемого катиона, в частности, натрия, в каждой из кислотных групп фосфоновой кислоты.
Все упомянутые выше производные N-бисфосфоновой кислоты хорошо известны из литературы. Это включает их получение (см., например, заявку на европейский патент ЕР-А-513760, стр. 13-48). Например, 3-амино-1-гидроксипропан-1,1-дифосфоновую кислоту получают, как описано, например, в патенте США №3962432, а также в виде динатриевой соли, как описано в патентах США №№4639338 и 4711880, а 1-гидрокси-2-(имидазол-1-ил)этан-1,1-дифосфоновую кислоту получают, как описано, например, в патенте США №4939130. См. также патенты США 4777163 и 4687767.
N-Бисфосфонаты могут использоваться в виде изомера или смеси изомеров, когда это подходит, обычно в виде оптических изомеров, например, энантиомеров или диастереоизомеров, или геометрических изомеров, обычно цис-транс-изомеров. Оптические изомеры получают в виде чистых антиподов и/или рацематов.
N-Бисфосфонаты могут также быть использованы в виде их гидратов или могут включать другие растворители, примененные для их кристаллизации.
N-Бисфосфонаты предпочтительно применяют в виде фармацевтических композиций, которые содержат терапевтически эффективное количество активного ингредиента необязательно вместе или в смеси с неорганическими или органическими, твердыми или жидкими фармацевтически приемлемыми носителями, подходящими для применения.
Фармацевтические композиции могут быть, например, композициями для введения через тонкий кишечник, как, например, перорально, через прямую кишку, путем аэрозольной ингаляции или введения через нос, композициями для парентерального введения, как, например, внутривенное или подкожное введение, или композициями для чрескожного введения (например, пассивного или с помощью электрофореза).
Предпочтительно фармацевтические композиции приспосабливают для перорального или парентерального (особенно внутривенного, внутриартериального или чрескожного) введения. Внутривенное и пероральное введение, и прежде всего внутривенное, рассматриваются как особенно важные. Предпочтительно активный ингредиент, являющийся N-бисфосфонатом, находится в форме для парентерального введения, наиболее предпочтительно в форме для внутривенного введения.
Определенный способ введения и дозировка могут быть выбраны при посещении врача с учетом особенностей больного, в частности, возраста, веса, образа жизни, активности и состояния болезни, в качестве принимаемых во внимание факторов. Наиболее предпочтительно, однако, N-бисфосфонат вводят внутривенно.
Дозировка N-бисфосфоната для применения по изобретению может зависеть от различных факторов, как, например, эффективность и продолжительность действия активного ингредиента, способ введения, виды теплокровных и/или пол, возраст, вес и индивидуальное состояние теплокровного животного.
Обычно дозировка подбирается так, чтобы разовая доза бисфосфонатного активного ингредиента от 0,002 до 20,0 мг/кг, в частности, 0,01-10,0 мг/кг, вводилась теплокровному животному с массой примерно 75 кг. Если желательно, эта доза может также вводиться в виде нескольких, необязательно одинаковых частичных доз.
Обозначение "мг/кг" означает количество мг препарата на кг массы тела млекопитающего, включая человека, подвергающегося лечению.
Упомянутая выше доза, либо введенная в виде одной дозы (что предпочтительно), либо в виде нескольких частичных доз, может быть повторно введена, например, один раз каждый день, один раз еженедельно, один раз каждый месяц, один раз каждые три месяца или менее часто. Другими словами, фармацевтические композиции могут вводиться по схемам, охватывающим диапазоны от непрерывной ежедневной терапии до прерывистой терапии циклами.
Предпочтительно N-бисфосфонаты вводят в дозах такой же величины, что и дозы, применяемые при лечении злокачественных заболеваний, поддающихся классическому лечению производными бисфосфоновой кислоты, например, вызванной опухолью гиперкальциемии или костных метастазов при ММ или раке молочной железы. Другими словами, предпочтительно производные N-бисфосфоновой кислоты вводятся в дозах, которые были бы подобным же образом терапевтически эффективны при лечении вызванной опухолью гиперкальциемии или костных метастазов при ММ или раке молочной железы, то есть предпочтительно они вводятся в дозах, которые бы так же эффективно подавляли костную резорбцию и инвазию и рост метастазов.
Готовые лекарственные формы в виде стандартной разовой дозы содержат предпочтительно примерно от 1% до примерно 90% активного ингредиента, а готовые лекарственные формы не в виде стандартной разовой дозы содержат предпочтительно примерно от 0,1% до примерно 20% активного ингредиента. Формы в виде стандартных разовых доз для перорального введения, как, например, капсулы, таблетки или драже, содержат, например, примерно от 1 мг до примерно 500 мг активного ингредиента.
Фармацевтическими препаратами для введения через тонкий кишечник и для парентерального введения являются, например, таковые, представленные в лекарственных формах со стандартной дозой, как, например, драже, таблетки или капсулы и также ампулы. Их производят известным по сути образом, например, с помощью обычных способов смешения, гранулирования, приготовления лекарственных средств в смеси с медом или в сиропе, растворения или лиофилизации. Например, фармацевтические препараты для перорального введения могут быть получены при смешении активного ингредиента с твердыми носителями, когда соответствующее гранулирование полученной в результате смеси и переработка смеси или гранулята, если желательно или необходимо после прибавления подходящих вспомогательных средств во внутреннее содержимое таблеток или драже.
Подходящими носителями являются, в частности, наполнители, как, например, сахара, например, лактоза, сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например, трикальцийфосфат или вторичный кислый фосфат кальция, и также связывающие вещества, как, например, крахмальные пасты, использующие, например, кукурузный, пшеничный, рисовый или картофельный крахмал, желатина, трагант, метилцеллюлоза и/или поливинилпирролидон и, если желательно, дезинтеграторы, как, например, упомянутые выше крахмалы, также карбоксиметилкрахмал, поливинилпирролидон с поперечной сшивкой, агар или альгиновая кислота или ее соль, например, альгинат натрия. Вспомогательными средствами являются главным образом регулирующие текучесть средства и смазывающие средства, например, кремневая кислота, тальк, стеариновая кислота или ее соли, как, например, стеарат магния или кальция, и/или полиэтиленгликоль. Внутреннее содержимое драже обеспечивают подходящими покрытиями, которые могут быть устойчивы к желудочному соку, при этом используются, среди прочего, концентрированные растворы сахара, которые необязательно содержат аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или двуокись титана, или растворы в подходящих органических растворителях или смесях растворителей для покрытия глазурью, или для получения устойчивых к желудочному соку покрытий, растворы подходящих препаратов целлюлозы, как, например, фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. Красители или пигменты могут быть добавлены к покрытиям для таблеток или драже, например, с целью идентификации или для указания различных доз активного ингредиента.
Другими перорально вводимыми фармацевтическими препаратами являются приготовленные из желатины капсулы с сухим содержимым и также мягкие герметизированные капсулы, приготовленные из желатины и пластификатора, как, например, глицерин или сорбит. Капсулы с сухим содержимым могут содержать активный ингредиент в виде гранулята, например, в смеси с наполнителями, как, например, лактоза, связывающими веществами, как, например, крахмалы, и/или средствами, придающими скользкость, как, например, тальк или стеарат магния, и, если нужно, стабилизаторами. В мягких капсулах активный ингредиент предпочтительно растворен или суспендирован в подходящих жидкостях, как, например, жирные масла, парафиновое масло или жидкие полиэтиленгликоли, возможно также добавлять стабилизаторы.
Готовыми лекарственными формами для парентерального введения являются главным образом инъецируемые жидкости, которые эффективны при введении различными способами, как, например, внутривенно, внутриартериально, внутримышечно, внутрибрюшинно, интраназально, интрадермально, подкожно, предпочтительно внутривенно. Такие жидкости являются предпочтительно изотоническими водными растворами или суспензиями, которые могут быть приготовлены перед употреблением, например, из лиофилизованных препаратов, которые содержат только один активный ингредиент или вместе с фармацевтически приемлемым носителем. Фармацевтические препараты могут быть стерилизованы и/или могут содержать вспомогательные средства, например, консерванты, стабилизаторы, увлажняющие средства и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. Предпочтительными формами для парентерального введения являются растворы для внутривенного вливания, предпочтительно содержащие примерно от 1 мг до примерно 20 мг активного вещества в одной стандартной дозе, например, в растворе для вливания объемом примерно от 5 до 200 мл, например, для вливания в течение периода времени примерно от 1 минуты до примерно 1 часа или более. Такие предпочтительные формы для парентерального введения обычно вводятся с интервалами примерно от одного раза в неделю до примерно одного раза в 3 месяца.
N-Бисфосфонаты для применения по изобретению могут вводиться в комбинации с другими активными веществами или терапевтическими средствами, применяемыми для лечения рака предстательной железы и связанных с этим метастазов.
Таким образом, изобретение включает способы лечения больных раком предстательной железы, охватывающие комбинированное лечение N-бисфосфонатом и другим средством против рака предстательной железы, или противораковую терапию предстательной железы.
Изобретение далее включает комбинированную композицию для одновременного, раздельного или объединенного лечения рака предстательной железы, состоящую из эффективного количества N-бисфосфоната и эффективного количества другого средства против рака предстательной железы.
Подходящие средства против рака предстательной железы включают цитотоксические химиотерапевтические средства, например, доксорубицин, данорубицин и т.д., цисплатин и т.д., таксол, гормональное средство, например, LHRH и его аналоги, стероиды и модификаторы биологической ответной реакции.
Подходящая терапия против рака предстательной железы включает лучевую терапию для лечения опухолей внескелетной и/или скелетной локализации.
Другие терапевтические средства, которые могут быть использованы в комбинации с N-бисфосфонатами при лечении рака предстательной железы, описываются далее в разделе "Описание клинических испытаний".
Подходящие готовые лекарственные формы для трансдермального применения включают эффективное количество активного ингредиента с носителем. Полезные носители включают абсорбируемые фармакологически приемлемые растворители для содействия прохождению через кожу организма-хозяина. Обычно чрескожные приспособления существуют в виде бандажа, включающего опорный элемент, резервуар, содержащий соединение, необязательно с носителями, необязательно регулирующий скорость барьер для доставки активного ингредиента с кожи организма-хозяина с контролируемой и предварительно определенной скоростью в течение продолжительного периода времени, и предназначающегося для гарантированного прикрепления приспособления к коже.
Следующие далее примеры иллюстрируют описанное выше изобретение. В следующих примерах термин "активный ингредиент" следует понимать как любое из производных N-бисфосфоновой кислоты, упомянутых выше, использующееся согласно настоящему изобретению.
Примеры
Пример 1: Капсулы, содержащие покрытые оболочкой пилюли активного ингредиента, например, пентагидрата динатриевой соли памидроновой кислоты в качестве активного ингредиента:
Ядро пилюли:
| Активный ингредиент (основа) | 197,3 мг |
| Микрокристаллическая целлюлоза | 52,7 мг |
| (Авицел® рН 105) |
+ Внутреннее покрытие:
| Целлюлоза НР-М 603 | 10,0 мг |
| Полиэтиленгликоль | 2,0 мг |
| Тальк | 8,0 мг |
+ Устойчивое к желудочному соку наружное покрытие:
| Эудрагит® L 30 D (твердый) | 90,0 мг |
| Триэтилцитрат | 21,0 мг |
| Антивспениватель® AF | 2,0 мг |
Вода
| Тальк | 7,0 мг |
Смесь активного ингредиента, например, динатриевой соли памидроновой кислоты, с авицелом® рН 105 увлажняют водой и перемешивают, выдавливают с помощью шприца, образуются шарики сферической формы. Высушенные пилюли затем последовательно покрывают в псевдоожиженном слое внутренним покрытием, состоящим из целлюлозы НР-М 603, полиэтиленгликоля (ПЭГ) 8000 и талька, и водным устойчивым к желудочному соку покрытием, состоящим из эудрагита® L 30 D, триэтилового эфира лимонной кислоты и антивспенивателя® AF. Пилюли с покрытием посыпают тальком и заполняют этим капсулы (капсулы размера 0) с помощью серийной машины для заполнения капсул, например, машины Хефлигера и Карга.
Пример 2: Монолитная адгезивная чрескожная система, содержащая в качестве активного ингредиента, например, 1-гидрокси-2-(имидазол-1-ил)этан-1,1-дифосфоновую кислоту:
Состав:
Полиизобутилен (PIB) 3005,0 г
(Оппанол В1, фирма BASF)
| PIB 35000 | 3,0 г |
(Оппанол В 10, фирма BASF)
| PIB 1200000 | 9,0 г |
(Оппанол В 100, фирма BASF)
| гидрогенизированная углеводородная смола | 43,0 г |
(Эскорец 5320, фирма Exxon)
| 1-додецилазациклогептан-2-он | 20,0 г |
(Азон, фирма Nelson Res., Irvine/CA)
| активный ингредиент | |
| Всего | 100,0 г |
Приготовление:
Вышеупомянутые компоненты вместе растворяют в 150 г кипящей при определенной температуре кипения нефтяной фракции 100-125 путем прокатывания на роликовом настиле с приводным устройством. Раствор наносят на полиэфирную пленку (Hostaphan, Kalle) с помощью приспособления для распределения, используя ракельный нож (300 мм), дающий покрытие примерно 75 г/м2. После высушивания (15 минут при 60°С) наносят в качестве отслаивающей пленки обработанную кремнием полиэфирную пленку (толщина 75 мм, Laufenberg). Приготовленные системы штампуют в желаемые формы размером от 5 до 30 см2, используя штампующее устройство. Приготовленные системы герметизируют по отдельности в пакетах-саше из алюминированной бумаги.
Пример 3: Флакон, содержащий 1,0 мг сухой, лиофилизованной 1-гидрокси-2-(имидазол-1-ил)этан-1,1-дифосфоновой кислоты (смесь ее натриевых солей). После разбавления 1 мл воды получают раствор (концентрация 1 мг/мл) для внутривенного вливания.
Состав:
| активный ингредиент (свободная дифосфоновая кислота) | 1,0 мг |
| маннит | 46,0 мг |
| тринатриевая соль лимонной кислоты | |
| в виде дигидрата около | 3,0 мг |
| вода | 1 мл |
| вода для инъекций | 1 мл |
В 1 мл воды активный ингредиент титруют дигидратом тринатриевой соли лимонной кислоты до рН 6,0. Затем прибавляют маннит и раствор подвергают лиофилизации, лиофилизат помещают во флакон.
Пример 4: Флакон, содержащий активный ингредиент, например, пентагидрат динатриевой соли памидроновой кислоты, растворенный в воде. Раствор (концентрация 3 мг/мл) используется для внутривенного вливания после разбавления.
Состав:
| активный ингредиент | 19,73 мг |
( 5,0 мг безводного активного ингредиента)\tab
| маннит | 250 мг |
| вода для инъекций | 5 мл |
Описание клинических испытаний
1. Цели исследования
Первой целью данного исследования является оценка эффективности лечения золедроновой кислотой (4 мг или 8 мг) в дополнение к противоопухолевой терапии по сравнению только с одной противоопухолевой терапией для предупреждения возникновения связанных с изменениями в костях скелета явлений у больных раком предстательной железы с метастатическим заболеванием костей в анамнезе, у которых болезнь прогрессировала согласно биохимическим данным [то есть наблюдали возросший уровень простатического специфического антигена в сыворотке (PSA)], несмотря на гормональную терапию первой линии для метастатического заболевания.
Связанные с изменениями в костях скелета явления (SRE) определяются как патологические переломы костей, явления компрессии спинного мозга, явления при хирургии костей, при лучевой терапии костей (включая применение радиоизотопов) и при изменении противоопухолевой терапии для лечения костной боли. Таким образом, SRE являются первыми конечными точками в этом исследовании. Ключевыми конечными точками оценки эффективности являются доля больных с, как минимум, одним SRE и время по отношению к первому SRE.
Второй целью исследования является оценка влияния терапии золедроновой кислотой на болевые показатели, на применение аналгезирующих средств на жизненный тонус показатели качества жизни, на время завершения участия в активном исследовании и оценка безопасности и переносимости золедроната. Оценивают также изменения костной резорбции и образование маркеров. Измерения плотности неорганических веществ в костях проводятся у больных в выбранных для этого клинических центрах. Кроме этого, оценивают время развития заболевания в костях и время полного развития заболевания.
Третьей целью исследования является оценка использования медико-санитарной помощи и данных о связанных с ней производственных затратах.
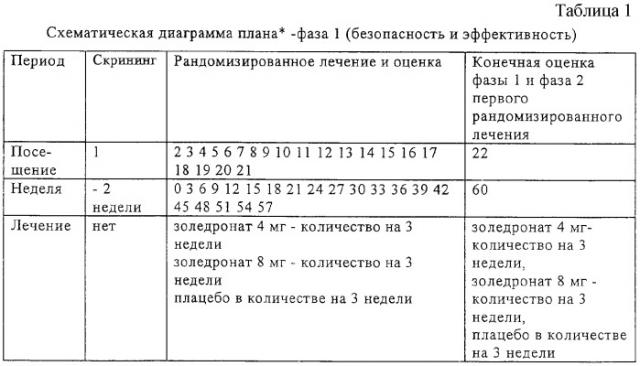
2. План исследования
2.1. Общий план исследования
Такое исследование является международным, многоцентровым, рандомизированным, с двойным слепым опытом, с параллельным контрольным исследованием с применением плацебо. Группа больных для такого исследования состоит из больных раком предстательной железы с историей болезни, включающей метастатическое заболевание костей, больных, имеющих повышенную концентрацию PSA в сывототке (см. раздел 2.3.2), несмотря на гормональную терапию первой линии для лечения метастатического заболевания. Повышенный уровень PSA в сыворотке документально подтверждается тремя последовательными измерениями повышения сывороточного PSA (т.е. третий уровень PSA должен быть > второго уровня PSA, который > первого уровня PSA, который > самого низкого уровня концентрации PSA сыворотки