Медицинское применение ингибитора гистоновой дезацетилазы и способ оценки его противоопухолевого действия
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лекарственному средству для лечения рака предстательной железы, содержащему соединение формулы (I) или его фармацевтически приемлемую соль, к фармацевтической композиции, содержащей указанное соединение, к способу лечения рака предстательной железы, предполагающему введение такого соединения и к применению данного соединения для лечения рака предстательной железы.
Технические результат - расширение арсенала лекарственных средств для лечения рака предстательной железы. 4 н. и 3 з.п., 2 табл., 5 ил.
Реферат
Техническая область
Настоящее изобретение относится к терапевтическому средству для лечения рака предстательной железы, терапевтическому средству для лечения злокачественной лимфомы (кроме T-клеточной лимфомы) и к способу оценки противоопухолевого действия ингибитора гистоновой дезацетилазы.
Предпосылки изобретения
В последние годы «индивидуальная медицина» представляет собой улучшенное распознавание, при котором рассматривают индивидуальные различия между пациентами, и считается необходимым поиск маркера для того, чтобы отличать злокачественную опухоль, против которой эффективно некоторое фармацевтическое средство, от злокачественной опухоли, против которой данное фармацевтическое средство неэффективно. Предпринята попытка в этическом и медицинском смысле улучшить эффективность затрат на лечение медикаментами путем введения фармацевтического средства пациентам после заблаговременного подтверждения вероятности проявления его действия, с улучшением таким образом эффективности и отменой токсичности фармацевтического средства, и со снижением бессмысленного применения фармацевтического средства. Для лечения злокачественных опухолей требовалась разработка способа предсказания эффективности противораковых средств, поскольку он может являться значимым средством для объединения фундаментальных исследований и клинических применений.
Кроме того, в отношении вещества или соединения, в общем указанного как проявляющее противоопухолевую активность, отмечалось, что, когда сообщение основывалось исключительно на результатах, полученных in vitro, такие результаты непосредственно не приводят к предсказанию результатов in vivo. Иными словами, проблемой является то, что вещество, проявляющее противоопухолевую активность in vitro, не обязательно проявляет противоопухолевую активность in vivo, и затруднено непосредственное применение вещества, проявляющего противоопухолевую активность in vitro, в качестве противоракового средства.
Например, вещество, представленное формулой (II),
как сообщается, обладает мощной противоопухолевой активностью, реализуемой путем селективного ингибирования гистоновой дезацетилазы (данное вещество, как также сообщается, вызывает высокую степень ацетилирования гистона в клетке, обработанной данным соединением, и в результате индуцирует активность в плане транскрипционного контроля различных генов, активность в плане ингибирования активности клеточного цикла и активность в плане ингибирования апоптоза (JP-B-7-64872, H. Nakajima et al, Exp. Cell Res. 241, 126-133 (1998))). Однако ни в одном сообщении не был установлен фактор, способствующий предсказанию противоопухолевого действия данного соединения, и по имеющейся ситуации многие проблемы еще подлежат решению, например, могут ли переноситься результаты, полученные in vitro, непосредственно на ситуацию in vivo, обладает ли данное соединение практическим действием in vivo в отношении любой опухоли, и тому подобное.
Гистоновая дезацетилаза представляет собой металлосодержащий дезацетилирующий фермент, где Zn координирован в активном центре (M.S. Finnin et al, Nature, 401, 188-193 (1999)). Данный фермент, как считается, изменяет сродство к ДНК различных ацетилированных гистонов. Это приводит непосредственно к такому биологическому феномену как изменения в структуре хроматина. Минимальной единицей структуры хроматина является нуклеосома, где 146 п.н. ДНК закручена 1,8 раза против часовой стрелки вокруг гистонового октамера (H2A, H2B, H3 и H4, по 2 молекулы каждого, коровый гистон). Коровый гистон стабилизирует структуру нуклеосом, поскольку положительный заряд с N-конца каждого белка-гистона взаимодействует с ДНК. Ацетилирование гистона контролируется балансом между реакцией ацетилирования, в которой участвует гистонацетилтрансфераза, и реакцией дезацетилирования, в которой участвует гистоновая дезацетилаза. Ацетилирование гистона происходит в эволюционно высококонсервативном остатке лизина на N-конце белка-гистона, за счет чего, как считается, белок корового гистона теряет заряд на N-конце, ослабляется взаимодействие с ДНК, и структура нуклеосомы становится нестабильной. В соответствии с этим дезацетилирование гистона, как считается, способствует обратному, а именно приводит к стабилизации структуры нуклеосомы. Однако пока остается много неясных аспектов, например, в какой степени ацетилирование изменяет структуру хроматина, и как оно относится к вторично индуцируемому транскрипционному контролю, и тому подобное.
Описание изобретения
Целью настоящего изобретения является предоставление нового терапевтического средства для лечения рака предстательной железы и терапевтического средства для лечения злокачественной лимфомы. Другой целью настоящего изобретения является предоставление способа оценки и предсказания противоопухолевого действия ингибитора гистоновой дезацетилазы.
Авторы настоящего изобретения провели интенсивные исследования в попытках решить указанные выше проблемы и обнаружить терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы, которые обеспечили подтверждение противоопухолевого действия in vivo. Более того, авторы настоящего изобретения обнаружили, что противоопухолевое действие ингибитора гистоновой дезацетилазы изменяется в зависимости от вида опухоли, и что данная вариация наблюдается в сочетании с изменениями в состоянии экспрессии конкретного гена или белка, и, основываясь на таком наблюдении, разработали способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы, результатом чего являлось завершение настоящего изобретения. В соответствии с этим настоящее изобретение относится к следующему.
(1) Средство для лечения рака предстательной железы или средство для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, которое содержит в качестве активного ингредиента соединение, представленное формулой (I) (здесь и далее также обозначается как FK228; SEQ ID; No 5),
в частности, соединение, представленное формулой (II) (здесь и далее также обозначенное как FR901228),
или его соль.
(2) Средство для лечения рака предстательной железы или средство для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, по указанному выше (1), которое обладает противоопухолевым действием in vivo.
(3) Фармацевтическая композиция для лечения рака предстательной железы или фармацевтическая композиция для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, которая содержит FK228, в частности, формулы FR901228, и фармацевтически приемлемый носитель.
(4) Фармацевтическая композиция для лечения рака предстательной железы или фармацевтическая композиция для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, по указанному выше (3), которое обладает противоопухолевым действием in vivo.
(5) Способ лечения рака предстательной железы или злокачественной лимфомы, отличной от Т-клеточной лимфомы, который охватывает введение эффективного количества FK228, в частности, формулы FR901228.
(6) Применение FK228, в частности, формулы FR901228, для продукции средства для лечения рака предстательной железы или средства для лечения злокачественной лимфомы, отличной от T-клеточной лимфомы.
(7) Применение указанного выше (6), где средство для лечения рака предстательной железы или средство для лечения злокачественной лимфомы, отличной от T-клеточной лимфомы, обладает противоопухолевым действием in vivo.
(8) Коммерческая упаковка, содержащая фармацевтическую композицию для лечения рака предстательной железы по указанному выше (3) и письменный материал, в котором указано, что фармацевтическая композиция может или должна применяться для лечения рака предстательной железы.
(9) Коммерческая упаковка, содержащая фармацевтическую композицию для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, по указанному выше (3), и письменные материалы, утверждающие, что фармацевтическая композиция может или должна применяться для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы.
(10) Способ оценки противоопухолевой активности ингибитора гистоновой дезацетилазы, который охватывает по меньшей мере стадию лечения тестируемой клетки ингибирования гистоновой дезацетилазы и стадию измерения изменения экспрессии конкретного гена (или конкретного белка) в тестируемой клетке до и после обработки указанным ингибитором и сравнения обоих экспрессированных количеств.
(11) Способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы по указанному выше (10), где конкретный ген представляет собой ген p21 и/или ген c-myc.
(12) Способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы по указанному выше (10), где конкретный белок представляет собой ген p21 и/или ген c-myc.
(13) Способ оценки противоопухолевого действия по любому из указанных выше (10)-(12), где ингибитор гистоновой дезацетилазы является соединением, представленным формулой FK228, в частности, FR901228, или его солью.
(14) Способ скрининга ингибитора гистоновой дезацетилазы, обладающего специфичной в отношении определенной области противоопухолевой активностью, который охватывает применение способа оценки противоопухолевого действия любого из указанных выше (10)-(13).
(15) Способ получения гена, способного стать индикатором для предсказания эффективности FK228, который охватывает по меньшей мере,
(1) стадию обработки FK228 чувствительной к FK228 опухолевой клетки и резистентной к FK228 опухолевой клетки,
(2) стадию выбора генов, которые характеризуются повышенной или сниженной экспрессией на указанной выше стадии (1), и
(3) стадию выбора из генов, выбранных на указанной выше стадии (2),
(i) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, более высоким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более низким уровнем экспрессии в резистентной к FK228 опухолевой клетке,
(ii) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, более низким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более высоким уровнем экспрессии в резистентной к FK228 опухолевой клетке,
(iii) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, более высоким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более низким уровнем экспрессии в резистентной к FK228 опухолевой клетке,
(iv) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, более низким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более высоким уровнем экспрессии в резистентной к FK228 опухолевой клетке.
Краткое описание фигур
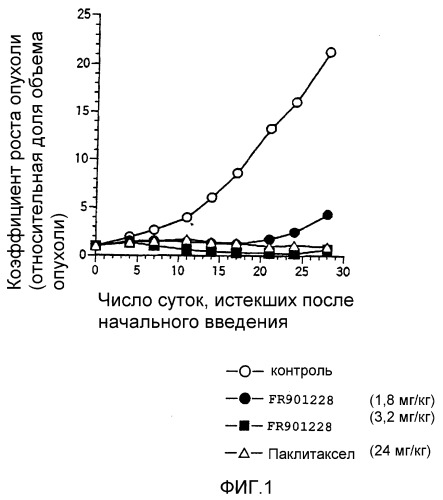
Фиг.1 представляет собой график, на котором показано противоопухолевое действие FR901228 на рак предстательной железы человека, где по вертикальной оси показана скорость роста опухоли, по поперечной оси показано число суток, истекших с момента начального введения, и скорость роста опухоли выражена в виде относительной доли объема опухоли после 0 суток по отношению к объему опухоли на 0 сутки, который принят за 1.
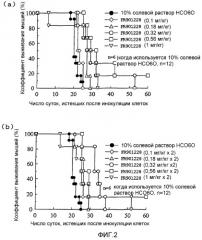
Фиг.2 охватывает графики, на которых показано противоопухолевое действие FR901228 на лимфому человека, где по вертикальной оси показана доля выживших мышей, а по поперечной оси показано число суток, истекших после имплантации опухолевых клеток.
Фиг.3 охватывает графики, на которых показано противоопухолевое действие FR901228 на рак предстательной железы человека ((a); PC-3) и рак почек ((b); ACHN), где по вертикальной оси показана скорость роста опухоли, по поперечной оси показано число суток, истекших с момента начального введения, и скорость роста опухоли выражена в виде относительной доли объема опухоли после 0 суток по отношению к объему опухоли на 0 сутки, который принят за 1.
Фиг.4 охватывает графики, на которых показано действие FR901228 на экспрессию гена p21 in vitro (клетка PC-3, клетка ACHN).
(a),(b). По вертикальной оси показана относительная величина экспрессии гена p21, а по поперечной оси показано время контакта (ч) с FR901228.
(c). По вертикальной оси показана относительная величина экспрессии гена p21.
Фиг.5 охватывает графики, на которых показано действие FR901228 на экспрессию гена p21 и экспрессию гена c-myc in vivo (клетки PC-3, клетки ACHN), где по вертикальной оси показана относительная величина экспрессии гена p21 или c-myc, а по поперечной оси показано число суток, истекших после введения FR901228.
Подробное описание изобретения
Терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы согласно настоящему изобретению содержат в качестве активного ингредиента соединение (FK228), представленное формулой (I), или его соль. Из соединений формулы (I) предпочтительным является соединение (FR901228), представленное формулой (II), которое является стереоизомером. Данные соединения обладают сильной ингибиторной активностью в отношении гистоновой дезацетилазы (Nakajima, H. et al; ibid. (1998)), и FR901228 особенно предпочтительно входит в состав терапевтического средства для лечения рака предстательной железы и терапевтического средства для лечения злокачественной лимфомы согласно изобретению, поскольку оно обладает более сильной ингибиторной активностью в отношении гистоновой дезацетилазы.
В настоящем описании простое указание на FK228 означает группу соединений независимо от стереоизомерии, включая соединения, представленные формулой (II), кроме тех случаев, где определено иначе.
FK228 и его соль являются известными и доступными веществами. Например, FR901228, которое является одним из стереоизомеров FK228, может быть получено путем культивирования штамма, способного продуцировать FR901228 и принадлежащего к роду Chromobacterium, в аэробных условиях, и получения данного вещества из культурального бульона. В качестве штамма, способного продуцировать FR901228 и принадлежащего к роду Chromobacterium, например, может быть упомянут Chromobacterium violaceum WB968 (FERM BP-1968). Более конкретно, FR901228 может быть получен из FR901228-продуцирующего штамма по способу, описанному в JP-B-7-64872 (соответствует патенту США № 4977138). FR901228 предпочтительно получают из штамма, способного продуцировать FR901228 и принадлежащего к роду Chromobacterium, поскольку его проще получить. Однако предпочтительными также являются синтетический или полусинтетический FR901228, поскольку для их получения не требуются стадии очистки или требуется их малое количество. Сходным образом FK228, отличный от FR901228, может также быть получен полусинтетическим или полностью синтетическим путем по общепринятому известному способу. Более конкретно, он может быть получен способом, о котором сообщают Khan W. Li, et al (J. Am. Chem. Soc., vol. 118, 7237-7238 (1996)).
Соль FK228 является биологически приемлемой, в основном нетоксичной солью, и ее примеры охватывают соли с неорганическим основанием (например, соли щелочных металлов, такие как соль натрия, соль калия, и т.д., соли щелочно-земельных металлов, таких как соль кальция, соль магния, и т.д., и соль аммония), соли с органическим основанием (например, соли органических аминов, таких как триэтиламиновая соль, соль диизопропилэтиламина, соль пиридина, соль пиколина, соль этаноламина, соль триэтаноламина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и т.д.), неорганические аддитивные соли (например, гидрохлорид, гидробромид, гидросульфат, фосфат и т.д.), аддитивные соли карбоновых кислот, сульфоновых кислот (например, формиат, ацетат, трифторацетат, малеат, тартрат, фумарат, метансульфонат, бензолсульфонат, толуолсульфонат и т.д.), соли с основными или кислыми аминокислотами (например, аргинин, аспарагиновая кислота, глутаминовая кислота и т.д.), соли с основными и кислыми аддитивными солями.
FK228 может иметь стереоизомер (например, FR901228), такой как оптический изомер или геометрический изомер, основанный на асимметричном атоме углерода или двойной связи, и все изомеры и их смесь находятся в объеме настоящего изобретения.
Сольватные соединения FK228, FR901228 и их соли (например, соединения включения (например, гидрат, и т.д.)) также могут входить в объем настоящего изобретения.
Согласно настоящему изобретению, in vivo и in vitro в основном имеют то же значение, что и обычно. Т.е. «in vivo» относится к состоянию, где целевая биологическая функция или реакция экспрессируется в живом организме, а «in vitro» относится к экспрессии такой функции или реакции в пробирке для тестирования (система тканевой культуры, система культуры клеток, бесклеточная система и т.д.).
Опухоль, являющаяся мишенью согласно изобретению, представляет собой опухоль, на которую оказывает противоопухолевое действие FK228, являющийся ингибитором гистоновой дезацетилазы, и ее примеры охватывают рак предстательной железы и злокачественную лимфому, где особенно примечательным является эффект in vivo. Злокачественная лимфома, на которую оказывает противоопухолевое действие терапевтическое средство для лечения злокачественной лимфомы согласно настоящему изобретению, предпочтительно является отличной от T-клеточной лимфомы, например, представляет собой В-клеточную лимфому, гистиоцитарную лимфому и тому подобное. В настоящем изобретении показано отличное противоопухолевое действие in vivo, особенно против данных опухолей.
Терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы согласно изобретению может использоваться в качестве фармацевтического препарата в виде твердого вещества, полутвердого вещества или жидкости, содержащей FK228 или его соль в качестве активного ингредиента в смеси с органическим или неорганическим носителем или наполнителем, подходящим для перорального или парентерального применения. Активный ингредиент может примешиваться к общепринятому нетоксичному фармацевтически приемлемому носителю, например, для получения порошка, таблетки, пилюли, капсулы, суппозитория, жидкости, эмульсии, суспензии, аэрозоля, спрея и другой формы, подходящей для применения. Там, где необходимо, может также использоваться добавка, стабилизатор, загуститель и тому подобное. Данные носители и наполнители могут использоваться, если необходимо, после стерилизационной обработки или могут стерилизоваться после составления в препарат. FK228 или его соль могут содержаться в количестве, достаточном для обеспечения противоопухолевого действия, в терапевтическом средстве для лечения рака предстательной железы и в терапевтическом средстве для лечения злокачественной лимфомы.
При использовании фармацевтического средства для человека его предпочтительно применяют путем внутривенного, внутримышечного и перорального введения. При том, что терапевтически эффективная доза FK228 или его соли, которые являются активными ингредиентами, варьирует в зависимости от возраста и состояния конкретных пациентов, подлежащих лечению, и вида злокачественной опухоли и вида злокачественной лимфомы, она в основном составляет 0,1-100 мг, предпочтительно 1-50 мг, более предпочтительно, 5-30 мг в сутки в количестве FK228 на площадь поверхности тела человека (м2) в случае внутривенного введения для лечения опухоли.
Настоящее изобретение также относится к способу оценки противоопухолевого действия ингибитора гистоновой дезацетилазы. С помощью данного способа может быть обнаружен ингибитор гистоновой дезацетилазы, который способен оказывать противоопухолевое действие на целевую опухолевую клетку, без действительного введения данного ингибитора в человеческий организм.
Под «ингибитором гистоновой дезацетилазы» подразумевается соединение, которое связывается с активным участком гистоновой дезацетилазы, конкурентно с субстратом, или соединение, которое связывается с участком, отличным от активного участка гистоновой дезацетилазы, и обладает действием по изменению ферментативной активности гистоновой дезацетилазы, и он охватывает соединение, уже известное как ингибитор гистоновой дезацетилазы, применение которого известно, все соединения (синтетические или природные), о которых сообщалось, что они имеют ингибиторную активность в отношении гистоновой дезацетилазы, и все соединения, о которых сообщат в будущем. Конкретно могут быть упомянуты указанное выше FK228, его соль и его производное (например, ацетилированное FK228, форма тиола, где восстановлена связь S-S, и т.д.). Кроме того, соединениями, об ингибиторной активности в отношении гистоновой дезацетилазы которых сообщалось, являются трихостатин A, бутират натрия, субероиланилидгидроксамовая кислота (SAHA), MS-275, циклический пептид, содержащий гидроксамовую кислоту, апицидин, трапоксин и тому подобное.
Способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы согласно изобретению охватывает по меньшей мере (i) стадию обработки тестируемой клетки ингибитором гистоновой дезацетилазы и (ii) стадию измерения изменения экспрессии конкретного гена и/или белка в тестируемой клетке до и после обработки указанным ингибитором, и сравнения обоих экспрессированных количеств. Каждая стадия подробно объясняется далее.
(i) Стадия обработки тестируемых клеток ингибитором гистоновой дезацетилазы
На данной стадии тестируемую клетку культивируют в растворе, содержащем ингибитор гистоновой дезацетилазы.
Хотя тестируемая клетка, подлежащая использованию согласно изобретению, особо не ограничена, лишь бы только она содержала гистоновую дезацетилазу, однако оценка противоопухолевого действия ингибитора гистоновой дезацетилазы, особенно местной опухолевой специфичности ингибитора, является одной из проблем настоящего изобретения, поэтому предпочтительно, чтобы используемая тестируемая клетка происходила из опухоли, действие на которую следует оценивать. Например, когда подлежит оценке действие на рак предстательной железы, используют клетку PC-3, которая представляет собой культивируемую клетку рака предстательной железы человека, и так далее, а когда подлежит оценке действие на рак почки, используют клетку ACHN, которая представляет собой культивируемую клетку рака почек человека, и так далее. Различные культивируемые клетки рака человека, подлежащие использованию в качестве тестируемых клеток, включая данные раковые клетки, коммерчески доступны или доступны из различных клеточных банков, и тому подобное. Для оценки долгосрочного эффекта лечения или эффективности для конкретных пациентов, а именно индивидуальной медицины, возможно культивирование раковой клетки, которая может быть получена из опухоли пациента, и применение данной раковой клетки в качестве тестируемой клетки.
Ингибитор гистоновой дезацетилазы, подлежащий использованию на данной стадии, соответствует указанному выше.
Условия обработки тестируемой клетки и ингибитор гистоновой дезацетилазы свободны от каких-либо конкретных ограничений, при условии, что действие ингибитора гистоновой дезацетилазы может оказываться полностью, и при подходящей установке по таким факторам, как вид тестируемой клетки, подлежащей использованию, и вид тестируемого ингибитора гистоновой дезацетилазы, и тому подобное.
Растворитель для получения раствора ингибитора гистоновой дезацетилазы конкретно не ограничен, при условии, что он способен растворять ингибитор гистоновой дезацетилазы, и он не проявляет токсичности в отношении тестируемой клетки. В общем, концентрированный раствор получают с этанолом, PEG400, 10%-ным раствором HCO-60, диметилсульфоксидом и тому подобным, смешанным растворителем из них и тому подобным, и разводят до требуемой концентрации культуральной средой, физиологическим буфером и тому подобным, и применяют. Концентрация ингибитора гистоновой дезацетилазы в данном растворе в основном составляет 0,001-1000 нМ, предпочтительно 0,01-100 нМ, более предпочтительно - 0,1-10 нМ, а в некоторых случаях раствор серийно разводят, и серию серийных разведений получают и применяют.
В способе оценки согласно изобретению число тестируемых клеток, подлежащих инокуляции, может подходящим образом повышаться или снижаться, в зависимости от времени обработки ингибитором гистоновой дезацетилазы и тому подобного. Оно в основном составляет примерно 1×103-1×106 клеток, предпочтительно, примерно 1×104-1×105 клеток на 1 мл культуральной среды.
Время обработки (время культивирования) тестовой клетки ингибитором гистоновой дезацетилазы подходящим образом устанавливается в соответствии с видом и концентрацией тестируемых клеток и с ингибитором и другими условиями культивирования, и варьирует, в зависимости от объекта оценки, однако оно в основном составляет 1-100 ч, предпочтительно 1-72 ч. Когда требуется подтверждение поддерживаемого в течение длительного времени противоопухолевого действия, устанавливают сравнительно большее время обработки. Тестируемую клетку в основном обрабатывают (культивируют) при 37°C в присутствии 5% CO2 + 95% O2.
(ii) Стадия измерения изменений в экспрессии конкретного гена и/или конкретного белка в тестируемой клетке до и после обработки указанным ингибитором и сравнения обоих количеств экспрессии
Данную стадию можно проводить любым способом, при помощи которого можно наблюдать количество экспрессии конкретного гена и/или конкретного белка в тестируемой клетке. Например, могут быть указаны процедуры, описанные далее.
(1) Ген, в частности, мРНК, или белок экстрагируют из тестируемой клетки до обработки ингибитором гистоновой дезацетилазы.
(2) Как подробно описано в указанной выше стадии (i) обработки тестируемой клетки ингибитором гистоновой дезацетилазы, после обработки тестируемой клетки ингибитором гистоновой дезацетилазы и культивирования в течение некоторого периода времени ген, в частности мРНК, или белок экстрагируют из обработанной клетки тем же способом, как указано выше (1).
(3) С использованием вещества, обладающего специфичной аффинностью в отношении конкретного гена (или конкретного белка) детектируют конкретный ген (или конкретный белок). Здесь конкретный ген (или конкретный белок) означает тот, который характеризуется изменением количества его экспрессии до и после обработки ингибитором гистоновой дезацетилазы и характеризуется корреляцией между изменением количества экспрессии и противоопухолевым действием ингибитора гистоновой дезацетилазы. Конкретно, может указываться ген (белок) p21 и ген (белок) c-myc. Ген p21 представляет собой ген, регулирующий клеточный цикл, участвующий в подавления прогресса клеточного цикла, и известно, что его продукт ингибирует активность комплекса циклин/циклинзависимая киназа, блокируя таким образом прогресс клеточного цикла. Ген c-myc кодирует внутриядерный белок, и его генная экспрессия заметно изменяется по ходу роста клетки, развития клетки и злокачественного перерождения. Соответственно, участие данного генного продукта в клеточном росте привлекает внимание.
Для конкретного гена (или конкретного белка), подлежащего измерению согласно настоящему изобретению, может быть достаточно применения одного вида измерения, но когда необходимо выявить противоопухолевое действие более подробно, предпочтительно одновременное измерение двух или более видов конкретных генов (или конкретных белков).
Вещество, обладающее специфичным сродством к конкретному гену или конкретному белку, свободно от какого-либо конкретного ограничения до тех пор, пока оно обладает той чувствительностью, которая обеспечивает детекцию экспрессии в тестируемых клетках. Здесь под «специфичным сродством» подразумевается свойство гибридизоваться или связываться исключительно с целевым геном или белком. Как вещество для детекции конкретного гена может быть указано вещество, полностью комплементарное целому указанному гену или его части, или вещество, содержащее одно или несколько несовпадений, в степени, удовлетворяющей указанному выше качеству. Конкретные примеры включают в себя олиго- или полинуклеотид, содержащий частично или полностью последовательность оснований гена и последовательности, комплементарные им, и тому подобное, и подходящее вещество выбирают, в зависимости от формы детектируемого гена. Происхождение данного вещества конкретно не ограничено, если только оно обладает специфичным сродством к гену, и оно может быть синтезировано или образовано путем отщепления необходимой части от гена и очистки этой части общепринятым способом. Данное вещество может быть мечено флуоресцентным веществом, ферментом, радиоизотопом и тому подобным. В качестве вещества, подлежащего использованию для детекции конкретного белка, например, может указываться антитело, обладающее конкретным сродством в отношении белка или его фрагмента. Его специфичное сродство означает способность к специфичному распознаванию белка в реакции антиген-антитело и связыванию с ним. Антитело и его фрагмент особо не ограничены, если только они могут конкретно связываться с белком, и могут быть поликлональным антителом, моноклональным антителом и их функциональными фрагментами. Данные антитела и их функциональные фрагменты могут продуцироваться по способу, обычно применяемому в данной области. Такие антитела и их фрагменты могут быть мечены флуоресцентным веществом, ферментом, радиоизотопом и тому подобным.
Экстракция гена, в частности, мРНК, а также экстракция белка из тестируемой клетки может проводиться способом, в основном используемым в связанной области, или подходящей комбинацией таких способов. При экстракции мРНК ее экспрессию оценивают способом, обычно используемым в данной области, таким как нозерн-блот, RT-PCR и тому подобное, с использованием вещества, обладающего специфичным сродством в отношении указанного выше конкретного гена. С другой стороны, когда белок экстрагируют, его экспрессию оценивают способом, обычно используемым в данной области, таким как иммуноблоттинг, вестерн-блоттинг и тому подобное, с использованием вещества (антитела, его фрагмента и т.д.), обладающего специфичным сродством в отношении указанного выше конкретного белка.
Таким образом, изменения в экспрессии конкретного гена (или конкретного белка) в тестируемой клетке до и после обработки ингибитором гистоновой дезацетилазы измеряют и сравнивают для определения того, проявляет ли тестируемый ингибитор гистоновой дезацетилазы эффективную противоопухолевую активность в тестируемой клетке. Когда в качестве индикатора используют ген (или белок) p21 и обработка ингибитором гистоновой дезацетилазы повышает количество экспрессии, определяют противоопухолевое действие ингибитора на происходящей из опухоли тестируемой клетке. Когда в качестве индикатора используют ген (или белок) c-myc и обработка ингибитором гистоновой дезацетилазы снижает количество экспрессии, определяют противоопухолевое действие ингибитора на происходящей из опухоли тестируемой клетке. Когда в качестве тестируемой клетки используют опухолевую клетку, полученную от пациента в клинике, достижимо предсказание противоопухолевого действия, отражающего индивидуальную специфичность пациента.
Способ скрининга ингибитора гистоновой дезацетилазы, согласно изобретению, обладающего противоопухолевой активностью в отношении конкретного участка (вида) опухоли, может быть предоставлен путем использования указанного выше способа оценки противоопухолевого действия ингибитора гистоновой дезацетилазы. Специфичность в отношении участков опухоли для каждого ингибитора может определяться путем использования тестируемой клетки, происходящей из целевой опухоли, обработки ингибитором гистоновой дезацетилазы, действие которого оценивают, и определения наличия или другого проявления противоопухолевого действия указанным выше способом.
Более того, настоящее изобретение относится к способу получения гена, который послужит индикатором эффективности действия FK228. Путем анализа экспрессии гена (группы), осуществляемого таким способом, может быть получена информация о том, может ли FK228 применяться для лечения, воздействует ли FK228 на целевую злокачественную опухоль и тому подобное, что может внести вклад в «индивидуальную медицину».
Данный способ конкретно осуществляется следующим образом.
(1) Стадия обработки FK228 чувствительной к FK228 опухолевой клетки и резистентной к FK228 опухолевой клетки
Чувствительная в отношении FK228 опухолевая клетка означает здесь тип опухолевой клетки, чей рост подавляется FK228. Как пример может быть указана клетка рака предстательной железы PC-3, что показано в описанных ниже примерах. Кроме того, одной из чувствительных к FK228 опухолевых клеток является SC-6, которая представляет собой клетку рака желудка. С другой стороны, резистентной к FK228 опухолевой клеткой является тип опухолевой клетки, чей рост не может подавляться FK228, и в ее отношении FK228 не может оказывать противоопухолевого действия. Как пример может указываться клетка рака почки ACHN, что показано описанными ниже примерами. Кроме того, одной из резистентных к FK228 опухолевых клеток является А498, которая представляет собой клетку рака почки.
Обработка данных опухолевых клеток FK228 проводится тем же способом, что на указанной выше «Стадии обработки тестируемой клетки ингибитором гистоновой дезацетилазы».
(2) Стадия выбора генов, которые характеризуются повышенной или сниженной экспрессией при обработке на указанной выше стадии (1)
Данная стадия отбора генов может осуществляться с использованием способов, приведенных в настоящем описании, и способов, обычно используемых в данной области. Способ с применением генного чипа предпочтительно используют в свете преимущества возможности одновременного анализа большого количества экспрессируемых генов.
(3) Стадия выбора из генов, отобранных выше на стадии (2),
(i) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, большей экспрессией в чувствительной к FK228 опухолевой клетке и меньшей экспрессией в резистентной к FK228 опухолевой клетке,
(ii) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, меньшей экспрессией в чувствительной к FK228 опухолевой клетке и большей экспрессией в резистентной к FK228 опухолевой клетке,
(iii) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, большей экспрессией в чувствительной к FK228 опухолевой клетке и меньшей экспрессией в резистентной к FK228 опухолевой клетке, или
(iv) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, меньшей экспрессией в чувствительной к FK228 опухолевой клетке и большей экспрессией в резистентной к FK228 опухолевой клетке.
Иными словами, данная стадия подразумевает селекцию генов, которые показывают некоторые изменения в экспрессии (увеличение или снижение) вследствие обработки FK228 и характеризуются различным состоянием экспрессии, в зависимости от того, чувствительны они к FK228 или нет. Анализ состояния экспрессии гена (группы) может представлять собой подходящее средство для предсказания эффективности FK228 без введения FK228.
Способ обнаружения повышения или снижения генной экспрессии может осуществляться в соответствии со способами, обычно используемыми в данной области, и проводится с использованием способов, описанных также в настоящем описании. Способ с применением генного чипа предпочтительно используют в свете преимущества возможности одновременного анализа большого количества экспрессируемых генов.
Примеры
Настоящее изобретение конкретно и подробно объясняется далее путем ссылки на примеры, которые, как подразумевается, не являются ограничивающими.
Пример 1
(1) Получение фармацевтического средства
Взвешивали необходимое количество FR901228, и добавляли растворитель (10% HCO-60/солевой раствор). Смесь обрабатывали ультразвуком, чтобы обеспечить растворение. Вещество положительного контроля паклитаксел перед тестированием растворяли в растворе Cremophor EL/этанол (1:1) до концентрации 24 мг/мл, и сохраняли в холодильнике. При использовании его разв