Новые ингибиторы дипептидилпептидазы iv и их применение в качестве противораковых агентов
Иллюстрации
Показать всеНастоящее изобретение относится к новому применению ингибиторов DPIV (изолейцилтиазолидина, изолейцилцианопирролидина, валилпирролидина) и их соответствующих фармацевтически приемлемых кислотно-аддитивных солевых форм для лечения и профилактики колонизации опухолевых клеток и/или метастазов. Перечисленные соединения уменьшали адгезию опухолевых клеток в легких крыс и приводили к уменьшению у них количества колоний опухолевых клеток, уменьшали метастазы. 2 з.п. ф-лы, 6 ил.
Реферат
Область изобретения
Настоящее изобретение относится к ингибиторам ферментативной активности дипептидилпептидазы IV и ферментов, подобных дипептидилпептидазе IV, и, более конкретно, к фармацевтическим композициям, содержащим указанные соединения, и к применению указанных соединений для лечения рака и опухолей. Настоящее изобретение относится особенно к способу ингибирования метастазирования и опухолевой колонизации.
Предпосылки к созданию изобретения
Дипептидилпептидаза IV (DPIV) представляет собой сериновую протеиназу, которая отщепляет N-концевые дипептиды от пептидной цепи, содержащей, предпочтительно, остаток пролина в предпоследнем положении. Хотя биологическая роль DPIV у млекопитающих еще не до конца установлена, полагают, что она играет важную роль в метаболизме нейропептидов, активации Т-кеток и проникновении ВИЧ в лимфоидные клетки.
Кроме того, было установлено, что DPIV отвечает за инактивацию глюкагон-подобного пептида-1 (GLP-1) и глюкозозависимого инсулинотропного пептида, известного также как желудочно-ингибирующий пептид (GIP). Поскольку GLP-1 является главным стимулятором секреции инсулина поджелудочной железой и оказывает прямое благоприятное действие на утилизацию глюкозы, в WO 97/40832 и US 6 303 661 ингибирование DPIV и DPIV-подобной ферментативной активности, как было показано, представляет привлекательный подход к лечению инсулиннезависимого сахарного диабета (NIDDM).
Настоящее изобретение относится к новому применению ингибиторов DPIV для профилактики и лечения состояний, опосредованных ингибированием DPIV и DPIV-подобных ферментов, в частности для профилактики и лечения рака и опухолей и для профилактики и лечения метастазирования и опухолевой колонизации, и фармацевтическим композициям, например, пригодным для ингибирования DPIV и DPIV-подобных ферментов, и к способу ингибирования указанной ферментативной активности.
Настоящее изобретение относится к способу лечения, в частности к способу профилактики и лечения рака, опухолей, метастазов и опухолевой колонизации, а также к соединениям и композициям для применения в указанном способе. Дипептидилпептидаза IV (DPIV) представляет собой пост-пролиновую (в меньшей степени, пост-аланиновую, пост-сериновую или пост-глициновую) отщепляющую сериновую протеиназу, которая обнаруживается в различных тканях организма, включая почки, печень и кишечник.
Известно, что ингибиторы DPIV могут быть пригодными для лечения нарушенной толерантности к глюкозе и сахарного диабета (международная патентная заявка, номер публикации WO 99/61431, Pederson R.A. et al., Diabetes, 1998, Aug; 47(8):1253-8 и Pauly R.P. et al., Metabolism 1999 Mar; 48(3):385-9). В частности, WO 99/61431 раскрывает ингибиторы DPIV, включающие аминокислотный остаток и тиазолидиновую или пирролидиновую группу, и их соли, особенно, L-трео-изолейцилтиазолидин, L-алло-изолейцилтиазолидин, L-трео-изолейцилпирролидин, L-алло-изолейцилтиазолидин, L-алло-изолейцилпирролидин и их соли.
Дополнительными примерами низкомолекулярных ингибиторов дипептидилпептидазы IV являются такие агенты, как производные тетрагидроизохинолин-3-карбоксамида, N-замещенные 2-цианопиролы и -пирролидины, N-(N'-замещенный глицил)-4-цианотиазолидины, аминоацил-бороно-пролил-ингибиторы, циклопропил-конденсированные пирролидины и гетероциклические соединения. Ингибиторы дипептидилпептидазы IV описаны в US 6380398; US 6011155; US 6107317; US 6110949; US 6124305; US 6172081; WO 95/15309; WO 99/61431; WO 99/67278; WO 99/67279; DE 19834591; WO 97/40832; DE 196 16 486 C 2; WO 98/19998; WO 00/07617; WO 99/38501; WO 99/46272; WO 99/38501; WO 01/68603; WO 01/40180; WO 01/81337; WO 01/81304; WO 01/55105; WO 02/02560 и WO 02/14271, целиком включенных в настоящий документ в качестве ссылок, особенно в том, что касается указанных ингибиторов, их определения, применения и производства.
Термин "DPIV-подобные ферменты" относится к ферментным белкам, структурно и/или функционально родственным DPIV/CD26 (Sedo & Malik, Dipeptidyl peptidase IV-like molecules: homologous proteins or homologous activities? Biochimica et Biophysica Acta 2001, 36506: 1-10). По существу, указанная небольшая группа ферментов была выделена во время процесса высвобождения дипептидов H-Xaa-Pro и дипептидов H-Xaa-Ala из N-конца олиго- или полипептидов. Они имеют общую черту в том, что они несут позиции Pro, также Ala, Ser, Thr и другие аминокислоты с малыми гидрофобными боковыми цепями, такие как Gly или Val. Гидролитическая эффективность выстраивается следующим образом: Pro>Ala " Ser, Thr " Gly, Val. Данные белки доступны только в таких малых количествах, что можно установить только пост-Pro или пост-Ala расщепление. В то время как белки DPIV, DP II, FAPα (Seprase), DP 6, DP 8 и DP 9 являются структурно родственными и демонстрируют высокую гомологичность последовательности, аттрактин представляет собой чрезвычайно функциональный DPIV-подобный фермент, отличающийся сходной активностью и характером ингибирующего действия.
DPIV-подобные ферменты описаны также в WO 01/19866, WO 02/04610, WO 02/34900 и WO 02/31134. WO 01/19866 раскрывает новую человеческую дипептидиламинопептидазу (DPP8), обладающую структурным и функциональным сходством с DPIV и белком, активирующим фибробласты (FAP). WO 02/34900 раскрывает новую дипептидилпептидазу 9 (DPP9), обладающую значительной гомологичностью с аминокислотными последовательностями DPIV и DPP8. WO 02/31134 раскрывает три DPIV-подобных фермента, DPRP1, DPRP2 и DPRP3. Секвенирование выявило, что DPRP1 является идентичной DPP8, как описано в WO 01/19866, что DPRP2 является идентичной DPP9 и что DPRP3 является идентичной KIAA1492, как описано в WO 02/04610.
DPIV и DPIV-подобные ферменты в иммунофизиологии и при раке
Дипептидилпептидаза IV (DPIV; ЕС 3.4.14.5; CD26) CD26 представляет собой Mr 110 000 поверхностный гликопротеин, обладающий рядом различных функциональных свойств, которые проявляются в различных тканях, включая эпителиальные клетки и субпопуляции лейкоцитов (Mentlein, 1999). Кроме того, она представляет собой связанную с мембраной эктопептидазу, которая проявляет свою активность во внеклеточном домене и которая способна отщеплять N-концевые дипептиды от полипептидов с L-полином или L-аланином на предпоследней позиции.
Патомеханизмы злокачественных опухолей
Злокачественные опухоли представляют собой группу из более 150 заболеваний, которые характеризуются неконтролируемым ростом патологических клеток в организме. Нормальные клетки становятся патологическими, когда они подвергаются воздействию канцерогенов, таких как радиация или определенные лекарственные средства или химические вещества. Они также могут стать злокачественными (раковыми), если они были поражены определенными вирусами или когда они получили еще не до конца понятный внутренний сигнал. После того, как клетки стали злокачественными, они делятся более быстро, чем обычные. Затем они часто образуют массы, называемые опухолями, которые инвазируют близлежащие ткани и мешают нормальному функционированию организма. Злокачественные клетки имеют также тенденцию распространяться к другим частям организма, где они могут образовывать вторичную опухоль.
Механизмы метастазирования
Результат метастазирования зависит от многочисленных взаимодействий в ткани-мишени и зависит от микроокружения, включая молекулы клеточной адгезии, хемокины или гидродинамические эффекты, а также многие другие факторы. Помимо этого, очень быстрое привлечение лейкоцитов и специфичные клеточные ответы в области опухоли могут играть важную роль в ранней защите хозяина от злокачественной опухоли. Данные ранние изменения могут играть главную роль в исходе метастатической болезни и могут расширить имеющиеся в настоящее время представления о резистентности хозяина против метастазирования.
WO 99/47152 раскрывает способ подавления злокачественного фенотипа или индуцирования апоптоза злокачественных клеток у субъекта, включающий внедрение в злокачественную клетку нуклеиновой кислоты, кодирующей белок - дипептидилпептидазу IV или белок-α, активирующий фибробласты, что подавляет злокачественный фенотип рака. WO 99/47152 также раскрывает способ индуцирования экспрессии дипептидилпептидазы IV или белка-α, активирующего фибробласты, включающий введение субъекту фармацевтической композиции, включающей терапевтически эффективное количество агента, способного активировать транскрипцию гена дипептидилпептидазы IV или гена белка-α, активирующего фибробласты, и фармацевтически приемлемый носитель или разбавитель.
Современные способы лечения злокачественных опухолей и адгезии опухолевых клеток
Современные способы лечения злокачественных опухолей включают хирургическую операцию, химиотерапию, облучение и другие способы лечения, включая иммунотерапию. Иммунотерапия состоит из использования или модификации естественных механизмов организма - в большинстве случаев иммунных механизмов - для борьбы со злокачественной опухолью. Химиотерапия убивает злокачественные клетки с помощью лекарственных средств или гормонов. После перорального приема или введения с помощью инъекции химиотерапевтические агенты используют при целом ряде злокачественных опухолей. Их можно использовать в отдельности или в комбинации с оперативным вмешательством или облучением или и с тем и с другим. Химиотерапия представляет собой общепринятый способ разрушения трудных для выявления злокачественных клеток, которые распространились по организму и циркулируют в нем. Анемия (низкое содержание эритроцитов) представляет собой частый побочный эффект химиотерапии и может вызывать такие симптомы, как чрезвычайная утомляемость, головокружение или одышка. Эпоэтин альфа (Procrit®, Epogen®) - рекомбинантный эритропоэтин, который стимулирует образование эритроцитов, является официальным лекарственным средством, имеющимся в распоряжении для лечения анемии, вызванной химиотерапией.
Иммунотерапия использует собственную иммунную систему организма или другие части организма для разрушения злокачественных клеток. Данная форма лечения все еще интенсивно изучается в ходе клинических испытаний; до настоящего времени она не является широко доступной для большинства пациентов, страдающих злокачественными опухолями. Различные используемые иммунологические агенты включают вещества, вырабатываемые организмом (такие как интерфероны, интерлейкины и фактор некроза опухолей), и вещества, получаемые в лабораторных условиях (такие как моноклональные антитела и вакцины). Иммунологические агенты работают различным образом и могут использоваться независимо от других форм лечения или в комбинации с ними.
Ингибиторы ангиогенеза как антиметастатические лекарственные средства в иммунотерапии
Ингибиторы ангиогенеза представляют собой лекарственные средства, которые блокируют развитие новых кровеносных сосудов. Солидные опухоли не могут расти без образования новых кровеносных сосудов. Блокирование развития новых кровеносных сосудов пресекает снабжение опухоли кислородом и питательными веществами.
В настоящее время несколько ингибиторов ангиогенеза проходят клинические испытания на людях. Ткань злокачественной опухоли не может расти или распространяться (давать метастазы) без образования новых кровеносных сосудов. Кровеносные сосуды снабжают ткани кислородом и питательными веществами, необходимыми для выживания и роста.
Краткое описание изобретения
Настоящее изобретение относится к новому применению ингибиторов DPIV формул 1-12 и их соответствующих фармацевтически приемлемых кислотно-аддитивных солевых форм для профилактики и лечения рака и опухолей. В более предпочтительном варианте осуществления настоящего изобретения соединения по настоящему изобретению являются пригодными для предотвращения и ингибирования метастазирования и опухолевой колонизации.
Сокращение экспрессии эктопептидазы DPIV и отсутствие DPIV-подобной активности в легких мутантных крыс F344, не имеющих ферментативной активности и экспрессии DPIV, приводит к снижению адгезии раковых клеток и метастазирования в легкие. Клеточную адгезию и рост сингенной аденокарциномы молочной железы MADB106 у крыс F344 in vivo изучали на крысах F344 после острого и хронического лечения DPIV-лигандами in vivo. Изучали мутантные сублинии F344, не обладающие ферментативной активностью DPIV, и F344 дикого типа. Постоянная внутрижелудочная инфузия изолейцилцианопирролидина TFA и фумарата изолейцилтиазолидина через осмотические мининасосы в течение двух недель дозозависимым образом уменьшала индуцированную злокачественной опухолью потерю массы тела и количество колоний опухоли на поверхности легких. Таким образом, метастазирование MADB106 уменьшалось с помощью постоянного лечения с использованием различных ингибиторов DPIV (фумарата изолейцилтиазолидина; изолейцилцианопиррилидина TFA), что предполагает наличие эффектов защитного класса у двух различных ингибиторов/лигандов DPIV. Возможно, фумарат изолейцилтиазолидина и изолейцилцианопиррилидин TFA защищают от метастазирования посредством взаимодействия с процессами клеточной адгезии, посредством модификации механизмов клеточной защиты хозяина, посредством модулирования ангиогенеза, посредством прямых воздействий на злокачественные клетки или посредством повышенных уровней субстратов DPIV, которые непрямым образом опосредуют защитные эффекты.
Краткое описание чертежей
Фиг. 1: Влияние однократной инъекции фумарата изолейцилтиазолидина на легочные метастазы у крыс F344. Меченные витальным красителем (карбоксифлуоресцеином; CFSE) опухолевые клетки MADB106 инъецировали в латеральную хвостовую вену и извлекали легкие через 30 мин после инокуляции. Положительные по CFSE опухолевые клетки в легких подсчитывали с помощью иммуногистологии и визуализирующего анализа. Данные представляют средние величины ± СКО среднего; достоверной разницы по сравнению с контролями, получавшими физиологический раствор, обнаружено не было.
Фиг. 2: Влияние однократной инъекции изолейцилцианопиррилидина TFA на адгезию опухолевых клеток через 30 мин после инъекции крысам F344USA. Меченные CFSE злокачественные клетки MADB106 инъецировали в латеральную хвостовую вену и извлекали легкие через 30 мин после инокуляции. Положительные по CFSE опухолевые клетки в легких подсчитывали с помощью иммуногистологии и визуализирующего анализа. Данные представляют средние величины ± СКО среднего; достоверной разницы по сравнению с контролями, получавшими физиологический раствор, обнаружено не было.
Фиг. 3: Влияние однократной инъекции фумарата валилпирролидина на адгезию опухолевых клеток через 30 мин после инъекции крысам F344USA. Меченные CFSE клетки аденокарциномы MADB106 инъецировали в латеральную хвостовую вену и извлекали легкие через 30 мин после инокуляции. Положительные по CFSE опухолевые клетки в легких подсчитывали с помощью иммуногистологии и визуализирующего анализа. Данные представляют средние величины ± СКО среднего; достоверной разницы по сравнению с контролями, получавшими физиологический раствор, обнаружено не было.
Фиг. 4: Влияние постоянной внутрижелудочной инфузии фумарата изолейцилтиазолидина на изменение массы тела в граммах у крыс F344, имеющих метастазы в легких. Показано дозозависимое уменьшение потери массы тела после постоянной инфузии различных доз фумарата изолейцилтиазолидина у крыс F344 через 2 недели после инъекции опухолевых клеток MADB106. Однофакторный ANOVA показал достоверное влияние на массу тела, которое стало достоверным при анализе post-hoc при дозах 0,4 мг и 4 мг. Данные представляют средние величины ± СКО среднего; p < 0,05 отражает достоверную разницу по сравнению с контролями SHAM, получавшими физиологический раствор, по определению Fisher PLSD.
Фиг. 5: Влияние постоянной внутрижелудочной инфузии фумарата изолейцилтиазолидина на количество опухолевых колоний в легких у крыс F344. Показано дозозависимое уменьшение количества опухолевых колоний в легких после постоянной инфузии различных доз фумарата изолейцилтиазолидина у крыс F344 через 2 недели после инъекции опухолевых клеток MADB106. Однофакторный ANOVA показал достоверное влияние, которое стало достоверным при анализе post-hoc при дозе 4 мг. Данные представляют средние величины ± СКО среднего; p < 0,05 отражает достоверную разницу по сравнению с контролями SHAM, получавшими физиологический раствор, по определению Fisher PLSD.
Фиг. 6: Влияние постоянной внутрижелудочной инфузии фумарата изолейцилтиазолидина, изолейцилцианопирролидина TFA и фумарата валилпирролидина на количество опухолевых колоний в легких у крыс F344. Показано достоверное уменьшение количества опухолевых колоний в легких после постоянной инфузии фумарата изолейцилтиазолидина и изолейцилцианопирролидина TFA у крыс F344 через 2 недели после инъекции опухолевых клеток MADB106. Данные представляют средние величины ± СКО среднего; p < 0,05 отражает достоверную разницу по сравнению с контролями SHAM, получавшими физиологический раствор, по определению ANOVA и Fisher PLSD.
Подробное описание изобретения
Настоящее изобретение относится к области ингибирования дипептидилпептидазы IV (DPIV) и, более конкретно, к новому применению ингибиторов DPIV и DPIV-подобной ферментативной активности для профилактики и лечения рака и опухолей, в частности для профилактики и ингибирования метастазирования и опухолевой колонизации, и к фармацевтическим композициям, содержащим указанные соединения.
В противоположность другим предложенным ранее способам, настоящее изобретение особо относится к перорально доступной терапии низкомолекулярными ингибиторами дипептидилпептидазы IV. Настоящее изобретение представляет новый подход к профилактике и лечению рака и метастатической болезни. Он является щадящим по отношению к пациенту, коммерчески доступным и подходящим для применения в терапевтическом режиме, особенно при заболеваниях человека.
Спонтанные мутации гена DPIV, наблюдающиеся в сублиниях крыс F344, обеспечивают модель для изучения роли DPIV в адгезии и колонизации опухолей. Мутации у крыс F344 приводят к отсутствию ферментативной активности DPIV и обнаруживаются в сублиниях из Германии (GER) и Японии (JAP) (Thompson et al., 1991; Tsuji et al., 1992), в то время как крысы из питомников США демонстрируют значительную ферментативную активность. У крыс F344JAP замена G633R в белке DPIV приводит к выраженному уменьшению экспрессии мутантного неактивного фермента (Cheng et al., 1999; Tsuji et al., 1992), в то время как другая DPIV-орицательная сублиния F344GER экспрессирует неактивный мутантный фермент (Thompson et al., 1991).
На основе данных открытий, изучение роли экспрессии и ферментативной активности DPIV при раке, согласно настоящему изобретению установило, что пероральное введение ингибиторов DPIV приводит к уменьшению метастазов в легких и колонизации.
Целью настоящего изобретения является разработка ингибиторов и/или лигандов дипептидилпептидазы IV, которые обладают высокой биодоступностью. В другом предпочтительном варианте осуществления настоящее изобретение относится к ингибиторам DPIV, которые демонстрируют точно предсказуемое время активности в ткани-мишени.
Примерами специфичных в отношении мишени, перорально доступных низкомолекулярных агентов являются пролекарства стабильных и нестабильных ингибиторов дипептидилпептидазы IV общей формулы А-В-С, где А представляет аминокислоту, В представляет химическую связь между А и С или аминокислоту, а С представляет нестабильный или стабильный ингибитор дипептидилпептидазы IV, соответственно. Они описаны в WO 99/67278 и WO 99/67279, идеи которых, касающиеся, получения, определения, применения и производства пролекарств, целиком включены в настоящий документ в качестве ссылок. Особо включены в настоящий документ в качестве ссылок подробные определения А, В и С.
Настоящее изобретение относится к новому способу, при котором снижение активности фермента дипептидилпептидазы (DPIV или CD26) или DPIV-подобной ферментативной активности, или связывание DPIV-специфичного лиганда вызывает подавляющее опухоль или иммуностимулирующее действие в организмах млекопитающих, индуцированное эффекторами фермента, и приводит, как следствие, к уменьшению роста или адгезии злокачественных клеток. Подобное лечение будет приводить к уменьшению или задержке адгезии злокачественных клеток (метастазирования) или роста опухоли. Как следствие, млекопитающим, имеющим злокачественную опухоль, лечение ингибиторами активности DPIV или DPIV-подобных ферментов приносит пользу.
Способ и применение по настоящему изобретению для профилактики и лечения злокачественной опухоли и связанных с ней нарушений у животного, включая человека, который в этом нуждается, включают противораковые эффекты посредством связывания или посредством ингибирования DPIV или родственной ферментативной активности, с использованием ингибитора или лиганда указанных ферментов. Пероральное введение ингибитора DPIV может быть предпочтительным при большинстве обстоятельств.
Настоящее изобретение далее иллюстрируется с помощью следующих примеров, касающихся противоракового и антиметастатического действия пониженной DPIV-подобной активности и/или связывания в исследовании in vivo адгезии злокачественных клеток (пример 13), а также в исследованиях колонизации злокачественных опухолей (пример 14).
В одном показательном примере настоящее изобретение относится к применению дипептидных соединений и соединений, аналогичных дипептидным соединениям, которые образуются из аминокислоты и тиазолидиновой или пирролидиновой группы, и их солей, далее в настоящем документе называемых дипептидными соединениями. Предпочтительно, аминокислота и тиазолидиновая или пирролидиновая группа связаны друг с другом посредством амидной связи.
Особенно подходящими для целей по настоящему изобретению являются дипептидные соединения, в которых аминокислота, предпочтительно, выбрана из натуральной аминокислоты, такой как, например, лейцин, валин, глутамин, глутаминовая кислота, пролин, изолейцин, аспарагины и аспарагиновая кислота.
Дипептидные соединения, используемые по настоящему изобретению, в концентрации (дипептидных соединений) 10 мкМ демонстрируют снижение активности дипептидилпептидазы IV или DPIV-аналогичных ферментов по меньшей мере на 10%, особенно, по меньшей мере на 40%. Часто требуется также снижение активности по меньшей мере на 60% или по меньшей мере на 70%. Предпочтительные эффекторы могут также демонстрировать снижение активности максимум на 20% или 30%.
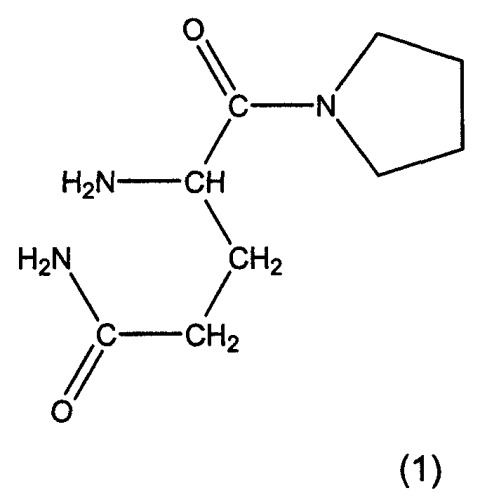
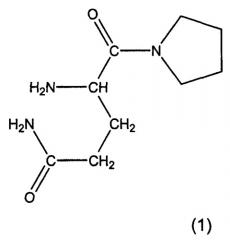
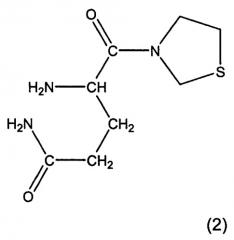
Предпочтительными соединениями являются L-алло-изолейцилтиазолидин, L-трео-изолейцилпирролидин и их соли, особенно, соли фумаровой кислоты, а также L-алло-изолейцилпирролидин и его соли. Особенно предпочтительными соединениями являются глутаминилпирролидин и глутаминилтиазолидин формул 1 и 2:
Другие предпочтительные соединения представлены в таблице 1.
Соли дипептидных соединений могут быть представлены в молярном соотношении дипептидного (-аналогичного) компонента и солевого компонента 1:1 или 2:1. Такой солью, например, является (Ile-Thia)2 фумаровая кислота.
| Таблица 1Структуры других предпочтительных дипептидных соединений |
| Эффектор |
| H-Asn-пирролидин |
| H-Asn-тиазолидин |
| H-Asp-пирролидин |
| H-Asp-тиазолидин |
| H-Asp(NHOH)-пирролидин |
| H-Asp(NHOH)-тиазолидин |
| H-Glu-пирролидин |
| H-Glu-тиазолидин |
| H-Glu(NHOH)-пирролидин |
| H-Glu(NHOH)-тиазолидин |
| H-His-пирролидин |
| H-His-тиазолидин |
| H-Pro-пирролидин |
| H-Pro-тиазолидин |
| H-Ile-азидидин |
| H-Ile-пирролидин |
| H-L-алло-Ile-тиазолидин |
| H-Val-пирролидин |
| H-Val-тиазолидин |
В другом предпочтительном варианте осуществления настоящее изобретение относится к применению пептидных соединений формулы 3, пригодных для конкурентного модулирования катализа дипептидилпептидазой IV:
где A, B, C, D и Е независимо представляют собой любые аминокислотные части, включая протеиногенные аминокислоты, непротеиногенные аминокислоты, L-аминокислоты и D-аминокислоты, и где Е и/или D могут отсутствовать.
Другие условия, касающиеся формулы (3):
А представляет собой аминокислоту, за исключением D-аминокислоты,
В представляет собой аминокислоту, выбранную из Pro, Ala, Ser, Gly, Hyp, ацетидин-(2)-карбоновой кислоты и пипеколиновой кислоты,
С представляет собой любую аминокислоту, за исключением Pro, Hyp, ацетидин-(2)-карбоновой кислоты, пипеколиновой кислоты, и за исключением N-алкилированных аминокислот, например N-метилвалина и саркозина,
D представляет собой любую аминокислоту или отсутствует,
Е представляет собой любую аминокислоту или отсутствует,
либо:
С представляет собой любую аминокислоту, за исключением Pro, Hyp, ацетидин-(2)-карбоновой кислоты, пипеколиновой кислоты, за исключением N-алкилированных аминокислот, например N-метилвалина и саркозина, и за исключением D-аминокислоты;
D представляет собой любую аминокислоту, выбранную из Pro, Ala, Ser, Gly, Hyp, ацетидин-(2)-карбоновой кислоты и пипеколиновой кислоты,
Е представляет собой любую аминокислоту, за исключением Pro, Hyp, ацетидин-(2)-карбоновой кислоты, пипеколиновой кислоты и за исключением N-алкилированных аминокислот, например N-метилвалина и саркозина.
Примерами аминокислот, которые можно использовать в настоящем изобретении, являются L- и D-аминокислоты, N-метиламинокислоты; алло- и трео-формы Ile и Thr, которые могут, например, представлять собой α-, β- или ω-аминокислоты, из которых предпочтительными являются α-аминокислоты.
Примерами аминокислот в формуле изобретения и описании являются:
аспарагиновая кислота (Asp), глутаминовая кислота (Glu), аргинин (Arg), лизин (Lys), гистидин (His), глицин (Gly), серин (Ser) и цистеин (Cys), треонин (Thr), аспарагин (Asn), глутамин (Gln), тирозин (Tyr), аланин (Ala), пролин (Pro), валин (Val), изолейцин (Ile), лейцин (Leu), метионин (Met), фенилаланин (Phe), триптофан (Trp), гидроксипролин (Hyp), бета-аланин (бета-Ala), 2-аминооктановая кислота (Aoa), азетидин-(2)-карбоновая кислота (Ace), пипеколиновая кислота (Pip), 3-аминопропионовая, 4-аминомасляная и т.п., альфа-аминоизомасляная кислота (Aib), саркозин (Sar), орнитин (Orn), цитрулин (Cit), гомоаргинин (Har), трет-бутилаланин (t-butyl-Ala), трет-бутилглицин (t-butyl-Gly), N-метилизолейцин (N-Melle), фенилглицин (Phg), циклогексилаланин (Cha), норлейцин (Nle), цистеиновая кислота (Cya) и метионинсульфоксид (MSO), ацетил-Lys, модифицированные аминокислоты, такие как фосфорилсерин (Ser(P)), бензилсерин (Ser(Bzl)) и фосфорилтирозин (Tyr(P)), 2-аминомасляная кислота (Abu), аминоэтилцистеин (AECys), карбоксиметилцистеин (Cmc), дегидроаланин (Dha), дегидроамино-2-масляная кислота (Dhb), карбоксиглутаминовая кислота (Gla), гомосерин (Hse), гидроксилизин (Hyl), цис-гидроксипролин (cisHyp), транс-гидроксипролин (transHyp), изовалин (Iva), пироглутаминовая кислота (Pyr), норвалин (Nva), 2-аминобензойная кислота (2-Abz), 3-аминобензойная кислота (3-Abz), 4-аминобензойная кислота (4-Abz), 4-(аминометил)бензойная кислота (Amb), 4-(аминометил)циклогексанкарбоновая кислота (4-Amc), пеницилламин (Pen), 2-амино-4-цианомасляная кислота (Cba), циклоалканкарбоновые кислоты.
Примерами ω-аминокислот являются, например: 5-Ara (аминоралеровая кислота), 6-Ahx (аминогексановая кислота), 8-Aoc (аминооктановая кислота), 9-Anc (аминованоевая кислота), 10-Adc (аминодекановая кислота), 11-Aun (аминоундекановая кислота), 12-Ado (аминододекановая кислота).
Дополнительные аминокислоты следующие: инданилглицин (Igl), индолин-2-карбоновая кислота (Idc), октагидроиндол-2-карбоновая кислота (Oic), диаминопропионовая кислота (Dpr), диаминомасляная кислота (Dbu), нафтилаланин (1-Nal), (2-Nal), 4-аминофенилаланин (Phe(4-NH2)), 4-бензоилфенилаланин (Bpa), дифенилаланин (Dip), 4-бромфенилаланин (Phe(4-Br)), 2-хлорфенилаланин (Phe(2-Cl)), 3-хлорфенилаланин (Phe(3-Cl)), 4-хлорфенилаланин (Phe(4-Cl)), 3,4-хлорфенилаланин (Phe(3,4-Cl2)), 3-фторфенилаланин (Phe(3-F)), 4-фторфенилаланин (Phe(4-F)), 3,4-фторфенилаланин (Phe(3,4-F2)), пентафторфенилаланин (Phe(F5)), 4-гуанидинфенилаланин (Phe(4-guanidino)), гомофенилаланин (hPhe), 3-йодфенилаланин (Phe(3-J)), 4-йодфенилаланин (Phe(4-J)), 4-метилфенилаланин (Phe(4-Ме)), 4-нитрофенилаланин (Phe-4-NO2)), бифенилаланин (Bip), 4-фосфонометилфенилаланин (Pmp), циклогексилглицин (Ghg), 3-пиридинилаланин (3-Pal), 4-пиридинилаланин (4-Pal), 3,4-дигидропролин (A-Pro), 4-кетопролин (Pro(4-keto)), тиопролин (Thz), изонипекотиновая кислота (Inp), 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота (Tic), пропаргилглицин (Pra), 6-гидроксинорлейцин (NU(6-OH), гомотирозин (hTyr), 3-йодтирозин (Tyr(3-J)), 3,5-дийодтирозин (Tyr(3,5-J2)), d-метилтирозин (Tyr(Me)), 3-NO2-тирозин (Tyr(3-NO2)), фосфотирозин (Tyr(PO3H2)), алкилглицин, 1-аминоиндан-1-карбоновая кислота, 2-аминоиндан-2-карбоновая кислота (Aic), 4-аминометилпиррол-2-карбоновая кислота (Py), 4-аминопирролидин-2-карбоновая кислота (Abpc), 2-аминотетралин-2-карбоновая кислота (Atc), диаминоуксусная кислота (Gly(NH2)), диаминомасляная кислота (Dab), 1,3-дигидро-2Н-изоинолкарбоновая кислота (Disc), гомоциклогексилаланин (hCha), гомофенилаланин (hPhe или Hof), транс-3-фенилазетидин-2-карбоновая кислота, 4-фенилпирролидин-2-карбоновая кислота, 5-фенилпирролидин-2-карбоновая кислота, 3-пиридилаланин (3-Pya), 4-пиридилаланин (4-Pya), стирилаланин, тетрагидроизохинолин-1-карбоновая кислота (Tiq), 1,2,3,4-тетрагидроноргарман-3-карбоновая кислота (Tpi), β-(2-тиенил)аланин (Tha).
Другие аминокислотные замены аминокислот, закодированных в генетическом коде, также могут быть включены в пептидные соединения в рамках настоящего изобретения и могут быть классифицированы с помощью указанной общей схемы.
Протеиногенные аминокислоты определяют как натуральные, полученные из белков α-аминокислоты. Непротеиногенные аминокислоты определяют как все остальные аминокислоты, которые не составляют блоки распространенных натуральных белков.
Полученные пептиды можно синтезировать в форме свободной С-концевой кислоты или в форме С-концевого амида. Свободные кислотные пептиды или амиды могут изменяться посредством модификаций боковых цепей. Указанные модификации боковых цепей включают, но не ограничиваются, например, образование гомосерина, образование пироглутаминовой кислоты, образование дисульфидной связи, дезамидирование остатков аспарагина или глутамина, метилирование, трет-бутилирование, трет-бутоксикарбонилирование, 4-метилбензилирование, тиоанизилирование, тиокрезилирование, бенцилоксиметилирование, 4-нитрофенилирование, бенцилоксикарбонилирование, 2-нитробенкоилирование, 2-нитросульфенилирование, 4-толуолсульфонилирование, пентафторфенилирование, дифенилметилирование, 2-хлорбензилоксикарбонилирование, 2,4,5-тихлорфенилирование, 2-бромбензилоксикарбонилирование, 9-фуоренилметилоксикарбонилирование, трифенилметилирование, 2,2,5,7,8-пентаметилхроман-6-сульфонилирование, гидроксилирование, окисление метионина, формилирование, ацетилирование, анизилирование, бенцилирование, бенкоилирование, трифторацетилирование, карбоксилирование аспарагиновой кислоты или глутаминовой кислоты, фосфорилирование, сульфатирование, цистеинилирование, гликозилирование пентозами, дезоксигексозами, гексозаминами, гексозами или N-ацетилгексозаминами, фарнезилирование, миристоолизирование, биотинилирование, пальмитоилирование, стеароилирование, геранилгеранилирование, глутатионилирование, 5'-аденозилирование, АДФ-рибозилирование, модификация с N-гликолилнейраминовой кислотой, N-ацетилнейраминовой кислотой, пиридоксальфосфатом, липоевой кислотой, 4'-фосфопантетеином или N-гидроксисукцинимидом.
В соединениях формулы (3) аминокислотные части A, B, C, D и Е присоединены, соответственно, к соседнему фрагменту амидными связями обычным образом, согласно стандартной номенклатуре, так, что амино-конец (N-конец) аминокислот (пептида) рисуют слева, а карбокси-конец аминокислот (пептида) рисуют справа (С-конец).
Известные пептидные субстраты пролин-специфичной сериновой протеиназы дипептидилпептидазы IV in vitro представляли собой трипептиды Diprotin A (Ile-Pro-Ile), Diprotin B (Val-Pro-Leu), и Diprotin C (Val-Pro-Ile). Установлено, что соединения, описанные в настоящем документе, действуют как субстраты дипептидилпептидазы IV in vivo у млекопитающих, и, в фармакологических дозах, ингибируют физиологический круговорот эндогенных субстратов посредством конкурентного катализа.
Особенно предпочтительные соединения по настоящему изобретению, которые пригодны в качестве модуляторов дипептидилпептидазы IV и DPIV-подобных ферментов, включают такие соединения, которые имеют величины Кi для связывания DPIV, эффективные для ингибирования DPIV in vivo после в/в и/или п/о введения крысам Wistar.
Другие предпочтительные соединения представляют собой пептидилкетоны формулы 4:
где A выбран из:
Х1 представляет собой Н или ацильную или оксикарбонильную группу, включая все аминокислоты и пептидные остатки,
Х2 представляет собой Н, -(CH)n-NH-C5H3N-Y с n = 2-4 или C5H3N-Y (двухвалентный пиридильный остаток), а Y выбран из H, Br, Cl, I, NO2 или CN,
Х3 представляет собой Н или фенильный или пиридильный остаток, незамещенный или замещенный одним, двумя или более остатками алкила, алкоксила, галогена, нитро, циано или карбоксила,
Х4 представляет собой Н или фенильный или пиридильный остаток, незамещенный или замещенный одним, двумя или более остатками алкила, алкоксила, галогена, нитро, циано или карбоксила,
Х5 представляет собой Н или алкильный, алкоксильный или фенильный остаток,
Х6 представляет собой Н или алкильный остаток,
при n = 1
Х выбран из H, OR2, SR2, NR2R3, N+R2R3R4,
где R2 выбран из ацильных остатков, которые являются незамещенными или замещенными одним, двумя или более алкильным, циклоалкильным, арильным или гетероарильным остатками, или выбран из аминокислот и пептидных остатков, или алкильных остатков, которые являются незамещенными или замещены одним, двумя или более алкильным, циклоалкильным, арильным и гетероарильным остатками,
R3 выбран из алкильных и ацильных функциональных групп, где R2 и R3 могут являться частью одной или более кольцевых структур насыщенных и ненасыщенных карбоциклических или гетероциклических структур,
R4 выбран из алкильных остатков, где R2 и R4 или R3 и R4 могут являться частью одной или более кольцевых структур насыщенных и ненасыщенных карбоциклических или гетероциклических структур,
при n = 0
Х выбран из
где В представляет собой: O, S, NR5, где R5 представляет собой Н, алкилиден или ацил,
C, D, E, F, G, H независимо выбраны из ненасыщенных и насыщенных алкильных, оксиалкильных, тиоалкильных, аминоалкильных, карбонилалкильных, ацильных, карбамоильных, арильных и гетероарильных остатков;
при n = 0 и n = 1
Z выбран из Н, или алкильного остатка с разветвленной или неразветвленной цепью из С1-С9, или алкенильного остатка с разветвленной или одинарной цепью из С2-С9,циклоалкильного остатка из С3-С8, циклоалкенильного остатка из С5-С7, арильного или гетероарильного остатка, или боковой цепи, выбранной из всех боковых цепей всех натуральных аминокислот или их производных.
Кроме того, согласно настоящему изобретению, соединения формул 5, 6, 7, 8, 9, 10 и 11, включая все их стереоизомеры и фармацевтически приемлемые соли, описаны и могут применяться:
где R1 представляет собой Н, разветвленный или линейный С1-С9 алкильный остаток, разветвленный или линейный С2-С9 алкенильный остаток, С3-С8 циклоалкильный, С5-С7 циклоалкенильный, арильный или гетероарильный остаток или боковую цепь натуральной аминокислоты или ее производного,
R3 и R4 выбраны из Н, гидроксила, алкила, алкокси, нитро, циано или галогена,
А представляет собой Н или изостеру карбоновой кислоты, такой как функциональная группа, выбранная из CN, SO3H, CONHOH, PO3R5R6, тетразола, амида, сложного эфира, ангидрида, тиазола и имидазола,
В выбран из
где R5 представляет собой Н, -(CH)n-NH-C5H3N-Y c n = 2-4 и C5H3N