Производные 1н-имидазола, обладающие cb1 -агонистической, частичной cb1-агонистической или cb1-антагонистической активностью
Иллюстрации
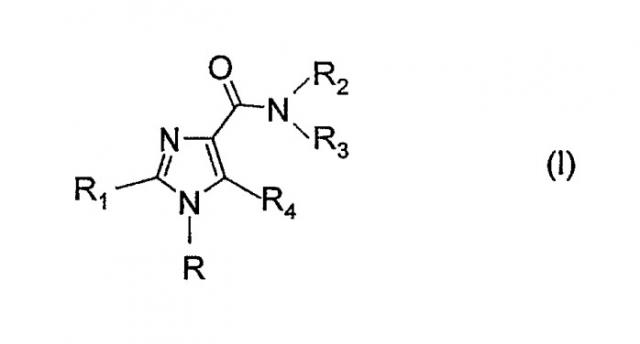
Показать всеОписываются производные 1Н-имидазол-4-карбоксамида формулы (I):
где R представляет собой фенил, 2-пиридинил, 3-пиридинил, возможно замещенные; R1 обозначает фенил, 5-членное ароматическое гетероциклическое кольцо с одним гетероатомом N, возможно замещенные; R2 обозначает Н, C1-8-алкил; R3 представляет собой С2-8-алкил, C1-8-алкокси, С3-8-циклоалкил, бензильную группу, ароматическое кольцо, возможно замещенные; R4 обозначает атом водорода или галогена, цианогруппу, сульфамоил, метансульфонил, метилсульфанил или C1-4-алкил. Описываются также способы получения таких соединений, фармацевтические композиции. Производные 1H-имидазол-4-карбоксамида являются эффективными агонистами, частичными агонистами или антагонистами каннабиноидных CB1-рецепторов, которые могут быть полезны при лечении психических и неврологических заболеваний, а также других заболеваний, вовлекающих каннабиноидную нейротрансмиссию. 9 н. и 2 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к группе новых производных 1Н-имидазола, к способам получения таких соединений и к фармацевтическим композициям, содержащим одно или несколько таких соединений в качестве активного компонента.
Такие производные 1Н-имидазола являются эффективными агонистами, частичными агонистами или антагонистами каннабиноидных СВ1 рецепторов, которые полезны при лечении психических и неврологических заболеваний, а также других заболеваний, включающих каннабиноидную нейротрансмиссию.
Каннабиноиды присутствуют в индийской конопле Cannabis sativa и веками используются в качестве лекарственных средств (Mechoulam R., Feigenbaum J.J., Prog. Med. Chem., 1987, 24, 159). Однако только в последние десять лет исследования в области каннабиноидов выявили основную информацию по каннабиноидным рецепторам и их (эндогенным) агонистам и антагонистам. Открытие и последующее клонирование двух различных подтипов каннабиноидных рецепторов (СВ1 и СВ2) стимулировало поиск новых антагонистов каннабиноидных рецепторов (Munro S., et al. Nature, 1993, 365, 61; Matsuda L.A, Bonner T.I. Cannabinoid Receptors, Pertwee, R.G., Ed., 1995, 117, Academic Press, London). Кроме того, фармацевтические компании заинтересовались разработкой каннабиноидных лекарственных средств для лечения заболеваний, связанных с нарушениями каннабиноидной системы (Consroe P. Neurobiology of Disease, 1998, 5, 534; Pop E. Curr. Opin. In CPNS Investigational Drugs, 1999, 1, 587; Greenberg, D.A. Drug News Perspect., 1999, 12, 458; Pertwee R.G. Progress in Neurobiology, 2001, 63, 569). В настоящее время известно несколько антагонистов СВ1 рецепторов. Sanofi описывает их диарилпиразольные аналоги в качестве селективных антагонистов СВ1 рецепторов. Типичным примером является SR-141716А (Dutta A.K. et al. Med. Chem. Res., 1994, 5, 54; Lan R. et al., J. Med. Chem., 1999, 42, 769; Nakamura-Palacios E.M et al., CNS Drug Rev., 1999, 5, 43). CP-272871 представляет собой производное пиразола, подобное SR-141716А, но менее эффективное и менее селективное к СВ1 подтипу рецептора, чем SR-141716А (Meschler J.P. et al., Biochem. Pharmacol. 2000, 60, 1315). В качестве антагонистов СВ1 рецепторов открыты аминоалкилиндолы. Типичным примером является йодопровадолин (АМ-630), который представлен в 1995. АМ-630 является умеренно активным антагонистом СВ1 рецепторов, проявляя себя при некоторых оценках как слабый частичный агонист (Hosohata K., et al., Life Sc., 1997, 61, PL115). Ученые фирмы Eli Lilly описали арил-ароилзамещенные бензофураны в качестве селективных антагонистов СВ1 рецепторов (например, LY-320135) (Felder C.C., et al., J. Pharmacol. Exp., Ther., 1998, 284, 291). 3-Алкил-5,5'-дифенилимидазолидин-дионы описаны в качестве лигандов каннабиноидных рецепторов, которые, как указывается, являются каннабиноидными антагонистами (Kanyonyo M., et al., Biorg. Med. Chem. Lett., 1999, 9, 2233). Aventis Pharma заявлены аналоги диарилметиленазетидина в качестве антагонистов СВ1 рецепторов (Mignani S., et al., патент Франции FR 2783246, 2000; Chem. Abstr., 2000, 132, 236982). Трициклические пиразолы заявлены фирмой Sanofi-Synthelabo в качестве антагонистов СВ1 рецепторов (Barth F., et al., патент WO 0132663, 2001; Chem. Abstr., 2001, 134, 340504). Интересно, что многие антагонисты СВ1 рецепторов, как было сообщено, ведут себя как обратимые агонисты in vitro (Landsman, R.S., et al., Eur. J. Pharmacol., 1997, 334, R1). Пиразольные каннабиноиды также представлены как частичные агонисты СВ1 рецепторов, проявляя in vivo каннабимиметические эффекты (Willey J.L., et al., J. Pharmacol. Exp. Ther., 2001, 296, 1013). Известен ряд классов агонистов СВ1 рецепторов, таких как, например, классические каннабиноиды (например, Δ9-ТНС), неклассические каннабиноиды, аминоалкилиндолы и эйкозаноиды (например, анандамид). Обзоры дают прекрасные общие сведения по исследованию в области каннабиноидов (Mechoulam R., et al., Prog. Med. Chem., 1998, 35, 199; Lambert D.M. Curr. Med. Chem., 1999, 6, 635; Mechoulam R., et al., Eur. J. Pharmacol., 1998, 359, 1; Williamson E.M., Evans F. J. Drugs, 2000, 60, 1303; Pertwee R., G., Addiction Biology, 2000, 5, 37; Robson P. Br. J. Psychiatry, 2001, 178, 107; Pertwee R.G. Prog. Neurobiol., 2001, 63, 569; Goya Р. and Jagerovic N. Exp. Opin. Ther. Patents 2000, 10, 1529; Pertwee R.G., Gut, 2001, 48, 859).
В настоящее время неожиданно было установлено, что новые производные 1Н-имидазола формулы (I), их пролекарства и соли являются эффективными агонистами, частичными агонистами или антагонистами на каннабиноидных-СВ1 рецепторах:
где
- R представляет собой фенил, тиенил, 2-пиридинил, 3-пиридинил, 4-пиридинил, пиримидинил, пиразинил, пиридазинил или триазинил, и эти группы могут быть замещены 1, 2, 3 или 4 заместителями Y, которые могут быть одинаковыми или разными, из группы, включающей С1-3-алкил или алкоксигруппу, гидроксигруппу, атом галогена, трифторметил, трифторметилтио, трифторметокси, нитро, амино, моно- или диалкил-(С1-2)-амино, моно- или диалкил-(С1-2)-амидогруппу, (С1-3)-алкоксикарбонил, карбоксил, цианогруппу, карбамоил и ацетил, или R представляет собой нафтил, при условии, что, когда R представляет собой 4-пиридинил, R4 представляет собой атом галогена или цианогруппу, карбамоил, формил, ацетил, трифторацетил, фторацетил, пропионил, сульфамоил, метансульфонил, метилсульфанил или разветвленную или неразветвленную С1-4-алкильную группу, и эта С1-4-алкильная группа может быть замещена 1-3 атомами фтора или атомами брома, хлора, йода, цианогруппой или гидроксильной группой,
- R1 представляет собой фенил или пиридинил, и эти группы могут быть замещены 1-4 заместителями Y, которые могут быть одинаковыми или разными, где Y имеет упомянутые выше значения, или R1 представляет собой пиримидинил, пиразинил, пиридазинил или триазинил, и эти группы могут быть замещены 1-2 заместителями Y, которые могут быть одинаковыми или разными, или R1 представляет собой пятичленное ароматическое гетероциклическое кольцо, содержащее один или два гетероатома из группы (N, O, S), и эти гетероатомы могут быть одинаковыми или разными, и это пятичленное ароматическое гетероциклическое кольцо может быть замещено 1-2 заместителями Y, которые могут быть одинаковыми или разными, или R1 представляет собой нафтил;
- R2 представляет собой Н, разветвленный или неразветвленный С1-8-алкил, С3-8-циклоалкил, С3-8-алкенил, С5-8-циклоалкенил, и эти группы могут содержать атом серы, кислорода или азота;
- R3 представляет собой разветвленный или неразветвленный C2-8-алкил, C1-8-алкокси, C5-8-циклоалкилоксигруппу, C3-8-циклоалкил, C5-10-бициклоалкил, C6-10-трициклоалкил, C3-8-алкенил, C5-8-циклоалкенил, и эти группы могут необязательно содержать один или несколько гетероатомов из группы (O, N, S), и эти группы могут быть замещены гидроксильной группой или 1-2 C1-3-алкильными группами или 1-3 атомами фтора, или R3 представляет собой бензильную или фенетильную группу, ароматические кольца которых могут быть замещены 1-5 заместителями Z, которые могут быть одинаковыми или разными, из группы, включающей C1-3-алкил или алкоксигруппу, гидроксигруппу, атом галогена, трифторметил, трифторметилтио, трифторметокси, нитро, амино, моно- или диалкил-(С1-2)-аминогруппу, моно- или диалкил-(С1-2)-амидогруппу, (С1-3)-алкилсульфонил, диметилсульфамидогруппу, (С1-3)-алкоксикарбонил, карбоксил, трифторметилсульфонил, цианогруппу, карбамоил, сульфамоил и ацетил, или R3 представляет собой фенильную или пиридинильную группу, и эти группы замещены 1-4 заместителями Z, где Z имеет значения, указанные выше,
или R3 представляет собой пиридинильную группу, или R3 представляет собой фенильную группу, при условии, что R4 представляет собой атом галогена или цианогруппу, карбамоил, формил, ацетил, трифторацетил, фторацетил, пропионил, сульфамоил, метансульфонил, метилсульфанил или С1-4-алкильную группу, и эта С1-4-алкильная группа может быть замещена 1-3 атомами фтора или атомами брома, хлора, йода, циано или гидроксильной группой,
или R3 представляет собой группу NR5R6 при условии, что R2 представляет собой атом водорода или метильную группу, где
- R5 и R6 являются одинаковыми или разными и представляют собой разветвленный или неразветвленный С1-4-алкил, или R5 и R6 вместе с атомом азота, с которым они связаны, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую гетероциклическую группу, содержащую от 4 до 10 атомов в цикле, и эта гетероциклическая группу содержит один или два гетероатома из группы (N, O, S), и эти гетероатомы могут быть одинаковыми или разными, причем указанные гетероциклические группы могут быть замещены С1-3-алкильной группой или гидроксильной группой, или R2 и R3 вместе с атомом азота, с которым они связаны, образуют насыщенную или ненасыщенную, гетероциклическую группу, содержащую от 4 до 10 атомов в цикле, и эта гетероциклическая группа содержит один или два гетероатома из группы (N, O, S), и эти гетероатомы могут быть одинаковыми или разными, причем указанные гетероциклические группы могут быть замещены С1-3-алкильной группой или гидроксильной группой,
- R4 представляет собой атом водорода или галогена, или цианогруппу, карбамоил, формил, ацетил, трифторацетил, фторацетил, пропионил, сульфамоил, метансульфонил, метилсульфанил или разветвленную или неразветвленную С1-4-алкильную группу, и эта С1-4-алкильная группа может быть замещена 1-3 атомами фтора или атомами брома, хлора, йода, циано или гидроксильной группой.
Благодаря высокой СВ1 агонистической, частичной агонистической или антагонистической активности соединения в соответствии с настоящим изобретением могут быть использованы при лечении психических заболеваний, таких как психоз, страх, депрессия, дефицит внимания, расстройства памяти, расстройства познавательной способности, нарушения аппетита, ожирение, пагубные привычки, влечение, лекарственная зависимость, и неврологические заболевания, такие как нейродегенеративные заболевания, слобоумие, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое поражение мозга, апоплексический удар, болезнь Паркинсона, болезнь Альцгеймера, заболевание Хантингтона, синдром Tourette, церебральная ишемия, церебральная апоплексия, черепно-мозговая травма, повреждение спинного мозга, нейровоспалительные заболевания, тромбосклероз, вирусный энцефалит, расстройства, связанные с демиелинизацией, а также для лечения болезненных нарушений, включая невропатические болезненные расстройства, и другие заболевания, вовлекающие каннабиноидную нейротрансмиссию, в том числе для лечения септического шока, глаукомы, диабета, рака, рвоты, тошноты, желудочно-кишечных расстройств, язвы желудка, диареи и сердечно-сосудистых заболеваний.
Сродство соединений настоящего изобретения к каннабиноидным СВ1 рецепторам определяют с использованием препаратов мембран клеток яичников китайского хомячка (Chinese hamster ovary, СНО), в которые стабильно трансфецирован человеческий каннабиноидный СВ1 рецептор в конъюгации с [3H]CP-55,940 в качестве радиолиганда. После выдерживания только что приготовленного препарата клеточных мембран с [3H]-лигандом с добавлением или без добавления соединений настоящего изобретения проводят отделение связанного и свободного лиганда путем фильтрации через стекловолоконные фильтры. Радиоактивность на фильтре измеряют с помощью жидкостного сцинтилляционного счетчика.
Каннабиноидную СВ1 антагонистическую активность соединений настоящего изобретения определяют с помощью функциональных исследований с использованием СНО-клеток, в которые устойчиво экспрессированы человеческие каннабиноидные СВ1 рецепторы. Аденилилциклазу стимулируют с использованием форсколина и определяют количество накопленного циклического АМФ. Сопутствующая активация СВ1 рецепторов с помощью агонистов СВ1 рецепторов (например, СР-55940 или (R)-WIN-55212-2) может ослабить индуцированное форсколином накопление цАМФ зависимым от концентрации образом. Такая опосредуемая СВ1 рецептором реакция может быть подавлена с помощью антагонистов СВ1 рецепторов, таких как соединения настоящего изобретения.
Каннабиноидная агонистическая активность соединений настоящего изобретения с неполной агонистической активностью может быть определена в соответствии с опубликованными способами, такими как оценка in vivo каннабимиметических эффектов (Wiley J.L., et al., J.Pharmacol. Exp. Ther. 2001, 296, 1013).
Изобретение относится как к рацематам, смесям диастереоизомеров, так и к индивидуальным стереоизомерам соединений, имеющих формулу (I).
Соединения настоящего изобретения могут быть переведены в формы, подходящие для введения, с помощью обычных процессов с использованием вспомогательных веществ и/или жидких или твердых носителей.
Подходящими схемами синтеза соединений настоящего изобретения являются следующие.
Схема синтеза А
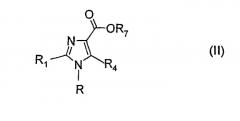
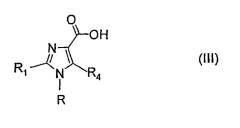
Стадия 1: гидролиз сложного эфира соединения формулы (II), где R7 представляет собой разветвленную или неразветвленную алкильную группу (С1-4) или бензильную группу:
Эта реакция дает соединение, имеющее формулу (III):
где R, R1 и R4 имеют значения, определенные выше.
Промежуточные соединения, имеющие формулу (II), где R7 представляет собой разветвленную или неразветвленную алкильную (С1-4) группу или бензильную группу, могут быть получены в соответствии с известными способами, например:
а) I.K. Khanna et al., J. Med. Chem. 2000, 43, 3168-3185;
b) N. Kudo et al., Chem. Pharm. Bull. 1999, 47, 857-868;
c) K. Tsuji et al., Chem. Pharm. Bull. 1997, 45, 987-995;
d) I.K. Khanna et al., J. Med. Chem. 1997, 40, 1634-1647;
e) M. Guillemet et al., Tetrahedron Lett. 1995, 36, 547-548.
Стадия 2: взаимодействие соединения, имеющего формулу (III), с соединением, имеющим формулу R2R3NH, где заместители R2 и R3 имеют значения, которые представлены выше, посредством методов активации и сочетания, такие как образование активного сложного эфира, или в присутствии сочетающих реагентов, таких как DCC, HBTU, BOP или аналогичные реагенты. Эта реакция приводит к желаемому производному 1Н-имидазола формулы (I).
(Информацию по методам активации и сочетания см.: M. Bodanszky and A. Bodanszky: The Practice of Peptide Synthesis, Springer-Verlag, New-York, 1994; ISBN: 0-387-57505-7).
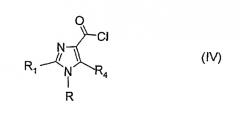
С другой стороны, соединение, имеющее формулу (III), вводят в реакцию с галогенирующим агентом, например, тионилхлоридом (SO2Cl). Эта реакция приводит к соответствующему карбонилхлориду (IV).
Реакция соединения, имеющего формулу (IV), с соединением, имеющим формулу R2R3NH, где заместители R2 и R3 имеют определенные выше значения, дает производное 1Н-имидазола, имеющего формулу (I). Эту реакцию предпочтительно проводят в присутствии органического основания, такого как, например, диизопропилэтиламин (DIPEA) или триэтиламин.
С другой стороны, соединение, имеющее формулу (II), взаимодействует в условиях реакции амидирования с соединением формулы R2R3NH, где заместители R2 и R3 имеют определенные выше значения, с получением производного 1Н-имидазола, имеющего формулу (I).
Схема синтеза В
Взаимодействие соединения, имеющего формулу (II), где заместитель R4 представляет собой атом водорода и где заместители R, R1 и R7 имеют значения, определенные выше для соединения (II), с соединением, имеющим общую формулу R4'-X, где Х представляет собой уходящую группу, а R4' представляет собой С1-4-алкильную группу, и эта алкильная группа может быть замещена 1-3 атомами фтора, или где R4' представляет собой цианогруппу, формильный, ацетильный, трифторацетильный, фторацетильный, метилсульфанильный или пропионильный остаток, или атом галогена. Эту реакцию проводят в присутствии сильного не нуклеофильного основания, такого как диизопропиламид лития (LDA), предпочтительно в безводных условиях в инертном органическом растворителе, например тетрагидрофуране, и получают соединение, имеющее формулу (II):
где заместители R, R1 и R7 имеют значения, определенные выше, и заместитель R4 представляет собой С1-4-алкильную группу, и эта алкильная группа может быть замещена с 1-3 атомами фтора, или где заместитель R4 представляет собой цианогруппу, формильную, ацетильную, трифторацетильную, фторацетильную, метилсульфанильную или пропионильную группу, или атом галогена.
Соединения общей формулы (II), которые получены в соответствии со схемой синтеза В, могут быть превращены в соединения общей формулы (I) аналогично методике, описанной в схеме синтеза А, стадия 1 схемы А или стадия 2 схемы А (см. выше).
Схема синтеза С
Соединения, имеющие формулу (II):
где заместитель R4 представляет собой разветвленную или неразветвленную С1-4-алкильную группу, и эта С1-4-алкильная группа может быть замещена 1-3 атомами фтора, и где заместители R, R1 имеют значения, определенные выше, а заместитель R7 представляет собой разветвленную или неразветвленную алкильную группу (С1-4) или бензильную группу, могут быть синтезированы при взаимодействии соединения, имеющего формулу (V) или его таутомера:
где заместители R и R1 имеют определенные выше значения, с соединением, имеющим формулу (VI):
где заместитель R4 представляет собой разветвленную или неразветвленную С1-4-алкильную группу, и эта С1-4-алкильная группа может быть замещена 1-3 атомами фтора, а заместитель R8 представляет собой уходящую группу, например атом брома, и заместитель R7 представляет собой разветвленную или неразветвленную алкильную группу (С1-4) или бензильную группу. Реакцию предпочтительно проводят в органическом растворителе, например в 2-пропаноле или в N-метил-2-пирролидиноне (NМП). Добавление кислоты типа трифторуксусной кислоты (ТФУК) во время реакции может увеличить образование соединений, имеющих формулу (II).
(Более подробную информацию по уходящим группам см.: M.B. Smith, J. March, Advanced organic Chemistry, p. 275, 5-th ed., (2001), John Wiley and Sons, New York. ISBN: 0-471-58589-0).
Соединения общей формулы (II), которые могут быть получены в соответствии со схемой синтеза С, могут быть превращены в соединения общей формулы (I) аналогично методике, описанной в схеме синтеза А, стадия 1 схемы А или стадия 2 схемы А (см. выше).
Соединения настоящего изобретения, имеющие формулу (VI), могут быть получены в соответствии с известными способами, например: P.Seifert et al., Helv. Chem. Acta, 1950, 33, 725.
Схема синтеза D
Взаимодействие соединения, имеющего формулу (II):
где заместитель R4 представляет собой метильную группу и заместители R, R1 имеют определенные выше значения, а заместитель R7 представляет собой разветвленную или неразветвленную алкильную группу (С1-4) или бензильную группу, с региоселективным бромирующим соединением, таким как N-бромсукцинимид (NBS), в органическом растворителе, таком как CCl4, в присутствии свободно-радикального ингибитора типа перекиси дибензоила, дает соединение формулы (VII):
где заместители R, R1 и R7 имеют определенные выше значения. Взаимодействие соединения, имеющего формулу (VII) (аналогично способу, описанному в работе Mathews, W.B., et al., J. Label. Compds. Radiopharm., 1999, 42, 589), например, с KCl, KI, KF или KCN дает соединение формулы (VIII):
где заместители R, R1 и R7 имеют определенные выше значения, а Nu представляет собой атомы хлора, йода, фтора или цианогруппу. Реакцию предпочтительно проводят в присутствии слабого основания типа NaHCO3 или в присутствии краун-эфира или криптанда (Более подробную информацию по краун-эфирам и криптандам см.: M.B. Smith and J. March, Advanced organic Chemistry, p. 105, 5th ed. (2001), John Wiley & Sons, New York. ISBN: 0-471-58589-0).
Соединения общих формул (VII) или (VIII), которые получены в соответствии со схемой синтеза D, могут быть превращены в соединения общей формулы (I) аналогично методике, описанной в схеме синтеза А, стадия 1 схемы А или стадия 2 схемы А (см. выше).
Пример 1
Часть А: К 1М раствору бис(триметилсилил)амида натрия в ТГФ (70 мл) добавляют по каплям раствор 4-хлоранилина (8,86 г, 69,5 ммоль) в безводном ТГФ в атмосфере азота. После перемешивания смеси в течение 20 мин добавляют раствор 2,4-дихлорбензонитрила (12 г, 70 ммоль) в ТГФ. Полученную смесь перемешивают в течение ночи, выливают в смесь лед-вода (400 мл) и экстрагируют дихлорметаном, сушат над Na2SO4 и концентрируют в вакууме. Получают желтое масло (15,7 г). Кристаллизация из смеси дихлорметан/гептан и последующая промывка метил-трет.-бутиловым эфиром дает N-(4-хлорфенил)-2,4-дихлорбензолкарбоксамидин (8,66 г, выход 42%) в виде желтого твердого вещества. Температура плавления (Т.пл.): 93-95°С.
Аналогично получен:
N-(4-бромфенил)-2,4-дихлорбензолкарбоксамидин. Т.пл.: 117-119°С.
Часть В: Смесь N-(4-хлорфенил)-2,4-дихлорбензолкарбоксамидина (2,00 г, 6,68 ммоль), этил-3-бром-2-оксопропаноата (2,65 г, 13,6 ммоль) и NaHCO3 (1,12 г, 13,3 ммоль) в 2-пропаноле перемешивают при температуре кипения с обратным холодильником в течение 20 ч. После охлаждения до комнатной температуры смесь концентрируют в вакууме и остаток суспендируют в дихлорметане, промывают водой (3×50 мл) и рассолом (3×50 мл). Водные слои экстрагируют дихлорметаном. Объединенные органические слои сушат над Na2SO4 и концентрируют в вакууме, получают сырой коричневый продукт (2,0 г). Этот продукт дополнительно очищают колоночной хроматографией (силикагель, гептан/EtOAc = 90/10 (об./об.)), получают этил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксилат (0,759 г, выход 29%) в виде желтого мала, которое медленно отверждается при стоянии. Температура плавления: 150-152°С; МС: 395 (МН+). 1H-ЯМР (400 МГц, CDCl3): δ 7,91 (с, 1Н), 7,49 (дд, J=8 Гц, J=2 Гц, 1Н), 7,29-7,36 (м, 4Н), 7,07 (дт, J=8 Гц, J=2 Гц, 2Н), 4,44 (кв, J=7 Гц, 2Н), 1,42 (т, J=7 Гц, 3Н).
Часть С: Этил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксилат (0,810 г, 2,06 ммоль) и LiOH (0,173 г, 7,20 ммоль) растворяют в смеси Н2О/ТГФ (20 мл/20 мл) и перемешивают при 50°С в течение 16 ч. Смесь концентрируют в вакууме, получают 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоновую кислоту. Добавляют тионилхлорид (60 мл), смесь нагревают при кипении с обратным холодильником 1 ч и концентрируют в вакууме, получают сырой 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбонилхлорид.
Часть D: Сырой 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбонилхлорид (919 мг, ˜2,39 ммоль), 1-аминопиперидин (0,469 г, 4,69 ммоль) и триэтиламин (0,363 г, 3,59 ммоль) растворяют в дихлорметане и перемешивают 1 ч при комнатной температуре. Смесь промывают насыщенным водным раствором NaHCO3 (3×20 мл), сушат над Na2SO4 и концентрируют в вакууме, дополнительно очищают колоночной хроматографией (этилацетат, силикагель), получают 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид (356 мг, выход 26% из расчета на этил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксилат). Масс-спектр (МС): 449.
Аналогично получены:
2. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(пирролидин-1-ил)-1Н-имидазол-4-карбоксамид. МС: 435.
3. N-(трет.-бутокси)-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксамид. МС: 438.
4. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-фенил-1Н-имидазол-4-карбоксамид. МС: 442.
5. 1-(4-хлорфенил)-N-циклогексил-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксамид. МС: 448.
6. N-(бензил)-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-метил-1Н-имидазол-4-карбоксамид. МС: 470.
7. 1-[1-(4-хлорфенил)-2-(2,4-дихлорфенил)-4-(1Н-имидазолил)карбонил]гексагидро-1Н-азепин. МС: 448.
8. 2-(4-хлорфенил)-1-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид (получен из 2,4-дихлоранилина и 4-хлорбензонитрила). МС: 449.
9. N-(трет.-бутокси)-2-(4-хлорфенил)-1-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксамид (получен из 2,4-дихлоранилина и 4-хлорбензонитрила). МС: 438.
Пример 10
Часть А: Диизопропиламин (2,30 г, 22,8 ммоль) добавляют по каплям к безводному ТГФ (100 мл) в атмосфере азота при 0°С. По каплям добавляют н-BuLi (7,34 мл, 2,5 М раствор в гексане, 18,4 ммоль). Полученный раствор охлаждают до -78°С. По каплям добавляют раствор этил-2-(4-хлорфенил)-1-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксилата (6,0 г, 15,2 ммоль) в безводном ТГФ. Цвет смеси меняется от желтого до фиолетово-коричневого. Смесь при перемешивании нагревают до -40°С и охлаждают до -78°С, оставляют на 30 мин. По каплям добавляют метилйодид (6,44 г, 45,4 ммоль) и полученный раствор перемешивают в течение 30 мин при -78°С, а затем оставляют до достижения комнатной температуры. Полученный раствор гасят водным раствором NH4Cl, добавляют диэтиловый эфир и органический слой сушат над MgSO4, фильтруют и концентрируют в вакууме, получают масло (6,4 г). Полученное масло очищают колоночной хроматографией (толуол/EtOAc = 10/2 (об./об.), силикагель), получают чистый этил-2-(4-хлорфенил)-1-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбоксилат (5,3 г, выход 85%) в виде желтого масла.
Часть В: Этил-2-(4-хлорфенил)-1-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбоксилат (0,250 г, 0,61 ммоль) и LiOH (0,052 г, 2,17 ммоль) растворяют в смеси Н2О/ТГФ (1:1 (об./об.); 50 мл) и перемешивают при 50°С в течение одного часа. Смесь концентрируют, получают сырую 2-(4-хлорфенил)-1-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбоновую кислоту. К полученной смеси добавляют SOCl2 (50 мл) и полученную смесь кипятят с обратным холодильником 1 ч. Смесь концентрируют, получают 2-(4-хлорфенил)-1-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбонилхлорид.
Часть С: 2-(4-Хлорфенил)-1-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбонилхлорид (1,5 г, 3,75 ммоль), 1-аминопиперидин (0,725 г, 7,25 ммоль) и триэтиламин (0,549, 5,44 ммоль) растворяют в дихлорметане и перемешивают 1 ч при комнатной температуре. Смесь промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют в вакууме, дополнительно очищают колоночной хроматографией (гептан/этилацетат = 1/1 (об./об.), силикагель), получают 2-(4-хлорфенил)-1-(2,4-дихлорфенил)-5-метил-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид (0,220 г, выход 13%) в виде белой пены. МС: 463.
Аналогично получены:
11. N-(трет.-бутокси)-2-(4-хлорфенил)-1-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбоксамид. МС: 452.
12. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-метил-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. МС: 463. Температура плавления: 165-167°С.
13. N-(трет.-бутокси)-2-(2,4-дихлорфенил)-1-(4-хлорфенил)-5-метил-1Н-имидазол-4-карбоксамид. МС: 452.
14. N-(трет.-бутокси)-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-этил-1Н-имидазол-4-карбоксамид. Аморфный продукт. МС: 468.
15. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-этил-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. МС: 477.
16. 1-(4-бромфенил)-N-(трет.-бутокси)-2-(2,4-дихлорфенил)-5-метил-1Н-имидазол-4-карбоксамид. Аморфный продукт.
17. 1-(4-бромфенил)-2-(2,4-дихлорфенил)-5-метил-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Т.пл.: >204°С; ТСХ (силикагель, EtOAc); Rf = 0,3.
18. 1-(4-бромфенил)-N-(трет.-бутокси)-2-(2,4-дихлорфенил)-5-этил-1Н-имидазол-4-карбоксамид. Аморфный продукт; ТСХ (силикагель, СН2Cl2/ацетон = 9/1 (об./об.)): Rf = 0,45.
19. 1-(4-бромфенил)-2-(2,4-дихлорфенил)-5-этил-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Т.пл.: >140°С; ТСХ (силикагель, EtOAc); Rf = 0,4.
20. 1-(4-бромфенил)-N-циклогексил-2-(2,4-дихлорфенил)-5-этил-1Н-имидазол-4-карбоксамид. Температура плавления: >135-140°С.
21. 1-(4-бромфенил)-2-(2,4-дихлорфенил)-5-этил-N-(н.-пентил)-1Н-имидазол-4-карбоксамид. Сироп. ТСХ (силикагель, СН2Cl2/ацетон = 19/1, (об./об.)); Rf = 0,4.
Пример 22
Часть А: К раствору этил-1-(4-бромфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксилата (6,10 г, 0,0139 моль) в ТГФ (70 мл) при перемешивании добавляют LiOH (0,67 г, 0,0278 моль) и воду (70 мл). Полученную смесь перемешивают 16 ч при 50°С, получают прозрачный раствор. После охлаждения до комнатной температуры добавляют HCl (1 н. раствор, 28 мл), получают маслянистый осадок, который полностью затвердевает по окончании перемешивания и при добавлении воды (70 мл). Осадок отфильтровывают, промывают водой и сушат в вакууме, получают 1-(4-бромфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоновую кислоту (4,92 г, выход 86%). Температура плавления: 138-142°С.
Часть В: К суспензии 1-(4-бромфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоновой кислоты (1,23 г, 2,99 ммоль) в сухом ацетоне (40 мл) при перемешивании последовательно добавляют диизопропилэтиламин (ДИПЭА) (1,15 мл, 6,6 ммоль), О-бензотриазол-1-ил-N,N,N',N'-тетраметилуронийгексафторфосфат (HBTU) (1,36 г, 3,6 ммоль) и 1-аминопиперидин (0,39 мл, 3,6 ммоль). После перемешивания в течение 16 ч полученную смесь концентрируют в вакууме. Остаток растворяют в этилацетате и добавляют водный раствор NaHCO3. Собирают этилацетатный слой, промывают водой и рассолом, сушат над Na2SO4, фильтруют и концентрируют с получением сырого твердого вещества. Полученное твердое вещество перекристаллизовывают из ацетонитрила, получают 1-(4-бромфенил)-2-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид (830 мг, выход 56%). Температура плавления: 219-221°С.
Аналогично получены:
23. N-(трет.-бутокси)-1-(4-бромфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксамид. Аморфный продукт. ТСХ (силикагель, Et2O); Rf = 0,3.
24. 1-(4-бромфенил)-2-(2,4-дихлорфенил)-N-(пирролидин-1-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 238-240°С.
25. N-(азепан-1-ил)-1-(4-бромфенил)-2-(2,4-дихлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 201-204°С.
26. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(гексагидроциклопента[с]пиррол-2(1Н)-ил)-1Н-имидазол-4-карбоксамид. МС: 475.
27. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-(4-фторбензил)-1Н-имидазол-4-карбоксамид. МС: 474.
28. 1-(4-хлорфенил)-2-(2-метокси-4-хлорфенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 220°С.
29. 1-(4-хлорфенил)-N-циклогексил-2-(2-метокси-4-хлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 177-179°С.
30. 1-(4-хлорфенил)-2-(2-фтор-4-хлорфенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 217-218°С.
31. 2-(2,4-дихлорфенил)-1-(4-фторфенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 175-176°С.
32. N-циклогексил-2-(2,4-дихлорфенил)-1-(4-фторфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 184-185°С.
33. N-циклогексил-2-(2-фтор-4-хлорфенил)-1-(4-хлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 157-159°С.
34. 1-(4-хлорфенил)-2-(2-метокси-4-хлорфенил)-N-(н.-пентил)-1Н-имидазол-4-карбоксамид. Температура плавления: 115°С.
35. 2-(2,4-дихлорфенил)-1-(4-метоксифенил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 178-179°С.
36. N-циклогексил-2-(2,4-дихлорфенил)-1-(4-метоксифенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 175-176°С.
37. 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N,N-диэтил-1Н-имидазол-4-карбоксамид. Температура плавления: 177-179°С.
38. 1-(4-хлорфенил)-N-циклогексил-2-(2-трифторметил-4-хлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 172°С.
39. 1-(4-хлорфенил)-N-(пиперидин-1-ил)-2-(2-трифторметил-4-хлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 219°С.
40. N-(1-адамантил)-1-(4-хлорфенил)-2-(2-трифторметил-4-хлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 288°С.
41. 1-(4-хлорфенил)-N-(2,2,2-трифторэтил)-2-(2-трифторметил-4-хлорфенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 149°С.
42. 2-(2,4-дихлорфенил)-1-(пиридин-3-ил)-N-(пиперидин-1-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 165-170°С.
43. N-циклогексил-2-(2,4-дихлорфенил)-(1-пиридин-3-ил)-1Н-имидазол-4-карбоксамид. Температура плавления: 195°С.
44. 2-(2,4-дихлорфенил)-(1-пиридин-3-ил)-N-(н.-пентил)-1Н-имидазол-4-карбоксамид. Температура плавления: 117°С.
Пример 45
Часть А: Растворяют 2,4-дихлорбензоилхлорид (40,0 г, 0,19 моль) в тетрагидрофуране (1 л). Затем к полученному раствору при перемешивании последовательно добавляют диизопропилэтиламин (ДИПЭА) (73,4 мл 2,2 мольных эквивалента) и 4-(трифторметил)фениламин (30,7 г, 0,19 моль). Через один час смесь концентрируют в вакууме, получают масло. Полученное масло кристаллизуют из этанола, получают чистый 2,4-дихлор-N-(4-(трифторметил)фенил)бензамид (53,2 г, выход 83%). 1Н-ЯМР (200 МГц, DMSO-d6): δ 10,90 (ушир.с, 1Н), 7,91 (ушир.д, J=8 Гц, 2Н), 7,63-7,77 (м, 4Н), 7,57 (дт, J=8 Гц, J=2 Гц, 1Н).
Часть В: Растворяют 2,4-дихлор-N-(4-(трифторметил)фенил)бензамид (19,0 г, 0,057 моль) в бензоле (150 мл) и добавляют PCl5 (13,0 г, 1,1 молярный эквивалент). Полученную смесь нагревают при кипении с обратным холодильником в течение двух часов, дают достичь комнатной температуры и концентрируют в вакууме, получают остаток. Полученный остаток растворяют в безводном ТГФ, охлаждают до 0°С и переносят в автоклав. Из лабораторной колбы быстро добавляют избыток NH3 и смесь перемешивают при комнатной температуре 50 ч. Добавляют смесь этилацетата и водного раствора NaHCO3. Этилацетатный слой собирают, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученное масло очищают колоночной хроматографией (диэтиловый эфир/петролейный эфир = 1/1 (об./об.), силикагель), получают чистый 2,4-дихлор-N-(4-трифторметил)фенил)бензолкарбоксамид (16,9 г, выход 89%). Температура плавления: 108-109°С.
Часть С: Растворяют 2,4-дихлор-N-(4-трифторметил)фенил)бензолкарбоксамидин (15,0 г, 0,0450 моль) в 2-пропаноле и последовательно добавляют этил-3-бром-2-оксобутаноат (20,8 г, 2 молярных эквивалента) и NaHCO3. Полученную смесь нагревают при температуре кипения с обратным холодильником 40 ч и позволяют достичь комнатной температуры. Удаляют 2-пропанол в вакууме, добавляют этилацетат к остатку и органический слой промывают NaHCO3 (5%-й водный раствор). Собирают этилацетатный слой, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученное масло очищают колоночной хроматографией (диэтиловый эфир/петролейный эфир = 1/3 (об./об.), силикагель) и дополнительно очищают кристаллизацией из циклогексана, получают этил 2-(2,4-дихлорфенил)-5-метил-1-(4-трифторметил)фенил)-1Н-имидазол-4-карбоксилат (10,45 г, выход 52%) в виде желтого твердого вещества. Температура плавления: 160-162°С.
Часть D: Полученный этил 2-(2,4-дихлорфенил)-5-метил-1-(4-(трифторметил)фенил)-1Н-имидазол-4-карбоксилат превращают в 2-(2,4-дихлорфенил)-5-метил-1-(4-(трифторметил)фенил)-1Н-имидазол-4-карбоновую кислоту (температура плавления: 224-226°С), и эту карбоновую кислоту превращают в 2-(2,4-дихлорфенил)-5-метил-N-(пиперидин-1-ил)-1-(4-(трифторметил)фенил)-1Н-имидазол-4-карбоксамид (температура плавления: 173-174°С) по методике, описанной выше в примере 22.
Аналогично получены:
46. 2-(2,4-дихлорфенил)-N-(пиперидин-1-ил)-1-(4-(трифторметил)фенил)-1Н-имидазол-4-карбоксамид. Температура плавления: >200°С (с разложением).
47. N-циклогексил-2-(2,4-дихлорфенил)-5-метил-1-(4-(трифторметил)фенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 178-179°С.
48. N-циклогексил-2-(2,4-дихлорфенил)-1-(4-(трифторметил)фенил)-1Н-имидазол-4-карбоксамид. Температура плавления: 199-200°С.
Пример 49
Часть А: Растворяют N-(4-метоксифенил)-2,4-дихлорбензолкарбоксамидин (15,0 г, 50,8 ммоль) в 2-пропаноле и последовательно добавляют этил 3-бром-2-оксобутаноат (23,5 г, 2 молярных эквивалента) и NaHCO3 (8,5 г, 2 молярных эквивалента). Полученную смесь нагревают при кипении с обратным холодильником в течение 40 ч и дают достичь комнатной температуры. Удаляют 2-пропанол в вакууме, к остатку добавляют этилацетат и полученный органический слой промывают NaHCO3 (5%-й водный раствор). Собирают этилацетатный слой, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученное масло очищают колоночной хроматографией (диэтиловый эфир/петролейный эфир = 1/3 (об./об.), силикагель)), получают этил 2-(2,4-дихлорфенил)-5-метил-1-(4-метоксифенил)-1Н-имидазол-4-карбоксилат (8,61 г, выход 42%) в виде твердого вещества.1Н-ЯМР (200 МГц, CDCl3): δ 7,33 (д, J=8 Гц, 1Н), 7,27 (д, J=2 Гц, 1Н), 7,18 (дд, J=8 Гц, J=2 Гц, 1Н), 7,03(дт, J=8 Гц, J=2 Гц, 2Н), 6,85 (дт, J=8 Гц, J=2 Гц, 2Н), 4,42 (кв, J=7 Гц, 2Н), 3,80 (с, 3Н), 2,43 (с, 3Н), 2,43 (с, 3Н), 1,43 (т, J=7 Гц, 3Н).
Часть В: К раствору этил 2-(2,4-дихлорфенил)-5-метил-1-(4-метоксифенил)-1Н-имидазол-4-карбоксилата (8,00 г, 0,0198 моль) в ТГФ (80 мл) при перемешивании добавляют LiOH (0,59 г, 2 молярных эквивалента) и воду (80 мл). Полученную смесь перемешивают 16 ч при 80°С. После охлаждения до комнатной температуры добавляют HCl (2 н. раствор, 12,3 мл), получают маслянистый осадок. После добавления воды и экстракции этилацетатом, этилацетатный слой собирают, сушат над Na2SO4, фильтруют и концен