Способ получения сульфамидзамещенных имидазотриазинонов
Иллюстрации
Показать всеДанное изобретение касается способа получения сульфамидзамещенных имидазотриазинонов нижепредставленной общей формулы (I), в котором соединения нижепредставленной общей формулы (II) подвергают взаимодействию с серной кислотой, и полученные продукты затем обрабатывают тионилхлоридом и без выделения в инертном растворителе подвергают взаимодействию с амином с получением целевого продукта, который при необходимости переводят в соответствующие соли или гидраты
Задачей настоящего изобретения является создание простого осуществления способа получения сульфамидзамещенных имидазотриазинонов для применения в промышленном масштабе с высоким выходом за счет того, что на промежуточной стадии не выделяют восприимчивый к гидролизу имидазотриазинонсульфонилхлорид и соответственно исключаются колебания выхода на промежуточной ступени. 4 з.п. ф-лы.
Реферат
Данное изобретение относится к известным сульфамидзамещенным имидазо-триазинонам, более конкретно к новому способу их получения.
Известно, что соединения, которые в состоянии ингибировать метаболизирующие циклический гуанозин-3',5'-монофосфат фосфодиэстеразы (cGMP-PDE), могут использоваться для лечения импотенции (смотри, например, Европейскую заявку на патент ЕР-В-0702555; К.Murray, Drugs, News & Perspectives 6 (1993), 150).
В международной заявке на патент WO 99/24433 описаны сульфамидзамещенные имидазотриазиноны, способные ингибировать одну либо несколько метаболизирующих циклический гуанозин-3',5'-монофосфат фосфодиэстеразы (cGMP-PDE). В соответствии с номенклатурой Beavo и Reifsnyder (Trends in Pharmacol. Sci. 11, 150-155, 1990) в случае этих cGMP-PDE речь идет о изоферментах фосфодиэстеразы PDE-I, PDE-II и PDE-V.
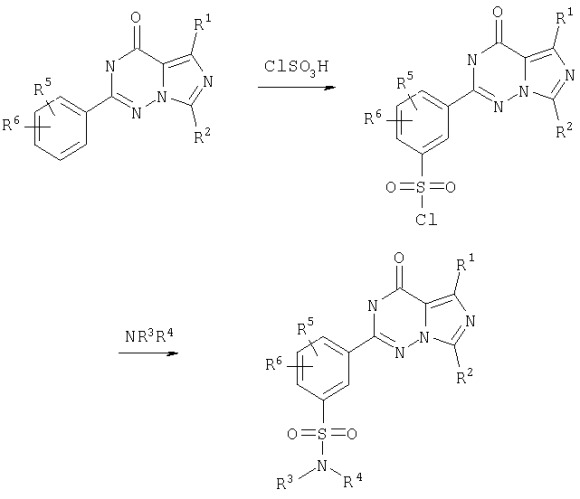
Согласно международной заявке на патент WO 99/24433 описанные там сульфамидзамещенные имидазотриазиноны получают из соответствующих 2-этоксифенилзамещенных имидазотриазинонов взаимодействием их с хлор-сульфоновой кислотой и последующим взаимодействием с соответствующим амином, что иллюстрируется следующей схемой (при этом R1-R6 имеют указанные в WO 99/24433 значения):
В этом способе в качестве реагента используют высокореакционную хлорсульфоновую кислоту. Кроме того, образующийся на промежуточной ступени имидазотриазинонсульфонилхлорид восприимчив к гидролизу, что может приводить, в частности при осуществлении этого метода в промышленном масштабе, к значительным колебаниям выхода целевого продукта.
Поэтому задачей настоящего изобретения является создание способа получения сульфамидзамещенных имидазотриазинонов, лишенного недостатков известного из уровня техники вышеуказанного процесса.
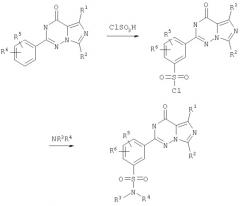
Поставленная задача достигается за счет исключения использования хлор-сульфоновой кислоты путем введения в реакцию с серной кислотой сульфоновой кислоты с последующим взаимодействием с тионилхлоридом. Кроме того, взаимодействие с тионилхлоридом и последующее взаимодействие с амином проводят в одном реакторе так, что на промежуточной стадии не выделяют восприимчивый к гидролизу имидазотриазинонсульфонилхлорид. В результате этого на промежуточной ступени исключаются колебания выхода за счет частичного гидролиза. Таким образом указанные преимущества обеспечивают более простое осуществление описываемого в настоящем изобретении процесса в промышленном масштабе, чем в международной заявке WO 99/24433.
Таким образом, объектом изобретения является способ получения сульфамидзамещенных имидазотриазинонов формулы (I)
в которой
R1 означает прямой или разветвленный алкил, содержащий до 4 атомов углерода,
R2 означает прямой алкил, содержащий до 4 атомов углерода,
R3 и R4 вместе с атомом азота образуют остаток формулы
где
R7 означает прямой или разветвленный алкил, содержащий до 6 атомов углерода,
R5 и R6 могут быть одинаковыми или разными и означают водород или прямой или разветвленный алкокси, содержащий до 6 атомов углерода,
который заключается в том, что соединение формулы (II)
где
R1, R2, R5 и R6 имеют вышеуказанные значения,
подвергают взаимодействию с серной кислотой с образованием соединения формулы (III)
где
R1, R2, R5 и R6 имеют вышеуказанные значения,
с последующим его взаимодействием с тионилхлоридом, и полученный таким образом продукт без выделения (in situ) в инертном растворителе подвергают взаимодействию с амином формулы (IV)
где
R3 и R4 имеют вышеуказанное значение,
а также при необходимости переводят в соли или гидраты.
Согласно предпочтительной форме исполнения данного изобретения реагенты и конечные продукты способа имеют следующие значения:
R1 означает прямой или разветвленный алкил, содержащий до 4 атомов углерода,
R2 означает прямой алкил, содержащий до 4 атомов углерода,
R3 и R4 вместе с атомом азота образуют остаток формулы
где
R7 означает прямой или разветвленный алкил, содержащий до 4 атомов углерода,
R5 и R6 могут быть одинаковыми или разными и означают водород или прямой или разветвленный алкил, содержащий до 6 атомов углерода.
Согласно другой предпочтительной форме исполнения данного изобретения реагенты и конечные продукты способа имеют следующие значения:
R1 означает водород или прямой или разветвленный алкил, содержащий до 4 атомов углерода,
R2 означает прямой алкил, содержащий до 4 атомов углерода,
R3 и R4 вместе с атомом азота образуют остаток формулы
где
R7 означает метил или этил,
R5 и R6 могут быть одинаковыми или разными и означают водород или прямой или разветвленный алкокси, содержащий до 6 атомов углерода.
В частности, вышеуказанные реагенты и конечные продукты предлагаемого способа имеют следующие значения:
R1 означает метил или этил,
R2 означает н-пропил,
R3 и R4 вместе с атомом азота образуют остаток формулы
где
R7 означает метил или этил,
R5 означает водород,
R6 означает этокси.
В соответствии с изобретением в качестве растворителя на отдельных стадиях процесса используют обычные органические растворители, которые не претерпевают изменений в условиях реакции. К ним принадлежат простые эфиры, предпочтительно диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир этиленгликоля, или углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции нефти, или галогенуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтан, трихлорэтилен, или хлорбензол, или сложный эфир уксусной кислоты, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон, диметоксиэтан или пиридин. Можно использовать также смеси упомянутых растворителей.
Особенно предпочтительно осуществлять взаимодействие соединений формулы (II) с серной кислотой без растворителя с последующим взаимодействием реакционной массы с тионилхлоридом преимущественно без растворителя и проведение последующей реакции с амином формулы (IV) в ксилоле.
В соответствии с изобретением температура реакции на разных стадиях процесса может варьироваться в широком интервале. В основном работают в области от минус 20°С до 200°С, предпочтительно от 0°С до 70°С.
В соответствии с изобретением стадии процесса проводят в основном при нормальном давлении. Можно также проводить их при повышенном давлении или при пониженном давлении (например, в области от 0,5 до 5 бар).
В соответствии с изобретением на первой стадии процесса серную кислоту используют в избытке, например в 2-20-кратном избытках, преимущественно в 2-10-кратном избытке, по отношению к 1 молю соединения формулы (II).
На второй стадии процесса в соответствии с изобретением тионилхлорид используют в избытке, например в 2-20-кратном избытке, преимущественно в 5-15-кратном избытке по отношению к 1 молю соединения формулы (III). Амин (IV) вводят в эквимолярном количестве или в избытке, например, в 2-10-кратном избытке, преимущественно в 2-5-кратном избытке по отношению к 1 молю соединения формулы (III).
Взаимодействие соединения формулы (III) с тионилхлоридом происходит преимущественно в присутствии каталитических количеств основания, причем под каталитическим количеством следует понимать значительно меньшее количество основания (к примеру, по меньшей мере более чем в десять раз) по сравнению с реагентами. В качестве основания подходят в основном циклические амины, как, например, пиперидин, пиридин, 4-N,N-диметиламинопиридин, или алкиламины с 1-4 атомами углерода, как, например, триэтиламин, или, предпочтительно, амиды, как, например, N,N-диметилформамид или N,N-дибутилформамид. Особенно предпочтителен N,N-диметилформамид.
Соединения формулы (II) можно получить описанным в международной заявке на патент WO 99/24433 образом путем взаимодействия соединений формулы (V)
в которой
R1 и R2 имеют указанное выше значение и
L означает прямой или разветвленный алкил, содержащий до 4 атомов углерода,
с соединением общей формулы (VI)
в которой
R5 и R6 имеют указанное выше значение.
Эта реакция может проводиться либо как описано в международной заявке на патент WO 99/24433 в две стадии в системе этанол и окситрихлорид фосфора/дихлорэтан, либо преимущественно согласно данному изобретению в две стадии в одном реакторе в системах метанол и окситрихлорид фосфора/уксусная кислота, или, особенно предпочтительно, метанол и ацетилхлорид/уксусная кислота.
В качестве растворителя для этой реакции используют обычные органические растворители, которые не претерпевают изменений в условиях реакции. К ним принадлежат простые эфиры, предпочтительно диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир этиленгликоля, или углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции нефти, или галгенуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтан, трихлорэтилен, или хлорбензол, или спирты, такие как метанол, этанол, н-пропанол, изопропанол или р-бутанол, или сложный эфир уксусной кислоты, ацетонитрил, ацетон, диметоксиэтан или пиридин, или кислота, например уксусная кислота. Можно использовать также смеси упомянутых растворителей. Для первой стадии в соответствии с изобретением предпочтительны спирты, особенно метанол, и для второй стадии используют либо дихлорэтан (как описано в международной заявке на патент WO 99/24433), либо особенно предпочтительно уксусную кислоту.
В этой реакции температура может варьироваться в широком интервале. В основном работают в области от -20°С до 200°С, предпочтительно от 0°С до 70°С.
Эта реакция проводится в основном при нормальном давлении. Можно также проводить ее при повышенном давлении или при пониженном давлении (например, в области от 0,5 до 5 бар).
Реагенты используются в этой реакции в качестве исходных продуктов. В зависимости от свойств реагенты могут использоваться в эквимолярных количествах или при избытке одного из реагентов.
Соединения формулы (V) частично известны или могут быть получены согласно международной заявке на патент WO 99/24433 взаимодействием соединения общей формулы (VII)
в которой
R2 имеет вышеуказанное значение и
Т означает галоген, преимущественно хлор,
с соединением общей формулы (VIII)
в которой
R1 имеет вышеуказанное значение
при необходимости в инертных растворителях при необходимости в присутствии основания и/или триметилхлорсилана, с получением соединения общей формулы (IX)
в которой
R1 и R2 имеет вышеуказанное значение,
и последующим взаимодействием его с соединением формулы (X)
где
L имеет вышеуказанное значение,
в инертных растворителях при необходимости в присутствии основания.
В качестве растворителя на отдельных стадиях процесса используют обычные органические растворители, которые не претерпевают изменений в условиях реакции. К ним принадлежат простые эфиры, предпочтительно диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир этиленгликоля, или углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции нефти, или галогенуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтан, трихлорэтилен, или хлорбензол, или сложный эфир уксусной кислоты, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон, диметоксиэтан или пиридин. Можно использовать также смеси упомянутых растворителей.
Особенно предпочтительным для первой стадии является проведение взаимодействия соединения формулы (VII) с соединением формулы (VIII) в дихлорметане или проведение процесса без инертного растворителя в присутствии основания, преимущественно гидроксида щелочного или щелочноземельного металла, особенно предпочтительно раствора едкого натра в качестве растворителя.
Для второй стадии процесса предпочтительно проведение взаимодействия соединения формулы (IX) с соединением формулы (X) в смеси из тетрагидрофурана и пиридина.
В качестве оснований в основном подходят циклические амины, как, например, пиперидин, пиридин, диметиламинопиридин или алкиламины с 1-4 атомами углерода, как, например, триэтиламин. Предпочтительны триэтиламин, пиридин и/или диметиламинопиридин.
Основания используют в основном в количестве от 1 до 5 мол-эквивалентов, предпочтительно от 1 до 3 мол-эквивалентов по отношению к реагентам.
Температура реакции может варьироваться в широком диапазоне. В основном работают в области от -20°С до 200°С, предпочтительно от 0°С до 100°С.
Соединения формулы (VII), (VIII) и (X) известны или могут быть получены известными специалистам методами, например, согласно описанным в международной заявке на патент WO 99/24433 процессам.
Соединения формулы (VII) и (VIII) используются в зависимости от свойств реагентов в эквимолярных количествах или при избытке одного из реагентов.
Соединения формулы (VII) и (VIII) используются в зависимости от свойств реагентов в эквимолярных количествах или при избытке одного из реагентов. Преимущественно соединение формулы (X) используют в 1,5-5-кратном избытке.
Соединения формулы (VI) можно получать различными способами. Например, их можно получить согласно международной заявке на патент WO 99/24433 взаимодействием соединения общей формулы (XI)
в которой
R5 и R6 имеют вышеуказанное значение,
с хлоридом аммония в толуоле в присутствии триметилалюминия в гексане при температуре от -20°С до комнатной температуры, преимущественно при 0°С, и нормальном давлении и с последующим взаимодействием образующегося амидина при необходимости без выделения (in situ), с гидразингидратом.
Соединения общей формулы (XI) сами по себе известны или могут быть получены обычными методами. Например, их получают согласно международной заявке на патент WO 99/24433 из соответствующих производных фенола путем переэтерификации. Возможно также осуществление взаимодействия соответствующих бензамидов в инертном органическом растворителе, таком как толуол, с тионилхлоридом при нагревании, например 50-100°С, преимущественно 70-100°С с образованием соединений формулы (XI).
Кроме того, соединения формулы (VI) можно также получать взаимодействием соединений формулы (XI) в присутствии основания в инертном органическом растворителе с гидрохлоридом гидроксиламина с образованием соединений формулы (XII)
где
R5 и R6 имеют вышеуказанное значение,
с последующим восстановлением в органическом растворителе до соединений формулы (XIII)
где
R5 и R6 имеют вышеуказанное значение,
которые затем путем взаимодействия с гидразингидратом при необходимости, без выделения (in situ), переводят в соединения формулы (VI).
В качестве растворителей для этих реакций подходят обыкновенные органические растворители, которые не изменяются в условиях реакции. К ним преимущественно принадлежат спирты, такие как метанол, этанол или изопропанол, эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир этиленгликоля, или углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции нефти, или галогенуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, дихлорэтан, трихлорэтилен, или хлорбензол, или сложный эфир уксусной кислоты, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон, диметоксиэтан или пиридин или уксусная кислота. Можно использовать также смеси упомянутых растворителей.
Особенно предпочтительно проводить преобразование соединений формулы (XI) в соединения формулы (XII) в изопропаноле. Преобразование соединений формулы (XII) в соединения формулы (XIII) особенно предпочтительно проводить в уксусной кислоте. Последующее взаимодействие соединений формулы (XIII) с гидразингидратом особенно предпочтительно проводить в метаноле. Эти реакции проводят в основном при нормальном давлении. Можно также проводить их при повышенном давлении или при пониженном давлении (например, в области от 0,5 до 5 бар).
Температура реакции может варьироваться в широком интервале. В основном работают в области от -20°С до 200°С, предпочтительно от 0°С до 100°С.
Преобразование соединений формулы (XI) до соединений формулы (XII) осуществляют в присутствии основания. В качестве основания подходят, в частности, циклические амины, как, например, пиперидин, пиридин, диметиламинопиридин, или алкиламины с 1-4 атомами углерода, как, например, триэтиламин. Предпочтителен триэтиламин. Основание используют в основном в количестве от 1 моля до 4 молей по отношению к 1 молю соединения формулы (XI) соответственно.
Восстановление соединений формулы (XII) до соединений формулы (XIII) может проводиться с обычными для таких реакций восстановителями при известных специалисту условиях. Особенно предпочтительно проводить восстановление путем гидрирования в присутствии катализатора, такого как палладиум на угле, в уксусной кислоте.
В зависимости от свойств реагентов соединения формулы (XI) и гидрохлорид гидроксиламина и соответственно соединения (XIII) и гидразингидрат используют в эквимолярных количествах или гидрохлорид гидроксиламина и соответственно гидразингидрат используют в избытке.
Соединения изобретения являются ингибиторами метаболизирующей циклический гуанозин-3',5'-монофосфат фосфодиэстеразы (cGMP-PDE) и описаны в международной заявке на патент WO 99/24433.
Данное изобретение иллюстрируется нижеследующими, не ограничивающими объем изобретения предпочтительными и сравнительными примерами.
Если не указано иначе, все указанные количества являются массовыми процентами.
Примеры
1H-ЯМР-спектры снимали на спектрометре SY WP-200 фирмы Bruker при комнатной температуре. В качестве растворителя использовали дейтерированный диметилсульфоксид или дейтерохлороформ с тетраметилсиланом в качестве внутреннего стандарта (если не отмечено иначе).
Масс-спектры снимали на спектрометре 40 М фирмы AMD и API 150 фирмы PE/SCIEX. Указана относительная интенсивность сигнала (в процентах по отношению к базовому пику).
Аналитическое исследование проводилось с помощью высокоскоростной колоночной жидкостной хроматографии (ВСЖХ) на хроматографе HP 1090 фирмы Hewlett Packard. Точные условия приведены в примерах выполнения.
Исходные соединения
Пример I: Получение 2-(2-этокси-фенил)-5-метил-7-пропил-3Н-имидазо-[5,1-f][1,2,4]триазин-4-она
Ia) Получение 2-бутириламинопропионовой кислоты
Раствор 100 кг D,L-аланина в водном растворе едкого натра подвергают взаимодействию с 119 кг хлормасляной кислоты на холоде. После добавления бутилацетата подкисляют соляной кислотой, отделяют органическую фазу и экстрагируют водную фазу. Органическую фазу сушат азеотропной перегонкой. Кристаллизат отделяют, промывают бутилацетатом и сушат.
Выход: 132,6 кг (68%)
1H-ЯМР: δ=0,8 (t, 3H), 1,25 (d, 3H), 1,5 (m, 2H), 2,1 (t, 2H), 4,2 (q, 1H), 8,1 (d, NH), 12,0-12,7 (s, COOH)
MC: 336 (2M+NH4, 40), 319 (2M+H, 15), 177 (М+NH4, 100), 160 (М+Н, 20)
Ib) Получение 2-этоксибензонитрила
К суспензии 250 кг 2-этоксибензамида в толуоле при 85-95°С добавляют 260 кг тионилхлорида путем дозирования. Реакционную смесь перемешивают при нагревании. Затем отгоняют тионилхлорид и толуол в вакууме. Продукт используют в качестве исходного материала на следующей стадии.
Выход: 228,5 кг (исходный продукт)
1H-ЯМР: δ=1,45 (t, 3Н), 4,15 (q, 2Н), 7,0 (m, 2Н, фенил), 7,5 (m, 2H, фенил)
MC: 312 (2M+NH4, 35), 165 (M+NH4, 100), 147 (5)
Ic) Получение 2-этокси-N-гидроксибензамидина
111 кг 2-Этоксибензонитрила (исходный продукт) из примера Ib нагревают с 164 л триэтиламина и 73 кг гидрохлорида гидроксиламина в изопропаноле с обратным холодильником. Реакционную смесь смешивают с водой и охлаждают. Кристаллизат отделяют, промывают и используют как сырой продукт на следующей стадии.
Выход: 92,6 кг (влажный продукт)
1H-ЯМР: δ=1,35 (t, 3H), 4,1 (q, 2H), 5,6 (s, 2H), 6,9-7,4 (4Н, фенил), 9,4 (s, 1H, OH)
МС: 361 (2М+Н, 30), 198 (M+NH4, 30), 181 (М+Н, 100)
Id) Получение 2-этоксибензамидин-гидрохлорида
135 кг 2-Этокси-N-гидроксибензамидина (сырой продукт) из примера Ic гидрируют в уксусной кислоте в присутствии палладиума на угле в качестве катализатора при 50-60°С. Реакционный продукт освобождают от катализатора, смешивают с соляной кислотой и концентрируют. Оставшуюся уксусную кислоту и воду удаляют азеотропной перегонкой с толуолом. Кристаллизат отделяют и сушат в вакууме.
Выход: 136,4 кг
Н-ЯМР: 1,35 (t, 3Н), 4,15 (q, 2H), 7,1-7,7 (m, 4Н, фенил), 9,1-9,4 (2×s, 3Н), 0,5-10,7 (s, 1H)
MS: 329 (2М+Н, 10), 165 (М+Н, 100)
Ie) Получение 2-(-2этокси-фенил)-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-она
231 кг 2-Бутириламинопропионовой кислоты из примера Ia смешивают в тетрагидрофуране с 341 кг пиридина, каталитическим количеством 4-N,N-диметил-аминопиридина и 392 кг этилхлороксалата и перемешивают при нагревании с обратным холодильником. Реакционную смесь разводят в этилацетате, промывают водой и концентрируют этилацетатную фазу. Остаток от дистилляции разводят в метаноле и смешивают со следующим раствором.
192 кг 2-Этоксибензамидин-гидрохлорида из примера Id смешивают в метаноле с 47,5 кг гидразингидрата и перемешивают при комнатной температуре. Раствор объединяют с вышеприготовленным раствором пропенил-этилового эфира 2-бутириламино-1-этоксикарбонил-щавелевой кислоты. Полученную таким образом реакционную смесь перемешивают при нагревании с обратным холодильником. Метанол удаляют дистилляцией и смешивают с уксусной кислотой.
Вариант А:
Добавляют 138,6 кг оксихлорида фосфора и перемешивают при нагревании. Уксусную кислоту отгоняют в вакууме. Остаток смешивают с водой и дихлор-метаном или при необходимости с метилизобутилкетоном и нейтрализуют раствором едкого натра. Органическую фазу концентрируют и остаток растворяют в ацетоне и кристаллизуют при охлаждении. Кристаллизат отделяют, промывают и сушат.
Вариант Б:
Добавляют минимум 190 кг ацетилхлорида и перемешивают при нагревании. Уксусную кислоту отгоняют в вакууме. Остаток от дистилляции смешивают с ацетоном и водой и продукт кристаллизуют путем нейтрализации раствором едкого натра. Продукт отделяют, промывают и сушат.
Выход: 90-160 кг
1H-ЯМР: δ=1,0 (t, 3Н), 1,6 (t, 3H), 1,9 (m, 2H), 2,8 (s, 3H), 3,3 (t, 2H), 4,3 (q, 2H), 7,0-8,2 (Ar, 4H), 10,3 (CONH, 1H)
MC: 313 (М+Н, 100), 149 (25), 151 (40), 121 (15)
ВСЖХ: Фаза Кромасил С-18, нейтральный фосфатный буфер, ацетонитрил, 233 нм, линейный градиент 30% ацетонитрил ->80% ацетонитрил (30 мин): 99 FI.% (Rt 19,1)
Примеры изготовления
Пример 1a: 4-Этокси-3-(5-метил-4-оксо-7-пропил-3,4-дигидро-имидазо[5,1-f][1,2,4]триазин-2-ил)-бензолсульфоновая кислота
194 кг 2-(2-этокси-фенил)-5-метил-7-пропил-3Н-имидазо[5,1-1][1,2,4]триазин-4-она из примера Ie смешивают с 504 кг концентрированной серной кислоты. К реакционной смеси добавляют воду, охлаждают, кристаллизат отделяют и сушат в вакууме.
Выход: 195,2 кг
1H-ЯМР: δ=0,95 (t, 3Н), 1,3 (t, 3H), 1,8 (m, 2H), 2,6 (s, 3H), 3,05 (t, 2H), 4,1 (q, 2H), 7,15 (Ar, 1H), 7,75 (m, 2H), 12,3 (SO2OH)
MC: 393 (М+Н, 100), 365 (25), 151 (40)
ВСЖХ: Фаза X-Terra C-18, водная фосфорная кислота, ацетонитрил, 242 нм, линейный градиент 10% ацетонитрил ->90% ацетонитрил (20 мин.): 98 FI. % (Rt 9,2)
Пример 1b): 2-[2-этокси-5-(4-этил-пиперазин-1-сульфонил)-фенил]-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-он
22,5 кг 4-Этокси-3-(5-метил-4-оксо-7-пропил-3,4-дигидро-имидазо[5,1-f][1,2,4]триазин-2-ил)-бензолсульфоновой кислоты из примера 1a смешивают с 74 кг тионилхлорида и каталитическим количествам диметилформамида до прекращения образования газа. К реакционной смеси добавляют ксилол и отгоняют тионилхлорид. К суспензии добавляют 15,1 кг N-этилпиперазина и перемешивают. После добавления воды соляной кислотой доводят рН до 1 и фазы разделяют. Водную фазу разводят ацетоном и нейтрализуют раствором едкого натра. Смесь охлаждают, кристаллизат отделяют, промывают и сушат в вакууме.
Выход: 26,1 кг
1H-ЯМР: δ=1,0 (2xt, 6H), 1,6 (t, 3H), 1,9 (m, 2H), 2,45 (q, 2H), 2,55 (m, 4H), 2,65 (s, 3H), 3,0 (t, 2H), 3,1 (m, 4H), 4,35 (q, 2H), 7,15 (Ar, 1H), 7,9 (Ar, 1H), 8.4 (Ar, 1H), 9.8 (CONH)
MC: 489 (М+Н, 100), 345 (10), 313, (10), 285 (10), 113 (20)
ВСЖХ: Фаза Х-Terra С-18, нейтральный фосфатный буфер, ацетонитрил, 242 нм, линейный градиент 20% ацетонитрил ->75% ацетонитрил (20 мин.): 98 FI.% (Rt 16,3)
1с) 2-[2-Этокси-5-(4-этил-пиперазин-1-сульфонил)-фенил]-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-он-гидрохлорид-тригидрат
22,5 кг 2-[2-Этокси-5-(4-этил-пипаразин-1-сульфонил)-фенил]-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-она из примера 1b растворяют в 5,1 кг концентрированной соляной кислоты и ацетона/воды (12:1 об/об) при нагревании. Прозрачный раствор подвергают горячему фильтрованию и кристаллизуют с помощью затравки и охлаждения. Кристаллизат отделяют, промывают и сушат в вакууме при примерно 30°С и примерно 300 мбар.
Выход: 25,4 кг
Тпл. (ДМС): 192°С
ВСЖХ: Фаза X-Terra C-18, нейтральный фосфатный буфер, ацетонитрил, 242 нм, линейный градиент 20% ацетонитрил ->75% ацетонитрил (20 мин.): 99 FI.% (Rt 16,3)
1. Способ получения сульфамидзамещенных имидазотриазинонов формулы (I)
в которой R1 означает водород или прямой или разветвленный алкил, содержащий до 4 атомов углерода;
R2 означает прямой алкил, содержащий до 4 атомов углерода;
R3 и R4 вместе с атомом азота образуют остаток формулы
где R7 означает прямой или разветвленный алкил, содержащий до 6 атомов углерода,
R5 и R6 могут быть одинаковыми или разными и означают водород или прямой или разветвленный алкокси, содержащий до 6 атомов углерода,
отличающийся тем, что соединение формулы (II)
где R1, R2, R5 и R6 имеют выше указанные значения,
подвергают взаимодействию с серной кислотой с образованием соединения формулы (III)
где R1, R2, R5 и R6 имеют выше указанные значения,
с последующим его взаимодействием с тионилхлоридом, и полученный таким образом продукт без выделения в инертном растворителе подвергают взаимодействию с амином формулы (IV)
где R3 и R4 имеют выше указанные значения,
а также, при необходимости, переводят в соли или гидраты.
2. Способ по п.1, в котором получают соединения формулы (I), в которых
R1 означает прямой или разветвленный алкил, содержащий до 4 атомов углерода;
R2 означает прямой алкил, содержащий до 4 атомов углерода;
R3 и R4 вместе с атомом азота образуют остаток формулы
где R7 прямой или разветвленный алкил, содержащий до 4 атомов углерода,
R5 и R6 могут быть одинаковыми или разными и означают водород или прямой или разветвленный алкокси, содержащий до 6 атомов углерода.
3. Способ по п.1, в котором получают соединения формулы (I), в которых
R1 означает водород или прямой или разветвленный алкил, содержащий до 4 атомов углерода;
R2 означает прямой алкил, содержащий до 4 атомов углерода;
R3 и R4 вместе с атомом азота образуют остаток формулы
где R7 означает метил или этил;
R5 и R6 могут быть одинаковыми или разными и означают водород или прямой или разветвленный алкокси, содержащий до 6 атомов углерода.
4. Способ по п.1, в котором получают соединения формулы (I), в которых
R1 означает метил или этил;
R2 означает н-пропил;
R3 и R4 вместе с атомом азота остаток формулы
где R7 означает метил или этил;
R5 означает водород;
R6 означает этокси.
5. Способ по п.1, отличающийся тем, что соединения формулы (II) получают путем взаимодействия соединений формулы (V)
в которой R1 и R2 имеют указанное в п.1 значение; и
L означает прямой или разветвленный алкил, содержащий до 4 атомов углерода,
с соединением общей формулы (VI)
в которой R5 и R6 имеют указанное в п.1 значение,
в две стадии в системах метанол и окситрихлорид фосфора/уксусная кислота или метанол и ацетилхлорид/уксусная кислота.