Антитело против остеопонтина и его применение
Иллюстрации
Показать всеИзобретение относится к иммунологии и биотехнологии. Описывается антитело против остеопонтина, которое ингибирует связывание интегрина и остеопонтина или его фрагмента, где интегрин распознает RGD-последовательность или последовательность SVVYGLR, SVAYGLR, SLAYGLR, SVAYGLK или SVAYRLK остеопонтина. Антитело получают при использовании в качестве антигена пептида, содержащего аминокислотную последовательность RGDSVVYGLR или родственную RGDSVVYGLR последовательность. Предложены также лекарственное средство для лечения аутоиммунного заболевания и способ лечения аутоиммунного заболевания на основе указанного антитела, где аутоиммунное заболевание выбирают из группы ревматизм, ревматоидный артрит и остеоартрит. Описано применение антитела для производства лекарственного препарата для лечения аутоиммунного заболевания, выбранного из группы ревматизм, ревматоидный артрит, остеоартрит. Использование изобретения улучшает артритный коэффициент, задерживает развитие артрита и снижает отек ног в экспериментальном артрите на мыши и может найти применение в медицине. 4 н. и 21 з.п. ф-лы, 16 ил., 13 табл.
Реферат
Область техники настоящего изобретения
Настоящее изобретение относится к антителу против человеческого остеопонтина и к способу терапевтического лечения аутоиммунных заболеваний, ревматизма и ревматоидного артрита с использованием данного антитела.
Предпосылки изобретения
Остеопонтин (обозначенный здесь и ниже как "OPN") представляет собой кислый кальцийсвязывающий гликопротеин, обильно представленный в кости. Известно, что в природе за счет альтернативного сплайсинга генерируются три типа изоформ человеческого OPN, а именно: остеопонтин-a (обозначенный здесь и ниже как "OPN-a"), остеопонтин-b (обозначенный здесь и ниже как "OPN-b") и остеопонтин-c (обозначенный здесь и ниже как "OPN-c") (Y. Saitoh et al., (1995): Laboratory Investigation, 72, 55-63). Полагают, что среди них предшественник OPN-a характеризуется аминокислотной последовательностью, показанной ниже в списке последовательностей как SEQ ID NO.1, от которой при секреции отщепляется сигнальный пептид с образованием зрелой формы OPN-a, включающей в себя I17-N314. Кроме того, зрелый OPN расщепляется тромбином биологического организма с С-концевой стороны от 168 остатка аргинина на два фрагмента, N-концевой и C-концевой.
Описанный выше OPN имеет различные физиологически, патологически значимые функции, например участвует в клеточной адгезии, миграции клеток, развитии опухолей, иммунном ответе и ингибировании опосредованного комплементом цитолиза. Различные типы рецепторов на клеточной поверхности опосредуют различные функции. OPN включает в себя RGD-последовательность (например, OPN-a содержит данную последовательность от остатка в положении 159 до остатка в положении 161). Формы интегринов, распознающие RGD-последовательность, такие как αVβ3, αVβ1 и αVβ5, являются главными рецепторами OPN; более конкретно, формы интегринов αVβ3, αVβ1 и αVβ5 опосредуют клеточную адгезию в гладкомышечных клетках сосудов. Далее, αVβ3 участвует в миграциях макрофагов, лимфоцитов, эндотелиальных клеток и гладкомышечных клеток и тому подобное.
Далее, в ходе исследовательских работ к настоящему моменту выявлено, что OPN также связывается посредством последовательности SVVYGLR с видами интегрина α9β1, α4β1 и α4β7, и также обнаружено различие в способе связывания, так что α4β1 связывается со всеми OPN, пока не расщепленными тромбином (OPN нерасщепленного типа), и с N-концевым фрагментом расщепленного тромбином OPN (OPN расщепленного типа), в то время как α9β1 связывается только с OPN расщепленного тромбином типа (Y. Yokosaki et al., (1999): The Journal of Biological Chemistry 274, 36328-36334/P. M. Green et al., (2001): FEBS Letters 503, 75-79/S. T. Barry et al., (2000): Experimental Cell Research 258, 342-351). Данные интегриновые субъединицы α9 и α4 или интегриновые субъединицы β1 и β7 имеют весьма сходные аминокислотные последовательности. Кроме того, формы интегрина α4β1 и α4β7 главным образом обнаружены в лимфоцитах и моноцитах, тогда как в неитрофилах данные формы интегрина экспрессированы очень слабо. Альтернативно, α9β1 высоко избирательно экспрессирован в нейтрофилах и выполняет функции, существенные для миграции нейтрофилов посредством VCAM-1 и тенасцина-С. Кроме того, интегрин также различно экспрессируется в мышечных клетках, эпителиальных клетках и клетках печени. Как описано выше, цитоплазматические домены интегринозых субъединиц α4 и α9 совместно способствуют миграции лейкоцитов в направлении очагов воспаления и их агрегации в этих очагах посредством индивидуальных путей передачи сигнала в клетке, отличающихся друг от друга, с целью усиления их активности при инфильтрации. Таким же образом интегриновые субъединицы участвуют в различных воспалительных реакциях.
Как описано выше, различные типы форм интегрина способствуют миграции лейкоцитов и таким образом участвуют в воспалительных реакциях. Поэтому фармацевтические вещества, ингибирующие данные виды активности интегринов, могут потенциально являться возможными противовоспалительными средствами. Например, интегрин αVβ3 экспрессируется в клетках-остеокластах, сосудистых эндотелиальных клетках и гладкомышечных клетках и тому подобных. Антитело против αVβ3 в настоящее время находится в процессе разработки, и оно может работать в качестве ингибитора связывания интегрина αVβ3 с различными связывающими его лигандами с потенциальным действием, направленным, например, на подавление повреждения суставов.
Поскольку рецепторы интегринового семейства обычно обнаруживаются в различных тканях, обеспечивая контроль жизненно важных функций активности, использование антител против интегрина для терапевтического лечения ревматоидного артрита и остеоартрита, возможно, может вызвать подобное ингибирование в иных участках и также может быть причиной наличия побочных реакций.
Кроме того, в WO 01/71358 описан способ скрининга на предмет вещества, ингибирующего связывание между α4-интегрином и остеопонтином, и способ терапевтического лечения воспалительных заболеваний, в котором используется вещество, полученное путем такого скрининга.
Было обнаружено, что в патогенез ревматоидного артрита вносят вклад различные факторы. Так, на эту тему было опубликовано много сообщений. Однако, не все из них достоверны. Кроме того, известные в настоящее время способы его лечения являются нозотропными и, по существу, не являются удовлетворительными.
Следовательно, существует большая потребность в окончательном прояснении патогенеза ревматоидного артрита и в обеспечении более эффективного лекарственного средства для его лечения. Целью настоящего изобретения является решение данных проблем.
Кроме того, ревматоидный артрит с трудом дифференцируют от остеоартрита. Поэтому другой целью изобретения является предоставление способа его диагностики.
Описание изобретения
Авторами изобретения обнаружено, что концентрация OPN в каждой суставной жидкости больных ревматизмом и больных остеоартритом принимала более высокое значение. Кроме того, авторами изобретения впервые обнаружено повышение отношения N-концевого фрагмента расщепляемого тромбином типа в общем OPN у больных ревматизмом. Таким образом, авторы изобретения предположили, что OPN может быть глубоко вовлеченным в развитие данных заболеваний. Как описано в следующем ссылочном примере, авторы изобретения затем подтвердили эти данные в экспериментах с использованием OPN-нокаут-мышей.
Далее авторы изобретения получили антитела, которые индивидуально и дискриминаторно распознавали N-концевой фрагмент и С-концевой фрагмент из расщепленного тромбином OPN. Затем авторы изобретения обнаружили в экспериментах с данными антителами, что N-концевой фрагмент расщепленного тромбином OPN находился в более высокой концентрации, в частности, в суставных жидкостях больных ревматоидным артритом.
Авторы изобретения сфокусировали свое внимание на одновременном присутствии RGD-последовательности и последовательности SVVYGLR, обе распознаваемые интегрином человеческого типа, в N-концевом фрагменте в такой высокой концентрации, как наблюдали у больных ревматоидным артритом. Затем авторы изобретения предположили, что антитело, одновременно блокирующее обе данных последовательности будет ингибировать связывание между OPN и интегрином настолько выраженно, что данное антитело будет эффективно для терапевтического лечения ревматоидного артрита и остеоартрита.
Кроме того, OPN распределен в почках, плаценте, яичниках, головном мозге, коже и тому подобном, но главным образом экспрессирован в костной ткани. Авторы изобретения предположили, что для терапевтического лечения ревматоидного артрита предпочтительно блокировать связывание между OPN и интегрином способом, более специфичным к OPN. Поскольку разные виды интегринов сочетанно участвуют в воспалении, то авторы изобретения считают, что будет эффективным шире блокировать связывание с данными различными видами интегрина.
Поэтому авторы изобретения получили антитело, ингибирующее связывание между RGD-последовательностью человеческого OPN и интегрина и связывание между последовательностью SVVYGLR человеческого OPN и интегрина, и подтверждали его эффекты в экспериментах по клеточной адгезии и миграции клеток и тому подобному. Кроме того, авторы изобретения получали антитело против синтетических пептидов, соответствующих таким внутренним последовательностям мышиного OPN для оценки эффективности такого антитела в качестве лекарственного средства с использованием экспериментального заболевания артритом у мыши.
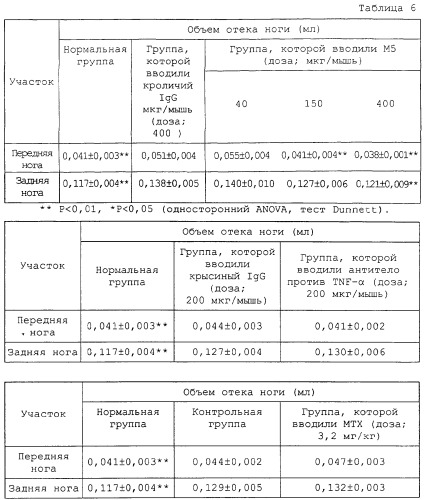
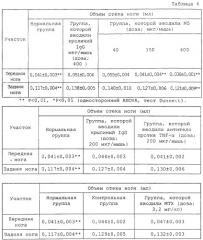
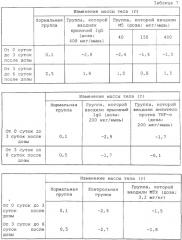
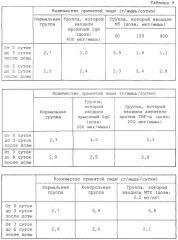
Более конкретно, поскольку мышиный OPN содержит последовательности RGD и SLAYGLR, распознаваемые мышиным интегрином, которые локализованы в положениях, гомологичных человеческому OPN в плане аминокислотной последовательности, антитело M5 получали в качестве антитела, одновременно блокирующего данные последовательности. Подтверждали, что связывание антитела M5 с мышиным OPN и продуктами его расщепления тромбином ингибировалось пептидом GRGDSP, включающим участок RGD, и что антитело M5 ингибировало миграцию TNF-α-активированного моноцита, выделенного из мышиной селезенки. Также наблюдали, что антитело M5 оказывало действие по подавлению повреждения кости в системе органной культуры мышиного свода черепа. Кроме того, подтверждали, что антитело оказывало очевидное терапевтическое действие при введении в экспериментальный коллагеновый артрит мыши.
Указанные выше результаты явно указывают на то, что антитело, одновременно блокирующее связывание участков последовательностей RGD и SVVYGLR с интегринами человеческого типа, ингибирует связывание между OPN и интегрином и поэтому является эффективным для терапевтического лечения ревматоидного артрита, и что данное антитело может, возможно, быть эффективным не только при ревматизме, таком как ювенильный суставный ревматизм и хронический ревматизм, но также при псориатическом артрите и псориазе. Кроме того, в хроническом отторжении после трансплантации органа обычно участвуют нарушения, связанные с сосудистыми и бронхиальными окклюзивными нарушениями. Их гистологическая оценка указывает на то, что сосудистая окклюзия, возможно, происходит по причине запуска путем активации T-клеток и макрофагов выброса цитокинов и факторов роста и нарушений клеток эндотелия сосудов, и также потому, что пролиферация гладкомышечных клеток сосудов вызывает фиброгенез и тому подобное (P. Freese et al., (2001): Nephrol Dial Transplant, 16, 2401-2406/J.R.Waller et al., (2001): British Journal of Surgery, 88, 1429-1441/S.R.Lehtonen et al., (2001): Transplantation, 72, 1138-1144). Одно из сообщений указывает на то, что OPN функционирует в качестве белка, существенного для активации макрофагов и фиброгенеза гладкомышечных клеток сосудов (A. O′Regan et al., (2000): Int J Exp Pathol, 81, 373-390). Таким образом, предложенное по изобретению антитело, ингибирующее OPN, подавляет миграцию моноцита и нейтрофила, таким образом, возможно, подавляя путь к такому фиброгенезу. Так, данное антитело подавляет хроническое отторжение после трансплантации органа, с участием в результате в адгезии органа. Кроме того, антитело эффективно при терапевтическом лечении аутоиммунных заболеваний, включая системные аутоиммунные заболевания, эритему, увеит, болезнь Бехчета, множественный миозит, пролиферативный гломерулонефрит, саркоидоз и тому подобное.
Другими словами, изобретение относится к антителу против остеопонтина, ингибирующему связывание между интегрином, распознающим последовательность RGD, и OPN или его фрагментом, и также широко ингибирующего связывание между интегрином, распознающим последовательность SVVYGLR или соответствующую последовательность, и остеопонтином или его фрагментом.
Далее изобретение относится к лекарственному средству от аутоиммунных заболеваний, лекарственному средству от ревматизма и лекарственному средству от ревматоидного артрита, и данные терапевтические средства содержат в качестве эффективных ингредиентов антитело против остеопонтина.
Кроме того, изобретение относится к способу терапевтического лечения аутоиммунных заболеваний, ревматизма и ревматоидного артрита, включающему введение антитела против остеопонтина больным ревматизмом и ревматоидным артритом для ингибирования связывания между последовательностью RGD остеопонтина и интегрином и/или ингибирования связывания между последовательностью SVVYGLR и интегрином.
Кроме того, изобретение относится к средству диагностики ревматизма и способу его диагностики, в котором задействуется антитело против остеопонтина.
Краткое описание фигур
На фиг.1 показаны графики, отображающие ингибирование RGD-зависимой клеточной адгезии к OPN.
На фиг.2 показаны графики, отображающие ингибирование RGD-зависимой и RGD-независимой клеточной адгезии между nOPN и α9-траснформированной SW480 клеткой за счет 2K1.
На фиг.3a показаны графики, отображающие OPN-индуцированную миграцию клеток.
На фиг.3b показаны графики, отображающие супрессию OPN-индуцированной миграции клеток за счет антител.
На фиг.4 показаны графики, отображающие изменение во времени артритного коэффициента при индивидуальном дозировании артритогенного коктейля антитела/LPS мыши, дефективной по гену OPN, и нормальной мыши.
На фиг.5 показаны графики, отображающие сравнение отека запястья при индивидуальном дозировании артритогенного коктейля антитела/LPS мыши, дефективной по гену OPN, и нормальной мыши.
На фиг.6 показаны графики, отображающие адгезию между мышиным OPN и NIH3T3 в концентрационно-зависимой манере.
На фиг.7 показаны графики, отображающие ингибирование адгезии между мышиным OPN и NIH3T3 за счет пептида GRGDSP.
На фиг.8 показаны графики, отображающие адгезию между мышиным OPN и NIH3T3 за счет антитела M5.
Способ осуществления изобретения
Антитело против остеопонтина (обозначенное здесь и ниже "антитело, ингибирующее OPN"), ингибирующее связывание между интегрином, распознающим последовательность RGD, и OPN или его фрагментом и также ингибирующее связывание между интегрином, распознающим последовательность SVVYGLR или соответствующую последовательность, и OPN или его фрагментом, может быть любым антителом, ингибирующим связывание интегрина, распознающего последовательность RGD, например αvβ1, αvβ3 и αvβ5, с OPN-a, OPN-b, OPN-c или их N-концевым фрагментом и также ингибирующих связывание интегрина, распознающего последовательность SVVYGLR, например α9β1, α4β1 и α4β7, с OPN-a, OPN-b, OPN-c или их N-концевым фрагментом. Последовательность SVVYGLR или соответствующая ей последовательность означает то, что описано ниже: последовательность SVVYGLR означает последовательность от серина в положении 162 до аргинина в положении 168 в человеческом OPN, в то время как соответствующая ей последовательность означает соответствующую SVVYGLR последовательность в OPN других млекопитающих, которая представляет собой, например, свиную SVVYGLR, идентичную данной последовательности у людей, SVAYGLR у обезьян, SLAYGLR у мыши и крысы, SVAYGLK у крупного рогатого скота и SVAYRLK у кролика. Антитело, ингибирующее OPN, по изобретению может быть любым из антител, сохраняющих такие свойства, и способ получения данного антитела конкретно не ограничен. Антитело, ингибирующее OPN, может быть получено, например, с использованием, OPN-a, OPN-b, OPN-c или их N-концевого фрагмента или пептида, содержащего аминокислотную последовательность RGDSVVYGLR или соответствующую ей последовательность (обозначенную здесь и ниже как "относящийся к OPN пептид") в качестве антигена. Указанный здесь фрагмент OPN включает фрагменты OPN, сгенерированные путем расщепления OPN протеиназами и тому подобным, и, например, представляет собой фрагмент, полученный путем расщепления тромбином.
Ингибирующее OPN антитело предпочтительно получают путем использования пептида, содержащего в качестве антигена последовательность RGDSVVYGLR. Более предпочтительно, ингибирующее OPN антитело получают, например, путем использования в качестве антигена (VDTYDGRGDSVVYGLRS), содержащего обе последовательности, которые следуют друг за другом и начинаются от валина в положении 153 и заканчиваются серином в положении 169 в случае OPN-a, и путем последовательной обработки данного пептида по общему способу. Для повышения антигенности предпочтительно применяют продукт относящегося к OPN пептида, связанный с биополимерным соединением.
Для работ по исследованию связанных с OPN заболеваний с использованием в качестве экспериментального животного мыши, предпочтительно, применяют антитело, ингибирующее OPN, против мышиного OPN. Такое антитело предпочтительно получают путем использования пептида, содержащего последовательность RGDSLAYGLR в качестве антигена.
Примеры биополимерного соединения, подлежащего связыванию с относящимся к OPN пептидом, включают, например, геомоцианин Macroschisma (обозначенный здесь и ниже как "KLH"), овальбумин (обозначенный здесь и ниже как "OVA"), бычий сывороточный альбумин (обозначенный здесь и ниже как "BSA"), кроличий сывороточный альбумин (обозначенный здесь и ниже, как "RSA") и тиреоглобулин. Среди них более предпочтительными являются KLH и тиреоглобулин.
Относящийся к OPN пептид и биополимерное соединение связывают друг с другом вместе известными способами, например способом смешанного ангидрида кислот (B.F.Erlanger et al., (1954): J. Biol. Chem. 234, 1090-1094) или способом активированного эфира (A.E.Karu et al., (1994): J. Agric. Food Chem. 42, 301-309).
Смешанный ангидрид кислот для применения по способу смешанного ангидрида кислот может быть получен путем участия относящегося к OPN пептида в общей реакции Шоттена-Бауманна, который затем способен взаимодействовать с биополимерным соединением для получения целевого связанного продукта соединения пептид-полимер. Галогенмуравьиный сложный эфир для применения по способу смешанного ангидрида кислот, например, включает метилхлорформиат, метилбромформиат, этилхлорформиат, этилбромформиат, изобутилхлорформиат и тому подобное. Отношения пептида, галогенмуравьиного сложного эфира и полимерного соединения, подлежащие использованию по данному способу, предпочтительно выбирают в широком диапазоне.
Здесь реакцию Шоттена-Бауманна проводят в присутствии основного соединения. Основное соединение для применения в данной реакции включает соединения для рутинного использования в реакции Шоттена-Бауманна, например, органические основания, такие как триэтиламин, триметиламин, пиридин, диметиланилин, N-метилморфолин, диазабициклононен (DBN), диазабициклоундецен (DBU), диазабициклооктан (DABCO) и тому подобное, и неорганические основания, такие как карбонат калия, карбонат натрия, гидрокарбонат калия, гидрокарбонат натрия и тому подобные.
Кроме того, реакцию в основном продолжают при температуре от -20°C до 100°C, предпочтительно, от 0°C до 50°C. Время реакции составляет примерно от 5 минут до 10 часов, предпочтительно от 5 минут до 2 часов.
Реакцию между полученным в результате смешанным ангидридом кислот и биополимерным соединением в основном осуществляют при температуре от -20°C до 150°C, предпочтительно от 0°C до 100°C, при времени реакции примерно от 5 минут до l0 часов, предпочтительно от 5 минут до 5 часов. Способ смешанного ангидрида кислот, в основном, осуществляют в растворителе. Растворитель, например, включает любой из растворителей, обычно используемых для способа смешанного ангидрида кислот, конкретно включая галогензамещенные углеводороды, такие как дихлорметан, хлороформ, и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; сложные эфиры, такие как метилацетат и этилацетат; апротонные полярные растворители, такие как N,N-диметилформамид, диметилсульфоксид и гексаметилфосфотриамид; и тому подобные.
Альтернативно, процесс активации сложного эфира в общем проводят следующим образом. Вначале растворяя относящийся к OPN пептид в органическом растворителе для взаимодействия с N-гидроксисукцинимидом в присутствии связывающего средства, продуцируют активированный N-гидроксисукцинимидом сложный эфир.
В качестве связывающего средства могут использоваться обычные связывающие средства для рутинного применения в реакции конденсации, включая, например, дициклогексилкарбодиимид, карбонилдиимидазол и водорастворимый карбодиимид. В качестве органического растворителя альтернативно могут, например, использоваться N,N-диметилформамид (DMF), диметилсульфоксид и диоксан. Молярное соотношение пептида и связывающего средства, такого как N-гидроксисукцинимид для применения в данной реакции, предпочтительно составляет от 1:10 до 10:1, наиболее предпочтительно 1:1. Температура реакции составляет от 0°C до 50°C, предпочтительно от 22°C до 27°C, в то время как время взаимодействия составляет от 5 минут до 24 часов, предпочтительно от одного часа до 2 часов. Удовлетворительная температура реакции представляет собой температуру выше индивидуальных температур плавления и ниже индивидуальных температур кипения.
После реакции связывания реакционный раствор добавляют к раствору, в котором растворено биополимерное соединение, для взаимодействия. В случае, когда биополимерное соединение имеет свободную аминогруппу, например образуется амидная связь с кислотой между аминогруппой и карбоксильной группой пептида, температура реакции составляет от 0°C до 60°C, предпочтительно от 5°C до 40°C, и более предпочтительно, от 22°C до 27°C, в то время как время реакции составляет от 5 минут до 24 часов, предпочтительно от одного часа до 16 часов и более предпочтительно от одного часа до 2 часов.
Продукт взаимодействия между относящимся к OPN пептидом и биополимерным соединением, полученный данным способом, очищают путем диализа или на обессоливающей колонке или другим подобным образом, с целью получения продукта относящегося к OPN пептида, связанного с биополимерным соединением (просто обозначенным здесь и ниже как "связанный продукт").
Ниже теперь следует описание способа получения антитела с использованием связанного продукта, полученного таким образом, в качестве антигена и способа иммунологического анализа с использованием данного антитела. Для получения антитела здесь могут подходящим образом использоваться известные способы, которые например, описаны в Zoku Seikagaku Jikken Koza (Серии лекций по экспериментальной биохимии) и Meneki Seikagaku Kenkyu Ho (Способ исследования в иммунобиохимии) (Nihon Seikagaku Gakkai hen (Japan Biochemical Association, ed.)).
Для получения поликлонального антитела с использованием связанного продукта по изобретению животное иммунизируют связанным продуктом для получения антитела от данного животного.
Более конкретно, например, связанный продукт, такой как относящийся к OPN пептид-тиреоглобулин, вначале растворяют в натрийфосфатном буфере (обозначенном здесь и ниже как "PBS"), который затем смешивают с полным адъювантом Фрейнда или неполным адъювантом Фрейнда, или вспомогательным средством, таким как алюминиевые квасцы. Полученную в результате смесь используют в качестве иммуногена для иммунизации млекопитающего.
Любое обычно используемое в данной области животное может применяться в качестве животного для иммунизации, включая, например, мышь, крысу, кролика, козу и лошадь. Кроме того, способ дозирования иммуногена для иммунизации может представлять собой подкожную инъекцию, внутрибрюшинную инъекцию, внутривенную инъекцию и внутримышечную инъекцию. Предпочтительными являются подкожная инъекция или внутрибрюшинная инъекция. Иммунизация может осуществляться единожды или много раз с подходящим интервалом, предпочтительно с интервалом от одной недели до 5 недель.
Затем по общему способу кровь собирают от иммунизированных животных и отделяют от нее сыворотку. Путем очистки фракции поликлональных антител может быть получено ингибирующее OPN антитело.
Кроме того, полученную по общему способу иммунную клетку путем иммунизации животного связанным продуктом сливают с миеломной клеткой для получения гибридомы. Путем сбора антител из культуры гибридомы можно получить ингибирующее OPN антитело в виде моноклонального антитела.
Когда антитело по изобретению предполагается к применению при терапевтическом лечении животных, включая людей, предпочтение отдается использованию химерного антитела (см. публикацию Европейского патента EP 0125023), полученного посредством модификации при помощи генной инженерии, так что полученное в результате ингибирующее OPN антитело может характеризоваться той же константной областью, что и у антитела субъекта, человека или животного, которое подлежит лечению, или использованию антитело, подвергшегося анимализации (см. публикацию Европейского патента EP 0239400 или EP 045126). В другом случае предпочтительно используют моноклональное антитело (антитело животного типа для данного вида животного) (см. публикацию Европейского патента EP 0546073 или WO 97/07671), полученное с использованием трансгенного животного с искусственно введенным геном, участвующим в получении антитела у субъекта, человека или животного, которое подлежит лечению.
В случае, когда подлежащий лечению субъект является человеком и животное, генерирующее ингибирующее OPN антитело, представляет собой мышь, предпочтительно используют человеческие-мышиные химерные антитела или гуманизированные антитела. Более предпочтительно, трансгенному животному, такому как мышь, вводят ген человека, участвующий в генерировании антител, для получения моноклонального антитела человеческого типа для последующего применения. Кроме того, способ фагового дисплея может удовлетворительно применяться для получения антител.
Ингибирующее OPN антитело, полученное таким образом, может применяться в виде Fv, Fab или F(ab′)2 с участком распознавания антитела, вырезанным из ингибирующего OPN антитела протеазой и тому подобным.
Полученное таким образом ингибирующее OPN антитело очищают далее, если необходимо, и впоследствии его включают в дозированные формы по основному способу, для применения при терапевтическом лечении ревматоидного артрита, ревматизма, такого как ювенильный суставный ревматизм и хронический ревматизм, псориатический артрит и псориаз; при подавлении хронических отторжений после трансплантации органов; и при терапевтическом лечении аутоиммунных заболеваний, таких как системные аутоиммунные заболевания, эритемы, увеит, болезнь Бехчета, множественный миозит, клубочковый пролиферативный нефрит и саркоидоз.
Ингибирующее OPN антитело по изобретению предпочтительно может использоваться в качестве лекарственного средства от ревматизма или лекарственного средства от ревматоидного артрита. Примеры дозированных форм данных терапевтических средств от ревматизма и тому подобного включают парентеральные формы, такие как инъекции и инфузии, которые предпочтительно дозируют путем внутривенной инъекции и подкожной инъекции (для применения в качестве лекарственного средства от аутоиммунных заболеваний должны последовать описанные выше примеры). Для препарата также дополнительно могут применяться фармацевтически приемлемые носители и добавки в фармацевтически приемлемом интервале в зависимости от дозированной формы.
Количество ингибирующего OPN антитела, подлежащего добавлению в препарат, варьируется в зависимости от тяжести симптомов и возраста больного, используемой дозированной формы препарата или титра связывания ингибирующего OPN антитела или тому подобного. Например, удовлетворительно может быть использовано количество примерно от 0,1 мг/кг до 100 мг/кг.
Поскольку ингибирующее OPN антитело в качестве эффективного ингредиента полученного таким образом лекарственного средства по изобретению прочно связывается с последовательностями RGD и SVVYGLR в OPN, ингибирующее OPN антитело возможно ингибирует связывание между данными областями OPN и интегрином для последующего подавления обострения симптомов ревматизма и ревматоидного артрита и других аутоиммунных заболеваний.
Поскольку ингибирующее OPN антитело по изобретению специфично связывается со стороны OPN, а не со стороны интегрина, данное антитело в принципе не может ингибировать другие значимые функции интегрина, так что ожидается, что можно будет избежать неблагоприятных побочных эффектов.
Кроме того, ингибирующее OPN антитело по изобретению может также применяться для целей скрининга лекарственного средства против аутоиммунных заболеваний. Как описано здесь, соединение, ингибирующее связывание между RGD-последовательностью OPN и интегрином и ингибирующее связывание между SVVYGLR-последовательностью OPN и интегрином, возможно, является терапевтическим средством от аутоиммунных заболеваний. Таким образом, применимость вещества, подлежащего скринингу (тестовое вещество) в качестве лекарственного средства против аутоиммунных заболеваний может оцениваться в реакционной системе, полученной путем добавления тестового вещества и ингибирующего OPN антитела в конкурентной манере в систему анализа, в присутствии заданных количеств OPN и интегрина, с целью анализа степени ингибирования связывания между OPN и интегрином по сравнению с используемым количеством ингибирующего OPN антитела.
Сходным образом, соединение, ингибирующее связывание между RGD-последовательностью OPN и интегрином и ингибирующее связывание между SVVYGLR-последовательностью и интегрином, возможно, служит в качестве лекарственного средства от ревматизма и ревматоидного артрита. Раз ингибирующее OPN антитело применяют для составления той же реакционной системы, что описана выше, то данная реакционная система может использоваться для скрининга ревматизма и ревматоидного артрита.
Ингибирующее OPN антитело по изобретению может далее использоваться в качестве средства диагностики ревматизма. Как описано выше, было продемонстрировано, что высокая концентрация N-концевого фрагмента расщепленного тромбином OPN особо хорошо обнаруживается в артрозе больного ревматоидным артритом. Таким образом, тест на OPN или его N-концевой фрагмент в образце с использованием ингибирующего OPN антитела может служить для диагностики ревматизма. В качестве способа данного тестирования могут использоваться следующие различные способы для применения в качестве способов общего иммунохимического анализа [″Hybridoma Method and Monoclonal Antibody″, издано R&D Planning KK., с.30-53, март 5, 1982]: радиоиммунологический анализ (RIA), ELISA (E. Engvall et al., (1980): Methods in Enzymol., 70, 419-439), способ флуоресцентного антитела, способ бляшкообразования, спот-способ, способ агрегации, тест по Оухтерлони и тому подобное.
Способ может быть подходящим образом выбран, исходя из различных положений. В плане чувствительности, простоты и тому подобного предпочтительным является ELISA. Данный способ более предпочтительно включает иммобилизацию ингибирующего OPN антитела по изобретению на носителе и мечение антитела, распознающего участок OPN, отличный от такового для ингибирующего OPN антитела по изобретению, с целью определения OPN или его N-концевого фрагмента. Таким образом, такой способ определения может использоваться для средства для диагностики ревматоидного артрита.
Вещество для мечения, применяемое при мечении антител, включает ферменты, такие как пероксидаза хрена (здесь и далее обозначенная "HRP"), щелочная фосфатаза (здесь и далее обозначенная "AP") и тому подобные, флуоресцентные вещества, такие как флуоресцеинизоцианат и родамин и подобные, радиоактивные вещества, такие как 32P, 125I и подобные, хемилюминесцентные вещества и тому подобное. Ниже описана процедура сэндвич-метода, как одного из более специфичных способов определения изоформ OPN. Конкретно, данная процедура включает первую стадию (a) иммобилизации антитела против изоформы OPN по изобретению на носителе, вторую стадию (b) блокирования поверхности носителя с иммобилизованным на ней антителом материалом, не относящимся к антигену, например белком. Процедура далее включает стадию (c) добавления к полученной в результате смеси образца, содержащего различные концентрации изоформы OPN, для получения комплекса изоформы OPN с антителом, стадию (d) последующего добавления меченого антитела против изоформы OPN для того, чтобы данное антитело могло связаться с иммобилизованным комплексом антиген-антитело, и конечную стадию (e) анализа количества метки, связанной с носителем для определения количества свободной изоформы OPN в образце, основанной на полученной ранее стандартной кривой.
Носитель, применяемый на стадии (a) для иммобилизации антитела, включает в качестве не ограниченных конкретно примеров любые носители для рутинного использования по способам иммунохимического анализа. Носитель может, например, включать полистирольные 96-луночные планшеты для микротитрования со связанными аминогруппами. Для дальнейшей иммобилизации антитела буфер, содержащий антитело, подходящим образом добавляют к носителю и инкубируют с ним. В качестве буфера могут использоваться известные буферы, одним из которых, например, является 10 мМ PBS. Концентрация антитела в буфере может быть выбрана из широкого интервала, но главным образом подходящая концентрация примерно составляет от 0,01 до 100 мкг/мл и предпочтительно от 0,1 до 20 мкг/мл. Кроме того, количество буфера составляет 300 мкл на лунку или менее и предпочтительно примерно от 20 до 150 мкл на лунку, где в качестве носителя используют 96-луночную планшету для микротитрования. Далее, условия инкубации включают в качестве неограниченных конкретно примеров инкубацию в течение ночи примерно при 4°C, что в общем является подходящим.
На стадии (b) блокирования блокирование далее осуществляется с целью предотвращения неспецифической адсорбции на носитель, поскольку часть веществ, возможно, способных адсорбироваться на носитель, несмотря на то, что они не имеют отношения к взаимодействию антиген-антитело, может потенциально существовать с OPN в образце, подлежащем добавлению на следующей стадии. В качестве блокирующего средства, например, могут использоваться раствор бычьего сывороточного альбумина (BSA) и сухого молока. С другой стороны, могут использоваться коммерчески доступные блокирующие средства, такие как Block-Ace (производимый Dainippon Pharmaceutical Co., Ltd.; Code No. UK-25B). В конкретном, но неограничивающем примере блокирование проводят путем добавления подходящего объема Block-Ace к части с иммобилизованным антигеном для инкубации в течение ночи примерно при 4°C и ополаскивания полученной в результате части буфером. Буфер включает в качестве конкретно не ограничивающего примера буфер с композицией 10 мМ PBS, pH 7,2, 0,8% (мас./об.) NaCl, 0,02% (мас./об.) KCl и 0,02% (об./об.) Tween 20.
Затем, на стадии (c), образцу, содержащему изоформу OPN, дают возможность контактировать с иммобилизованным антителом для захвата изоформы OPN иммобилизованным антителом и получения комплекса иммобилизованного антитела с изоформой OPN. Без ограничений, реакцию проводят примерно при 37°C примерно в течение одного часа. По окончании реакции носитель ополаскивают буфером для удаления непрореагировавшего белка и тому подобного. В качестве буфера, используемого в данной реакции, предпочтительным является 10 мМ PBS, pH 7,2 и 0,05% (об./об.) Tween 20.
Далее на стадии (d) комплекс иммобилизованное антитело-изоформа OPN-меченое антитело образуется путем добавления меченого антитела, распознающего другой эпитоп изоформы OPN, захваченной иммобилизованным антителом. По окончании реакции носитель предпочтительно ополаскивают буфером для удаления непрореагировавшего белка и тому подобного. Буфер, описанный для стадии (c), применяют в качестве буфера для реакции.
Меченое антитело, подлежащее использованию на стадии (d) требуется для распознавания эпитопа, отличного от эпитопа, распознаваемого иммобилизованным антителом на стадии (a). Когда, например, в качестве иммобилизованного антитела используется поликлональное антитело, распознающее домен первой половины изоформы OPN, в качестве антитела, меченного связанным ферментом (например, HRP или AP и тому подобным), применяют поликлональное антитело, распознающее домен второй половины изоформы OPN. Применение таких антител, распознающих различные участки, как описано выше, обеспечивает высокочувствительный, специфичный анализ изоформы OPN, сгенерированной путем альтернативного сплайсинга.
Количество подлежащ