Кристаллическая натриевая соль парекоксиба
Иллюстрации
Показать всеИзобретение относится к натриевой соли парекоксиба в кристаллической форме, которая обладает свойствами селективного ингибитора циклооксигеназы-2 (СОХ-2) и может найти применение при лечении, например, воспалительных заболеваний и боли. Предлагаемые согласно изобретению кристаллические формы имеют характеристические пики порошковой рентгенограммы, полученной с использованием Cu-источника излучения, выраженной в градусах 2θ, и выбраны из групп, по меньшей мере состоящих из величин 5,6, 9,6, 11,0 и 14,5±0,2 градуса (форма А), 4,2, 8,3, 12,4, 16,7, 17,5, 20,8 и 24,7±0,2 градуса (форма В) и 8,8, 11,3, 15,6, 22,4, 23,5 и 26,4±0,2 градуса (форма Е), каждая из которых является по существу безводной и по существу несольватированной. Изобретение также относится к способу получения кристаллической формы А и к фармацевтической композиции. 4 н. и 17 з.п. ф-лы, 5 табл., 12 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллическим формам натриевой соли парекоксиба, фармацевтическим композициям, содержащим такие кристаллические формы, и способам использования таких композиций для лечения опосредованных циклооксигеназой-2 (СОХ-2) нарушений.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Нестероидные противовоспалительные лекарственные средства (NSAID) широко используют для лечения воспаления и боли, например, при артрите и головной боли. Такие лекарственные средства являются эффективными, но их длительное использование может быть ограничено желудочно-кишечными побочными действиями, включающими диспепсию и абдоминальную боль, а в некоторых случаях прободение язвы желудка или двенадцатиперстной кишки и/или кровотечение. Разработка селективных ингибирующих СОХ-2 лекарственных средств явилось революционным событием в лечении воспаления и боли, дав возможность сочетать терапевтическую эффективность традиционных NSAID с улучшенным в значительной степени профилем желудочно-кишечной безопасности.
Считается, что ингибирование ферментов циклооксигеназ (СОХ) является по меньшей мере первичным механизмом, которым NSAID оказывают свои характерные противовоспалительные, жаропонижающие и анальгезирующие действия посредством ингибирования синтеза простагландинов. Общепринятые NSAID, такие как кеторолак, диклофенак, напроксен и их соли ингибируют как конститутивно экспрессированный СОХ-1, так и связанные с воспалением или вызываемые воспалением СОХ-2-изоформы циклооксигеназы при терапевтических дозах. Оказывается, что ингибирование СОХ-1, который продуцирует простагландины, необходимые для функции нормальных клеток, является причиной некоторых отрицательных побочных действий, которые связаны с использованием общепринятых NSAID. В противоположность этому, селективное ингибирование СОХ-2 без значительного ингибирования СОХ-1 приводит к противовоспалительным, жаропонижающим, анальгезирующим и другим полезным терапевтическим действиям при минимизации или исключении таких отрицательных побочных действий. Таким образом, селективно ингибирующие СОХ-2 лекарственные средства обеспечивают основной прогресс в данной области. Эти лекарственные средства изготовляют в виде различных перорально доставляемых лекарственных форм.
Парентеральные пути введения, включая подкожную, внутримышечную и внутривенную инъекцию, обеспечивают многочисленные преимущества по сравнению с пероральной доставкой в определенных ситуациях для большого числа лекарственных средств. Например, парентеральное введение лекарственного средства обычно приводит к достижению терапевтически эффективной концентрации лекарственного средства в сыворотке крови за более короткое время, чем может быть достигнуто при пероральном введении. Это особенно справедливо для внутривенной инъекции, посредством которой лекарственное средство вводят непосредственно в кровоток. Парентеральное введение приводит также к более предсказуемым концентрациям лекарственного средства в сыворотке крови, поскольку исключаются потери в желудочно-кишечном тракте вследствие метаболизма, связывания с пищей и других причин. Из-за сходных причин парентеральное введение часто позволяет снизить дозу. Парентеральное введение обычно является предпочтительным способом доставки лекарственного средства при критических состояниях и является также полезным при лечении пациентов, которые не взаимодействуют с окружающими, находятся без сознания или по иным причинам не могут или не желают принимать пероральную лекарственную терапию.
Относительно мало NSAID являются коммерчески доступными в инъецируемой форме. Неселективные NSAID, такие как соль трометамина и кеторолака, которые являются доступными для парентерального использования, являются эффективными анальгетиками, но связаны с побочными действиями, типичными для таких неселективных NSAID. Эти побочные действия включают образование язвы и кровотечение в верхней части желудочно-кишечного тракта, особенно у старшего поколения; пониженную почечную функцию, что потенциально приводит к застою жидкости и обострению гипертензии; и ингибирование функции тромбоцитов, что потенциально предрасполагает субъекта к усиленному кровотечению, например, во время хирургической операции. Такие побочные действия серьезно ограничивают использование парентеральных препаратов неселективных NSAID.
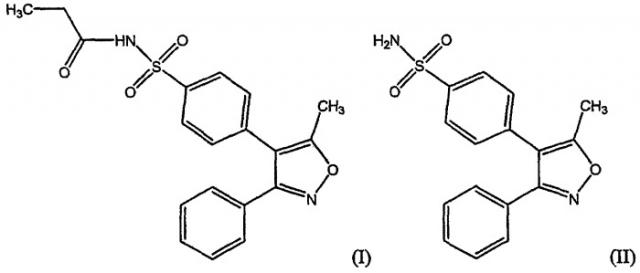
Парекоксиб, описанный в патенте США № 5932598 на имя Talley et al., является представителем класса водорастворимых пролекарств селективных СОХ-2-ингибирующих лекарственных средств. Парекоксиб быстро превращается по существу в водонерастворимое селективное СОХ-2-ингибирующее лекарственное средство валдекоксиб после введения пациенту. Парекоксиб превращается в валдекоксиб также при воздействии воды, например, при растворении в воде. Высокая растворимость в воде парекоксиба, особенно солей парекоксиба, таких как натриевая соль, по сравнению с большинством селективных СОХ-2-ингибирующих лекарственных средств, таких как целекоксиб и валдекоксиб, вызывает интерес к разработке парекоксиба для парентерального использования. Парекоксиб, имеющий приведенную ниже структурную формулу (I), сам обнаруживает in vitro слабую ингибирующую активность как против СОХ-1, так и СОХ-2, тогда как валдекоксиб (II) обладает сильной ингибирующей активностью против СОХ-2, но является слабым ингибитором СОХ-1.
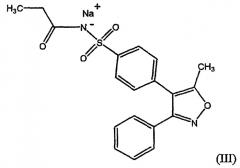
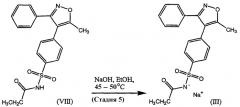
Натриевая соль парекоксиба имеет структурную формулу (III), показанную ниже.
В вышеуказанном патенте США № 5932598 в примере 18 описана натриевая соль парекоксиба. Парекоксиб может быть синтезирован способом, описанным в примерах 13 и 14, с замещением подходящего сульфонамида и ангидрида.
Существует потребность в стабильной кристаллической форме парекоксиба, подходящей в качестве активного фармацевтического ингредиента (API), иначе называемого здесь "лекарственным веществом", которая может быть дополнительно обработана для получения фармацевтической композиции для терапевтического использования.
Кристаллическая структура натриевой соли парекоксиба не охарактеризована в цитированном выше патенте США № 5932598, за исключением описания точки плавления 271,5-272,7°С. Однако описанный здесь способ включает стадию кристаллизации из этанола, стадию, в которой, как показано здесь ниже, образуется сольват этанола. Точка плавления не является показателем формы твердого состояния, так как все кристаллические формы, до сих пор идентичные, обнаруживают сходную точку плавления, в некоторых случаях после фазового превращения.
Для получения товарного лекарственного вещества безводные несольватированные кристаллические формы являются обычно предпочтительными по сравнению с сольватами и гидратами по различным причинам, включая тенденцию таких безводных несольватированных форм проявлять повышенную физическую стабильность. Таким образом, существует особая потребность в данной области в безводной несольватированной кристаллической форме натриевой соли парекоксиба, особенно для такой кристаллической формы, имеющей низкую гигроскопичность.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Здесь предлагается натриевая соль парекоксиба в кристаллической форме, которая является по существу безводной и по существу несольватированной. Теперь были идентифицированы различные такие безводные и несольватированные кристаллические формы.
В первом варианте осуществления предложена форма А. Эта кристаллическая форма натриевой соли парекоксиба является безводной и несольватированной и характеризуется, по меньшей мере, картиной порошковой рентгенограммы (PXRD), имеющей по меньшей мере две величины 2θ, выбранные из группы, состоящей из величин 5,6, 9,6, 11,0 и 14,5 градусов.
Должно быть понятно, что все данные здесь ссылки на величину 2θ являются приблизительными и могут включать нормальную ошибку измерения, в зависимости от используемой аппаратуры и регулировки, например, ошибку ±0,2 градуса 2θ.
Во втором варианте осуществления предложена форма В. Эта кристаллическая форма натриевой соли парекоксиба является безводной и несольватированной и характеризуется, по меньшей мере, картиной PXRD, имеющей по меньшей мере две величины 2θ, выбранные из группы, состоящей из величин 4,2, 8,3, 12,4, 16,7, 17,5, 20,8 и 24,7 градуса.
В третьем варианте осуществления предложена форма Е. Эта кристаллическая форма натриевой соли парекоксиба является безводной и несольватированной и характеризуется, по меньшей мере, картиной PXRD, имеющей по меньшей мере две величины 2θ, выбранные из группы, состоящей из величин 8,8, 11,3, 15,6, 22,4, 23,5 и 26,4 градуса.
Предлагается также лекарственное вещество натриевой соли парекоксиба, в котором по меньшей мере приблизительно 90%, предпочтительно, по меньшей мере приблизительно 95%, более предпочтительно, по существу вся натриевая соль парекоксиба, является одной или несколькими безводными несольватированными кристаллическими формами, описываемыми выше. Такое лекарственное вещество является стабильным при хранении промежуточным продуктом, который может быть дополнительно обработан, например, растворением или диспергированием в водной среде вместе с одним или несколькими парентерально приемлемыми эксципиентами с последующей лиофилизацией образовавшегося раствора или суспензии для получения пересоздаваемой инъецируемой композиции, подходящей для терапевтического использования.
Также предложен способ лечения СОХ-2-опосредованного заболевания у пациента, причем указанный способ включает введение пациенту терапевтически эффективного количества фармацевтической композиции, содержащей такое лекарственное вещество натриевой соли парекоксиба и по меньшей мере один фармацевтически приемлемый эксципиент.
Также предложен способ использования такого лекарственного вещества натриевой соли парекоксиба при изготовлении лекарственного средства для лечения СОХ-2-опосредованного заболевания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показана картина PXRD формы А натриевой соли парекоксиба по примеру 4.
На фиг.2 показан инфракрасный спектр с преобразованием Фурье (FTIR) формы А натриевой соли парекоксиба по примеру 5.
На фиг.3 показана термограмма дифференциальной сканирующей калориметрии (DSC) формы А натриевой соли парекоксиба по примеру 6.
На фиг.4 показан профиль сорбции влаги при 25°С для формы А по примеру 7.
На фиг.5 показана картина PXRD формы В натриевой соли парекоксиба по примеру 4.
На фиг.6 показан спектр FTIR формы В натриевой соли парекоксиба по примеру 5.
На фиг.7 показана термограмма DSC формы В натриевой соли парекоксиба по примеру 6.
На фиг.8 показан профиль сорбции влаги при 25°С для формы В по примеру 7.
На фиг.9 показана картина PXRD формы Е натриевой соли парекоксиба по примеру 4.
На фиг.10 показан спектр FTIR формы Е натриевой соли парекоксиба по примеру 5.
На фиг.11 показана термограмма DSC формы Е натриевой соли парекоксиба по примеру 6.
На фиг.12 показан профиль сорбции влаги при 25°С для формы Е по примеру 7.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что натриевая соль парекоксиба существует в виде неожиданно большого числа безводных несольватированных кристаллических форм. Обнаружение и получение характеристик этих кристаллических форм, каждая из которых проявляет преимущества при получении, очистке, хранении и изготовлении препарата натриевой соли парекоксиба, обеспечивают основное преимущество в данной области повышением экономической обоснованности важного нового терапевтического агента.
Обнаружены также многочисленные гидраты и сольваты. Они обладают тенденцией к нестабильности, постепенно высвобождая воду или растворитель и превращаясь в другие формы стабильных состояний. Возможно, что некоторые величины 2θ, указанные здесь в качестве характеристики картины PXRD форм А, В или Е, могут также встречаться в гидрате или сольвате. Однако новые безводные несольватированные кристаллические формы настоящего изобретения легко отличают от таких гидратов или сольватов благодаря стабильности их картины PXRD в условиях, в которых гидраты и сольваты являются нестабильными вследствие высвобождения воды и растворителя из кристаллической решетки.
Форма А
Первая из новых безводных несольватированных кристаллических форм демонстрирует картину PXRD, имеющую по меньшей мере две величины 2θ, выбранные из группы, состоящей из величин 5,6, 9,6, 11,0 и 14,5 градуса, и описана здесь как форма А. В альтернативном случае или кроме этого, форма А может быть характеризована картиной PXRD, имеющей величины 2θ, находящиеся по существу в соответствии с таблицей 1 в примере 5. В альтернативном случае или кроме этого, форма А может быть характеризована картиной PXRD по существу в соответствии с фиг.1.
В альтернативном случае или кроме этого, форма А может быть характеризована спектром FTIR по существу в соответствии с фиг.2.
В альтернативном случае или кроме этого, форма А может быть характеризована термограммой DSC по существу в соответствии с фиг.3.
В одном предпочтительном варианте осуществления изобретения предложено лекарственное вещество натриевой соли парекоксиба, где по меньшей мере приблизительно 90%, более предпочтительно, по меньшей мере приблизительно 95% и еще более предпочтительно, по существу вся натриевая соль парекоксиба присутствует в виде формы А. Такое лекарственное вещество является пригодным в количестве по меньшей мере приблизительно 1 г, предпочтительно, по меньшей мере приблизительно 10 г, более предпочтительно, по меньшей мере приблизительно 100 г и, наиболее предпочтительно, по меньшей мере приблизительно 1 кг, для хранения в промышленном масштабе натриевой соли парекоксиба и для дальнейшей обработки при изготовлении формы лекарственного продута натриевой соли парекоксиба, подходящей для терапевтического введения.
Форма В
Вторая из новых безводных несольватированных кристаллических форм демонстрирует картину PXRD, имеющую по меньшей мере две величины 2θ, выбранные из группы, состоящей из величин 4,2, 8,3, 12,4, 16,7, 17,5, 20,8 и 24,7 градуса, и описана здесь как форма В. В альтернативном случае или кроме этого, форма В может быть характеризована картиной PXRD, имеющей величины 2θ, находящиеся по существу в соответствии с таблицей 2 в примере 5. В альтернативном случае или кроме этого форма В может быть характеризована картиной PXRD по существу в соответствии с фиг.5.
В альтернативном случае или кроме этого, форма В может быть характеризована спектром FTIR по существу в соответствии с фиг.6.
В альтернативном случае или кроме этого, форма В может быть характеризована термограммой DSC по существу в соответствии с фиг.7.
В другом предпочтительном варианте осуществления изобретения предложено лекарственное вещество натриевой соли парекоксиба, где по меньшей мере приблизительно 90%, более предпочтительно, по меньшей мере приблизительно 95% и еще более предпочтительно, по существу вся натриевая соль парекоксиба присутствует в виде формы В.
Форма Е
Третья из новых безводных несольватированных кристаллических форм демонстрирует картину PXRD, имеющую по меньшей мере две величины 2θ, выбранные из группы, состоящей из величин 8,8, 11,3, 15,6, 22,4, 23,5 и 26,4 градуса, и описана здесь как форма Е. В альтернативном случае или кроме этого, форма Е может быть характеризована картиной PXRD, имеющей величины 2θ, находящиеся по существу в соответствии с таблицей 3 в примере 5. В альтернативном случае или кроме этого, форма Е может быть характеризована картиной PXRD по существу в соответствии с фиг.9.
В альтернативном случае или кроме этого, форма Е может быть характеризована спектром FTIR по существу в соответствии с фиг.10.
В альтернативном случае или кроме этого форма Е может быть характеризована термограммой DSC по существу в соответствии с фиг.11.
Еще в одном предпочтительном варианте осуществления изобретения предложено лекарственное вещество натриевой соли парекоксиба, где по меньшей мере приблизительно 90%, более предпочтительно, по меньшей мере приблизительно 95% и еще более предпочтительно, по существу вся натриевая соль парекоксиба присутствует в виде формы Е.
Получение натриевой соли парекоксиба
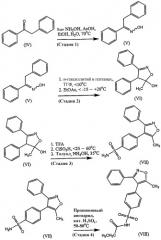
Натриевую соль парекоксиба, пригодную при получении любых безводных несольватированных кристаллических форм или любого из лекарственных веществ натриевой соли парекоксиба, описанных выше, могут быть получены любым подходящим способом, включая способы, известные сами по себе. В одном таком способе синтез натриевой соли парекоксиба (III) включает пять химических стадий, начиная с коммерчески доступных исходных материалов, и показан на схеме 1.
Схема 1
В первой стадии в реакционный сосуд загружают 210 кг дезоксибензоина (IV), 711 литров этанола и 77 литров 80% водной уксусной кислоты. В альтернативном случае могут быть использованы ледяная уксусная кислота (63 литра) и вода (16,5 литра). Смесь нагревают до 70°С и добавляют 71 литр 50% водного гидроксиламина и 55 литров воды. Смесь выдерживают при 70°С в течение по меньшей мере 1 часа. В процессе реакции проводят проверку для гарантии того, что количество не прореагировавшего дезоксибензоина (IV) составляет не более чем 0,5%.
Смесь охлаждают и выдерживают при 45°С, в то время как добавляют воду (266 литров) для кристаллизации продукта. В смесь можно вносить затравку, если кристаллизация не начинается. Температуру смеси поддерживают при 45°С в течение по меньшей мере 1 часа и затем медленно добавляют воду (816 литров) для полного осаждения продукта. Смесь охлаждают до 20°С и выдерживают при 20°С в течение по меньшей мере 1 часа.
Продукт выделяют, промывают смесью этанола и воды (по меньшей мере 420 литров, имеющей отношение этанола к воде 1:2) и затем водой (по меньшей мере, 168 литров). Продукт сушат при температуре до 55°С в вакууме до тех пор, пока остаточное количество воды будет не больше, чем 0,5%, получая при этом оксим 1,2-дифенилэтанона (V) с обычным выходом 223 кг (106 мас.%).
Во второй стадии в реакционный сосуд загружают оксим 1,2-дифенилэтанона (V) (93 кг) и тетрагидрофуран (ТГФ, 620 литров).
Раствор охлаждают и добавляют н-гексиллитий (248 кг) при поддержании температуры 10°С или ниже. Для споласкивания линий переноса используют минимальное количество гептана и жидкость после споласкивания добавляют к реакционной смеси.
После завершения добавления н-гексиллития реакционную смесь охлаждают до -15°С или ниже и добавляют этилацетат (237 литров). Реакционную смесь гасят добавлением ее к раствору хлорида натрия (41 кг) в воде (474 литра) при поддержании температуры при 15°С или ниже. Реакционный сосуд и линии переноса споласкивают этилацетатом (118 литров).
Слои разделяют и органическую фазу промывают раствором бикарбоната натрия (28,4 кг) в воде (474 литра). Органическую фазу разбавляют толуолом (355 литров) и смесь перегоняют при атмосферном давлении до удаления приблизительно двух третей массы. Горячий раствор разбавляют гептаном (1300 литров), охлаждают до 5°С и выдерживают при 5°С в течение по меньшей мере 1 часа. Осажденный продукт отделяют и промывают смесью гептана и толуола (по меньшей мере 110 литров, имеющий отношение гептана к толуолу 1:1).
Продукт сушат в вакууме при температуре до 50°С, потери при сушке (LOD) будут не более чем 0,5%, получая при этом 4,5-дигидро-5-метил-3,4-дифенил-5-изоксазолол (VI) с обычным выходом 72 кг (77 мас.%).
В третьей стадии в реакционный сосуд загружают 4,5-дигидро-5-метил-3,4-дифенил-5-изоксазолол (VI) (152 кг) и трифторуксусную кислоту (TFA, 116 литров). Смесь охлаждают и добавляют хлорсульфоновую кислоту (705 кг) при поддержании температуры реакционной смеси ниже 25°С.
После завершения добавления реакционную смесь медленно нагревают до 60°С и выдерживают при 60°С в течение 1 часа. Реакционную смесь охлаждают и гасят добавлением ее к смеси воды (456 литров) и толуола (570 литров), которую выдерживают при температуре ниже 25°С во время этого добавления. Реакционный сосуд и линии переноса споласкивают смесью воды (152 литра) и толуола (61 литр). Слои разделяют и органическую фазу промывают водой (220 литров).
Органическую фазу обрабатывают водным гидроксидом аммония (190 литров) и смесь нагревают до 35°С и выдерживают при 35°С в течение по меньшей мере 30 минут. В процессе реакции проводят проверку для гарантии того, что рН водной фазы не меньше, чем 9.
Добавляют изопропиловый спирт (729 литров) и смесь выдерживают при 35°С в течение по меньшей мере 1 часа. Смесь охлаждают до 20°С и выдерживают при 20°С в течение по меньшей мере 1 часа. Осажденный продукт выделяют и промывают изопропиловым спиртом (304 литра) и затем водой (по меньшей мере 101 литр).
Неочищенный продукт растворяют в горячем метаноле (709 литров). Раствор фильтруют для удаления осадков и разбавляют дополнительным метанолом (355 литров) и водой (274 литра). Смесь нагревают до 70°С для растворения твердого вещества и затем медленно охлаждают для инициирования кристаллизации продукта. В смесь можно вносить затравку, если кристаллизация не начинается ко времени, когда температура достигает 45°С. После того, как происходит кристаллизация, смесь перемешивают при 50°С в течение по меньшей мере 1 часа и затем медленно охлаждают до 5-10°С и выдерживают при такой температуре в течение по меньшей мере 1 часа. Продукт выделяют и промывают смесью метанола и воды (по меньшей мере 95 литров при отношении метанола к воде 3:1). В альтернативном случае продукт может быть очищен перекристаллизацией из смеси этанола (1300 литров) и воды (68 литров) с использованием такой же процедуры, какая описана выше.
Продукт сушат в вакууме при температурах до 100°С до тех пор, пока количество остаточных растворителей, определенных LOD или газовой хроматографией, не будет больше, чем 0,5%, получая при этом 4-(5-метил-3-фенил-4-изоксазолил)бензолсульфонамид (VII) с обычным выходом 103 кг (62 мас.%).
В четвертой стадии в реакционный сосуд загружают 4-(5-метил-3-фенил-4-изоксазолил)бензолсульфонамид (VII) (21 кг) и пропионовый ангидрид (86 кг). Образовавшуюся суспензию нагревают до 50°С и добавляют серную кислоту (21 мл). Реакционную смесь нагревают до 80°С и выдерживают в течение по меньшей мере 30 минут.
Смесь медленно охлаждают до 50°С для инициирования кристаллизации продукта. Смесь выдерживают при 50°С в течение по меньшей мере 30 минут после инициирования кристаллизации. В смесь можно вносить затравку, если кристаллизация не начинается при 50°С. Смесь медленно охлаждают до 0°С и выдерживают в течение по меньшей мере 1 часа для завершения кристаллизации.
Продукт отделяют, промывают метил-трет-бутиловым эфиром (80 литров) и частично сушат на фильтре до тех пор, пока проверка не покажет, что LOD составляет не больше, чем 5%, получая при этом н-[[4-(5-метил-3-фенил-4-изоксазолил)фенил]сульфонил]пропанамид (VIII) в виде влажного осадка, который переносят непосредственно на пятую стадию без дополнительной очистки или сушки.
В пятой стадии влажный осадок, полученный в четвертой стадии, растворяют в абсолютном этаноле (12,6 кг/кг (VIII), в расчете на сухую массу) при 45°С и смесь фильтруют для удаления частиц.
В отдельном реакционном сосуде получают раствор гидроксида натрия (приблизительно 5 мас.%) в абсолютном этаноле и молярность раствора определяют титрованием. Вычисленное количество раствора гидроксида натрия добавляют через фильтр на линии к раствору (VIII) в этаноле и смесь выдерживают при 45°С и добавляют в нее затравку для инициирования кристаллизации.
После внесения затравки смесь нагревают до 50°С, выдерживают в течение по меньшей мере 30 минут и затем охлаждают до 0°С для завершения кристаллизации. Смесь перемешивают при 0°С в течение по меньшей мере 30 минут и продукт выделяют и промывают холодным абсолютным этанолом (по меньшей мере, 88 кг).
Наконец, продукт сушат в вакууме при температуре до 135°С, получая при этом натриевую соль парекоксиба (III) с обычным выходом 17,2 кг (82 мас.%).
Должно быть понятно, что описанный выше способ предложен для иллюстративных целей. Варианты указанного выше способа, не выходящие за пределы настоящего изобретения, включающие условия и масштаб способа, легко могут быть сделаны специалистом данной области техники.
Получение форм А, В и Е натриевой соли парекоксиба
Неожиданно было обнаружено, что во время пятой стадии вышеописанного способа небольшие изменения в условиях сушки вызывают образование различных безводных сольватированных и гидратированных кристаллических форм. По меньшей мере часть полученной натриевой соли парекоксиба обычно находится в форме сольвата этанола. Можно получить сольваты этанола натриевой соли парекоксиба, имеющие различные стехиометрии, т.е. больше или меньше сольватов этанола, что непосредственно связано с эффективностью сушки.
Вне зависимости от кристаллической формы натриевой соли парекоксиба, полученной в пятой стадии, если температуру повышают приблизительно до 210°С во время или после сушки, натриевая соль парекоксиба превращается в форму А. При охлаждении натриевая соль парекоксиба сохраняется в виде формы А.
В соответствии с этим предложен первый способ получения формы А натриевой соли парекоксиба, содержащий стадию нагревания кристаллической формы натриевой соли парекоксиба, отличной от формы А, до температуры приблизительно от 210°С до точки плавления натриевой соли парекоксиба в течение периода времени, достаточного для превращения натриевой соли парекоксиба в форму А, и охлаждения образовавшейся формы А натриевой соли парекоксиба до температуры окружающей среды.
Кроме того, было обнаружено, что смесь формы А и сольвата этанола натриевой соли парекоксиба может быть превращена по существу в чистую форму А нагреванием смеси при давлении окружающей среды в течение приблизительно 3 часов приблизительно при 150°С.
В соответствии с этим предложен второй способ получения формы А натриевой соли парекоксиба, включающий стадию нагревания сольвата этанола натриевой соли парекоксиба в присутствии формы А натриевой соли парекоксиба до температуры приблизительно от 150°С до точки плавления натриевой соли парекоксиба в течение периода, достаточного для превращения сольвата этанола в форму А, и охлаждение образовавшейся формы А натриевой соли парекоксиба до температуры окружающей среды.
Также было обнаружено, что аморфная форма натриевой соли парекоксиба, которая может быть получена растворением любой твердой формы натриевой соли парекоксиба в воде с последующей лиофилизацией, превращается в форму А при нагревании приблизительно от 125°С до приблизительно 130°С в отсутствие влаги.
В соответствии с этим, предложен третий способ получения формы А натриевой соли парекоксиба, включающий стадию нагревания аморфной или лиофилизованной натриевой соли парекоксиба, по существу в отсутствие влаги, до температуры приблизительно от 125°С до точки плавления натриевой соли парекоксиба в течение периода, достаточного для превращения аморфной или лиофилизованной натриевой соли парекоксиба в форму А, и охлаждение образовавшейся формы А натриевой соли парекоксиба до температуры окружающей среды.
Способ получения лекарственного вещества натриевой соли парекоксиба, содержащего по меньшей мере 90% формы А, включает стадии (а) кристаллизации натриевой соли парекоксиба из кристаллизующего растворителя (например, этанола) для получения кристаллической формы натриевой соли парекоксиба и (b) нагревания образовавшейся кристаллической натриевой соли парекоксиба при температуре приблизительно от 110°С до приблизительно 230°С для получения требуемого лекарственного вещества натриевой соли парекоксиба.
При уровнях относительной влажности (RH) выше, чем приблизительно 60% RH, форма А превращается со временем в гидратированную кристаллическую форму. Полное превращение в гидрат происходит, например, после выдерживания формы А под воздействием приблизительно 75% RH в течение от приблизительно 3 до приблизительно 7 дней. Было обнаружено, что когда такой гидрат сушат при температуре окружающей среды, например, сушкой над эффективным дессикантом, таким как Р2О5, форма твердого состояния не превращается опять в форму А, но вместе этого становится формой В.
В соответствии с этим, предложен способ получения формы В натриевой соли парекоксиба, включающий стадию сушки гидратированной кристаллической формы натриевой соли парекоксиба над дессикантом при температуре ниже, чем температура, которая вызывает образование формы А, с образованием формы В натриевой соли парекоксиба.
Форма Е натриевой соли парекоксиба может быть получена перекристаллизацией сольвата этанола натриевой соли парекоксиба из гептана с образованием кристаллов формы Е.
Свойства форм А, В и Е натриевой соли парекоксиба
Изотермы сорбции влаги для форм А, В и Е при температуре окружающей среды показаны на фиг.4, 8 и 12, соответственно. Форма А сорбирует меньше, чем 1% влаги при RH приблизительно ниже 60%, но при RH приблизительно выше 60% имеет склонность сорбировать воду и даже разжижаться. Формы В и Е являются менее гигроскопичными, чем форма А, тем самым обнаруживая слабую тенденцию к сорбции воды даже при RH приблизительно до 80%.
Более низкая гигроскопичность форм В и Е по сравнению с формой А может быть согласована посредством ссылки на относительную термодинамическую стабильность этих форм твердых состояний. Как показано на диаграмме энергия/температура фиг.17, форма А имеет более высокий уровень энергии, чем формы В и Е, которые сходны друг с другом. Считается, без претензий на теорию, что формы В и Е являются менее гигроскопичными, чем форма А, поскольку они имеют более низкий уровень энергии, т.е. находятся в более термодинамически стабильных состояниях.
Относительная легкость, с которой форма А может быть получена из других форм твердых состояний натриевой соли парекоксиба в промышленном масштабе, например, способом нагревания и охлаждения, является неожиданной и обеспечивает основное коммерческое преимущество формы А. После получения форма А проявляет высокую степень стабильности и в этом отношении обеспечивает преимущество над гидратами и сольватами, например, считается, что результатом способа, предложенного в цитированном выше патенте США № 5932598, является сольват этанола. Существование различных гидратов и сольватов с различными стехиометриями приводит к изменению продукта, которое преодолевается настоящим изобретением. Когда требуется более низкая гигроскопичность, форма В и форма Е имеют преимущество в этом отношении над формой А.
Полезность форм А, В и Е натриевой соли парекоксиба
Как указано ранее, новые кристаллические формы натриевой соли парекоксиба, предложенные настоящим изобретением, являются особенно подходящими для использования в качестве лекарственного вещества или API, которое можно хранить до тех пор, пока оно не будет готово для последующей обработки для получения фармацевтической композиции. Эти формы можно, если нужно, включить как таковые вместе с одним или несколькими фармацевтически приемлемыми эксципиентами в препарат в твердом состоянии, такой как таблетка или капсула для перорального введения или гель или пластырь для местного введения. Если необходимо, размер частиц этих кристаллических форм может быть уменьшен или сделан более равномерным путем размалывания или измельчения или другими физическими способами перед получением препарата.
В альтернативном случае новые кристаллические формы могут быть превращены в некристаллическую форму, например, раствор или аморфную форму, при получении фармацевтической композиции. Например, новые кристаллические формы могут быть рассмотрены как стабильные промежуточные продукты способа.
В одном варианте осуществления настоящего изобретения предложен способ получения фармацевтической композиции, полезной при лечении СОХ-2-опосредованного нарушения, причем способ включает стадию растворения в водной среде лекарственного вещества натриевой соли парекоксиба, где по меньшей мере 90% натриевой соли парекоксиба находится в одной или нескольких формах из форм А, В и Е, вместе по меньшей мере с одним фармацевтически приемлемым эксципиентом, с образованием раствора.
Таким раствором может быть готовая к применению инъецируемая композиция. В альтернативном случае такой раствор может быть подвергнут дополнительной стадии лиофилизации для получения твердой фармацевтической композицией в форме частиц, содержащей натриевую соль парекоксиба. Такая композиция может быть восстановлена добавлением парентерально приемлемого водного разбавителя с образованием инъецируемого раствора натриевой соли парекоксиба. Подразумевается, что термин "раствор", используемый в отношении материала, который нужно лиофилизовать, включает суспензию, а также истинный раствор.
В соответствии с настоящим изобретением, предпочтительно, чтобы по меньшей мере приблизительно 90%, более предпочтительно, по меньшей мере приблизительно 95% лекарственного вещества, которое растворяют в водной среде перед образованием фармацевтической композиции, было формой А или формой В, или формой Е. Наиболее предпочтительно, когда такое лекарственное средство является по существу чистой фазой формы А, формы В или формы Е.
Терапевтический способ применения
Лекарственное вещество согласно изобретению после превращения или включения в фармацевтическую композицию, как указано выше, является полезным при лечении и профилактике очень широкого диапазона нарушений, опосредованных СОХ-2, включая, но не ограничиваясь перечисленным, нарушения, характеризующиеся воспалением, болью и/или лихорадкой. Такие композиции являются особенно ценными в качестве противовоспалительных агентов, таких как агенты для лечении артрита, дополнительное преимущество которых состоит в том, что они обладают значительно менее вредными побочными действиями, особенно при системном введении, чем композиции общепринятых NSAID, которые лишены селективности в отношении СОХ-2 по сравнению с СОХ-1. Таким образом, композиции по изобретению являются особенно полезными в качестве альтернативы общепринятым NSAID, когда такие NSAID являются противопоказанными, например, для пациентов с пептической язвой, гастритом, региональным энтеритом, неспецифическим язвенным колитом, дивертикулитом или с историей болезни с рецидивами желудочно-кишечных повреждений; для лечения желудочно-кишечного кровотечения, нарушений коагуляции, включающих анемию, такую как гипопротромбинемия, гемофилию или другие проблемы кровотечения; заболевания почек, или для введения пациентам перед хирургической операцией или пациентам, получающим антикоагулянты.
Рассматриваемые композиции являются полезными при лечении различных артритных нарушений, включающих, но не ограничивающихся перечисленным, ревматоидный артрит, спондилоатропатии, подагрический артрит, остеоартрит, системную красную волчанку, ювенильный артрит.
Такие композиции являются полезными при лечении астмы, бронхита, менструальных болей, преждевременных родов, тендинита, бурсита, аллергического неврита, цитомегаловирусной инфекции, апоптоза, в том числе ВИЧ-индуцированного апоптоза, люмбаго, заболевания печени, включая гепатит, относящихся к коже состояний, таких как псориаз, экзема, ожоги, дерматит и повреждение ультрафиолетовой радиацией, в том числе солнечный ожог, и послеоперационного воспаления.
Такие композиции являются полезными для лечения желудочно-кишечных состояний, таких как воспалительное заболевание кишечника, болезнь Крона, гастрит, синдром раздраженной толстой кишки и неспецифический язвенный колит.
Такие композиции являются полезными при лечении воспаления при таких заболеваниях, как головные боли типа мигрени, узелковый периартериит, тироидит, гипопластическая анемия, болезнь