Новый фермент, образующий пептид, микроорганизм, продуцирующий данный фермент, и способ синтеза дипептида с их применением
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой фермент, который катализирует реакцию образования пептида из карбоксильного компонента и аминного компонента. Данное изобретение относится также к штаммам микроорганизма рода Empedobacter и рода Sphingobacterium, которые продуцируют данный фермент, и к способу получения дипептидов из карбоксильного компонента и аминного компонента с использованием фермента. Данное изобретение позволяет легко, недорого и с высоким выходом образовывать пептид без проведения сложного способа синтеза. 5 н. и 6 з.п. ф-лы, 18 табл., 3 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к новому ферменту, который может легко, недорого и с высоким выходом образовывать пептид без проведения сложного способа синтеза. Более конкретно данное изобретение относится к новому ферменту, который катализирует реакцию образования пептида из карбоксильного компонента и аминного компонента, к микроорганизму, который продуцирует данный фермент, и к способу получения дипептида с использованием фермента или микроорганизма.
УРОВЕНЬ ТЕХНИКИ
Пептиды используют в области фармацевтических средств, пищевых продуктов и других различных областях. Например, поскольку L-аланил-L-глутамин имеет более высокую стабильность и растворимость в воде, чем L-глутамин, он широко используется в качестве компонента инфузионных жидкостей и бессывороточных сред.
Способы химического синтеза, которые известны в качестве способов получения пептидов, не всегда являются простыми. Известные примеры таких способов включают способ, в котором используют N-бензилоксикарбонилаланин (в дальнейшем, "Z-аланин") и защищенный L-глутамин (смотри Bull. Chem. Soc. Jpn., 34, 739 (1961), Bull. Chem. Soc. Jpn., 35, 1966 (1962)), способ, в котором используют Z-аланин и защищенный сложный -метиловый эфир L-глутаминовой кислоты (смотри Bull. Chem. Soc. Jpn., 37, 200 (1964)), способ, в котором используют сложный эфир Z-аланина и незащищенную глутаминовую кислоту (смотри выложенную публикацию заявки на выдачу патента Японии No. H1-96194), способ, который заключается в синтезе производного N-(2-замещенного)пропионилглутамина в качестве промежуточного продукта из 2-замещенного пропионилгалогенида в качестве исходного вещества (смотри выложенную публикацию заявки на выдачу патента No. H6-234715).
Однако поскольку все указанные способы требуют введения и удаления защитных групп или применения оптически активных промежуточных продуктов, их считают недостаточно удовлетворительными с точки зрения их преимуществ при промышленном применении.
С другой стороны, широко известные примеры типичных способов получения пептидов с использованием ферментов состоят из реакции конденсации, в которой используют N-защищенный и C-незащищенный карбоксильный компонент и N-незащищенный, C-защищенный аминный компонент (в дальнейшем, "реакция 1"), и реакции замещения, в которой используют N-защищенный, C-защищенный карбоксильный компонент и N-незащищенный, C-защищенный аминный компонент (в дальнейшем "реакция 2"). Примером реакции 1 является способ получения сложного метилового эфира Z-аспартилфенилаланина из Z-аспарагиновой кислоты и сложного метилового эфира фенилаланина (смотри выложенную публикацию заявки на выдачу патента Японии No. S53-92729), в то время как примером реакции 2 является способ получения амида ацетилфенилаланиллейцина из сложного этилового эфира ацетилфенилаланина и амида лейцина (смотри Biochemical J., 163, 531 (1977)). Сообщалось очень немного примеров исследования способов, в которых используют N-незащищенный, C-защищенный карбоксильный компонент. Пример реакции замещения, в которой используют N-незащищенный, C-защищенный карбоксильный компонент и N-незащищенный, C-защищенный аминный компонент (в дальнейшем, "реакция 3") описан в международной публикации патента WO 90/01555. Например, может быть указан способ получения амида аргиниллейцина из сложного этилового эфира аргинина и амида лейцина. Примеры реакций замещения, в которых используют N-незащищенный, C-защищенный карбоксильный компонент и N-незащищенный, C-незащищенный аминный компонент (в дальнейшем "реакция 4") описаны в публикациях Европейских патентов EP 278787A1 и EP 359399B1. Например, можно указать способ получения тирозинилаланина из сложного этилового эфира тирозина и аланина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Наиболее дешевый способ получения среди указанных выше способов с использованием реакций 1-4, конечно, относится к классу реакции 4, в которую вовлечено наименьшее количество защитных групп.
Однако пример реакции 4 предшествующего уровня техники (публикация Европейского патента EP 278787A1) имел следующие основные проблемы:
(1) очень низкая скорость образования пептида,
(2) низкий выход образования пептида,
(3) пептиды, которые могут быть получены, ограничены пептидами, которые содержат аминокислоты со сравнительно высокой гидрофобностью,
(4) количество добавляемого фермента очень высокое, и
(5) требуются сравнительно дорогостоящие препараты карбоксипептидазы, полученные из плесневых грибов, дрожжей или растений. В случае реакции 4 не существует ни одного известного способа, в котором используют фермент, полученный из бактерий или других дрожжей, отличных от дрожжей рода Saccharomyces, и не существует известного способа получения аланилглутамина и других пептидов, которые являются высоко гидрофильными. Принимая во внимание данный уровень техники, существует необходимость в разработке промышленно недорогого способа получения указанных пептидов.
Целью данного изобретения является новый фермент, который легко, недорого и с высоким выходом образует пептид без проведения сложного способа синтеза. Более конкретно целью данного изобретения является новый фермент, который катализирует реакцию образования пептида из карбоксильного компонента и аминного компонента, микроорганизм, который продуцирует данный фермент, и способ недорогого получения пептида с использованием фермента или микроорганизма.
Авторы данного изобретения обнаружили новый фермент, который эффективно образует пептид, из вновь открытых бактерий, относящихся к роду Empedobacter, и так далее, и осуществили данное изобретение.
Данное изобретение представляет собой изобретение, которое описано ниже:
[1] Фермент, полученный из микроорганизма, относящегося к роду, выбранному из рода Empedobacter и рода Sphingobacterium, обладающий способностью образовывать пептид из карбоксильного компонента и аминного компонента.
[2] Фермент, обладающий способностью образовывать пептид из карбоксильного компонента и аминного компонента и способностью образовывать L-аланил-L-глутамин со скоростью образования 0,03 мМ/мин или выше в реакции образования дипептида при условиях (i)-(iv):
(i) карбоксильным компонентом является гидрохлорид сложного метилового эфира L-аланина в количестве 100 мМ;
(ii) аминным компонентом является L-глутамин в количестве 200 мМ;
(iii) pH равно 9,0; и
(iv) количество добавляемого гомогенно очищенного фермента составляет менее 0,61 мг/мл в расчете на белок.
[3] Фермент по [1] или [2], в котором карбоксильный компонент в качестве субстрата включает как сложный эфир аминокислоты, так и амид аминокислоты.
[4] Фермент по любому из [1]-[3], в котором любое из аминокислоты, C-защищенной аминокислоты и амина можно использовать в качестве субстрата в случае аминного компонента.
[5] Фермент по любому из [1]-[4], в котором фермент обладает способностью образовывать пептид в диапазоне pH от 6,5 до 10,5.
[6] Фермент по любому из [1]-[5], в котором фермент обладает способностью образовывать пептид в диапазоне температур от 0 до 60°C.
[7] Фермент по любому из [1]-[6], в котором фермент не ингибируется ингибитором серинового фермента, фенилметилсульфонилфторидом, но ингибируется пара-нитрофенил-пара'-гуанидинбензоатом.
[8] Фермент по любому из [1]-[7], в котором фермент имеет молекулярную массу, определенную посредством SDS-гель-электрофореза, составляющую примерно 75 килодальтон, и молекулярную массу, определенную посредством хроматографии на основе гель-фильтрации, составляющую примерно 150 килодальтон.
[9] Микроорганизм, который продуцирует фермент по любому из [1]-[8].
[10] Микроорганизм по [9], в котором микроорганизм представляет собой Empedobacter brevis, штамм FERM BP-8113 (Депозитарный институт: независимая административная корпорация, National Institute for Advanced Industrial Science and Technology, International Patent Organism Depositary, адрес депозитарного института: Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan, дата передачи международного депозита: 8 июля 2002) или Sphingobacterium sp., штамм FERM BP-8124 (депозитарный институт: независимая административная корпорация, National Institute for Advanced Industrial Science and Technology, International Patent Organism Depositary, адрес депозитарного института: Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan, дата передачи международного депозита: 22 июля 2002).
[11] Способ получения дипептида, включающий в себя образование дипептида из карбоксильного компонента и аминного компонента с использованием фермента по любому из [1]-[8] или вещества, содержащего фермент.
КРАТКОЕ ОПИСАНИЕ ФИГУР
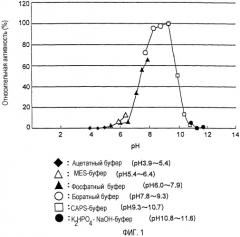
Фиг. 1 является диаграммой, показывающей оптимум pH фермента согласно данному изобретению;
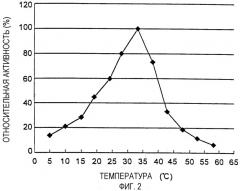
Фиг. 2 является диаграммой, показывающей оптимум температуры фермента согласно данному изобретению; и
Фиг. 3 является диаграммой, показывающей временной ход образования L-аланил-L-глутамина из сложного метилового эфира L-аланина и L-глутамина.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Способы осуществления данного изобретения объясняются подробно в следующем порядке
(1) микроорганизм, продуцирующий фермент согласно данному изобретению,
(2) культивирование микроорганизма,
(3) очистка фермента,
(4) свойства фермента, и
(5) способ синтеза дипептида.
(1) Микроорганизм, продуцирующий фермент согласно данному изобретению
Фермент согласно данному изобретению может представлять собой любой фермент, который обладает способностью образовывать пептид из карбоксильного компонента и аминного компонента, и не существует особого ограничения организмов, которые продуцируют такой фермент. В данном описании карбоксильный компонент относится к компоненту, который обеспечивает карбонильный сайт (CO) в пептидной связи (-CONH-), тогда как аминный компонент относится к компоненту, который обеспечивает амино-сайт (NH) в пептидной связи. Кроме того, в данном описании термин "пептид", используемый отдельно, относится к полимеру, имеющему по меньшей мере одну пептидную связь, если не оговорено особо. Кроме того, термин "дипептид" в данном описании относится к пептиду, имеющему одну пептидную связь.
Примеры микроорганизмов, которые продуцируют фермент согласно данному изобретению, включают бактерии, относящиеся к роду Empedobacter и так далее, конкретные примеры которых включают Empedobacter brevis, штамм ATCC 14234 (штамм FERM P-18545), и Sphingobacterium sp., штамм FERM BP-8124. Empedobacter brevis, штамм ATCC 14234 (штамм FERM P-18545, штамм FERM BP-8113), и Sphingobacterium sp., штамм FERM BP-8124 являются микроорганизмами, которые были отобраны авторами данного изобретения в результате поиска микроорганизмов, которые продуцируют пептид из карбоксильного компонента и аминного компонента с высоким выходом. Микроорганизмы, обладающие бактериологическими свойствами, сходными со свойствами Empedobacter brevis, штамм ATCC 14234 (штамм FERM P-18545) или Sphingobacterium sp., штамм FERM BP-8124 также являются микроорганизмами, которые продуцируют фермент согласно данному изобретению.
Empedobacter brevis, штамм ATCC 14234 (штамм FERM P-18545), депонировали в международном депозитарии патентуемых организмов в National Institute for Advanced Industrial Science and Technology (Central 6, 1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan) 1 октября 2001, и ему присвоен номер депозита FERM P-18545. Контроль данного организма затем передан для депонирования по условиям Будапештского договора в международный депозитарий патентуемых организмов в National Institute for Advanced Industrial Science and Technology 8 июля 2002, и ему был присвоен номер депозита FERM BP-8113 (обозначение микроорганизма: Empedobacter brevis, штамм AJ 13933).
Sphingobacterium sp., штамм AJ 110003, депонировали в международном депозитарии патентуемых организмов в National Institute for Advanced Industrial Science and Technology 22 июля 2002, и ему присвоен номер депозита FERM BP-8124. Следует отметить, что штамм AJ 110003 идентифицировали как вышеуказанный Sphingobacterium sp. посредством экспериментов по идентификации, описанных ниже. Штамм FERM BP-8124 (Депозитарный институт: независимая административная корпорация, National Institute for Advanced Industrial Science and Technology, International Patent Organism Depositary, адрес депозитарного института: Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan, дата международного депозита: 22 июля 2002) является грамотрицательной палочкой (0,7-0,8 х 1,5-2,0 микрометра (мкм)), которая не образует спор и является неподвижной. Ее колонии являются круглыми с совершенно ровной границей, содержат мало выступающих частей и имеют блестящую светло-желтую окраску. Организм растет при 30°C и является позитивным по каталазе, позитивным по оксидазе и негативным в случае OF-теста (глюкоза) и идентифицирован как бактерия, относящаяся к роду Sphingobacterium на основании указанных свойств. Кроме того, на основании свойств, состоящих в том, что микроорганизм является негативным в отношении восстановления нитратов, негативным в отношении продукции индола, негативным в отношении продукции кислоты из глюкозы, негативным по аргининдигидролазе, позитивным по уреазе, позитивным по гидролизу эскулина, негативным по гидролизу желатина, позитивным по Я-галактозидазе, позитивным в отношении ассимиляции глюкозы, негативным в отношении ассимиляции L-арабинозы, позитивным в отношении ассимиляции D-маннозы, негативным в отношении ассимиляции D-маннита, позитивным в отношении ассимиляции N-ацетил-D-глюкозамина, позитивным в отношении ассимиляции мальтозы, негативным в отношении ассимиляции глюконата калия, негативным по н-каприновой кислоте, негативным в отношении ассимиляции адипиновой кислоты, негативным в отношении ассимиляции DL-яблочной кислоты, негативным в отношении ассимиляции цитрата натрия, негативным в отношении ассимиляции фенилацетата и позитивным по цитохромоксидазе, определили, что он обладает свойствами, сходными со свойствами Sphingobacterium multivorum или Sphingobacterium spiritivorum. Кроме того, в результате анализа гомологии последовательности оснований гена 16S рРНК, несмотря на то, что наиболее высокая степень гомологии проявлялась со Sphingobacterium multivorum (98,8%), не было штамма, с которым бы микроорганизм совпадал полностью. Поэтому данный бактериальный штамм идентифицирован как Sphingobacterium sp.
Фермент согласно данному изобретению можно получить посредством выделения и очистки из указанных выше клеток Empedobacter brevis или Sphingobacterium sp. Кроме того, фермент согласно данному изобретению, а также микроорганизмы, которые продуцируют фермент, также можно получить с помощью способов генной инженерии на основании выделенного фермента. А именно, фермент и микроорганизм согласно данному изобретению можно получить выделением ДНК, которая кодирует фермент согласно данному изобретению, на основании выделенного и очищенного фермента с последующей экспрессией ДНК посредством введения ДНК в подходящего хозяина. Кроме того, фермент, обладающий способностью образовывать пептид из карбоксильного компонента и аминного компонента, также можно получить из других микроорганизмов, получая зонд, основанный на полинуклеотиде, и т.д., который кодирует фермент согласно данному изобретению, полученный из Empedobacter brevis. Различные способы рекомбинации генов описаны в Molecular Cloning, 2nd edition, Cold Spring Harbor Press (1989) и других публикациях.
(2) Культивирование микроорганизмов
Чтобы получить культивируемые клетки микроорганизмов, имеющие фермент, используемый в данном изобретении, достаточно культивировать и выращивать микроорганизмы в подходящей среде. Не существует особых ограничений среды, используемой для данной цели, при условии, что она обеспечивает возможность роста микроорганизма. Указанной средой может быть обычная среда, содержащая обычные источники углерода, источники азота, источники фосфора, источники серы, неорганические ионы и источники органических питательных веществ, которые необходимы.
Например, можно использовать любой источник углерода при условии, что микроорганизм может его утилизировать. Конкретные примеры источника углерода, которые можно использовать, включают сахара, такие как глюкоза, фруктоза, мальтоза и амилоза, спирты, такие как сорбит, этанол и глицерин, органические кислоты, такие как фумаровая кислота, лимонная кислота, уксусная кислота и пропионовая кислота, и их соли, углеводороды, такие как парафин, а также их смеси.
Примеры источников азота, которые можно использовать, включают аммонийные соли неорганических кислот, такие как сульфат аммония и хлорид аммония, аммонийные соли органических кислот, такие как фумарат аммония и цитрат аммония, нитраты, такие как нитрат натрия и нитрат калия, органические азотсодержащие соединения, такие как пептоны, дрожжевой экстракт, мясной экстракт и кукурузный экстракт, а также их смеси.
Кроме того, обычные источники питательных веществ, используемые в средах, такие как неорганические соли, соли микроэлементов металлов и витамины, также можно соответствующим образом смешивать и использовать.
Не существует особых ограничений условий культивирования, и культивирование можно, например, осуществлять в течение примерно от 12 до 48 часов, надлежащим образом контролируя pH и температуру в пределах pH от 5 до 8, и в диапазоне температур от 15 до 40°C, соответственно, в аэробных условиях.
(3) Очистка фермента
Способ выделения и очистки образующего пептид фермента из Empedobacter brevis объясняется в виде примера очистки фермента согласно данному изобретению. Сначала получают экстракт клеток микроорганизмов, например, из клеток микроорганизмов Empedobacter brevis, штамм FERM BP-8113 (Депозитарный институт: независимая административная корпорация, National Institute for Advanced Industrial Science and Technology, International Patent Organism Depositary, Адрес депозитарного института: Central 6, 1-1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan, дата передачи международного депозита: 8 июля 2002), и тому подобных разрушением клеток с использованием физического способа, такого как разрушение ультразвуком или ферментативным способом с использованием фермента, растворяющего клеточную стенку, и удаления нерастворимой фракции разделением на основе центрифугирования и т.д.
Фермент, образующий пептид, затем можно очистить из клеточного экстракта, полученного описанным выше способом, комбинируя обычные способы очистки белков, такие как анионообменная хроматография, катионообменная хроматография или хроматография на основе гель-фильтрации.
Примером носителя для использования в анионообменной хроматографии является Q-сефароза HP (производства Amersham). Фермент извлекают в неадсорбируемой фракции в условиях pH 8,5, обеспечивая возможность прохождения клеточного экстракта, содержащего фермент, через колонку, заполненную носителем.
Примером носителя для использования в катионообменной хроматографии является MonoS HR (производства Amersham). После адсорбции фермента на носителе (в колонке), посредством обеспечения возможности прохождения клеточного экстракта, содержащего фермент, через колонку, заполненную носителем, и затем промывки колонки, фермент элюируют буферным раствором, имеющим высокую концентрацию соли. При этом концентрацию соли можно последовательно увеличивать или градиентно увеличивать. Например, в случае использования MonoS HR фермент, адсорбированный на носителе, элюируют при концентрации NaCl примерно от 0,2 до 0,5 М.
Фермент, очищенный описанным выше образом, затем можно дополнительно очистить до гомогенности хроматографией на основе гель-фильтрации и т.д. Примером носителя для использования в хроматографии на основе гель-фильтрации является Sephadex 200pg (производства Amersham).
Фракцию, которая содержит данный фермент, в ходе указанной выше процедуры очистки можно подтвердить анализом активности в образовании пептида каждой фракции согласно способу, описанному далее.
(4) Свойства фермента согласно данному изобретению
Хотя фермент согласно данному изобретению является ферментом, который обладает способностью образовывать пептид из карбоксильного компонента и аминного компонента, ниже будет дано пояснение предпочтительного типа фермента согласно данному изобретению с точки зрения его свойств.
Фермент, обладающий описанными ниже возможностями, для которого в качестве показателя используется скорость образования дипептида, является предпочтительным типом фермента согласно данному изобретению. А именно предпочтительным типом фермента согласно данному изобретению является фермент, который обладает способностью образовывать пептид из карбоксильного компонента и аминного компонента и способностью обеспечивать скорость образования L-аланил-L-глутамина, равную предпочтительно 0,03 мМ/мин или выше, более предпочтительно 0,3 мМ/мин или выше и особенно предпочтительно 1,0 мМ/мин или выше в реакции образования дипептида в условиях (i)-(iv), описанных ниже. Условия реакции образования дипептида представляют собой следующие условия:
(i) Карбоксильным компонентом является гидрохлорид сложного метилового эфира L-аланина (100 миллимоль (мМ));
(ii) Аминным компонентом является L-глутамин (200 мМ);
(iii) Значение pH равно 9,0; и
(iv) Количество добавляемого гомогенно очищенного фермента составляет менее 0,61 мг/мл в расчете на количество белка.
Вышеуказанное количество добавляемого фермента показывает конечное количество добавленного фермента, которое добавляют в систему реакции, и желательно добавление фермента в количестве 0,01 мг/мл или более и предпочтительно 0,02 мг/мл или более в расчете на количество белка. Термин "количество белка" относится к значению, измеренному колориметрическим способом с применением Кумасси бриллиантового синего, используя раствор CBB для анализа белка (производства Nakarai) и бычий сывороточный альбумин в качестве стандартного вещества.
Вышеуказанная скорость образования намного превосходит обычную скорость образования в случае образования пептида с использованием фермента, и фермент согласно данному изобретению обладает способностью катализировать образование пептида с очень высокой скоростью.
В качестве конкретного примера способа анализа активности фермента активность фермента можно анализировать, обеспечивая возможность взаимодействия фермента в растворе боратного буфера, содержащего сложный эфир аминокислоты и амин в качестве субстратов, с последующим количественным определением полученного в результате пептида. В качестве более конкретного примера ферменту дают возможность взаимодействовать в течение нескольких минут при 25°C, используя 100 мМ раствор боратного буфера (pH 9,0), содержащий 100 мМ сложного метилового эфира L-аланина и 200 мМ L-глутамина.
Единицу активности фермента, используемую в данном изобретении, определяют так, что 1 единица (U) представляет собой количество фермента, которое образует 1 микромоль пептида за 1 минуту в условиях взаимодействия при 25°C с использованием 100 мМ раствора боратного буфера (pH 9,0), содержащего 100 мМ сложного метилового эфира L-аланина и 200 мМ L-глутамина.
Кроме того, предпочтительным типом фермента согласно данному изобретению является фермент, обладающий свойством, благодаря которому в качестве субстрата в виде карбоксильного компонента можно использовать как сложный эфир аминокислоты, так и амид аминокислоты. Слова "в качестве субстрата можно использовать как сложный эфир аминокислоты, так и амид аминокислоты" означают, что по меньшей мере один тип сложного эфира аминокислоты и по меньшей мере один тип амида аминокислоты можно использовать в качестве субстрата. Кроме того, одним предпочтительным типом фермента согласно данному изобретению является фермент, который обладает свойством, благодаря которому в качестве субстрата в виде аминного компонента можно использовать любой компонент: аминокислоту, C-защищенную аминокислоту и амин. Слова "в качестве субстрата можно использовать аминокислоту, C-защищенную аминокислоту и амин" означают, что по меньшей мере один тип аминокислоты, по меньшей мере один тип C-защищенной аминокислоты и по меньшей мере один тип амина можно использовать в качестве субстрата. В результате обладания широким диапазоном субстратной специфичности в отношении карбоксильного компонента или аминокомпонента, фермент согласно данному изобретению является предпочтительным в том смысле, что можно выбрать широкий круг исходных веществ, что в свою очередь имеет преимущества с точки зрения стоимости и производственного оборудования в случае промышленного производства.
Конкретные примеры карбоксильных компонентов включают сложные эфиры L-аминокислот, сложные эфиры D-аминокислот, амиды L-аминокислот и амиды D-аминокислот. Кроме того, сложные эфиры аминокислот включают не только сложные эфиры аминокислот, соответствующие встречающимся в природе аминокислотам, но также сложные эфиры аминокислот, соответствующие не встречающимся в природе аминокислотам или их производным. Кроме того, сложные эфиры аминокислот включают сложные эфиры a-аминокислот, а также сложные эфиры Я-, - и -аминокислот и тому подобное, которые имеют разные участки связывания аминогрупп. Типичные примеры сложных эфиров аминокислот включают метиловые сложные эфиры, этиловые сложные эфиры, н-пропиловые сложные эфиры, изопропиловые сложные эфиры, н-бутиловые сложные эфиры, изобутиловые сложные эфиры и трет-бутиловые сложные эфиры аминокислот и т.д.
Конкретные примеры аминных компонентов включают L-аминокислоты, C-защищенные L-аминокислоты, D-аминокислоты, C-защищенные D-аминокислоты и амины. Кроме того, примеры аминов включают не только встречающиеся в природе амины, но также не встречающиеся в природе амины или их производные. Кроме того, примеры аминокислот включают не только встречающиеся в природе аминокислоты, но также не встречающиеся в природе аминокислоты или их производные. Они включают a-аминокислоты, а также Я-, и -аминокислоты и тому подобное, которые имеют разные участки связывания аминогрупп.
Кроме того, в другом аспекте одним предпочтительным типом фермента согласно данному изобретению является фермент, у которого диапазон значений pH, в пределах которого может быть катализирована реакция образования пептида, составляет от 6,5 до 10,5. Способность фермента согласно данному изобретению катализировать данную реакцию в широком диапазоне pH предпочтительна по той причине, что она позволяет гибко приспосабливать промышленное производство, которое может быть подвержено влиянию различных ограничений. Однако в существующем в настоящее время производстве пептида предпочтительно использовать фермент, дополнительно доведя значение pH до оптимального, соответствующего полученному ферменту с тем, чтобы максимизировать каталитическую эффективность фермента.
Кроме того, другой отличительный аспект предпочтительного типа фермента согласно данному изобретению заключается в том, что он является ферментом, для которого диапазон температуры, на протяжении которого фермент способен катализировать реакцию образования пептида, находится в пределах от 0 до 60°C. Так как фермент согласно данному изобретению способен катализировать реакцию в широком диапазоне температур, он является предпочтительным по той причине, что он позволяет гибко приспосабливать промышленное производство, которое может быть подвержено влиянию различных ограничений. Однако в существующем в настоящее время производстве пептидов предпочтительно использовать фермент, дополнительно доведя температуру до оптимальной, соответствующей полученному ферменту, с тем чтобы максимизировать каталитическую эффективность фермента.
(5) Способ синтеза дипептида
Способ получения дипептида согласно данному изобретению заключается в синтезе дипептида посредством обеспечения возможности для фермента, обладающего способностью образовывать пептид из карбоксильного компонента и аминного компонента, или вещества, которое содержит данный фермент, действовать на карбоксильный компонент и аминный компонент.
В случае способа, обеспечивающего возможность фермента, используемого в данном изобретении, или вещества, содержащего фермент, действовать на карбоксильный компонент и аминный компонент, достаточно, чтобы фермент или вещество, содержащее фермент, карбоксильный компонент и аминный компонент, были смешаны. Более конкретно можно использовать способ, при котором фермент или содержащее фермент вещество добавляют к раствору, содержащему карбоксильный компонент и аминный компонент, и дают возможность взаимодействовать, или, в случае использования микроорганизма, который продуцирует фермент, можно использовать способ, при котором микроорганизм, который продуцирует фермент, культивируют, фермент, присутствующий в микроорганизме или бульоне для культивирования микроорганизмов, продуцируется и накапливается, и затем к культуральному бульону добавляют карбоксильный компонент и аминный компонент. Затем синтезированный дипептид можно собрать разработанными способами и очистить при необходимости.
Термин "вещество, содержащее фермент" относится к веществу, которое содержит фермент, и примеры конкретных форм вещества включают культуру микроорганизмов, которые продуцируют фермент, клетки микроорганизмов, выделенные из культуры, и продукт обработки клеток микроорганизмов. Культура микроорганизмов относится к культуре, которая получена путем культивирования микроорганизмов, и более конкретно к смеси клеток микроорганизмов, среды, используемой для культивирования микроорганизмов, и веществ, продуцируемых культивируемыми микроорганизмами и тому подобного. Кроме того, клетки микроорганизмов можно промыть и использовать в форме промытых клеток микроорганизмов. Кроме того, продукт обработки клеток микроорганизмов включает измельченные, лизированные или высушенные вымораживанием клетки микроорганизмов, а также включает неочищенный фермент, извлеченный путем обработки клеток микроорганизмов, и т.д., а также очищенный фермент, полученный очисткой неочищенного фермента. Частично очищенный фермент, полученный различными видами способов очистки, можно использовать в качестве очищенного фермента или можно использовать иммобилизованный фермент, который был иммобилизован способами ковалентного связывания, адсорбции или включения. Кроме того, поскольку некоторые микроорганизмы частично лизируются во время культивирования в зависимости от используемых микроорганизмов, в таких случаях также можно использовать надосадок культуры в качестве вещества, содержащего фермент.
Кроме того, не только дикие штаммы, но также генетически рекомбинантные штаммы можно использовать в качестве микроорганизмов, которые содержат фермент. Микроорганизмы не ограничены интактными клетками, но лучше также можно использовать обработанные ацетоном клетки микроорганизмов, высушенные вымораживанием клетки микроорганизмов или другие обработанные клетки микроорганизмов. Также можно использовать иммобилизованные клетки микроорганизмов, иммобилизованные способами ковалентного связывания, адсорбции, включения или другими способами, а также обработанные иммобилизованные клетки микроорганизмов.
Следует отметить, что в случае использования культур, культивируемых клеток микроорганизмов или продукта обработки клеток микроорганизмов, имеется много случаев, при которых существует фермент, который не принимает участия в образовании пептидов, а расщепляет образованные пептиды, и в таких случаях весьма предпочтительно добавлять ингибитор металлопротеаз, такой как этилендиаминтетрауксусную кислоту (EDTA), в зависимости от случая. Добавляемое количество находится в пределах от 0,1 мМ до 300 мМ и предпочтительно от 1 мМ до 100 мМ.
Количество используемого фермента или содержащего фермент вещества должно представлять собой количество, при котором проявляется целевой эффект (в дальнейшем "эффективное количество"). Хотя специалист в данной области легко может определить такое эффективное количество посредством простого предварительного экспериментирования, в случае использования фермента его используемое количество, например, составляет примерно от 0,01 до 100 единиц (U), тогда как в случае использования промытых клеток микроорганизмов его используемое количество составляет примерно от 1 до 500 г/л.
Можно использовать любой карбоксильный компонент при условии, что он способен образовывать пептид при конденсации с другим субстратом в форме аминного компонента. Примеры карбоксильных компонентов включают сложные эфиры L-аминокислот, сложные эфиры D-аминокислот, амиды L-аминокислот и амиды D-аминокислот. Примеры сложных эфиров аминокислот включают не только сложные эфиры аминокислот, соответствующие встречающимся в природе аминокислотам, но также сложные эфиры аминокислот, соответствующие не встречающимся в природе аминокислотам или их производным. Кроме того, примеры сложных эфиров аминокислот включают сложные эфиры a-аминокислот, а также сложные эфиры Я-, - и -аминокислот и тому подобное, которые имеют разные участки связывания аминогрупп. Типичные примеры сложных эфиров аминокислот включают метиловые сложные эфиры, этиловые сложные эфиры, н-пропиловые сложные эфиры, изопропиловые сложные эфиры, н-бутиловые сложные эфиры, изобутиловые сложные эфиры и трет-бутиловые сложные эфиры аминокислот.
Можно использовать любой аминный компонент при условии, что он способен образовывать пептид при конденсации с другим субстратом в форме карбоксильного компонента. Примеры аминных компонентов включают L-аминокислоты, C-защищенные L-аминокислоты, D-аминокислоты, C-защищенные D-аминокислоты и амины. Кроме того, примеры аминов включают не только встречающиеся в природе амины, но также не встречающиеся в природе амины или их производные. Примеры аминокислот включают не только встречающиеся в природе аминокислоты, но также не встречающиеся в природе аминокислоты или их производные. Они включают a-аминокислоты, а также Я-, - и -аминокислоты и тому подобное, которые имеют разные участки связывания аминогрупп.
Хотя концентрации карбоксильного компонента и аминного компонента, служащих в качестве исходных веществ, составляют от 1 мМ до 10 М, и предпочтительно от 0,05 моль (М) до 2 М, соответственно, имеют место случаи, при которых предпочтительно добавлять аминный компонент в количестве, равном или превышающем количество карбоксильного компонента. Кроме того, в случае субстратов, которые ингибируют реакцию при высоких концентрациях, их количество необходимо довести до концентрации, которая не приводит к ингибированию, и благополучно добавлять во время реакции.
Температура реакции, которая позволяет образовывать пептид, составляет от 0 до 60°C и предпочтительно от 5 до 40°C. Значение pH реакционной смеси, которое позволяет образовывать пептид, составляет от 6,5 до 10,5 и предпочтительно от 7,0 до 10,0.
ПРИМЕРЫ
Хотя нижеследующее дает более подробное объяснение данного изобретения с помощью примеров, данное изобретение не ограничено указанными примерами. Кроме подтверждения окрашиванием нингидрином тонкослойных хроматограмм (качественных) осуществляли количественные определения посредством последующей высокоэффективной жидкостной хроматографии, чтобы проанализировать продукты. Колонка: InertsiL ODS-2 (производства GL Science, Inc.), элюат: водный фосфатный раствор, содержащий 5,0 мМ 1-октансульфонат натрия (pH 2,1):метанол=100:15-50, расход: 1,0 мл/мин, регистрация: 210 нанометров (нм).
Пример 1. Культивирование микроорганизмов (Empedobacter brevis, штамм FERM BP-8113)
50 мл среды (pH 6,2), содержащей 5 грамм (г) глюкозы, 5 г сульфата аммония, 1 г однозамещенного фосфата калия, 3 г двухзамещенного фосфата калия, 0,5 г сульфата магния, 10 г дрожжевого экстракта и 10 г пептона в 1 литре (л) переносили в колбу Сакагучи объемом 500 мл и стерилизовали при 115°C в течение 15 минут. Затем в данную среду инокулировали одну полную петлю культурального бульона Empedobacter brevis, штамм FERM BP-8113 (Депозитарный институт: независимая административная корпорация, National Institute for Advanced Industrial Science and Technology, International Patent Organism Depositary, адрес депозитарного института: Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan, дата передачи международного депозита: 8 июля 2002), который культивировали при 30°C в течение 16 часов в такой же среде, с последующим культивированием на качалке при 30°C в течение 16 часов и 120 качаниях/мин.
Пример 2. Получение пептида с использованием клеток микроорганизмов
Клетки микроорганизмов собирали центрифугированием (10000 оборотов в минуту (об/мин), 15 минут) культурального бульона, полученного в примере 1, с последующим суспендированием до концентрации 100 г/л в 100 мМ боратном буфере (pH 9,0), содержащем 10 мМ EDTA. После добавления соответственно 1 мл полученной суспензии к 1 мл 100 мМ боратного буфера (pH 9,0), содержащего 1