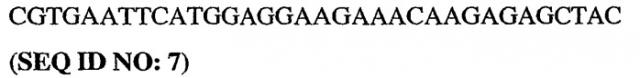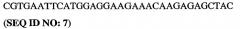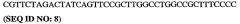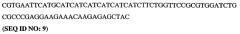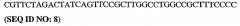Кристаллическая структура фосфодиэстеразы 5 и ее использование
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к кристаллическим структурам фосфодиэстеразы 5 (PDE5) и комплексов "РDЕ5/лиганд PDE5" и к их применениям для идентификации лигандов PDE5, включая соединения-ингибиторы PDE5. Настоящее изобретение также относится к способам идентификации указанных PDE5-ингибирующих соединений. Заявленное изобретение позволяет получить новый кристалл. 11 н. и 13 з.п. ф-лы, 5 ил., 8 табл.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к кристаллическим структурам фосфодиэстеразы 5 (PDE5) и комплексов "PDE5/лиганд PDE5" и к их использованию для идентификации лигандов PDE5, включая соедиенния-ингибиторы PDE5. Настоящее изобретение также относится к способам идентификации указанных PDE5-ингибирующих соединений и к их использованию в медицине. В настоящем изобретении также рассматриваются кристаллы комплексов "PDE5/ингибитор PDE5".
На различные биологические процессы широкого ряда, включая сокращение сердечной мышцы, регуляцию кровообращения, передачу сигналов нейронами, гландулярную секрецию, дифференцировку клеток и экспрессию генов, влияют стационарные уровни циклических нуклеотидов, вторичных мессенджеров сАМР и cGMP. Внутриклеточными рецепторами этих молекул являются циклические нуклеотид-зависимые протеинкиназы (PGK) (Lohmann et al., 1997), каналы, открываемые циклическими нуклеотидами и фосфодиэстеразы класса I (PDE) (Charbonneau, 1990). PDE представляют собой большое семейство белков, о котором впервые сообщили Сазерленд (Sutherland) и сотрудники (Rall & Sutherland, Butcher & Sutherland, 1962). Ферменты семейства (циклические нуклеотиды)-фосфодиэстераз, катализируют гидролиз 3',5'-циклических нуклеотидов с образованием соответствующих 5'-монофосфатов. В современной литературе указывается, что существует одиннадцать родственных, но биохимически отличающихся групп, генов человеческих фосфодиэстераз, и что многие из этих групп включают более чем один подтип генов, состоящий, в целом, из двадцати генов. Некоторые из PDE являются в высокой степени специфичными в отношении гидролиза сАМР (PDE4, PDE7, PDE8), некоторые из них являются в высокой степени специфичными в отношении гидролиза cGMP (PDE5, PDE6, PDE9), а некоторые имеют смешанную специфичность (PDE1, PDE2, PDE3, PDE10, PDE11).
Все PDE представляют собой мультидоменные белки; при этом каждый PDE содержит домен примерно из 270 аминокислот, расположенный ближе к С-концу и имеющий в высокой степени консервативные аминокислотные последовательности для всех семейств (Charbonneau, 1986). Были проведены тщательные исследования этого домена, и было показано, что он этот домен является ответственным за общие каталитические функции (Francis, S.H. et al., 1994). Негомологичные сегменты остальной части белка обладают регуляторными функциями или наделяют этот белок специфическими свойствами связывания. Сообщалось, что PDE2, PDE5, PDE6 и PDE10 содержат предполагаемые домены GAF в своей регуляторной амино-концевой части (Aravind & Ponting 1997 & Soderling & Beavo 2000). Было показано, что эти домены GAF связываются с cGMP, однако их функция пока еще полностью не ясна. До сих пор считалось, что полноразмерные PDE млекопитающих характеризуются тем, что они образуют димеры в растворе, однако роль этой димерной структуры не ясна. Недавно была определена структура регуляторного сегмента PDE2А, связанного с cGMP, и был выявлен параллельный димер из четырех доменов GAF, причем, cGMP связывается только с одним из двух доменов GAF на каждом мономере (Martinez et al., 2001).
За последние годы было установлено, что PDE5, cGMP-специфический PDE, является важной терапевтической мишенью. Он состоит из консервативного С-концевого, цинк-содержащего каталитического домена, который катализирует расщепление cGMP, и N-концевой регуляторной части, которая содержит два повтора домена GAF. Каждый домен GAF содержит cGMP-связывающий сайт, один из которых обладает высокой аффинностью, а другой обладает более низкой аффинностью. Активность PDE5 регулируется посредством связывания cGMP с cGMP-связывающими сайтами с высокой и низкой степенью аффинности, и последующего фосфорилирования, которое происходит только в том случае, если оба эти сайта являются занятыми (Thomas et al., 1990). PDE5 присутствует в различных концентрациях в различных тканях, включая тромбоциты, гладкие мышцы сосудов и внутренних органов, и скелетную мышцу. Этот белок является ключевым регулятором уровней cGMP в гладкой мышце кавернозной ткани полового члена. Физиологический механизм эрекции заключается в высвобождении окиси азота (NO) в пещеристом теле во время полового возбуждения. Затем NO активирует фермент гуанилат-циклазу, что приводит к увеличению уровней cGMP, к релаксации гладкой мышцы в пещеристом теле и к притоку крови. Ингибирование PDE5 предотвращает разложение cGMP, что приводит к сохранению уровней cGMP, а следовательно, и к релаксации гладкой мышцы (Corbin & Francis, 1999). Силденафил (Sildenafil) (UK-092480), являющийся активным ингредиентом виагры (Viagra®) и сильным ингибитором PDE5, представляет особый интерес для эффективного лечения нарушения эрекции у мужчин.
Недавно были получены структурные данные для каталитического домена PDE4b, то есть сАМР-специфического PDE (Xu et al., 2000). Эта структура дает информацию о всей укладке каталитического домена белков семейства PDE, но до настоящего времени отсутствовали какие-либо структурные данные, указывающие на механизм связывания потенциальных ингибиторов с ферментом.
Была определена кристаллографическая структура рекомбинантной конструкции PDE5, содержащей каталитический домен в комплексе с силденафилом. Методами генной инженерии была также получена конструкция, которая давала более высокое качество при продуцировании кристаллов комплексов PDE5/ингибитор. Этот белок был также использован для расшифровки его структуры, связанной с силденафилом. Эти комплексы не только позволяют получить важную информацию о структуре этого нового семейства белков, но также позволяют сконструировать более сильные и специфические ингибиторы для лечения многих заболеваний, в которых определенную роль играют PDE.
Краткое описание изобретения
Было обнаружено, что PDE5 может кристаллизоваться. Было также обнаружено, что модификация аминокислотной последовательности PDE5 дикого типа может стимулировать кристаллизацию PDE5. В частности, было обнаружено, что модификация некоторых частей аминокислотной последовательности PDE5 дикого типа может стимулировать кристаллизацию PDE5.
Было показано, что модификация каталитического домена PDE5, а в частности области 657-682 PDE5 ("области петли"), может стимулировать кристаллизацию PDE5. Более конкретно, модификация аминокислотной последовательности области петли (HRGVNNSYIQRSEHPLAQLYCHSIME = SEQ ID NO:1) PDE5 может стимулировать кристаллизацию PDE5. Эта модификация может быть осуществлена посредством делеции, добавления или замены одного или более аминокислотных остатков "области петли" PDE5, либо она может быть осуществлена путем полной замены области петли PDE5 на область петли (или другую эквивалентную аминокислотную последовательность, например, субдомен), происходящую от другого белка, предпочтительно от другого PDE, более предпочтительно от PDE4, а наиболее предпочтительно от PDE4b.
Было обнаружено, что кристаллы PDE5 могут быть использованы для скрининга лигандов PDE5, а в частности ингибиторов PDE5 (например, путем совместной кристаллизации PDE5 с лигандом PDE5 (например, с ингибитором PDE5), либо путем погружения лиганда PDE5 (например, ингибитора PDE5) в кристалл PDE5).
Лиганды PDE5, а в частности, ингибиторы PDE5, идентифицированные способами настоящего изобретения, могут быть использованы для лечебной, паллиативной или профилактической терапии.
Таким образом, настоящее изобретение относится к следующим (пронумерованным) аспектам, таким как:
1. Кристалл фосфодиэстеразы 5 (PDE5).
2. Кристалл PDE5, в соответствии с аспектом 1, где указанный PDE5 происходит от млекопитающих.
3. Кристалл PDE5, в соответствии с аспектом 1 или с аспектом 2, где указанный PDE5 происходит от человека.
4. Кристалл PDE5, в соответствии с любым из аспектов 1-3, где указанный PDE5 представляет собой изоформу, выбранную из группы, состоящей из PDE5А1, PDE5А2, PDE5А3 и PDE5А4.
5. Кристалл PDE5, в соответствии с аспектом 3 или с аспектом 4, где указанный PDE5 содержит SEQ ID NO:1 или его гомолог, фрагмент, вариант, аналог или производное.
SEQ ID NO:1 представляет собой так называемую "область петли" PDE5. Эта область петли или ее гомолог, фрагмент, вариант, аналог или производное включает добавления, делеции или замены аминокислотных остатков, присутствующих в области петли.
Вариант, относящийся к аминокислотной последовательности кристалла PDE5 настоящего изобретения, предпочтительно, включает делецию или замену гистидинового (His/Н) остатка, показанного жирным шрифтом и подчеркнутого в SEQ ID NO:1 (HRGVNNSYIQRSEHPLAQLYCHSIME). Этот гистидин координирует атом цинка в PDE5 дикого типа. Замену указанного гистидинового (Н) остатка, предпочтительно, осуществляют путем введения одного или более аминокислотных остатков (но не гистидиновых), где указанные аминокислотные остатки, предпочтительно, являются нейтральными или неполярными.
Более предпочтительно, вариант, относящийся к аминокислотной последовательности кристалла PDE5 настоящего изобретения, включает область петли, полностью замененную на область петли (или другую аминокислотную последовательность, например, эквивалентный субдомен), происходящую от другого белка, предпочтительно от PDE, более предпочтительно от PDE4, а наиболее предпочтительно от PDE4b (см. ниже).
Альтернативно, вариант, относящийся к аминокислотной последовательности кристалла PDE5 настоящего изобретения, включает делецию или замену аминокислотных остатков PLAQ (пролина, лейцина, аланина и глутамина), показанных жирным шрифтом и подчеркнутых в SEQ ID NO:1 (HRGVNNSYIQRSEHPLAQLYCHSIME). Аминокислотная последовательность PLAQ представляет собой сайт протеолитического расщепления PDE5. Путем модификации этого сайта, например посредством делеции и/или замены одного или более аминокислотных остатков, может быть предотвращено нежелательное протеолитическое расщепление PDE5 или снижен его уровень. Предпочтительно, такую замену аминокислотных остатков осуществляют с использованием аминокислот с зарядом, аналогичным заряду замененных аминокислот.
Модификации "области петли" PDE5 могут быть осуществлены в соответствии с настоящим изобретением в целях стабилизации данной области. Аналогичные модификации могут быть осуществлены в PDE5-родственных белках, в других белках PDE и в PDE-родственных белках в целях стабилизации указанных белков.
Таким образом, настоящее изобретение относится к (пронумерованным) аспектам, таким как:
6. Кристалл PDE5 в соответствии с любым из аспектов 3-5, где указанный PDE5 содержит SEQ ID NO:2 или его гомолог, фрагмент, вариант, аналог или производное. Предпочтительно, указанный PDE5 состоит из SEQ ID NO:2 или его гомолога, фрагмента, варианта, аналога или производного.
7. Кристалл PDE5 в соответствии с любым из аспектов 3-6, где указанный PDE5 содержит SEQ ID NO:3 или его гомолог, фрагмент, вариант, аналог или производное. Предпочтительно, указанный PDE5 состоит из SEQ ID NO:3 или его гомолог, фрагмент, вариант, аналог или производное.
8. Кристалл PDE5 в соответствии с любым аспектом 3 или аспектом 4, где указанный PDE5 содержит SEQ ID NO:4 или его гомолог, фрагмент, вариант, аналог или производное.
SEQ ID NO:4 представляет собой так называемую "область петли" (или субдомен) PDE4 (PDE4b). Эта область петли или ее гомолог, фрагмент, вариант, аналог или производное включает добавления, делеции или замены аминокислотных остатков, присутствующих в области петли.
9. Кристалл PDE5 в соответствии с любым из аспектов 3, 4 или 8, где указанный PDE5 содержит SEQ ID NO:5 или его гомолог, фрагмент, вариант, аналог или производное. Предпочтительно, указанный PDE5 состоит из SEQ ID NO:5 или его гомолога, фрагмента, варианта, аналога или производного.
10. Кристалл PDE5 в соответствии с любым из аспектов 3, 4, 8 или 9, где указанный PDE5 содержит SEQ ID NO:6 или его гомолог, фрагмент, вариант, аналог или производное. Предпочтительно, указанный PDE5 состоит из SEQ ID NO:6 или его гомолога, фрагмента, варианта, аналога или производного.
11. Кристалл комплекса PDE5/лиганд PDE5.
12. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 11, где указанным лигандом PDE5 является ингибитор PDE5.
13. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 12, где указанным ингибитором лиганда PDE5 является силденафил.
14. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с любым из аспектов 11-13, где указанный лиганд PDE5 определен в любом из аспектов 1-10.
15. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с любым из аспектов 11-13, где указанный лиганд PDE5 определен в любом из аспектов 5-7.
16. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с любым из аспектов 11-13, где указанный лиганд PDE5 определен в любом из аспектов 8-10.
17. Кристалл PDE5 в соответствии с любым из аспектов 1-10, или кристалл комплекса PDE5/лиганд PDE5 в соответствии с любым из аспектов 11-16, выращенный в растворе, содержащем буфер и/или преципитирующий агент.
18. Кристалл PDE5 в соответствии с любым из аспектов 5-7, выращенный в растворе, содержащем буфер и/или фосфат.
19. Кристалл PDE5 в соответствии с аспектом 18, где указанным фосфатным буфером является фосфат натрия/калия, фосфат натрия или фосфат аммония. Предпочтительно, указанный фосфатный буфер представляет собой 1,8-2,3 М фосфат натрия, рН 3,4-5,0, и содержит или не содержит 0,1 М Hepes, рН 7,0-8,0, либо он представляет собой 1,8-2,3 М фосфат натрия/калия, рН 3,4-5,0, и содержит или не содержит 0,1 М Hepes, рН 7,0-8,0.
20. Кристалл PDE5 в соответствии с любым из аспектов 8-10, или кристалл комплекса PDE5/лиганд PDE5 в соответствии с любым из аспектов 11-16, выращенный в растворе, содержащем:
(i) Трис- или MES-буфер, фосфат аммония и/или PEG2KMME. Предпочтительно, указанный трис- или MES-буфер имеет рН 6,0-8,4. Более предпочтительно, указанный раствор содержит 0,1 М трис, рН 8,0, 50 мМ фосфат аммония, рН 7,0; 16-26% мас./об. PEG2KMME. Альтернативно, указанный раствор содержит 0,1 М MES, рН 6,0-6,5, 50 мМ фосфат аммония, рН 7,5; 22-34% мас./об. PEG2KMME; или
(ii) 0,16 М ацетат натрия, 80 мМ трис-гидрохлорид, рН 8,5, 24% мас./об. полиэтиленгликоля 8000 (или PEG8KMME).
21. Кристалл PDE5 в соответствии с любым из аспектов 8-10, или кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 16, выращенные в растворе, содержащем:
(i) Трис-буфер, ацетат натрия и/или PEG4K. Предпочтительно, указанный трис-буфер имеет рН 6,5-8,6. Альтернативно, указанный трис-буфер имеет рН 8,2-8,6. Более предпочтительно, указанный раствор содержит 0,1 М трис, рН 8,2-8,6, 0,2М ацетат натрия и 26-30% мас./об. PEG4K; или
(ii) 0,16 М ацетат натрия, 80 мМ трис-гидрохлорид, рН 8,5, 24% мас./об. полиэтиленгликоля 8000 (или PEG8KMME).
22. Кристалл PDE5, определенный в любом из аспектов 5-7 и имеющий одну или более из нижеследующих характеристик:
(а) спейсерную группу Р62;
(b) размеры элементарной ячейки а˜95 ű1%, b˜95 ű1%, c˜82 ű1%, α=β=90°, γ=120°;
(с) 1 молекулу на один асимметричный элемент:
(d) содержит PDE5 с молекулярной массой приблизительно 40 кДа ± 2 кДа;
(е) вычисленное содержание растворителя приблизительно 43±5%; и
(f) гексагональную кристаллическую систему.
23. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 15, имеющий одну или более из нижеследующих характеристик:
(а) спейсерную группу Р212121;
(b) размеры элементарной ячейки а˜94 ű1%, b˜104 ű1%, c˜142 ű1%, α=β=γ=90°;
(с) 4 молекулы на один асимметричный элемент:
(d) содержит PDE5 с молекулярной массой приблизительно 40 кДа ± 2 кДа;
(е) вычисленное содержание растворителя составляет приблизительно 43±5%; и
(f) орторомбическую кристаллическую систему.
24. Кристалл PDE5, определенный в соответствии с одним из аспектов 8-10, или кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 16, имеющий одну или более из нижеследующих характеристик:
(а) спейсерную группу Р21;
(b) размеры элементарной ячейки а˜55 ű1%, b˜78 ű1%, c˜82 ű1%, α=γ=90°, β˜101°±2°;
(с) 2 молекулы на один асимметричный элемент:
(d) содержит PDE5 с молекулярной массой приблизительно 38 кДа ± 2 кДа;
(е) вычисленное содержание растворителя составляет приблизительно 46±5%; и
(f) моноклинную кристаллическую систему.
25. Кристалл PDE5 в соответствии с одним из аспектов 5-7, где указанный PDE5 имеет трехмерную структуру, характеризующуюся атомными координатами, представленными в таблице 3, или производное, выраженное в любой системе отсчета.
26. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 15, где указанный комплекс PDE5/лиганд PDE5 имеет трехмерную структуру, характеризующуюся атомными координатами, представленными в таблице 4, или производное, выраженное в любой системе отсчета.
27. Кристалл PDE5 в соответствии с одним из аспектов 8-10, где указанный PDE5 имеет трехмерную структуру, характеризующуюся атомными координатами, представленными в таблице 5, или производное, выраженное в любой системе отсчета.
28. Кристалл комплекса PDE5/лиганд PDE5 в соответствии с аспектом 16, где указанный комплекс PDE5/лиганд PDE5 имеет трехмерную структуру, характеризующуюся атомными координатами, представленными в таблице 6, или производное, выраженное в любой системе отсчета.
29. Использование атомных координат, определенных исходя из кристалла PDE5 в соответствии с аспектом 25 или из кристалла комплекса PDE5/лиганд PDE5 в соответствии с аспектом 26, для определения трехмерной структуры (i) полноразмерного PDE5 дикого типа или его мутанта, производного, фрагмента, варианта, аналога или гомолога, или (ii) субдомена PDE5 дикого типа или его мутанта, производного, фрагмента, варианта, аналога или гомолога.
30. Использование в соответствии с аспектом 29, где указанный субдомен PDE5 представляет собой каталитический домен.
31. Использование атомных координат, определенных для кристалла PDE5 в соответствии с аспектом 27 или кристалла комплекса PDE5/лиганд PDE5 в соответствии с аспектом 28, для определения трехмерной структуры (i) полноразмерного PDE5 дикого типа или его мутанта, производного, фрагмента, варианта, аналога или гомолога, или (ii) субдомена PDE5 дикого типа или его мутанта, производного, фрагмента, варианта, аналога или гомолога.
32. Использование в соответствии с аспектом 31, где указанный субдомен PDE5 представляет собой каталитический домен.
33. Использование трехмерной структуры (i) полноразмерного PDE5 дикого типа или его мутанта, производного, фрагмента, варианта, аналога или гомолога, или (ii) субдомена PDE5 дикого типа или его мутанта, производного, фрагмента, варианта, аналога или гомолога, определенных в соответствии с любым из аспектов 29, 30, 31 или 32 для компьютерной оценки или оценки каким-либо иным способом, взаимодействий связывания лиганда PDE5 с активным сайтом на PDE5.
34. Использование в соответствии с аспектом 33, где указанный лиганд PDE5 представляет собой ингибитор PDE5.
35. Использование в соответствии с аспектом 34, где указанным ингибитором PDE5 является Силденафил.
36. Использование по любому из аспектов 33-35, где указанный активный центр на PDE5 находится в третьем субдомене белка и ограничен спиралями 15 (Н15 813-824) и 14 (Н14 772-797), С-концом спирали 13 (Н13 749-765) и С-концом спирали 11 (Н11 706-721) вместе с областью петли, расположенной между спиралями 11 и 12а (Н12а 725-731), как показано на фигуре 2.
37. Использование по любому из аспектов 33-36, где указанный активный сайт на PDE5 содержит Leu 765, Ala 767 и Ile 768 и один или более Phe 820, Val 782, Phe 786, Tyr 612, Leu 804, Ala 779, Ala 783, Ile 813, Met 816 и Gln 817.
38. Использование по любому из аспектов 33-37 для конструирования соединения, способного связываться с PDE5.
39. Использование по любому из аспектов 33-38 для конструирования соединения, способного связываться с любым активным сайтом PDE5.
40. Использование в соответствии с аспектом 38 или с аспектом 39, где указанным соединением является лиганд PDE5.
41. Использование в соответствии с аспектом 40, где указанным лигандом PDE5 является ингибитор PDE5.
42. Способ идентификации соединения, способного связываться с PDE5, включающий совместную кристаллизацию или погружение указанного соединения в кристалл PDE5 в соответствии с одним из аспектов 1-10 и определение трехмерной структуры в целях установления факта связывания указанного соединения с PDE5. Что касается термина "погружение", следует отметить, что соединение может быть добавлено к кристаллу, и таким образом, соединение погружается в этот кристалл. Альтернативно, кристалл может быть добавлен к соединению (например, в растворе), и в этом случае соединение погружается в кристалл.
43. Способ идентификации соединения, способного связываться с любым активным сайтом PDE5, включающий совместную кристаллизацию или погружение указанного соединения в кристалл PDE5 в соответствии с одним из аспектов 1-10 и определение трехмерной структуры в целях установления факта связывания указанного соединения с PDE5.
44. Соединение, сконструированное с использованием, описанным в любом из аспектов 33-41, или идентифицированное способом, описанным в аспекте 42 или в аспекте 43.
45. Соединение в соответствии с аспектом 44, которое является ингибитором PDE5.
46. Способ отбора лиганда PDE5 из группы возможных лигандов PDE5, включающий следующие стадии:
(а) компьютерного моделирования трехмерного представления структуры PDE5, выведенной исходя из атомных координат, определенных в соответствии с любым из аспектов 29, 30, 31 или 32, и трехмерного представления структуры потенциального лиганда PDE5;
(b) совместного отображения трехмерного представления потенциального лиганда PDE5 вместе с трехмерным представлением структуры PDE5; и
(с) установления факта соответствия трехмерного представления потенциального лиганда PDE5 и трехмерного представления активного сайта структуры PDE5.
47. Способ в соответствии с аспектом 46, дополнително включающий следующие стадии:
(d) включения потенциального лиганда PDE5 в анализе на биологическую активность PDE5; и
(е) установления факта модуляции активности PDE5 потенциальным лигандом PDE5 в указанном анализе.
48. Способ в соответствии с аспектом 46 или аспектом 47, где указанным потенциальным лигандом PDE5 является потенциальное соединение-ингибитор PDE5, и указанное потенциальное соединение-ингибитор PDE5 ингибирует активность PDE5.
49. Лиганд PDE5, выбранный способом, определенным в аспекте 46 или в аспекте 47, или соединение-ингибитор PDE5, выбранное способом, определенным в аспекте 48.
50. Фармацевтическая композиция, содержащая один или более лигандов PDE5 или соединений-ингибиторов PDE5 в соответствии с аспектом 49 и один или более фармацевтически приемлемых наполнителей.
51. Использование лиганда PDE5 или соединения-ингибитора PDE5 в соответствии с аспектом 49 в качестве фармацевтического средства.
52. Использование лиганда PDE5 или соединения-ингибитора PDE5 в соответствии с аспектом 49 для производства лекарственного средства для профилактики или лечения состояния, заболевания, расстройства или дисфункции, в случае, когда ингибирование PDE5 оказывает профилактически или терапевтически благоприятное действие.
53. Использование в соответствии с аспектом 52, где указанным расстройством является сексуальное расстройство млекопитающего.
Лечебная, паллиативная или профилактическая терапия, рассматриваемая в настоящем изобретении, включает лечебную, паллиативную или профилактическую терапию сексуальных расстройств у млекопитающих, в частности лечение половых расстройств у млекопитающих, таких как нарушение эрекции у мужчин (MED), импотенция, сексуальная дисфункция у женщин (FSD), дисфункция клитора, расстройство, связанное с пониженным сексуальным влечением у женщин, расстройство, связанное с половым возбуждением у женщин (FSAD), расстройство, связанное с возникновением боли во время полового акта у женщин, или нарушение наступления оргазма у женщин (FSOD), а также сексуальная дисфункция, вызванная поражением спинного мозга, или сексуальная дисфункция, индуцированная ингибитором селективного обратного захвата серотонина, но, как очевидно, такая терапия может быть использована и для лечения других клинических состояний, при которых показан ингибитор PDE5. Такими состояниями являются преждевременные роды, дисменорея, доброкачественная гиперплазия предстательной железы (ВРН), обструкция отверстия мочевого пузыря, недержание мочи, стабильная, нестабильная и вариантная стенокардия (болезнь Принцметала), гипертензия, легочная гипертензия, хроническое обструктивное заболевание легких, ишемическая болезнь сердца, застойная сердечная недостаточность, атеросклероз, состояния, связанные с пониженной проходимостью кровеносных сосудов, например, пост-чрезкожная катетерная коронарная ангиопластика (пост-РТСА), заболевания периферических сосудов, инсульт, индуцированная нитратом толерантность, бронхит, аллергическая астма, хроническая астма, аллергический ринит, глазные болезни и связанные с ними расстройства, такие как глаукома, невропатия зрительного нерва, дегенерация пятна, повышенное внутриглазное давление, окклюзия сетчатки и артерий глаза и заболевания, характеризующиеся нарушениями кишечной перистальтики, например синдром раздражения кишечника (СРК).
Другими клиническими состояниями, для которых показан ингибитор PDE5 и к которым может быть применено лечение соединениями настоящего изобретения, являются преэклампсия, синдром Кавазаки, рассеянный склероз, диабетическая нефропатия, невропатия, включая автономную и периферическую невропатию, а в частности, диабетическую невропатию и ее симптомы, гастропарез, периферическая диабетическая невропатия, болезнь Альцгеймера, острая респираторная недостаточность, псориаз, некроз кожи, рак, метастазы, облысение, эзофагит типа «щелкунчик», трещина заднего прохода, геморрой, синдром инсулинорезистентности, диабет, вазоконстрикция при гипоксии, а также стабилизация кровяного давления во время гемодиализа.
Особенно предпочтительными состояниями являются MED и FSD (предпочтительно, FSAD).
Другими (пронумерованными) аспектами настоящего изобретения являются:
54. Использование атомных координат, определенных для кристалла PDE5 в соответствии с аспектом 25 или аспектом 27, или для кристалла комплекса PDE5/лиганд PDE5 в соответствии с аспектом 26 или аспектом 28, для определения кристаллической структуры мутанта, производного, фрагмента, варианта, аналога, гомолога или комплекса PDE-родственного белка.
55. Использование в соответствии с аспектом 54, где указанным PDE-родственным белком является PDE.
56. Использование в соответствии с аспектом 55, где указанным PDE является PDE-родственный белок.
57. Использование в соответствии с аспектом 56, где указанным PDE5-родственным белком является PDE5.
58. Использование атомных координат, определенных для кристалла PDE5 в соответствии с аспектом 25 или аспектом 27, или кристалла комплекса PDE5/лиганд PDE5 в соответствии с аспектом 26 или аспектом 28, для получения модели трехмерной структуры PDE-родственного белка.
59. Использование в соответствии с аспектом 58, где указанным PDE-родственным белком является PDE.
60. Использование в соответствии с аспектом 59, где указанным PDE является PDE5-родственный белок.
61. Использование в соответствии с аспектом 60, где указанным PDE5-родственным белком является PDE5.
62. Использование трехмерной структуры PDE5 в соответствии с любым из аспектов 29, 30, 31 или 32 для сайт-направленного конструирования мутантов, имитирующих другие изоформы PDE5 или его варианты.
63. Кристалл PDE5 или кристалл комплекса PDE5/лиганд PDE5, где указанный активный сайт на PDE5 находится в третьем субдомене белка и ограничен спиралями 15 (Н15 813-824) и 14 (Н14 772-797), С-концом спирали 13 (Н13 749-765) и С-концом спирали 11 (Н11 706-721) вместе с областью петли, расположенной между спиралями 11 и 12а (Н12а 725-731), как показано на фигуре 2.
64. Кристалл PDE5 или кристалл комплекса PDE5/лиганд PDE5, где указанный активный сайт на PDE5 содержит Leu 765, Ala 767 и Ile 768 и один или более Phe 820, Val 782, Phe 786, Tyr 612, Leu 804, Ala 779, Ala 783, Ile 813, Met 816 и Gln 817.
65. Кристалл PDE5, где кристаллическая система указанного кристалла характеризуется тем, что она является моноклинной, орторомбической или гексагональной.
66. Кристалл комплекса PDE5/лиганд PDE5, где кристаллическая система указанного кристалла характеризуется тем, что она является моноклинной или орторомбической.
67. Способ продуцирования структурно стабилизированного PDE-родственного белка, включающий:
(а) сопоставление аминокислотной последовательности PDE-родственного белка с аминокислотной последовательностью (i) PDE4, (ii) каталитического домена PDE4, показанного на фигуре 1, или (iii) SEQ ID NO:4;
(b) идентификацию структурно-эквивалентного субдомена PDE-родственного белка, который соответствует SEQ ID NO:4; и
(с) осуществление методами генной инженерии замены структурно-эквивалентного субдомена PDE-родственного белка или его части последовательностью SEQ ID NO:4 или ее гомологом, фрагментом, вариантом, аналогом или производным.
68. Способ в соответствии с аспектом 67, дополнительно включающий:
(d) экспрессию сконструированного PDE-родственного белка со стадии (с), в клетке-хозяине.
69. Способ в соответствии с аспектом 68, дополнительно включающий:
(е) очистку экспрессированного сконструированного PDE-родственного белка со стадии (d).
70. Способ в соответствии с аспектом 69, дополнительно включающий:
(f) кристаллизацию очищенного сконструированного PDE-родственного белка со стадии (е).
71. Способ в соответствии с любым из аспектов 67-70, где указанным PDE-родственным белком является PDE.
72. Способ в соответствии с аспектом 71, где указанным PDE является PDE5-родственный белок.
73. Способ в соответствии с аспектом 72, где указанным PDE5-родственным белком является PDE5.
74. Способ в соответствии с аспектом 73, где указанный PDE5 определен в любом из аспектов 5-7.
Соединение настоящего изобретения (то есть соединение в соответствии с аспектом 44 или аспектом 45, или лиганд PDE5, или соединение-ингибитор PDE5 в соответствии с аспектом 49, называемые далее одним общим термином "соединение") может быть введено отдельно, но при лечении человека его обычно вводят в смеси с подходящим фармацевтическим наполнителем, разбавителем или носителем, выбранным в соответствии с нужным способом введения и в соответствии со стандартной фармацевтической практикой. Таким образом, фармацевтические композиции, фармацевтические средства и лекарственные средства, рассматриваемые в настоящем изобретении, могут быть приготовлены и введены различными методами, хорошо известными специалистам.
Так, например, для быстрого, замедленного, модифицированного или регулируемого высвобождения, такого как пролонгированная, двухразовая или периодическая доставка соединения настоящего изобретения, это соединение может быть введено перорально, трансбуккально или подъязычно в форме таблеток, капсул (включая мягкие гелевые капсулы), овулей, эликсиров, растворов или суспензий, которые могут содержать отдушки или подкрашивающие агенты. Соединение может быть также введено посредством инъекции вовнутрь пещеристого тела. Указанное соединение может быть также введено в виде быстро диспергирующихся или быстро растворяющихся лекарственных форм, либо в виде высокоэнергетической дисперсии, либо в виде частиц с оболочкой. Подходящие фармацевтические препараты данного соединения, при необходимости, могут иметь или не иметь оболочки.
Указанные таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция, глицин и крахмал (предпочтительно, кукурузный крахмал, картофельный крахмал или крахмал из тапиоки), дезинтегрирующие агенты, такие как натрийсодержащий гликолят крахмала, натрийсодержащая кроскармилоза и некоторые комплексные силикаты, и связующие агенты для грануляции, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин и аравийская камедь. Кроме того, могут быть включены замасливающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк.
Твердые композиции аналогичного типа могут быть также использованы в качестве наполнителей в желатиновых капсулах. При этом предпочтительными наполнителями являются лактоза, крахмал, целлюлоза, молочный сахар и высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров, данное соединение может быть объединено с различными подслащивающими или ароматизирующими агентами, с подкрашивающим веществом или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин и их комбинации.
Лекарственные формы с модифицированным и периодическим высвобождением могут содержать наполнители, такие как наполнители, конкретно указанные при описании лекарственных форм быстрого высвобождения, вместе с дополнительными наполнителями, которые действуют как модификаторы скорости высвобождения и которые могут быть нанесены на корпус устройства и/или включены в него. Модификаторами скорости высвобождения являются, но не ограничиваются исключительно ими, гидроксипропилметилцеллюлоза, метилцеллюлоза, натрийсодержащая карбоксиметилцеллюлоза, этилцеллюлоза, ацетат целлюлозы, полиэтиленоксид, ксантановая камедь, карбомер, сополимер аммиака и метакрилата, гидрогенизированное касторовое масло, воск карнаубы, парафиновый воск, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, сополимер метакриловой кислоты и их смеси. Лекарственные формы с модифицированным и периодическим высвобождением могут содержать один наполнитель, модифицирующий скорость высвобождения, или комбинацию таких наполнителей. Наполнители, модифицирующие скорость высвобождения, могут присутствовать в лекарственной форме, то есть в матриксе, и/или на лекарственной форме, то есть на ее поверхности или оболочке.
Быстро диспергирующиеся или растворяющиеся лекарственные препараты (FDDF) могут содержать следующие ингредиенты: аспартам, ацесульфам-калий, лимонную кислоту, натрийсодержащую кроскармелозу, кросповидон, двухосновную аскорбиновую кислоту, этилакрилат, этилцеллюлозу, желатин, гидроксипропиметилцеллюлозу, стеарат магния, маннит, метилметакрилат, мятную отдушку, полиэтиленгликоль, дымящую двуокись кремния, двуокись кремния, натрийсодержащий гликолят крахмала, стеарилфумарат натрия, сорбит, ксилит. Термины "диспергирующийся" или "растворяющийся", используемые здесь для описания FDDF, применяются в зависимости от степени растворимости используемого лекарственного вещества, то есть, если данное лекарственное вещество является нерастворимым, то на его основе может быть получена быстро диспергирующаяся лекарственная форма, а если данное лекарственное вещество является растворимым, то на его основе может быть получена быстро растворяющаяся лекарственная форма.
Соединение может быть также введено парентерально, например вовнутрь пещеристого тела, внутривенно, внутриартериально, внутрибрюшинно, интратекально, интравентрикулярно, интрауретрально, интрастернально, интракраниально, внутримышечно или подкожно, либо оно может быть введено путем вливания или путем инъекции с использованием безыгольного шприца. Для такого парентерального введения наиболее подходящей формой является стерильный водный раствор, который может содержать другие вещества, например достаточное количество соли или глюкозы, которые придают такому раствору изотоничность к крови. Если это необходимо, то водные растворы должны быть соответствующим образом забуферены (предпочтительно до рН от 3 до 9). Получение подходящих парентеральных композиций в стерильных условиях может быть легко осуществлено стандартными фармацевтическими методами, хорошо известными специалистам.
Для перорального и парентерального введения человеку ежедневная доза такого соединения обычно составляет от 10 до 500 мг (в виде разовой дозы или дробных доз).
Так, например, таблетки или капсулы данного соединения могут содержать от 5 мг до 250 мг активного соединения и могут быть введены один раз, два раза или более раз через определенные интервалы времени, когда это необходимо. В любом случае, врач может самостоятельно определить фактическую дозу, которая является наиболее подходящей для данного конкретного пациента, и эта доза будет варьироваться в зависимости от возраста, веса и восприимчивости конкретного пациента. Вышеуказанные дозы даны в качестве примеров для среднего пациента. Само собой разумеется, что отдельные случаи, где могут оказаться подходящими интервалы с более высокими или более низкими дозами, также входят в объем настоящего изобретения. Для каждого специалиста очевидно, что для лече