Средство, обладающее антигипоксической и цитопротекторной активностями, используемое для снижения токсичности ремантадина при лечении гриппозной инфекции
Иллюстрации
Показать всеИзобретение относится к медицине. Соединение, представляющее собой 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия, обладает антигипоксическим и цитопротекторным действием. Также предложена композиция, обладающая противогриппозным действием. Композиция включает ремантадин и 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия. Указанное соединение позволяет снизить токсичность ремантадина при его использовании в высоких дозах при лечении гриппозной инфекции. 4 н.п. ф-лы, 6 ил.
Реферат
Изобретение относится к медицине, а именно к фармацевтическим препаратам. Изобретение выявило ранее не известные свойства у соединения 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия, а именно: его цитопротекторное действие, способность проявлять антигипоксическую активность. Изобретение касается сочетанного применения ремантадина и соединения 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия. Такая композиция применима при лечении гриппозной инфекции. Сочетание этих двух препаратов позволяет существенно снизить токсические побочные эффекты ремантадина и обеспечить применение последнего в широком диапазоне терапевтических дозировок.
В литературе указывается, что при стандартных дозировках ремантадин эффективен только против вирусов гриппа А, в то время как повышенные дозы расширяют спектр его действия против других вирусов, например вирусов гриппа В, на которые ремантадин не действует при изолированном применении [Справочник Видаль. Лекарственные препараты в России, 1998, АстраФармСервис, М., Е-197; Киселев О.И., Деева Э.Г., Слита А.В., Платонов В.Г. Антивирусные препараты для лечения гриппа и ОРЗ. Дизайн препаратов на основе полимерных носителей. "Время", С.-Петербург, 2000].
Грипп - массовое вирусное заболевание, которое сопровождается осложнениями и даже такими, которые имеют летальный исход. Ежегодные эпидемии гриппа оказывают существенное влияние на общее здоровье нации и имеют серьезные экономические и социальные последствия. Поэтому постоянно ведется поиск новых средств для его лечения.
Этиотропными противогриппозными препаратами являются арбидол, занимивир и озельтамивир. Механизм противовирусного действия арбидола еще не изучен до конца, к тому же он эффективен только на самых ранних стадиях гриппозной инфекции. Занимивир и озельтамивир являются ингибиторами нейраминидазы. Это импортные весьма дорогостоящие препараты, в силу чего их массовое применение в период эпидемий гриппа маловероятно [Киселев О.И., Деева Э.Г., Слита А.В., Платонов В.Г. Антивирусные препараты для лечения гриппа и ОРЗ. Дизайн препаратов на основе полимерных носителей. "Время", С.Петербург, 2000].
Хорошо зарекомендовавшим себя в борьбе с гриппозной инфекцией препаратом является ремантадин - одно из ведущих средств этиотропной терапии гриппа, вызванного вирусом гриппа А-типа [Машковский М.Д. Лекрственные средства, ч.2, М., "Медицина", 1993, с.295-306]. Ремантадин (римантадин) - α-метил-1-адамантилметиламина гидрохлорид - используется в медицинской практике в виде таблеток белого цвета, горького вкуса. Ремантадин обладает противовирусной активностью в отношении широкого ряда штаммов вируса гриппа типа А, особенно сероподтипа H3N2.
Механизм его действия достаточно изучен [Ефимов Е.И., Разгулин С.А., Воен. Мед. журнал, 1995, т.80 (2), 48-49; Киселев О.И., Блинов В.М., Козелецкая К.И. и др. Вестник РАМН, 1993, №3, 10-15]. Он эффективно взаимодействует с мембранами инфицированных клеток, в частности с отрицательно заряженными фосфолипидами. Гидрофобное ядро адамантана интеркалирует внутрь мембраны между остатками жирных кислот, где соединение практически полностью блокирует функцию вирусного белка М2, выполняющего роль протонной помпы. Тем самым достигается подавление инфекционной активности вируса на этапах его рецепторзависимого эндоцитоза, декапсидации в фаголизосоме, а также самосборки вирусных частиц и почкования [Киселев О.И., Блинов В.М., Козелецкая К.И. и др. Вестник РАМН, 1993, №3, 10-15].
Ремантадин назначают пациентам в дозе 100-300 мг на суточный прием, дробно или одновременно.
В то же время ремантадин в общепринятой лекарственной форме обладает рядом существенных недостатков, главные из которых: 1) препарат активен только в отношении вируса гриппа типа А; 2) относительно высокая токсичность - при приеме в высоких дозах регистрируется побочное действие в отношении ЦНС, печени и почек, желудочно-кишечного тракта; 3) быстрое формирование резистетных штаммов вируса. Из-за побочного действия препарата существуют ограничения в его назначении пациентам, например он противопоказан при эпилепсии [Видаль, 1998, АстраФармСервис, М., Е-197; Машковский М.Д. Лекарственные средства. М., "Новая Волна", 2000, Т.2, с.325].
Целью данного изобретения было снижение токсичности ремантадина и создание новой композиции на основе ремантадина для лечения гриппозной инфекции. Снижение токсичности ремантадина позволило бы применять его в повышенных дозах, не опасаясь осложнений за счет побочного действия ремантадина. Последний обладает довольно высокой токсичностью: при концентрации его в плазме крови уже 1-5 мг/л вызывает токсические эффекты в центральной нервной системе, увеличивает риск эпилептических припадков, увеличивает риск геморрагического инсульта [Видаль, 1998, АстраФармСервис, М., Е-197; Машковский М.Д. Лекарственные средства. М., "Новая Волна", 2000, Т.2, с.325].
Задача была выполнена с помощью добавления к действующему началу - ремантадину - химического соединения 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия, описанного и охарактеризованного в патенте РФ №2244546: обладает антиоксидантной активностью, которая необходима для ликвидации последствий окислительного стресса и противовирусной активностью в отношении гриппозной инфекции. В заявляемом изобретении установлено, что это соединение обладает также антигипоксантным и цитопротекторным действием.
Токсический эффект ремантадина обусловлен его воздействием на клеточном уровне, поэтому тестирование осуществляли в лабораторных условиях с помощью тестов на клеточных культурах, чувствительных к вирусам гриппа.
Снижение токсичности лекарственных препаратов может достигаться за счет совместного использования с ними препаратов класса антиоксидантов и/или антигипоксантов, поскольку окислительный стресс, сопровождающий токсическое действие большинства ксенобиотиков, провоцирует серьезное повышение уровня перекисного окисления липидов, белков и нуклеиновых кислот, нарушает физиологически адекватное состояние клеточных мембран и угнетает клеточное дыхание и, как следствие, выработку макроэргов. Поэтому протективный препарат должен обладать способностью либо гасить свободнорадикальное окисление, либо поддерживать целостность митохондриальной дыхательной цепи. Очевидно, что еще эффективнее будут препараты, которые в силу своего строения способны принимать участие в обоих процессах одновременно.
Общие предпосылки о снижении токсичности лекарственных препаратов были положены нами в основу при поиске цитопротекторных средств при использовании ремантадина. Ранее никакие препараты не использовались для снижения токсического действия ремантадина.
Результаты нашей более ранней работы показали, что далеко не все протективные фармакологические препараты, разрешенные к применению, проявляют защитное действие при употреблении с конкретными ксенобиотиками, а наиболее эффективные комбинации следует подбирать и оценивать в ходе самостоятельного исследования [Еропкина Е.М., Мамаева Е.Г., Еропкин М.Ю. Эксп. клинич. фармакол., 2003, №5, 48-52].
Фармакологические препараты, обладающие антиокислительной активностью, можно классифицировать в зависимости от их воздействия на определенное звено антиоксидантной системы организма [Машковский М.Д. Лекарственные средства. М., "Новая Волна", 2000, Т.2, с.187]. Одним из классов наиболее эффективных антиоксидантов, сочетающих в себе не только антиокислительную, но и антигипоксическую активность, являются производные убихинона (коэнзима Q). Известны следующие препараты данного класса: сам убихинон (препарат убинон) применяется в комплексной терапии ИБС. Сходную структуру имеет идебенон [2-(10-Гидроксидецил)-5,6-диметокси-3-метил-2,5-циклогексадиен-1,4-дион], относящийся к ноотропам, у которого также отмечали антигипоксическую и антиоксидантную активности [Машковский М.Д. Лекарственные средства. М., "Новая Волна", 2000, Т.2, с.187; Ж. Высокомолекулярные соединения, 1975, т.17(А), №3, с.557-563; Ikejiri Y., Ishii К., Yasuda M. Neurology, 1996, v.47, p.583-585].
Исходя из того, что 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия близок по структуре к природным хинонам, в частности к убихинону, и обладает антиоксидантными свойствами, было решено изучить его защитное действие на клетки, проверить антигипоксическую активность и цитопротекторное действие, а также испытать его в сочетании с ремантадином. Поскольку 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия обладает собственной противовирусной активностью в отношении вирусов гриппа, которая связана с начальными стадиями их репликативного цикла [патент РФ №2244546], а сочетанное его действие с ремантадином было неизвестно, было изучено действие на вирусы гриппа композиции этих 2-х препаратов.
Сущностью данного изобретения является то, что установлены не известные ранее свойства 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия - его антигипоксантное действие, а также цитопротекторное действие, что позволяет снизить токсичность, вызванную высокими дозами ремантадина; обнаружен высокий биологический эффект от совместного использования ремантадина и 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия при действии на гриппозную инфекцию.
Экспериментальная часть работы
В комплекс оценки 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия in vitro входило:
1) исследование собственной антирадикальной активности препарата в бесклеточной системе (тест на антирадикальную активность - восстановление препаратом стабильного свободного радикала дифенилпикрилгидразила (ДФПГ) [Починок Т.В., Тароховский М.Л., Портнягина В.А. и др. Хим.-фарм. Ж, 1985, №5, с.565-569] и ингибирование вызванного ионами Fe2+ перекисного окисления липидов в системе желточных липосом - антиоксидантная активность [Клебанов Г.И., Бабенкова И.В., Теселкин Ю.А. и др. Лаб.дело, 1988, №5, с.59-62];
2) оценка антигипоксического эффекта препарата на клетках в культуре по их способности к восстановлению реактива МТТ митохондриальными дыхательными ферментами [Mosmann Т., J Immunol Meth, 1983, v.65 (1), p.55-63];
3) оценка диапазона безопасных концентраций препарата и установление его ЦТД50 (средняя цитотоксическая концентрация, снижающая жизнеспособность клеток в культуре на 50% от контроля);
4) исследование действия 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия на токсический эффект ремантадина в культурах клеток, причем ремантадин применялся в диапазоне концентраций, включающем его токсичные дозы;
5) исследование противовирусной активности in vitro на культурах чувствительных к вирусам гриппа клеток MDCK ремантадина и 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия как при изолированном, так и сочетанном применении препаратов.
Во всех тестированиях 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия применялся в клинически адекватных концентрациях. Рекомендованные разовые дозы препарата составляют от 0,5 до 0,75-1,25 г, что соответствует при средней массе тела 70 кг 11-19 мг/кг (без учета кинетики всасывания, распределения и клиренса), а максимальная терапевтическая доза препарата определена как 50 мг/кг.
Высокоэффективные в отношении снижения токсичности ремантадина и полностью безопасные концентрации 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия, подобранные авторами и затем использованные в серийных опытах, составили 20-40 мг/л (в среднем около 55 микромолей на литр).
Собственную антирадикальную активность препарата определяли с помощью двух методик:
1. Определение антирадикальной активности с ДФПГ.
Определение осуществляли по методу, в основу которого положен следующий принцип: 2,2'-дифенилпикрилгидразил (ДФПГ) - стабильный свободный радикал с максимумом поглощения при 517 нм в ходе реакции с антиоксидантом превращается в нерадикальную форму - 2,2'-дифенилпикрилгидразин с потерей характерного максимума поглощения [Починок Т.В., Тароховский М.Л., Портнягина В.А. и др. Хим.-фарм. Ж, 1985, №5, с.565-569].
Ход определения: Рабочий раствор ДФПГ (ICN, США) готовили на 95° этаноле и подбирали концентрацию таким образом, чтобы оптическая плотность при 517 нм была в пределах 0,4-0,5 (зона максимальной чувствительности теста). К образцу исследуемого препарата в объеме 0,1 мл добавляли 2 мл рабочего раствора ДФПГ и инкубировали 15 мин. Оптическую плотность регистрировали на спектрофотометре СФ-46 (ЛОМО) против оптического контроля. Образцы получали путем нескольких последовательных двоичных разведении исходного препарата.
2. Определение общей антиокислительной активности препарата (АОА) с суспензией липопротеинов желтка куриных яиц.
АОА 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия оценивали по модифицированному методу Клебанова и др. [Клебанов Г.И., Бабенкова И.В., Теселкин Ю.А. и др. Лаб.дело, 1988, №5, с.59-62].
Принцип метода: При использовании в качестве субстрата пероксидации суспензии многослойных липосом, полученных из желтка куриных яиц, АОА проявляется в виде подавления индуцированных ионами двухвалентного железа реакций перекисного окисления липидов (ПОЛ), регистрируемых по взаимодействию продуктов пероксидации с тиобарбитуровой кислотой.
Ход определения: Яичный желток смешивали с 0,1 М Na-фосфатным буфером, рН 7,4, в соотношении 1:1, суспендировали, разбавляли тем же буфером в соотношении 1:25. Использовали только свежеприготовленную суспензию. К 0,1 мл исследуемого образца добавляли 1,6 мл Na-фосфатного буфера, 0,1 мл рабочей суспензии липосом и 20 мкл раствора FeSO4 (конечная концентрация - 1 мМ), инкубировали 15 мин при 37°С, после чего реакцию останавливали внесением 0,2 мл 50%-ной трихлоруксусной кислоты. Далее пробы центрифугировали при 3000 g 10 мин и определяли ТБК-положительные продукты в реакции с 0,8%-ной тиобарбитуровой кислотой фотометрическим методом при длине волны 532 нм. Степень АОА выражали в процентах от контрольных проб.
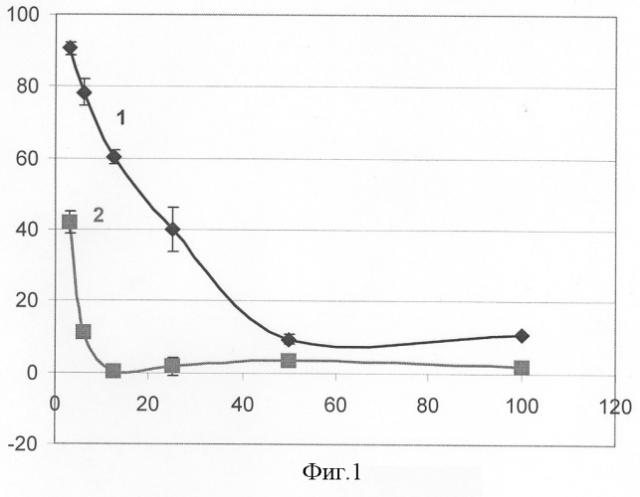
Дозозависимое уменьшение свободных радикалов в тесте с ДФПГ и продуктов индуцированного ПОЛ в системе с желточными липосомами представлено на фиг.1. (Фиг.1. Антиоксидантная активность 3,6-диоксоциклагекса-1,4-диен-1,2,4,5-тетрасульфоната Na in vitro). По оси абсцисс представлена концентрация препарата в мг/л, по оси ординат - оптическая плотность в % от контроля. Кривая 1 - антирадикальная активность 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия в тесте с ДФПГ, кривая 2 - антиоксидантная активность в тесте с липосомами. Вертикальные столбики здесь и на следующих чертежах - стандартное отклонение.
Из фиг.1 видно, что тест с липосомами оказался более чувствительным и, если оценить концентрацию, ингибирующую на 50% свободнорадикальные процессы (IC50) в этом методе, то эта цифра составит менее 10 мг/л. Для сравнения: данные in vivo, полученные на мышах, показали эффективную терапевтическую концентрацию около 50 мг/кг.
Опыты на клеточных культурах
Клеточные культуры, использованные в работе - MDCK (эпителиоидная линия почки собаки-спаниэля), и фибробласты легкого эмбриона человека являются линиями, депонированными в коллекции клеточных культур НИИ гриппа РАМН, С.Петербург, и охарактеризованы в соответствии с требованиями, предъявляемыми к паспортизации депонированных клеточных линий [Соминина А.А. (ред.) Методические рекомендации по работе с клеточными культурами и средами. Л., Всес.НИИ гриппа МЗ СССР, 1975, 43 с.].
Клетки выращивали на рекомендованных для соответствующей культуры питательных средах - среде Игла или ДМЕМ ("Биолот", СПб.) с добавлением 10%-ной фетальной сыворотки теленка ("Sigma", США). При проведении опытов клетки рассевали в посевной концентрации 200.000-250.000 клеток/мл в пластиковые 24-х или 96-ти луночные культуральные планшеты фирм "Sarysedt" (Германия) или "Orange" (Бельгия) и инкубировали при 37°С в СО2-инкубаторе ("Sanyo", Япония) в атмосфере 5% CO2. Ремантадин и 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия растворяли в забуференном физиологическом растворе (PBS) или в ростовой среде Игла в зависимости от длительности экспозиции культур с препаратами. Клетки инкубировали с препаратами 2 час (PBS), 24 час или 72 час (ростовая среда).
Оценка жизнеспособности клеток и интенсивности клеточного метаболизма
Принцип метода: Восстановление клетками водорастворимого тетразолиевого красителя МТТ: 3-(4,5-диметилтиазолил-2)2,5-дифенилтетразолий бромид (ICN Pharmaceuticals, США) отражает интегральную активность митохондриальных дегидрогеназ и служит адекватным показателем жизнеспособности клеток в культуре и напряженности окислительных процессов. Этот метод - один из наиболее часто используемых показателей цитотоксичности [Clemedson С.et al., ATLA, 1996, v.24, Suppl.1, p.251-311].
Ход определения: Микротетразолиевый тест проводили согласно Mosmann [Mosmann Т. J Immunol Meth, 1983, v.65 (1), р.55-63]. Клеточные культуры, выращенные в 24-х или 96-ти луночных планшетах до состояния конфлуэнтного монослоя, инкубировали 3 ч в растворе МТТ (0,5 мг/мл) на забуференном физиологическом растворе при 37°С в СО2-инкубаторе. Образовавшиеся водонерастворимые кристаллы формазана экстрагировали 95° этанолом 30 мин и измеряли оптическую плотность образцов при длине волны 550 нм. Средние цитотоксические дозы - концентрации препаратов, подавляющие жизнеспособность клеток на 50%, рассчитывали из уравнений линейной регрессии, построенных по зависимости доза-эффект. Математическую и статистическую обработку результатов проводили по программному пакету Statistica 6.0 ("Statsoft Inc.", США).
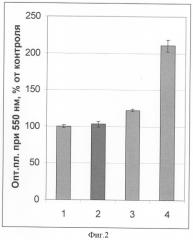
Антигипоксический эффект 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия, выраженный в возрастании активности митохондриальных дегидрогеназ, в особенности сукцинатдегидроргеназы, и регистрируемый в тесте МТТ, представлен на фиг.2. (Фиг.2. Антигипоксический эффект 3,6-диоксоциклагекса-1,4-диен-1,2,4,5-тетрасульфоната Na на культурах MDCK в условиях бессывороточной среды культивирования. Концентрация препарата 31,3 мкг/мл (≈55 мкМ). Показатель окислительного метаболизма - МТТ. 1 - контроль; 2 - инкубация 2 час; 3 - инкубация 48 час; 4 - инкубация 48 час в условиях гипоксии).
По оси абсцисс на этом чертеже - состав опытных проб; по оси ординат - оптическая плотность в тесте МТТ, выраженная в процентах от таковой интактного контроля (клеточная культура без воздействия). Культуры клеток MDCK инкубировали с препаратом разные сроки в бессывороточной среде в нормальных условиях (негерметично закрытые пластиковые планшеты в CO2-инкубаторе) и в условиях гипоксии ("пенициллиновые" флаконы с герметично закрытыми резиновыми пробками). Антигипоксический эффект препарата особенно ярко проявлялся при длительном сроке инкубации клеток и в условиях гипоксии (фиг.2): так, при инкубации 2 час активность дыхательных ферментов клеток не отличалась достоверно от контроля, при инкубации 48 час достоверно превышала контрольные значения на 22-24%, а при инкубации 48 час в условиях гипоксии их активность под действием 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия превышала контрольные значения более чем в два раза.
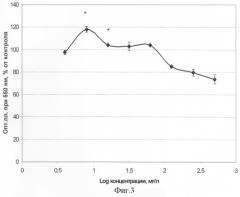
Было протестировано также действие широкого диапазона концентраций 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия на фибробласты человека в культуре по вышеописанному методу Mosmann [Mosmann Т. J Immunol Meth, 1983, v.65 (1), p.55-63]. Получены результаты, подтверждающие, что препарат обладает низкой токсичностью - фиг.3 (Фиг.3. Действие 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната Na на эмбриональные фибробласты человека в культуре. Тест-метод - МТТ. * - Область достоверных превышений контроля).
На этом чертеже по оси абсцисс - десятичный логарифм концентрации препарата в мг/л, по оси ординат - опт. плотность при 550 нм в % от контроля. В пределах концентраций от 2 до 1000 мг/л ЦТД50 не достигается.
Более того, при низких концентрациях препарата (7,9-63,1 мг/л) отмечено действие, стимулирующее дыхательную активность клеток. При аппроксимации полученных данных методом линейного регрессионного анализа вычисленное значение ЦТД50 составило 1700 мг/л. Оценка фармакологического индекса, показывающего в данном случае, во сколько раз ЦТД50 больше эффективной терапевтической концентрации, дала очень хороший показатель - больше 50, тогда как даже при показателе, равном десяти, препарат считается перспективным для дальнейшего проведения по доклиническому испытанию. Вывод: антигипоксантный и антиоксидантный эффекты соединения ответственны за его цитопротекторное действие.
Далее было проведено определение цитопротекторного действия 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия в присутствии ремантадина, то есть изучено воздействие на клетки двух препаратов при их совместном использовании, чтобы выявить снижение токсичности ремантадина в присутствии 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия.
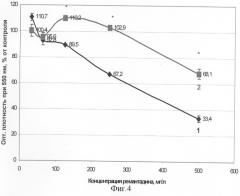
Цитопротекторное действие 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия определяли по вышеприведенной методике восстановления МТТ [Mosmann Т. J Immunol Meth, 1983, v.65 (1), p.55-63]. Доказательство эффективного цитопротекторного действия 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия на клетки в присутствии разных концентраций ремантадина проиллюстрировано примерами на фиг.4 и 5. На этих чертежах по оси абсцисс - концентрация ремантадина, по оси ординат - опт. плотность при 550 нм в % от контроля. Снижение токсичности ремантадина в культурах эмбриональных фибробластов человека показано на фиг.4. (Фиг.4. Действие 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната Na на вызванный ремантадином цитотоксический ответ эмбриональных фибробластов человека в культуре. Показатель токсичности - МТТ. * - отличие от проб с соответствующей концентрацией ремантадина достоверно, р<0,01).
Кривая 1 соответствует дозозависимому снижению суммарной активности дыхательных ферментов фибробластов в присутствии ремантадина. При всех токсичных в отношении нормальных фибробластов концентрациях ремантадина (125-500 мг/л) наблюдается достоверное повышение жизнеспособности клеток под воздействием 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия. ЦТД50 в данном случае определяется как 378 мг/л. Кривая 2 - это снижение дыхательной активности клеток, защищенных 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонатом натрия в концентрации 31,2 мкг/мл. ЦТД50 в этом случае существенно выше (862 мг/л), то есть отмечено уменьшение токсичности ремантадина в 2,3 раза. Защитный эффект в отношении культур клеток линии MDCK (эпителиоидные клетки почки собаки) оказался чуть ниже - снижение токсичности в 1,8 раз (фиг.5), но в обоих случаях этот эффект значимый в широких пределах концентраций ремантадина: от 7,8 до 500 мг/л. Аналогичные данные получены для концентраций 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия 20-80 мкг/мл.
Таким образом, показана высокая эффективность 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия in vitro не только как антиоксиданта/антигипоксанта, но и как агента, способного существенно снижать токсичность ремантадина при их совместном применении.
Вирусологические исследования
Противовирусная активность 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия отмечена ранее [патент РФ №2244546]. Было интересно определить, как 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия и ремантадин действуют на вирусную инфекцию при сочетанном применении.
Принцип метода: с тем, чтобы оценить, влияет ли 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия на противовирусный эффект ремантадина, оценивали цитопатогенное действие вируса гриппа A H3N2 на культуры клеток MDCK в присутствии данных препаратов в отдельности и их комбинации. Цитопатическую реакцию клеток при воздействии на них вируса оценивали указанным выше методом МТТ. Степень угнетения жизнеспособности клеток в культуре коррелирует с развитием вирусной инфекции in vitro.
Ход определения: в качестве эталонного был выбран высокоинфекционный штамм вируса гриппа А Новосибирск /4/ 04 H3N2. Лиофильно высушенный вирус восстанавливали на культуре клеток MDCK: к лиофилизату, полученному из 1 мл вируссодержащей среды, добавляли 1 мл среды Игла и 0,2 мл полученной суспензии вносили в культуральные флаконы с клетками, через 1 час добавляли по 2 мл поддерживающей среды Игла на флакон, после чего культуры инкубировали 48-72 ч при 34°С. Присутствие вируса в среде инкубации определяли микрометодом реакции гемагглютинации с 0,5%-ной суспензией человеческих эритроцитов I (0) группы крови. В результате определяли инфекционную дозу рабочего вируса и подбирали разведения для последующего заражения опытных культур.
Результаты тестирования показаны на фиг.6. (Фиг.6. Действие ремантадина и 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната Na на цитопатическую реакцию в культурах клеток MDCK, вызванную вирусом гриппа А Новосибирск /4/ 04 H3N2. Инкубация с вирусом и препаратами 24 час. 1 - контроль; 2 - вирус; 3 - вирус, ремантадин-1; 4 - вирус, ремантадин-2; 5 - вирус, препарат; 6 - вирус, ремантадин-1+ препарат; 7 - вирус, ремантадин-2+ препарат. * - отличие от контроля достоверно, р<0,001).
Здесь по оси абсцисс - состав среды инкубации, по оси ординат оптическая плотность при 550 нм в % от контрольных проб (интактные клетки, не инфицированные вирусом). Концентрации ремантадина составили - ремантадин: 1-30 мг/л (что является среднеэффективной противовирусной дозой in vitro в отношении гриппа подтипа А), ремантадин: 2-10 мг/л. Концентрация 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия в данном случае: 31,3 мг/л. Показаны данные, полученные при заражении вирусом в титре 0,5×10-1. Как видно из фиг.6, вирус гриппа вызывал ярко выраженную цитопатическую реакцию клеток в культуре (угнетение жизнеспособности до 25,2±5,4% от контроля), в то время как ремантадин оказывал существенное защитное действие: при дозе ремантадина 10 мг/л угнетение жизнеспособности клеток составило 40,6±1,88% от контроля; при его дозе 30 мг/л соответствующий показатель был 54,4±5,9 от контроля.
3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия, как сам по себе, так и в комбинации с ремантадином, полностью восстанавливал жизнеспособность клеток: интегральный показатель их жизнеспособности в тесте МТТ составил 110,5-112,4% по отношении к интактным клеткам. Следовательно, в дополнение к цитопротекторному действию в отношении токсичности, вызванной высокими концентрациями ремантадина, 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия не только не снижал противовирусное действие последнего в эффективных противовирусных дозах, но напротив существенно усиливал жизнеспособность клеток при воздействии вирусной инфекции.
Заключение: токсичность ремантадина, установленная нами in vitro, составила 200-350 мг/л (IC50) при 2-х часовой экспозиции, что хорошо совпадает с данными, установленными in vivo (LD50=160-210 мг/кг для мышей при парентеральном введении). При конечных концентрациях 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия 20-40 мг/л снижение токсичности ремантадина при его комбинированном введении с испытываемым препаратом (увеличение IC50) составило 1,8-2,3 раза (фиг.4 и 5), следовательно, терапевтические дозы ремантадина могут быть увеличены в два раза без каких-либо побочных эффектов. Применяемое химическое соединение не ухудшает действие основного препарата - ремантадина, а дает ему возможность проявить полностью свою биологическую (антивирусную) активность.
Исходя из испытаний средства на предмет снижения токсичности ремантадина авторами проведены исследования на оптимальные соотношения препаратов, когда полностью сохраняется противовирусный эффект от действия ремантадина и в то же время у препарата ремантадина не отмечено токсического действия (фиг.4-6). Таким образом установлено, что оптимальным соотношением по массе ремантадин: 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия в композиции составляет от 1:1 до 1:4. В таком сочетании больным можно назначать лечение ремантадином, не опасаясь осложнений из-за наличия у них сопутствующих заболеваний.
1. Средство с антигипоксическим действием, отличающееся тем, что оно представляет собой 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия.
2. Применение 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия в качестве цитопротекторного средства.
3. Применение 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфоната натрия в качестве средства для снижения токсичности ремантадина на клеточном уровне.
4. Композиция, обладающая противогриппозным действием, включающая ремантадин, отличающаяся тем, что она дополнительно содержит 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфонат натрия при соотношении ингредиентов, мг:
| ремантадин | 1 |
| 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетра- | |
| сульфонат натрия | 1-4 |