Карбамидзамещенные имидазохинолиновые эфиры
Иллюстрации
Показать всеИзобретение относится к карбамидзамещенным имидазохинолиновым эфирам. Описывается соединение формулы (I):
Х представляет собой -CHR5-, -CHR5-алкильную группу; R1 выбран из группы, содержащей радикалы: -R4-NR8-CR3-NR5-Z-R6-алкил; -R4-NR8-CR3-NR5-Z-R6-фенил; -R4-NR8-CR3-NR5-Z-R6-фуранил; -R4-NR8-CR3-NR5R7; при этом фенил замещается или не замещается одним или более заместителями, выбранными из группы, состоящей из метила; метоксила; метилтио; циано; водорода; диметиламина и ацетила; R2 выбран из группы, содержащий радикалы: -водород; -алкил; -алкил-Y-алкил; R3 представляет собой =O или =S; R4 представляет собой алкил, в который может войти одна или несколько -O-групп; каждый R5 представляет собой Н или C1-10алкил; R6 представляет собой связь или алкил; R7 соединяется с R5, образуя цикл; R8 представляет собой Н, С1-10алкил или R4 и R8 могут соединяться, образуя морфолиновое кольцо; Y представляет собой -O-; Z представляет собой связь, -СО- или -SO2-; n имеет значение 0; каждый R выбран независимо из группы, состоящей из радикалов С1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил; или же соль фармацевтического качества указанных соединений. Также описываются соединения общей формулы (II), промежуточные соединения общих формул (III) и (IV), фармацевтические составы на основе соединений формул (I) и (II) являющиеся иммуномодуляторами для биосинтеза цитокинов, способы стимулирования биосинтеза цитокинов на основе соединений формул (I) и (II), способы лечения вирусного заболевания на основе соединений формул (I) и (II), способы лечения опухолевого заболевания на основе соединений формул (I) и (II). Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 13 н. и 10 з.п. ф-лы, 4 табл.
Реферат
Настоящее изобретение касается имидазохинолиновых соединений, имеющих простую эфирную и мочевинную группы в положении 1, и фармацевтических составов, содержащих такие соединения. Другой аспект настоящего изобретения затрагивает применение данных соединений в качестве иммуномодуляторов для стимулирования биосинтеза цитокинов в организме животных и для лечения заболеваний, включая вирусные болезни и опухолевые заболевания.
Первый надежный отчет о циклической системе 1Н-имидазо[4,5-с]хинолина (Бакман и др., J. Orq. Chem. 15, 1278-1284 (1950)) описывает синтез 1-(6-метокси-8-хинолинил)-2-метил-1Н-имидазо[4,5-с]хинолина для возможного применения в качестве противомалярийного средства. Далее поступило сообщение о синтезе различных замещенных 1H-имидазо[4,5-с]хинолинов. Так, например, было синтезировано соединение 1-[2-(4-пиперидил)этил]-1Н-имидазо[4,5-с]хинолин (Джейн и др., J. Med. Chem. 11, p.87-92 (1968)) в качестве предполагаемого противосудорожного и сердечно-сосудистого средства. Имелись также сообщения о ряде 2-оксоимидазо[4,5-с]хинолинов (Баранов и др., Chem. Abs. 85, 94362 (1976), Берени и др., J. Heterocyclic Chem. 18, 1537-1540 (1981)).
Позднее было обнаружено, что некоторые 1H-имидазо[4,5-с]хинолин-4-амины и их 1- и 2-замещенные производные могут найти применение как противовирусные средства, бронхолитические средства и иммуномодуляторы. В числе прочих публикаций можно сослаться на патенты США №4689338, 4698348, 4929624, 5037986, 5268376, 5346905 и 5389640; все эти патенты приведены здесь в качестве ссылок.
Продолжает вызывать интерес циклическая система имидазохинолина.
Известны некоторые 1H-имидазо[4,5-с]нафтиридин-4-амины, 1H-имидазо[4,5-с]пиридин-4-амины и 1Н-имидазо[4,5-с]хинолин-4-амины, имеющие заместитель с простой эфирной группой в положении 1. Они описаны в патентах США №5268376, 5389640 и 5494916 и в международной заявке WO 99/29693.
Несмотря на указанные попытки выявить соединения, полезные в качестве модификаторов иммунной реакции, по-прежнему имеется потребность в соединениях, которые обладают способностью модулировать иммунную реакцию путем стимулирования биосинтеза цитокинов или под действием иных механизмов.
Краткое описание сущности изобретения
Авторами был обнаружен новый класс соединений, способных стимулировать биосинтез цитокинов в организме животных. Настоящее изобретение поэтому касается соединений имидазохинолин-4-амина и тетрагидроимидазохинолин-4-амина, имеющих заместитель с простой эфирной и мочевинной группами в положении 1. Данные соединения могут быть описаны формулами (I) и (II); подробности их строения приведены ниже. Общая структурная формула этих соединений такова:
При этом X, R1, R2 и R определены для каждого класса соединений, имеющих формулы (I) и (II).
Соединения, представленные формулами (I) и (II), могут применяться в качестве модификаторов иммунной реакции вследствие их способности стимулировать биосинтез цитокинов и иными способами модулировать иммунную реакцию при введении в организм животных. Эти свойства делают указанные соединения полезными для лечения ряда заболеваний, таких как вирусные болезни и опухоли, реагирующие на изменения в иммунной реакции.
Настоящее изобретение касается фармацевтических составов, содержащих соединения, модифицирующие иммунную реакцию, и способов стимулирования биосинтеза цитокинов в организме животных, лечения вирусной инфекции у животных и(или) лечения опухолевых заболеваний у животных путем введения животным соединений формулы (I) или (II).
Кроме того, настоящее изобретение затрагивает способы синтеза соединений, представленных в нем, и промежуточных продуктов, используемых при синтезе данных соединений.
Подробное описание изобретения
Как было упомянуто выше, обнаружены некоторые соединения, стимулирующие биосинтез цитокинов и модифицирующие иммунную реакцию в организме животных. Такие соединения представлены формулами (I) и (II), приведенными ниже.
Имидазохинолиновые соединения, составляющие предмет изобретения и имеющие простую эфирную и мочевинную группы в положении 1, представлены формулой (I):
Где X представляет собой -CHR5-, -CHR5-алкильную или -CHR5-алкенильную группу;
R1 выбран из группы, содержащей радикалы:
-R4-NR8-CR3-NR5-Z-R6-алкил;
-R4-NR8-CR3-NR5-Z-R6-алкенил;
-R4-NR8-CR3-NR5-Z-R6-арил;
-R4-NR8-CR3-NR5-Z-R6-гетероарил;
-R4-NR8-CR3-NR5-Z-R6-гетероциклил;
-R4-NR8-CR3-NR5R7;
-R4-NR8-CR3-NR9-Z-R6-алкил;
-R4-NR8-CR3-NR9-Z-R6-алкенил;
-R4-NR8-CR3-NR9-Z-R6-арил;
-R4-NR8-CR3-NR9-Z-R6-гетероарил;
-R4-NR8-CR3-NR9-Z-R6-гетероциклил;
R2 выбран из группы, содержащей радикалы:
-водород;
-алкил;
-алкенил;
-арил;
-гетероарил;
-гетероциклил;
-алкил-Y-алкил;
-алкил-Y-алкенил;
-алкил-Y-арил; а также
-алкил или алкенил, с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
-ОН;
-галоген;
-N(R5)2;
-CO-N(R5)2;
-СО-С1-10алкил;
-СО-O-С1-10алкил;
-N3;
-арил;
-гетероарил;
-гетероциклил;
-СО-арил; а также
-СО-гетероарил;
каждый R3 представляет собой =O или =S;
каждый R4 представляет собой независимо алкил или алкенил, в который может войти одна или несколько -O-групп;
каждый R5 представляет собой независимо Н или C1-10алкил;
R6 представляет собой связь или же алкил или алкенил, который может прерваться одной или несколькими -O-группами;
R7 представляет собой Н или C1-10алкил, в который может войти гетероатом, или же R7 и R5 могут соединиться, образуя цикл;
R8 представляет собой Н, C1-10алкил или арилалкил или же R4 и R8 могут соединиться, образуя цикл;
R9 представляет собой C1-10алкил, который может соединиться с R8 с образованием цикла;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
Z представляет собой связь, -СО- или -SO2-;
n может иметь значение от 0 до 4;
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Настоящее изобретение также включает в себя тетрагидроимидазохинолиновые соединения, несущие простую эфирную группу и заместитель, содержащий мочевину, в положении 1. Такие тетрагидроимидазохинолиновые соединения представлены формулой (II):
Где Х представляет собой -CHR5-, -CHR5-алкильную или -CHR5-алкенильную группу;
R1 выбран из группы, содержащей радикалы:
-R4-NR8-CR3-NR5-Z-R6-алкил;
-R4-NR8-CR3-NR5-Z-R6-алкенил;
-R4-NR8-CR3-NR5-Z-R6-арил;
-R4-NR8-CR3-NR5-Z-R6-гетероарил
-R4-NR8-CR3-NR5-Z-R6-гетероциклил
-R4-NR8-CR3-NR5R7
-R4-NR8-CR3-NR9-Z-R6-арил
-R4-NR8-CR3-NR9-Z-R6-алкенил;
-R4-NR8-CR3-NR9-Z-R6-арил;
-R4-NR8-CR3-NR9-Z-R6-гетероарил; а также
-R4-NR8-CR3-NR9-Z-R6-гетероциклил;
R2 выбран из группы, содержащей радикалы:
-водород;
-алкил;
-алкенил;
-арил;
-гетероарил;
-гетероциклил;
-алкил-Y-алкил;
-алкил-Y-алкенил;
-алкил-Y-арил; а также
-алкил или алкенил, с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
-ОН;
-галоген;
-N(R5)2;
-CO-N(R5)2;
-CO-C1-10алкил;
-CO-O-C1-10алкил;
-N3;
-арил;
-гетероарил;
-гетероциклил;
-СО-арил; а также
-СО-гетероарил;
каждый R3 представляет собой =O или =S;
каждый R4 представляет собой независимо алкил или алкенил, в который может войти одна или несколько -O-групп;
каждый R5 представляет собой независимо Н или C1-10алкил;
R6 представляет собой связь или же алкил или алкенил, который может прерваться одной или несколькими -O-группами;
R7 представляет собой Н или С1-10алкил, в который может войти гетероатом, или же R5 и R7 могут соединиться, образуя цикл;
R8 представляет собой Н, С1-10алкил или арилалкил или же R4 и R8 могут соединиться, образуя цикл;
R9 представляет собой C1-10алкил, который может соединиться с R8, образуя цикл;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
Z представляет собой связь, -СО- или -SO2-;
n может иметь значение от 0 до 4;
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Получение соединений
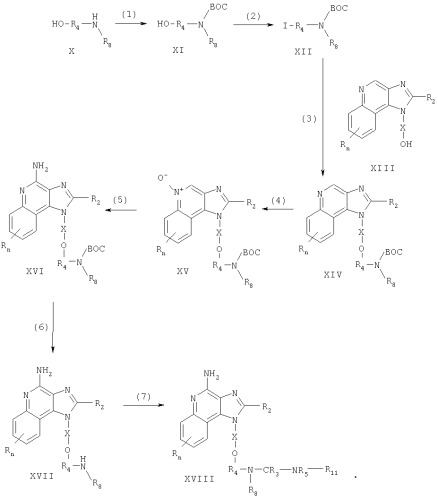
Соединения, представляющие собой предмет настоящего изобретения, можно получать по схеме реакции I, где R, R2, R3, R4, R5, R8, Х и n определены выше, ВОС представляет собой трет-бутоксикарбонил, a R11 это -Z-R6-алкил, -Z-R6-алкенил, -Z-R6-арил, -Z-R6-гетероарил, -Z-R6-гетероциклил или же R11 представляет собой R7, причем значения R6, R7 и Z определены выше.
На стадии (1) процесса (схема I реакции) аминогруппа аминоспирта формулы X защищена трет-бутоксикарбонильной группой. Раствор аминоспирта в тетрагидрофуране обрабатывают ди-трет-бутилдикарбонатом в присутствии основания, например, гидроксида натрия. Многие аминоспирты формулы Х коммерчески доступны; другие могут быть получены с применением известных способов синтеза.
На стадии (2) процесса (схема I реакции) защищенный аминоспирт формулы XI превращают в йодид (формула XII). Йод вводят в раствор трифенилфосфина и имидазола в дихлорметане; далее добавляют раствор защищенного аминоспирта формулы XI в дихлорметане. Реакцию проводят при температуре окружающей среды.
На стадии (3) процесса (схема I реакции) 1H-имидазо[4,5-с]хинолин-1-иловый спирт формулы XIII алкилируют йодидом формулы XII с получением 1Н-имидазо[4,5-с]хинолин-1-илового простого эфира формулы XIV. Спирт формулы XIII обрабатывают гидридом натрия в соответствующем растворителе, таком как N,N-диметилформамиде образуя алкоксид. При температуре окружающей среды к раствору алкоксида добавляют указанный йодид. По завершении добавления реакционную смесь перемешивают при повышенной температуре (прибл. 100°С). Известны многие соединения формулы XIII; см., например, патент США 4689338 (Герстер). Другие соединения могут быть получены без затруднений по известным способам синтеза, см., например, патенты США №5605899 (Герстер и др.) и 5175296 (Герстер).
На стадии (4) процесса (схема I реакции) 1H-имидазо[4,5-с]хинолин-1-иловый эфир формулы XIV окисляют до 1Н-имидазо[4,5-с]хинолин-5N-оксида формулы XV с применением обычно используемого окислителя, способного образовывать N-оксиды. Предпочтительно окислять раствор соединения формулы XIV в хлороформе 3-хлорпероксибензойной кислотой при температуре окружающей среды.
На стадии (5) процесса (схема I реакции) 1Н-имидазо[4,5-с]хинолин-5N-оксид формулы XV аминируют с получением 1Н-имидазо[4,5-с]хинолин-4-амина формулы XVI. В стадию (5) входят следующие части: (i) реакция соединения формулы XV с ацилирующим веществом и (ii) реакция полученного продукта с аминирующим веществом. Часть (I) стадии (5) вступает в реакцию N-оксида формулы XV с ацилирующим веществом. В число подходящих ацилирующих веществ входят алкил- или арилсульфонилхлориды (например, бензолсульфонилхлорид, метансульфонилхлорид, п-толуолсульфонилхлорид). Предпочтение отдается арилсульфонилхлоридам. Наиболее применим n-толуолсульфонилхлорид. Часть (ii) стадии (5) включает в себя взаимодействие продукта части (i) с избытком аминирующего вещества. В число подходящих аминирующих веществ входят аммиак (например, в виде гидроксида аммония) и соли аммония (например, карбонат аммония, бикарбонат аммония, фосфат аммония). Предпочтение отдается гидроксиду аммония. Реакцию предпочтительно проводить путем растворения N-оксида формулы XV в инертном растворителе (таком, как дихлорметан или 1,2-дихлорэтан) при нагревании, если это необходимо, добавления аминирующего вещества к раствору и медленного введения ацилирующего вещества. В качестве варианта можно проводить реакцию в автоклаве при повышенной температуре (85-100°С).
На стадии (6) процесса (схема I реакции) защитную группу удаляют путем гидролиза в кислотных условиях, получая 1H-имидазо[4,5-с]хинолин-4-амин формулы XVII. Предпочтительно обрабатывать соединение формулы XVI соляной кислотой с этанолом при температуре окружающей среды или при осторожном нагревании.
На стадии (7) процесса (схема I реакции) 1H-имидазо[4,5-с]хинолин-4-амин формулы XVII превращают в производное мочевины или тиомочевины формулы XVIII с применением известных способов синтеза. Так, например, соединение формулы XVII можно обработать изоцианатом формулы R12-N=C=O, где R12 это -R6-алкил, -R6-алкенил, -R6-арил, R6-гетероарил или -R6-гетероциклил. Реакцию можно проводить путем добавления раствора изоцианата в соответствующем растворителе, таком как дихлорметан или 1-метил-2-пирролидинон, к раствору соединения формулы XVII при температуре окружающей среды. В качестве варианта можно обработать соединение формулы XVII тиоизоцианатом формулы R12-N=C=S, ацилизоцианатом формулы R12-C(O)-N=C=O, сульфонилизоцианатом формулы R12-S(O2)-N=C=O или карбамоилхлоридом формулы R13-N-C(O)Cl, где R13 это R12 или R7. Продукт или его соль фармацевтического качества можно выделить по стандартным способам.
Схема I реакции
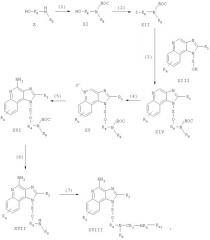
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой II реакции, где R, R2, R3, R4, R5, R8, X и n определены выше, а ВОС представляет собой трет-бутоксикарбонил.
На стадии (1) процесса (схема II реакции) аминогруппа аминоспирта формулы XIX защищена трет-бутоксикарбонильной группой. Раствор аминоспирта в тетрагидрофуране обрабатывают ди-трет-бутилдикарбонатом в присутствии основания, например гидроксида натрия. Многие аминоспирты формулы XIX коммерчески доступны; другие могут быть получены с применением известных способов синтеза.
На стадии (2) процесса (схема II реакции) защищенный аминоспирт формулы XX превращают в метансульфонат (формула XXI). Раствор соединения формулы XX в соответствующем растворителе, например в дихлорметане, обрабатывают метансульфонилхлоридом в присутствии основания, например триэтиламина. Реакцию можно проводить при пониженной температуре (0°С).
На стадии (3а) процесса (схема II реакции) метансульфонат формулы XXI превращают в азид формулы XXII. К раствору соединения формулы XXI в подходящем растворителе, таком как N,N-диметилформамид, добавляют азид натрия. Реакцию можно проводить при повышенной температуре (80-100°С).
На стадии (3b) процесса (схема II реакции) соединение формулы XXII алкилируют галогенидом формулы Hal-R8, получая соединения формулы XXIII. Для соединений, у которых R8 представляет собой водород, данный этап пропускают. Проводят реакцию между соединением формулы XXII и гидридом натрия в подходящем растворителе, таком как N,N-диметилформамид или тетрагидрофуран, с образованием аниона, после чего осуществляют взаимодействие с галогенидом. Реакцию можно проводить при температуре окружающей среды.
На стадии (4) процесса (схема II реакции) азид формулы XXII или XXIII восстанавливают до амина формулы XXIV. Предпочтительно проводить восстановление с применением обычного гетерогенного катализатора гидрогенизации, например палладия на углероде. Реакцию удобно выполнять в аппарате Парра в соответствующем растворителе, например в метаноле или изопропаноле.
На стадии (5) процесса (схема II реакции) 4-хлор-3-нитрохинолин формулы XXV реагирует с амином формулы XXIV, образуя 3-нитрохинолин формулы XXVI. Реакцию можно выполнять путем добавления амина формулы XXIV к раствору соединения формулы XXV в соответствующем растворителе, например в дихлорметане, в присутствии основания, например триэтиламина. Известно много хинолинов формулы XXV; такие хинолины можно также получать, используя известные способы: см., например, патент США 4689338 (Герстер) и данные в нем ссылки.
На стадии (6) процесса (схема II реакции) 3-нитрохинолин формулы XXVI восстанавливают до 3-аминохинолина формулы XXVII. Предпочтительно проводить восстановление с применением обычного гетерогенного катализатора гидрогенизации, например палладия на углероде. Реакцию удобно выполнять в аппарате Парра в соответствующем растворителе, например в толуоле.
На стадии (7) процесса (схема II реакции) соединение формулы XXVII реагирует с карбоновой кислотой или ее эквивалентом, образуя 1Н-имидазо[4,5-финолин формулы XIV. В число подходящих эквивалентов карбоновой кислоты входят сложные ортоэфиры и 1,1-диалкоксиалкилалканоаты. Карбоновую кислоту или ее эквивалент выбирают так, чтобы в состав соединения формулы XIV входил желаемый заместитель R2. Так, например, при введении триэтилортоформиата образуется соединение, в котором R2 представляет собой водород; в присутствии триэтилортовалерата R2 представляет собой бутил. Реакцию можно проводить в отсутствие растворителя или в инертном растворителе, таком как толуол. Реакция протекает с разогревом, достаточным для того, чтобы любой спирт или вода, образующиеся как побочные продукты, улетучились. В качестве варианта можно ввести каталитическое количество пиридингидрохлорида.
В качестве альтернативы можно выполнить стадию (7) путем (i) проведения реакции между соединением формулы XXVII и ацилгалогенидом формулы R2C(O)Cl и (ii) циклизации. В части (i) ацилгалогенид добавляют к раствору соединения формулы XXVII в инертном растворителе, например в ацетонитриле или дихлорметане. Эту реакцию можно проводить при температуре окружающей среды или пониженной температуре. В части (ii) продукт части (i) нагревают в спиртовом растворе в присутствии основания. Предпочтительно нагревать этанольный раствор продукта части (i) в присутствии избытка триэтиламина с обратным холодильником или же нагревать в метанольном растворе аммиака.
Стадии (8), (9), (10) и (11) проводят так же, как стадии (4), (5), (6) и (7) процесса (схема I реакции).
Схема II реакции
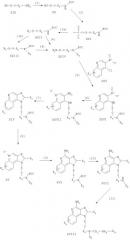
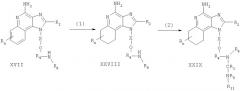
Соединения, представляющие собой предмет настоящего изобретения, можно получать по схеме III реакции, где R, R2, R3, R4, R5, R8, R11, Х и n определены выше.
На стадии (1) процесса (схема III реакции) 1H-имидазо[4,5-с]хинолин-4-амин формулы XVII восстанавливают до 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амина формулы XXVIII. Предпочтительно проводить восстановление путем суспендирования или растворения соединения формулы XVII в трифторуксусной кислоте, добавления каталитического количества оксида платины (IV) и последующей гидрогенизации. Реакцию удобно выполнять в аппарате Парра.
Стадию (2) проводят так же, как стадию (7) процесса (схема I реакции) получая 6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-4-амин формулы XXIX. Продукт или его соль фармацевтического качества можно выделить по стандартным способам.
Реакционная схема III
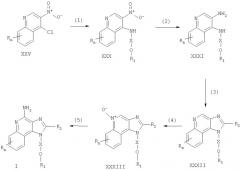
Соединения, представляющие собой предмет настоящего изобретения, можно также получать в соответствии со схемой IV реакции, где R, R2, Х и n определены выше.
На стадии (1) процесса (схема IV реакции) 4-хлор-3-нитрохинолин формулы XXV реагирует с амином формулы R1-O-X-NH2, образуя 3-нитрохинолин-4-амин формулы XXX. Реакцию можно проводить путем добавления амина к раствору соединения формулы XXV в подходящем растворителе, таком как хлороформ или дихлорметан, с возможным нагревом. Многие хинолины формулы XXV хорошо известны: см., например патент США 4689338 (Герстер) и приведенные там ссылки.
На стадии (2) процесса (схема IV реакции) 3-нитрохинолин-4-амин формулы XXX восстанавливают с применением способа, описанного для стадии (6) процесса (схема II реакции), получая хинолин-3,4-диамин формулы XXXI.
На стадии (3) процесса (схема IV реакции) хинолин-3,4-диамин формулы XXXI подвергают циклизации по способу, описанному для стадии (7) процесса (схема II реакции), получая 1H-имидазо[4,5-с]хинолин формулы XXXII.
На стадии (4) процесса (схема IV реакции) 1H-имидазо[4,5-с]хинолин формулы XXXII окисляют по способу, описанному для стадии (4) процесса (схема I реакции), получая 1H-имидазо[4,5-с]хинолин-5N-оксид формулы XXXIII.
На стадии (5) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин-5N-оксид формулы XXXIII аминируют по способу, описанному для стадии (5) процесса (схема I реакции) с получением 1Н-имидазо[4,5-с]хинолин-4-амина формулы I. Продукт или его соль фармацевтического качества можно выделить по стандартным способам.
Схема IV реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой V реакции, где R, R2, R3, R4, R5, R8, R11, Х и n определены выше.
На стадии (1) процесса (схема V реакции) группу ВОС удаляют из соединения формулы XIV, применяя способ, описанный для стадии (6) процесса (схема I реакции), с получением 1H-имидазо[4,5-с]хинолина формулы XXXIV.
На стадии (2) процесса (схема V реакции) 1Н-имидазо[4,5-с]хинолин формулы XXXIV превращают в производное мочевины или тиомочевины формулы XXXV, применяя способ, описанный для стадии (7) процесса (схема I реакции).
На стадии (3) процесса (схема V реакции) 1H-имидазо[4,5-с]хинолин формулы XXXV окисляют согласно способу, описанному для стадии (4) процесса (схема I реакции), с получением 1Н-имидазо[4,5-с]хинолин-5N-оксида формулы XXXVI.
На стадии (4) процесса (схема V реакции) 1H-имидазо[4,5-с]хинолин-5N-оксид формулы XXXVI окисляют по способу, описанному для стадии (5) процесса (схема I реакции), с получением 1H-имидазо[4,5-с]хинолин-4-амина формулы XVIII. Продукт или его соль фармацевтического качества можно выделить по стандартным способам.
Схема V реакции
Настоящее изобретение также включает в себя новые соединения, используемые в качестве промежуточных продуктов синтеза соединений с формулами (I) и (II). Эти промежуточные соединения характеризуются структурными формулами (III) и (IV) и подробно описаны ниже.
Один класс промежуточных соединений имеет формулу (III):
Где Х представляет собой -CHR5-, -CHR5-алкильную или -CHR5-алкенильную группу;
R1 выбран из группы, содержащей радикалы:
-R4-NR8-CR3-NR5-Z-R6-алкил;
-R4-NR8-CR3-NR5-Z-R6-алкенил;
-R4-NR8-CR3-NR5-Z-R6-арил;
-R4-NR8-CR3-NR5-Z-R6-гетероарил;
-R4-NR8-CR3-NR5-Z-R6-гетероциклил; а также
-R4-NR8-CR3-NR5R7;
-R4-NR8-CR3-NR9-Z-R6-алкил;
-R4-NR8-CR3-NR9-Z-R6-алкенил;
-R4-NR8-CR3-NR9-Z-R6-арил;
-R4-NR8-CR3-NR9-Z-R6-гетероциклил; а также
-R4-NR8-CR3-NR9-Z-R6-гетероциклил;
R2 выбран из группы, содержащей радикалы:
-водород;
-алкил;
-алкенил;
-арил;
-гетероарил;
-гетероциклил;
-алкил-Y-алкил;
-алкил-Y-алкенил;
-алкил-Y-арил; а также
-алкил или алкенил, с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
-ОН;
-галоген;
-N(R5)2;
-CO-N(R5)2;
-СО-С1-10алкил;
-СО-O-С1-10алкил;
-N3;
-арил;
-гетероарил;
-гетероциклил;
-СО-арил; а также
-СО-гетероарил;
каждый R3 представляет собой =O или =S;
каждый R4 представляет собой независимо алкил или алкенил, в который может войти одна или несколько -O-групп;
каждый R5 представляет собой независимо Н или C1-10алкил;
R6 представляет собой связь, или же алкил, или алкенил, который может прерваться одной или несколькими -O-группами;
R7 представляет собой Н или C1-10алкил, в который может войти гетероатом, или же R7 и R5 могут соединиться, образуя цикл;
R8 представляет собой Н, C1-10алкил, или арилалкил; или же R4 и R8 могут соединиться, образуя цикл;
R9 представляет собой C1-10алкил, который может соединиться с R8 с образованием цикла;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
Z представляет собой связь, -СО- или -SO2-;
n может иметь значение от 0 до 4;
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Настоящее изобретение также включает в себя соединения имидазохинолин-N-оксида формулы (IV):
Где X представляет собой -CHR5-, -CHR5-алкиленовую или -CHR5-алкениленовую группу;
R1 выбран из группы, содержащей радикалы:
-R4-NR8-CR3-NR5-Z-R6-алкил;
-R4-NR8-CR3-NR5-Z-R6-алкенил;
-R4-NR8-CR3-NR5-Z-R6-арил;
-R4-NR8-CR3-NR5-Z-R6-гетероарил;
-R4-NR8-CR3-NR5-Z-R6-гетероциклил;
-R4-NR8-CR3-NR5R7;
-R4-NR8-CR3-NR9-Z-R6-алкил;
-R4-NR8-CR3-NR9-Z-R6-алкенил;
-R4-NR8-CR3-NR9-Z-R6-арил;
-R4-NR8-CR3-NR9-Z-R6-гетероарил; а также
-R4-NR8-CR3-NR9-Z-R6-гетероциклил;
каждый Y представляет собой независимо -О- или -S(О)0-2-;
Z представляет собой связь, -СО- или -SO2-;
каждый R4 представляет собой независимо алкил или алкенил, в который может войти одна или несколько -О-групп;
каждый R5 представляет собой независимо Н или С1-10алкил;
R6 представляет собой связь, или же алкил, или алкенил, который может прерваться одной или несколькими -О-группами;
R7 представляет собой Н или С1-10алкил, в который может войти гетероатом, или же R7 и R5 могут соединиться, образуя цикл;
R8 представляет собой Н, C1-10алкил, или арилалкил; или же R4 и R6 могут соединиться, образуя цикл;
R9 представляет собой C1-10алкил, который может соединиться с R8 с образованием цикла;
n может иметь значение от 0 до 4;
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Применяемые в тексте термины «алкил», «алкенил» и префикс «алк-» включают в себя как группы с прямой и разветвленной цепью, так и циклические группы, т.е. циклоалкильные и циклоалкенильные остатки. Если иное не оговорено специально, эти группы содержат от 1 до 20 атомов углерода, причем алкенильные группы содержат от 2 до 20 атомов углерода. Суммарное число атомов углерода в группах, которым отдается предпочтение, может доходить до 10. Циклические группы могут содержать один цикл или несколько циклов; предпочтение отдается числу атомов углерода в цикле от 3 до 10. В числе примеров можно назвать такие остатки, как циклопропил, циклопропилметил, циклопентил, циклогексил, и адамантил.
Следует также добавить, что алкильная и алкенильная части -Х-групп могут не иметь заместителей или содержат заместители (один или большее число); эти заместители выбраны из групп, включающих в себя алкил, алкенил, арил, гетероарил, гетероциклил, арилалкил, гетероарилалкил и гетероциклилалкил.
Термин «галогеналкил» включает в себя группы, замещенные одним или несколькими атомами галогена, в том числе и перфторированные группы. Это утверждение верно и в отношении групп, в наименование которых входит префикс «гало-». Примерами приемлемых галогеналкильных групп являются хлорметильный, трифторметильный и аналогичные остатки.
Применяемый здесь термин «арил» относится к карбоциклическим ароматическим циклам или к системам циклов. В числе примеров арильных групп можно назвать фенил, нафтил, дифенил, фторфенил и инденил. Термин «гетероарил» касается ароматических циклов или систем циклов, содержащих хотя бы один гетероатом (например, О, S, N) в цикле. В число используемых гетероарильных групп входят фурил, тиенил, пиридил, хинолинил, изохинолинил, индолил, изоиндолил, триазолил, пирролил, тетразолил, имидазолил, пиразолил, оксазолил, тиазолил, бензофуранил, бензотиофенил, карбазолил, бензоксазолил, пиримидинил, бензимидазолил, хиноксалинил, бензотиазолил, нафтиридинил, изоксазолил, изотиазолил, пуринил, хиназолинил и т.д.
Термин «гетероциклил» включает в себя неароматические циклы или системы циклов, содержащие хотя бы один гетероатом (например, О, S, N) в цикле. Сюда относятся все полностью насыщенные и частично ненасыщенные производные вышеупомянутых гетероарильных групп. В числе примеров гетероциклических групп можно назвать пирролидинил, тетрагидрофуранил, морфолинил, тиоморфолинил, пиперидинил, пиперазинил, тиазолидинил, имидазолидинил, изотиазолидинил, и т.д.
Арильные, гетероарильные и гетероциклильные группы могут быть незамещенными или замещенными; в последнем случае они могут содержать один заместитель или несколько заместителей, независимо выбранных из группы, состоящей из таких радикалов, как алкил, алкокси, алкилтио, галогеналкил, галогеналкокси, галогеналкилтио, галоген, нитро, гидрокси, меркапто, циано, карбокси, формил, арил, арилокси, арилтио, арилалкокси, арилалкилтио, гетероарил, гетероарилокси, гетероарилтио, гетероарилалкокси, гетероарилалкилтио, амино, алкиламино, диалкиламино, гетероциклил, гетероциклоалкил, алкилкарбонил, алкенилкарбонил, алкоксикарбонил, галогеналкилкарбонил, галогеналкоксикарбонил, алкилтиокарбонил, арилкарбонил, гетероарилкарбонил, арилоксикарбонил, гетероарилоксикарбонил, арилтиокарбонил, гетероарилтиокарбонил, алканоилокси, алканоилтио, алканоиламино, арилкарбонилокси, арилкарбонилтио, алкиламиносульфонил, алкилсульфонил, арилсульфонил, гетероарилсульфонил, арилдиазинил, алкилсульфониламино, арилсульфониламино, арилалкилсульфониламино, алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, арилалкилкарбониламино, гетероарилкарбониламино, гетероарилалкилкарбониламино, алкилсульфониламино, алкенилсульфониламино, арилсульфониламино, арилалкилсульфониламино, гетероарилсульфониламино, гетероарилалкилсульфониламино, алкиламинокарбониламино, алкениламинокарбониламино, ариламинокарбониламино, арилалкиламинокарбониламино, гетероариламинокарбониламино, гетероарилалкиламинокарбониламино и, в случае гетероциклильного остатка, оксо. Если о каких-либо иных группах говорят, что они «замещены» или «возможно замещены», то эти группы также могут содержать один или несколько из вышеупомянутых заместителей.
В целом некоторым заместителям отдано большее предпочтение. Так, например, в число предпочитаемых R1-групп входят R4-NR8-CR3-NR5-Z-R6-алкил и R4-NR8-CR3-NR5-Z-R6-арил, где алкильная и арильная группы могут не содержать заместителей или содержать их; предпочтительно, чтобы R4 являлся этиленом или н-бутиленом или же R4 и R8 могут соединяться, образуя цикл. Предпочтительно отсутствие R-заместителей, т.е. n=0. В число предпочитаемых групп R2 входят водород, алкильные группы с 1-4 атомами углерода (это метил, этил, пропил, изопропил, н-бутил, втор-бутил, изобутил и циклопропилметил), метоксиэтил и этоксиметил. Для замещенных групп, таких как замещенные алкильные или замещенные арильные остатки, в число предпочитаемых заместителей входят галоген, нитрил, метокси, метилтио, трифторметил и трифторметокси. Один или несколько из этих предпочитаемых заместителей при их наличии могут находиться в составе соединений, являющихся предметом настоящего изобретения, в любой комбинации.
Настоящее изобретение включает в себя описанные здесь соединения в любой фармацевтически доступной форме, включая изомеры (например, диастереомеры и энантиомеры), соли, сольваты, полиморфные варианты и т.д. В особенности, если соединение является оптически активным, настоящее изобретение включает в себя каждый из энантиомеров соединения, а также рацемические смеси энантиомеров.
Фармацевтические составы и биологическая активность
Фармацевтические составы, являющиеся предметом настоящего изобретения, содержат терапевтически эффективные количества описанного выше соединения в сочетании с фармацевтически доступным носителем.
Термин «терапевтически эффективное количество» означает то количество соединения, которое достаточно для достижения терапевтического эффекта, такого как стимулирование синтеза цитокинов, проявление противоопухолевой активности и(или) проявление противовирусной активности. Хотя точное количество активного соединения, примененного в фармацевтическом составе, являющемся предметом настоящего изобретения, может меняться в зависимости от факторов, известных тем, кто является специалистом в этой области (например, физическая и химическая природа соединения, природа носителя и предполагаемый режим дозирования), предполагается, что составы, являющиеся предметом настоящего изобретения, будут содержать достаточное количество активного ингредиента для создания дозы соединения от приблизительно 100 нг/кг до приблизительно 50 мг/кг, предпочтительно от приблизительно 10 мкг/кг до приблизительно 5 мг/кг при расчете на массу тела пациента. Могут быть использованы любые известные лекарственные формы, такие как таблетки, пастилки, парентеральные препараты, сиропы, кремы, мази, аэрозольные препараты, чрезкожные пластыри, пластыри на слизистой оболочке и т.д.
Соединения, являющиеся предметом настоящего изобретения, можно применять как единственное терапевтическое средство в схеме лечения или же данные соединения можно применять в виде сочетания одного с другим или с иными активными веществами, включая дополнительные модификаторы иммунной реакции, противовирусные вещества, антибиотики и т.д.
Было показано, что соединения, являющиеся предметом настоящего изобретения, стимулируют синтез определенных цитокинов в экспериментах, выполненных в соответствии с условиями испытаний, описанными ниже. Результаты испытаний показывают, что указанные соединения используются в качестве модификаторов иммунной реакции; они могут изменять иммунную реакцию разными путями, что делает эти соединения весьма полезными при лечении различных заболеваний.
В число цитокинов, синтез которых может быть стимулирован применением соединений, являющихся предметом настоящего изобретения, обычно включают интерферон-α (ИФ-α) и(или) фактор некроза опухолей-α (ФНО-α), а также некоторые интерлейкины (ИЛ). В группу цитокинов, биосинтез которых может стимулироваться соединениями, являющимися предметом настоящего изобретения, входят ИФ-α, ФНО-α, ИЛ-1, ИЛ-6, ИЛ-10 и ИЛ-12, а также некоторые другие цитокины. Среди прочих эффектов эти и иные цитокины могут ингибировать размножение вирусов и рост опухолевых клеток, что делает данные соединения полезными при лечении вирусных заболеваний и опухолей. В связи со сказанным настоящее изобретение касается способа стимулирования биосинтеза цитокинов в организме животного путем введения эффективного количества соединения, являющегося предметом настоящего изобретения, или состава в организм животного.
Было обнаружено, что некоторые соединения, являющиеся предметом настоящего изобретения, в большей степени стимулируют экспрессию ИФ-α в популяции кроветворных клеток, таких как ОКПК (одноядерные клетки периферической крови) и клетки pDC2 (дендритные клетки-предшественники тип 2) без сопутствующего си