Новый специфический механизм ингибирования адгезии тромбоцитов к коллагену
Иллюстрации
Показать всеПредложено применение рекомбинантного протеина 12 кДа пиявки Hirudo medicinalis, ингибирующего зависящее от vWF образование связей тромбоцитов с коллагенами стенки артерии при условиях повышенного сдвига (Саратина), в качестве средства для ингибирования аккумулирования тромбоцитов после повреждения сосуда или эндартеректомии, для предотвращения адгезии тромбоцитов, тромбоза и рестеноза также предложены покрытие поверхности хирургического устройства или хирургического инструмента на его основе, гидрогелевое покрытие катетера для введения и локальной доставки Саратина и применение Саратина в качестве средства для покрытия хирургического устройства или хирургического инструмента, а именно катетера, стента или внутрисосудистого трансплантата. Изобретение отличает уменьшение скорости развития тромбоза и закупорки сосудов в месте воздействия при отсутствии системных эффектов, т.к. Саратин не влияет на случаи системного кровотечения и количество тромбоцитов. 4 н. и 6 з.п. ф-лы, 3 табл., 9 ил.
Реферат
Резюме изобретения
Изобретение относится к действию полипептида Саратина, который значительно уменьшает адгезию и аккумулирование тромбоцитов после повреждений сосудов, таких как эндартеректомия. Кроме того, изобретение относится к ингибированию зависящего от vWF связывания тромбоцитов с коллагенами стенки сосуда в условиях повышенного сдвига и конкретнее к новому применению Саратина в медицине в качестве ингибитора тромбоза, при котором упомянутый полипептид можно применять местно, в виде топического вещества или в виде покрытия на медицинских устройствах.
Отрасль изобретения
Адгезия клеток крови, особенно тромбоцитов, к стенкам поврежденных сосудов - явление, широко известное в ангиопластике и хирургии. Такие повреждения могут возникать в ходе различных вариантов хирургического открытия блокированных каналов, протоков и других полостей, чтобы удалить больные ткани и имплантировать замещающие ткани или их компоненты.
Были разработаны различные типы методик вмешательства, которые усиливают или ослабляют, либо устраняют блокирование кровеносных сосудов, обеспечивая кровоток через сосуд. Один из методов лечения стеноза или закупорки кровеносных сосудов состоит в ангиопластике путем подкожного надувания. Баллонный катетер проводят через артериальную систему пациента и вставляют в зауженную или блокированную зону, затем в него накачивают воздух, чтобы расширить зауженную зону. Подкожная транслюминальная ангиопластика (РТСА) представляет собой методику ангиопластики, которая наиболее широко используется для раскрытия закупоренных атеросклеротических артерий.
В общем случае ангиопластические методы позволяют получать прекрасные результаты, поскольку позволяют обходиться без шунтирующей хирургии, но примерно у 30-40% пациентов, у которых наблюдались явные улучшения при первичном расширении артерии, впоследствии, через 3-9 месяцев возникает повторное сужение сосуда (рестеноз). Если рестеноз проявляется в тяжелой форме, пациенту может потребоваться повторная ангиопластика, часто с имплантацией стента, который в сосуде выполняет функцию распорки.
В других случаях может потребоваться реконструкция артерии при помощи шунтирующей хирургии, которая сопряжена с более высоким риском. Притом, что в мире ежегодно проводится более 800000 операций РТСА, социально-экономические последствия этих 30-40% случаев рестеноза стали объектом серьезного беспокойства хирургов-кардиологов.
Рестеноз часто является результатом растяжения и сминания баллоном стенки артерии и существует возможность, что направляющий провод катетеров, используемых в таких процедурах, в процессе разворачивания причинит повреждения и может привести к пролиферации клеток гладкой мускулатуры артерии, что обуславливает повторное закрытие артерии («рестеноз») через несколько месяцев.
Из-за возможных осложнений, связанных с рестенозом и угрозой перемещения эмбола от язвенного атеросклеротического повреждения ткани, что сопряжено с тяжелыми последствиями, применение повторной ангиопластики в сонной артерии строго ограничено вариантами минимального инвазионного вмешательства.
Раньше пытались лечить закупорку сонных артерий, ведущих к мозгу, путем вмешательств другого типа.
Эндартеректомия сонной артерии - хирургический метод устранения закупорки сонных артерий и в сосудистой хирургии США он используется чаще всего. Результаты испытаний, проведенных во многих центрах, продемонстрировали эффективность этой методики при лечении внечерепной сонной болезни как у симптоматических пациентов, так и пациентов, не обнаруживающих симптомов заболевания (JAMA 1995; 273: 1421-28; N Engl. J. Med. 1991; 325: 445-53), кроме того, методы эндартеректомии используются для лечения заболеваний закупорки сосудов, расположенных в других местах (Vasc. Surg. 1999; 33: 461-70).
При эндартеректомии сонную артерию разрезают и атеро склеротическое повреждение ткани удаляют из сосуда через разрез. В хирургии осуществляют раздвоение сонной артерии через разрез в шее пациента и помещают зажимы с обеих сторон места закупорки, чтобы изолировать его, затем делают разрез, чтобы раскрыть артерию. Удаляют закупорку, изолированную область промывают и удаляют из полости жидкость, затем артерию закрывают при помощи наложения шва. Зажимы удаляют, чтобы восстановить кровоток через артерию. Инвагинация и возможные загрязнения зажимов могут послужить причиной серьезных проблем, возникающих после открытия сонной артерии и возобновления кровотока в изолированной ранее области.
Хотя эндартеректомия является эффективным методом терапии, после нее часто остается адвентиция, и значительные области незащищенного тромбогенного субэндотелия. Несмотря на эффективность эндартеректомии сонной артерии, эта операция может приводить к осложнениям, включая тромбоз и развитие гиперплазии интимы, которые обуславливают осложнения, сводящие на нет эффект от вмешательства, или создают новые проблемы.
Клинические исследования свидетельствуют, что после эндартеректомии сонной артерии, непосредственно в послеоперационный период у 1-10% пациентов возникают инсульты, обусловленные, главным образом, образованием тромбов в зоне эндартеректомии с последующей церебральной эмболизацией (Stroke 1984; 15; 950-55). Аккумулирование тромбоцитов может также приводить к рестенозу, связанному с развитием гиперплазии интимы, который может возникать в течение двух лет после операции. Были сообщения, что через 2-5 лет после эндартеректомии у 10-20% пациентов возникает рестеноз, обусловленный гиперплазией интимы, утолщением интимы и уменьшением диаметра сосудов: об этом свидетельствует дуплексное ультразвуковое сканирование сонной артерии (J. Vasc. Surg. 1986; 3; 10-23).
На клеточном и молекулярном уровне реакцией стенки сосуда на механические травмы, хирургическое вмешательство, введение стента, введение трансплантированного сосуда (артериального или артериально венозного трансплантата, т.е. диализного трансплантата) является сложная комбинация воспаления, миграции клеток гладкой мускулатуры, пролиферации и трансформации миофибробластов; эти явления возникают непосредственно после травмы (Futura; 1997. p.289-317). Если в результате заболевания артерия сильно повреждена, что может усугубляться отложением кальция, вмешательство может также в некоторой мере обуславливать дополнительное повреждение с очаговой эндотелиализацией и уязвимость основных компонентов внеклеточного матрикса, таких как коллаген и эластин. У некоторых пациентов появление избытка тромбоцитов и фибриногена может приводить к острой тромботической закупорке.
Исследования, проведенные на моделях крыс после эндартеректомии сонной артерии (Neurosurg 1985; 16: 773-79), а также на моделях эмболектомии баллонных повреждений (Lab. Invest 1983; 49: 327-33), показали, что при повреждении сосуда обдираются клетки эндотелия и начинается адгезия тромбоцитов к незащищенному субэндотелию. Методом сканирующей электронной микроскопии Spallone и др. (Neurosurg, 1985; 16: 773-79) установили, что через пять минут после эндартеректомии сонной артерии у крысы в поврежденной зоне формируется монослой тромбоцитов. Через пятнадцать минут после травмы наблюдается агрегация тромбоцитов и формирование тромбов. Через тридцать минут после эндартеректомии эта область оказывается покрытой активированными тромбоцитами, фибрином и красными кровяными клетками. Образование тромбов достигает пика через три часа после травмы и наблюдается толстый фибрино-тромбоцитный слой. Тромбоциты являются важнейшими участниками этого процесса образования тромбов, а следовательно, неотъемлемыми компонентами тромбоза, но, кроме того, они также играют важную роль в развитии гиперплазии интимы.
Исследования с использованием тромбопенических крыс свидетельствуют, кроме того, что у них наблюдается значительно меньшая толщина интимы после повреждения сонной артерии по сравнению с контрольными крысами (Proc. Natl Acad. SCI, USA 1989; 86: 8412-16). Когда тромбоциты прилипают к незащищенному субэндотелию поврежденного сосуда, они активируются и высвобождают свои гранулы. Эти гранулы содержат вазоактивные и тромботические факторы (серотонин, ADP, фибриноген, фактор Von Willebrands, тромбоксан А2), а также факторы роста (порожденный тромбоцитом фактор роста, трансформирующий рост фактор-бета и фактор эпидермального роста) (Circulation 1985; 72: 735-40). Точные механизмы, по которым тромбоциты ускоряют развитие гиперплазии интимы, полностью пока неясны. Результаты исследований позволяют предположить, что тромбоциты, в первую очередь, поставляют фактор, вызывающий хемотаксис для миграции срединных клеток гладкой мускулатуры по направлению к интиме во второй фазе развития гиперплазии интимы (Vasc. Surg, 1991; 13: 885-91). Другие исследования с использованием антител анти-PDGF продемонстрировали важнейшую роль, которую PDGF играют в аккумулировании неоинтимальных клеток гладкой мускулатуры после повреждения сосуда (Science 1991; 253: 1129-32). Другой механизм, по которому тромбоциты могут усиливать развитие гиперплазии интимы, заключается в активации каскада коагуляции и последующего аккумулирования тромбина в зоне повреждения. Результаты некоторых исследований свидетельствуют о митогеническом воздействии тромбина на клетки гладкой мускулатуры (J. Clin. Invest. 1993; 91: 94-98, J. Vasc. Surg. 1990; 11: 307-13). Кроме того, установлено, что тромбин является фактором, стимулирующим активацию тромбоцитов. Безотносительно к точному механизму адгезия и активация тромбоцитов в зоне повреждения сосуда играют важную роль в развитии тромбоза и гиперплазии интимы, а следовательно, ингибирование адгезии и активации тромбоцитов может способствовать предотвращению или уменьшению скорости развития тромбоза и гиперплазии интимы.
Медиатором прилипания тромбоцитов к поврежденной стенке артерии является, в первую очередь, фактор von Willebrand (vWF), мультимерный гликопротеин, который высвобождается из клеток эндотелия и циркулирует в плазме, где функционирует в качестве переносчика протеина для фактора VIII (Annu. Tev. Biochem. 1998; 67: 395-424). Высокомультимеризованный vWF тоже циркулирует, заключенный внутри альфа-гранул тромбоцитов, из которых он высвобождается после активации тромбоцита (Annu. Tev. Biochem. 1998; 67: 395-424). В условиях повышенного сдвига, которые встречаются в зоне атероматического очага или механического повреждения, vWF может через свой домен A3 образовывать связи с выходящими на поверхность волокнами коллагена (Biochemistry 1986; 25(26): 8357-8361, Blood 1987; 70(5); 1577-1583, J.Biol. Chem. 1987; 262(28); 13835-13841). Затем связанный с коллагеном vWF, в свою очередь, связывает тромбоциты через антигенную детерминанту, появляющуюся в зависимости от сдвига в домене А1 vWF, которая взаимодействует с тромбоцитом GPIb/IX/V (Blood 1985; 65(1): 85-90. Blood 1985; 65(4): 823-831, Br.J.Haematol 1986; 63(4): 681-691). Таким образом, vWF играет роль мостика между коллагеном и тромбоцитами и это является необходимым условием для осуществления адгезии тромбоцитов к коллагену в потоке (J.Lab. Clin. Med, 1974; 83(2): 296-300). Тем не менее, прокатывание тромбоцита по vWF приводит к слабой адгезии, и для осуществления прочной адгезии, активации и агрегации тромбоцитов требуются, кроме того, прямые взаимодействия между коллагеном и другими рецепторами на поверхности тромбоцита (Thromb. Haemost 1997; 78(1): 434-438, Thromb. Haemost 1997; 78(1): 439-444). В число прямых рецепторов коллагена на тромбоцитах входят GP VI (Blood 1987; 69(6): 1712-1720. Thromb. Haemost 1999; 81(5): 782-792, J Clin. Invest 1989; 84(5): 1440-1445), GP Ia/IIa (α2/β1) (J. Clin. Invest. 1989; 84(5): 1440-1445, Nature 1985; 318(6045): 470-472) и в меньшей степени GP IV (CD36) (J. Biol. Chem. 1989; 264(13): 7576-7583) и, возможно, даже р65 (J. Clin. Invest. 1997; 100(3): 514-521). Установлено, что в отсутствие связывания тромбоцитов при участии vWF эти рецепторы являются слишком слабыми медиаторами, чтобы осаждать тромбоциты на коллагене из потока (Br.J.Haematol 1986; 63(4): 681-691). Наконец, vVW в комбинации с фибриногеном способствует структурированию и дальнейшей активации тромбоцитов через связывание с GP IIb/IIIa тромбоцита (J. Clin. Invest. 2000; 105(6): 783-791), что обеспечивает стабильность и прочность, необходимые для развития тромба.
В последние годы, после открытия GP IIb/IIIa тромбоцита и антагонистов рецептора ADP, в противоагрегационной терапии появился большой прогресс (Coronary Art Dis 1999; 10(8): 553-560, J.Am, Coil. Surg. 2000; 191((1): 76-92). Тем не менее, разработанные методы не предназначены для ингибирования начальной адгезии тромбоцитов к подверженным этому волокнам коллагена, и, несмотря на эффективность антагонистов GP IIb/IIIa в ослаблении взаимодействий тромбоцит-тромбоцит, тромбоциты по-прежнему налипают на поврежденные участки стенки сосуда (Blood 1993; 81(5): 1263-1276, Circulation 1995; 91(5): 1354-1362). Далее активация тромбоцитов почти всегда влечет за собой более широкие последствия, чем агрегация и острый тромбоз, прогрессирование подострой и хронической гиперплазии интимы должно быть, по крайней мере, частично, подвержено воздействию митогенических медиаторов, таких как произведенный тромбоцитом фактор роста (PDGF), высвобождаемый активацией тромбоцитов. В самом деле, было установлено, что ингибирование PDGF уменьшает гиперплазию интимы у различных видов животных (Science 1991; 253(5024): 1129-11f32, Circulation 1999; 99(25): 3292-3299).
Предположить, что vWF имеет большое патофизиологическое значение, можно исходя из факта повышения количества циркулирующих vWF у пациентов с острым инфарктом миокарда (Thromb Haemost 2000; 84: 204-209, Circulation 1998; 98(4): 294-299), причем уровни vWF положительно коррелируют с плохим прогнозом (Circulation 1998; 98(4): 294-299). Кроме того, исследования in vivo свидетельствуют, что нейтрализация антител анти-vWF приводит к ингибированию экспериментального тромбоза, что подтверждает важную роль vWF в формировании тромбов (Thromb. Haemost 1998; 79(1): 202-210). Далее, по мере еще большего распространения в лечении острых коронарных синдромов методов ангиопластики, которые неизбежно приводят к повреждению стенки сосуда и уязвимости коллагена, становится еще более актуальной разработка способов как можно более раннего фармакологического вмешательства в каскад адгезия-активация агрегация тромбоцитов.
Два основных направления в современной терапии, имеющей целью ограничение адгезии и активации тромбоцитов, а также последующего тромбоза и гиперплазии интимы, состоят в использовании антитромбоцитных агентов и антитромботических назначений. Хотя такие лекарственные препараты, как аспирин, эффективно блокируют синтез Тромбоксана А2 за счет ингибирования мостиков циклооксигеназы, они не предотвращают индуцированную коллагеном адгезию и активацию тромбоцитов, которые стимулируют развитие гиперплазии интимы. Применение гепарина в качестве антитромботического агента сопряжено с осложнениями и ограничениями, включая непредсказуемую реакцию на дозу, необходимую для надежного лабораторного мониторинга, ограниченную активность против связанного с тромбом тромбина, множественные зоны ингибирования, зависимость от антитромбина III, риск сильного кровотечения, так же, как и необходимость в непрерывном вливании. Очевидно, что идеальный терапевтический агент должен оказывать специфическое к зоне и локализованное действие, без системного распределения или общей коагулопатии.
Обнаружилось, что важнейшие эффекты, которые инициируют каскад событий, приводящих к тромбозу и последующей гиперплазии интимы, возникают в результате взаимодействий между незащищенным коллагеном субэндотелия в зоне повреждения сосуда и монослоем тромбоцитов, которые налипли на незащищенный коллаген. Следовательно, специфический ингибитор адгезии тромбоцита к коллагену субэндотелия может предотвращать или, по крайней мере, тормозить развитие тромбоза и гиперплазии интимы.
В литературе описано, что некоторые извлеченные из пиявки вещества способны ингибировать взаимодействия коллаген-тромбоцит (Blood 1995; 85(3): 705-711, Platelets 2000; 11(2): 83-86, J. Biol. Chem, 1992; 267(10): 6893-6898, J. Biol. Chem. 1992; 267(10): 6899-6904, Blood Coagul Fibrinolysis 1991, 2(1): 179-184). Известно, что дестабилаза, изопептидаза, проявляющая активность в плане деполимеризации фибрина, выделенная из Hirudo medicinalis, ингибирует агрегацию тромбоцитов, вызываемую различными агонистами, включая коллаген, но считается, что она образовывает связи непосредственно с мембраной тромбоцита (Platelets 2000; 11(2): 83-86). Антитромбоцитный протеин пиявки (LAPP), протеин с массой ≈13 кДа из слюны Haementeria officinalis, ингибирует адгезию тромбоцитов к коллагену при статических условиях (J. Biol. Chem. 1992; 267{10): 6899-6904, Thromb. Haemost 1999, 82(3):1160-11б3) и при ускоренном протоке (Arterioscler Thromb. Vasc. Biol 1995, 15(9): 1424-1431) и оказывает воздействие как на vWF, так и на связывание тромбоцита с коллагеном, медиатором которого является GP Ia/IIa (Thromb. Haemost 1999, 82(3): 1160-1163). Калин представляет собой протеин ≈65 кДа из Hirudo medicinalis, который обладает аналогичным действием. Калин тоже ингибирует взаимодействия коллаген-тромбоцит как в статических, так и в динамических условиях (Blood 1995; 85(3): 705-711, Blood Coagul Fibrinolysis 1991, 2(1): 179-184, Thromb. Haemost 1999, 82(3): 1160-1163). Кроме того, как LAPP, так и Калин являются потенциальными ингибиторами инициируемой коллагеном агрегации тромбоцитов, ингибирующими агрегацию при концентрациях, близких к тем, которые блокируют образование связей vWF с коллагеном (J. Biol. Chem. 1992; 267(10): 6893-6898, Blood Coagul Fibrinolysis 1991, 2(1): 179-184, Blood 1995, 85(8):712-719).
Оценка эффективности как LAPP, так и Калина при тестировании в моделях тромбоза in vivo имела переменный успех. Обнаружено, что LAPP не может тормозить формирование тромба на покрытых коллагеном трансплантатах артериально-венозной развилки в бабуине, несмотря на применение доз, которые ингибируют инициированную коллагеном агрегацию (Arterioscler Thromb 1993, 13(11): 1593-1601), тогда как Калин оказывал зависящее от дозы ингибирующее действие на формирование тромбов в модели венозного тромбоза хомяка (Blood 1995, 85(3): 712-719).
В этой отрасли знаний известны нетромбогенные и антитромбогенные покрытия для стентов и катетеров. Нетромбогенные покрытия и продукты основаны на модифицированных и высших полимерах, примеры описаны в заявках WO 9301221 и WO 9830615.
Антитромботические и антирестенозные покрытия представляют собой в общем случае биосовместимые покрытия, которые могут также служить источниками местной поставки лекарственных препаратов. Покрытия основаны, главным образом, на гидрогелях, их примеры описаны в патентной литературе, посвященной методикам приготовления различных типов гидрогелей и покрытий для медицинских устройств, в том числе такие примеры приведены в заявках WO 9211896, WO 9811828, WO 0147572, ЕР 0887369 и WO 0139811.
Профиль выхода содержащихся в покрытии терапевтических веществ можно регулировать, например, при помощи варьирования толщины полимерных слоев или путем выбора специфических полимерных покрытий, которые обладают подобранными физико-химическими свойствами (такими как заряд, гидрофобность, гидрофильность) и/или путем приготовления покрытий в виде различных слоев. Специалистам известны критерии выбора полимера и оптимизации скорости выхода. Другие покрытия описаны в работе Fischell (Circulation, 1996, 94: 1494-95), Topol и др. (Circulation, 1998, 98: 1802-20) и McNair и др. в методике Technology, 1996, 16-22.
Применение стентов, проводов и катетеров в сердечно-сосудистой системе является общепринятой практикой, поэтому повреждение сосудов, эмболизация и последующий рестеноз являются главным объектом беспокойства кардиологов в процессе катетеризации или хирургического вмешательства, а также в послеоперационный период. Альтернативные методы, такие как эндартеректомия, сопряжены с возникновением сопоставимых проблем. Каждая процедура, связанная с манипулированием артериями, т.е. сосудистая хирургия и ангиопластика допускает развитие гиперплазии интимы. Пользу, которую могут принести способы предотвращения или торможения развития гиперплазии интимы, невозможно переоценить, а преимущества способа, позволяющего достигать этих эффектов без попутного создания системных эффектов, являются еще более очевидными.
Таким образом, очевидна необходимость разработки улучшенных фармацевтических препаратов и способов ингибирования самых ранних событий в патофизиологии (т.е. адгезии тромбоцитов) и ожидается, что достижения в этой сфере позволят значительно понизить уровни заболеваемости и смертности, сопряженных с такими процедурами как ангиопластика и хирургическое вмешательство.
Описание изобретения
В общем случае настоящее изобретение включает введение недавно описанного ингибитора адгезии тромбоцитов Саратина внутрь или на выбранную зону внутри или на полости тканей, т.е. в сосудистую систему или органы, при таких условиях, чтобы Саратин можно было применять местно, в качестве топического агента или связывающего покрытия на поверхности, для предотвращения и ингибирования нежелательной тромботической и/или рестенозной реакции на повреждение стенки сосуда, включая повреждения, обусловленные стентами, диализными трансплантатами, другими сосудистыми трансплантатами, и для лечения формирующихся при легких травмах рубцов, а также для лечения и пассивации нестабильных атеросклеротических очагов.
Белок (названный Саратином) характеризуется аминокислотной последовательностью (SEQ. ID. No.l) и содержит 103 аминокислотных остатка, его теоретическая относительная молекулярная масса составляет приблизительно 12068±1 кДа. Белок характеризуется уникальной первичной структурой и отсутствием значительной гомологии с ранее описанными белками. Белок характеризуется высоким содержанием аспаратиновой и глутаминовой кислот, которые вносят вклад в низкую величину изоэлектрической точки молекулы pI 3,7±0,5 по данным изоэлектрофокусирования в полиакриламидном геле (ИЭФ-ПААГ).
Последовательность ID.No.1
Он был недавно описан (см. WO 0056885 стр.6 строки 31-33 и стр.7 строки 1-4) рекомбинантный протеин 12 кД, исходно выделенный из пиявки. Протеин ингибирует зависящее от vWF образование связей тромбоцитов с коллагенами стенки артерии при условиях повышенного сдвига, и именно этот аспект изобретения делает Саратин пригодным для ингибирования артериального тромбоза. Другой новый аспект состоит в том, что Саратин можно применять в качестве топического агента в зоне повреждения, что приводит к торможению тромбоза и/или гиперплазии интимы без каких бы то ни было системных эффектов. Это представляет методику со специфическими эффектами, вполне подходящую для применения в равной мере как хирургами, так и радиологами.
Саратин можно комбинировать с множеством разнообразных терапевтических агентов для поставки на месте. Примерами веществ, применяемых в коронарных артериях, являются антитромботические агенты, такие как простациклин и салицилаты, тромболитические агенты, такие как стрептокиназа, урокиназа, активатор плазминогена тканей (ТРА) и анисоилированный активирующий комплекс плазминоген-стрептокиназа (APSAC), сосудорасширяющие агенты, такие как нитраты, лекарства, блокирующие кальций в каналах, антипролиферационные агенты, такие как колхицин, и алкилирующие агенты, интеркаляционные агенты, факторы модулирования роста, такие как интерлейкины, трансформирующий рост фактор-бета и аналоги выделенного из тромбоцита фактора роста, моноклонные антитела, ориентированные против факторов роста, противовоспалительные агенты как стероидные, так и нестероидные, и другие агенты, которые могут модулировать тоны сосудов, их функции, артериосклероз, и реакцию заживления повреждения сосуда или органа, возникшего в результате вмешательства. В комбинации или покрытия по данному изобретению можно также включать антибиотики. Более того, покрытие можно применять для доставки фармацевтических препаратов ориентированно, внутрь стенки сосуда. При помощи введения действующего вещества в способный разбухать полимер этот активный агент можно высвобождать при разбухании полимера. В одном из воплощений данного изобретения покрытие приготавливают из гидрогеля, такого как оксид полиэтилена, альбумин, гидрофильные полиметакрилаты и гидрофильные полиуретаны. Настоящее изобретение относится, кроме того, к применению Саратина и его производных, например, через устройства для доставки лекарства в нужное место/катетеры или через стенты и покрытия стентов, а также через сосудистые трансплантаты и покрытия трансплантатов. Изобретение относится также к способам назначения Саратина в композициях, из которых с течением времени вымывается регулируемое количество Саратина в локализованной области. В частности, одно из воплощений настоящего изобретения относится к применениям катетерных устройств для доставки Саратина к нужной зоне; при помощи катетеров Саратин можно также применять внутри тканей самостоятельно или вместе с другими терапевтическими агентами вне полимерной матрицы. Основные требования к применяемому полимерному материалу по данному способу заключаются в его биосовместимости и способности высвобождать лекарственные вещества, которую можно приспособить для специфического применения. Контролируемого местного высвобождения Саратина можно добиться путем одного только пропитывания, одного только ионтофореза и одной только электропорации, или для эффективного высвобождения и введения Саратина внутрь полости сосуда можно использовать комбинацию ионтофореза и электропорации. Предпочтительно, если катетер пригоден для выполнения процедуры, направленной на поддержание высокой концентрации лекарственного препарата в выбранной области пространства сосуда, так, что это приводит к улучшенному покрытию сосуда одним Саратином или его комбинацией с дополнительными лекарственными веществами. Данное изобретение особенно полезно для местной поставки Саратина в течение или после процедур кардиологического вмешательства, таких как ангиопластика, имплантация стента и эндартеректомия.
Подробное описание изобретения
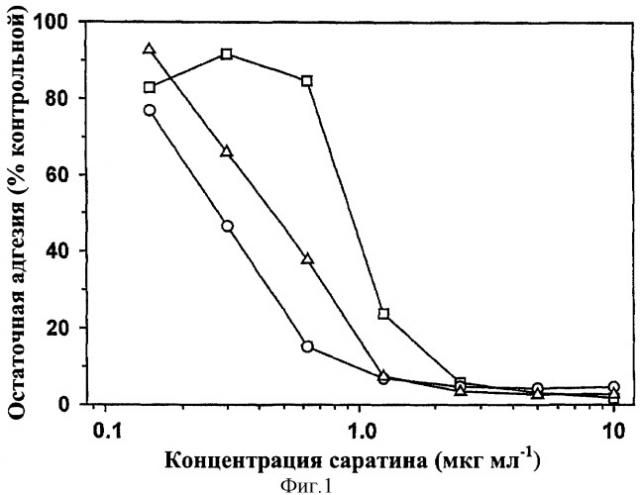
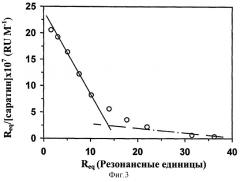
Рекомбинантный Саратин, подходящий для применения по данному изобретению, экспрессировали и выделили из Hansenula polymorpha; было обнаружено, что он действует через блокирование образования связей vWF с коллагеном и эффективно предотвращает адгезию тромбоцитов к коллагену при повышенном сдвиге. Саратин производил зависящее от дозы ингибирование связывания очищенного человеческого vWF с человеческими коллагенами типа I и типа III (IC50=0,23±0,004 и 0,81±0,04 мкг мл-1 соответственно) и с коллагеном кожи теленка (IC50=0,44±0,008 мкг мл-1). Кроме того, Саратин проявил аналогичную ингибирующую способность против связывания с этими коллагенами vWF плазмы человека, грызунов и свиней. В проточной камере, при условиях повышенного сдвига (2700 сек-1) Саратин проявлял зависящее от дозы и сильное ингибирующее действие на формирование агрегатов тромбоцитов на покрытой коллагеном поверхности (IC50=0,96±0,25 мкг мл-1), но при пониженном сдвиге (1300 сек-1) на кривой зависимости от дозы наблюдался сдвиг вправо (IC50=5,2±1,4 мкг мл-1). Резонансным анализом поверхностных плазмонов на человеческом коллагене типа III обнаружены связывающие Саратин сайты как с высоким, так и с низким сродством (Кd=5·10-8М и 2·10-6М соответственно), и хотя низкие концентрации Саратина, которые ингибировали адгезию тромбоцитов при повышенном сдвиге (т.е. насыщение связывающих сайтов с высоким сродством), не оказывала действия на зависящую от vWF агрегацию тромбоцитов, индуцированную коллагеном, было обнаружено, что высокие концентрации (т.е. насыщение связывающих сайтов с низким сродством) ингибируют агрегацию тромбоцитов. Эти данные свидетельствуют, что Саратин является сильным ингибитором зависящей от vWF адгезии тромбоцитов к коллагену, что создает основу для его терапевтического потенциала в качестве антитромботического агента. Кроме того, исследованиями установлено, что Саратин проявляет сильное и зависящее от дозы ингибирующее действие на связывание vWF не только с коллагеном кожи теленка, но и с человеческим коллагеном типов I и III, каждый из которых в изобилии присутствует в субэндотелиальных слоях стенки артерии, и, как считается, играет важную роль во взаимодействиях тромбоцитов со стенкой сосуда (Thromb Haemost 1997, 78(1): 434-438). Поскольку взаимодействия коллаген - vWF - GP Ib/IX/V происходят только при достаточно повышенном сдвиге, важным аспектом настоящего изобретения являлась демонстрация факта, что Саратин эффективен не только при статических условиях, но также и в среде, которая наиболее приближена к ситуации, встречающейся in vivo. В проточной камере, позволяющей изменять силы сдвига для моделирования такой среды, Саратин отчетливо ингибировал аккумулирование тромбоцитов к коллагену, особенно при более высоких сдвигах. Смещение вправо кривой зависимости от дозы в результате уменьшения сдвига является существенным, поскольку из этого можно сделать вывод, что эффективность Саратина in vivo может быть локализована в областях высокого сдвига, где в результате изменений обращенной к крови эндотелиальной поверхности, например, в связанных с атеросклеротическими очагами или механическим вмешательством, происходит нарушение ламинарности кровяного потока. Исследованием резонанса поверхностных плазмонов с Саратином установлено, что коллаген может захватывать Саратин двумя независимыми связывающими сайтами, один - с высоким сродством, а второй - с низким сродством. Способность Саратина ингибировать связывание vWF с коллагеном объясняется насыщением связывающего сайта с высоким сродством, у которого значения IC50 составляют около 5·10-8М, т.е. равны константе диссоциации для этого сайта. Поскольку независящая от vWF индуцированная коллагеном агрегация тромбоцитов ингибировалась только большими дозами Саратина (более 100 мкМ), можно предположить, что насыщение связывающих коллаген сайтов с низким сродством ассоциировано с ингибированием прямых взаимодействий коллаген-рецептор коллагена.
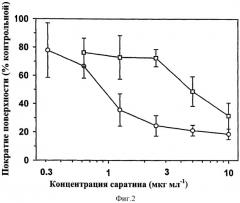
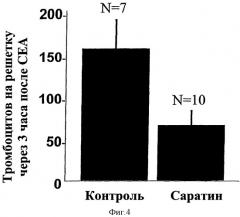
Другим предметом настоящего изобретения является эффект, состоящий в воздействии, которое Саратин оказывает на локальное окружение эндартеректомизированного сосуда без необходимости системного распределения и без изменения функции тромбоцита или изменения коагуляции, что делает его идеальной методикой для топического применения в процессе процедур сосудистой хирургии и радиологического вмешательства. В этом аспекте данного изобретения действие терапевтического Саратина исследовали на модели эндартеректомии сонной артерии крыс (СЕА), описанной ранее (J.Vasc. Surg. 1998, 28: 909-918). Предполагается, что активация PLT является первым этапом развития тромбоза и рестеноза после СЕА, обусловленных IH. Было обнаружено, что местное применение Саратина на поверхности со стороны полости уменьшает количество тромбоцитов, налипающих на эндартеректомизированную артерию, и таким образом тормозит развитие постоперационного тромбоза и IH. Результаты экспериментов по антиадгезионному действию Саратина на тромбоциты, которое оценивали после прохождения двух различных послеоперационных периодов, свидетельствуют, что количество тромбоцитов, налипших на стенку сосуда через 3 ч (фигура 4) и через 24 ч (фигура 5) после эндартеректомии сонной артерии, у крыс, обработанных Саратином, было значительно меньшим, чем у крыс из контрольной группы. Адгезия тромбоцитов через 3 часа была уменьшена на 59% (64±17,2 по сравнению с 155±33,4 PLT на решетку, Р=0,05) и на 77% через 24 ч (35±11,3 по сравнению с 149±36,6 PLT на решетку, Р=0,0110). В контрольной группе адгезия тромбоцитов была аналогичной через 3 ч и через 34 ч, однако в группе, обработанной саратином, адгезия уменьшилась от 64 до 35 тромбоцитов на решетку.
На фигурах 6 и 7 представлены типичные картины эндартеректомизированной поверхности, обработанной и не обработанной топическим Саратином, полученные при помощи сканирующей электронной микроскопии при 2000-кратном увеличении. На фигуре 6А показана контрольная поверхность через 3 часа после эндартеректомии сонной артерии, свидетельствующая об изобилии клеточного материала, фибриновых нитей, многочисленных красных кровяных клеток и многочисленных тромбоцитов, различимых совершенно отчетливо. На фигуре 6В показана обработанная Саратином поверхность через 3 часа после эндартеректомии сонной артерии. Отмечены недостаток клеточных элементов и почти свободная поверхность коллагена. На фигуре 7А показана контрольная поверхность через 24 часа после эндартеректомии сонной артерии, тромбоциты видны как маленькие белые точки. На фигуре 7В показана обработанная Саратином поверхность через 24 часа после эндартеректомии сонной артерии. В случае обработки Саратином наблюдается отчетливое уменьшение адгезии тромбоцитов. Применение топического Саратина после эндартеректомии сонной артерии значительно тормозит развитие гиперплазии интимы по сравнению с контрольной группой. Процент полостного стеноза, который используется как мера IH, был значительно меньшим в случае применения Саратина, чем у контрольной группы. Это снижение формирования IH коррелировало с ингибированием адгезии PLT. В исчислении полостного стеноза у контрольных крыс наблюдалось 29,8±6,8%, р=0,0042 полостного стеноза против 10,9±1,8% полостного стеноза у обработанной Саратином группы (фигура 6). У обработанной Саратином крысы диаметр полости был на 18,9% больше, чем у контрольных крыс. Результаты гистологического анализа свидетельствуют, что через две недели после эндартеректомии сонной артерии у 5 из 15 контрольных крыс (15%) развился полноценный тромбоз сонной артерии притом, что тромбоз сонной артерии наблюдался у 0 крыс из 15 особей, обработанных Саратином (0%). Вероятностный анализ хи-квадрат дает вероятность успешного исхода 16,238, это означает, что вероятность развития тромбоза с закупоркой у контрольной группы в 16 раз больше, чем у крыс, обработанных Саратином Р=0,0156. У обработанной Саратином группы не наблюдалось повышенного кровотечения вдоль линии наложенного на артерию шва. У обработанных Саратином крыс не обнаружено значительных изменений в продолжительности кровотечения и числе системных тромбоцитов по сравнению с контрольными крысами через 3 и 24 ч после эндартеректомии. Модель СЕА находится в близком соответствии с операцией СЕА человека, и следовательно, на основании полученных результатов можно предложить способ уменьшения вредного воздействия адгезии и агрегации тромбоцитов в зоне эндартеректомии без системного воздействия на функцию тромбоцитов или снижения гемостаза. Простое, топическое применение Саратина в процессе СЕА крыс уменьшает адгезию и агрегацию тромбоцитов, а также последующий рестоноз в полости сонной артерии, обусловленный гиперплазией интимы. В таблице 3 приведены результаты по продолжительности кровотечения и количеству тромбоцитов. Статистически значимого различия между продолжительностями кровотечения до и после операции не наблюдалось. Кроме того, не наблюдалось статистически значимого различия между числом тромбоцитов у обработанных Саратином и контрольных крыс. Мы доказали значительное уменьшение адгезии и аккумулирования тромбоцитов после повреждения сосуда, аналогичного эндартеректомии. Уменьшение адгезии тромбоцитов наблюдалось как сразу после эндартеректомии (3 ч), так и через 24 ч. Через 24 ч эффект был более значительным, чем мы ожидали, и этот эффект обусловлен непрямым ингибирующим воздействием Саратина на коллаген (период полураспада Саратина в сыворотке составляет 90 мин), а связан скорее с исходным ингибированием агрегации тромбоцитов и последующим нарушением каскада активации тромбоцитов. Если ингибируется исходное прилипание тромбоцитов к незащищенному коллагену, то не может начаться и каскад активации тромбоцитов. Данные, представленные на фигурах 4 и 5, демонстрируют, что местное применение Саратина на свежеповрежденном сосуде может в значительной степени ингибировать адгезию тромбоцитов. Саратин ингибировал адгезию тромбоцитов на 60% и 75% через 3 и 24 ч соответственно. Это ингибирование определяется по видимым различиям в осаждении клеточных элементов, которые наблюдаются между контрольными и обработанными Саратином артериями через 3 ч и 24 ч (фигуры 7 и 8). Мы предполагаем, что это уменьшение клеточной реакции обусловлено ингибированием адгезии тромбоцитов. Это представляет уникальный вариант терапии для ингибирования адгезии тромбоцитов к поврежденному сосуду. Через две недели после эндартеректомии сонной артерии у контрольных крыс был значительно меньший диаметр полости, чем у особей, обработанных Саратином (фигура 9). Кол