Азаиндолоксоуксусные производные пиперазины и фармацевтическая композиция на их основе
Иллюстрации
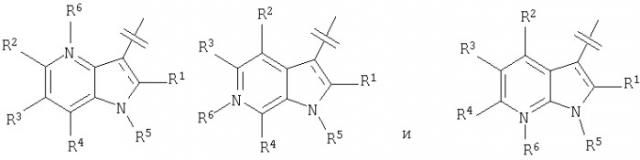
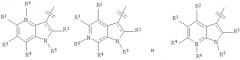
Показать всеНастоящее изобретение относится к азаиндолоксоуксусным производным пиперазина общей формулы I
и в которой:
Q выбран из группы, состоящей из:
-W- представляет собой
Соединения обладают антивирусной активностью как при использовании отдельно, так и в комбинации с другими антивирусными, противоинфекционными агентами, иммуномодуляторами или ингибиторами входа ВИЧ. Описана также фармацевтическая композиция на основе соединений формулы I. 2 н. и 52 з.п. ф-лы, 9 табл.
Реферат
Область изобретения
Настоящее изобретение относится к соединениям, обладающим лекарственными и биологически активными свойствами, их фармацевтическим композициям и к способу их применения. В особенности настоящее изобретение касается производных азаиндолпиперазиндиамида, которые обладают уникальной противовирусной активностью. В частности, настоящее изобретение касается соединений, применимых для лечения ВИЧ инфекции и СПИДа.
Уровень техники
Заражение ВИЧ-I (вирус-1 иммунодефицита человека) остается главной медицинской проблемой с учетом имеющихся приблизительно 33.6 миллионов зараженных во всем мире людей. Количество случаев заражений ВИЧ инфекцией и СПИДом (синдром приобретенного иммунодефицита) за последнее время резко повысилось. В 1999 г. сообщалось о 5.6 миллионах новых инфицированных больных и 2.6 миллионов человек умерли от СПИДа. В настоящее время препараты, которые имеются для лечения ВИЧ инфекции, включают шесть нуклеозидных ингибиторов обратных транскриптаз (RT) (зидовудин, диданозин, ставудин, ламивудин, залцитабин и абакавир), три ненуклеозидных ингибитора обратной транскриптазы (невирапин, делавирдин и эфавиренц) и шесть пептидомиметических ингибиторов протеазы (саквинавир, индинавир, ритонавир, нелфинавир, ампренавир и лопинавир). Каждый из этих препаратов может только скоротечно сдержать вирусное размножение при использовании отдельно. Однако, когда его используют в комбинации, эти препараты имеют пролонгированный эффект на вирусемию и развитие болезни. Фактически, значительные снижения в показателях смертности среди пациентов, зараженных СПИДом, которые были недавно зарегистрированы, являются следствием широко распространенного применения комбинированной терапии. Однако, несмотря на эти значительные результаты, 30-50 % пациентам в конечном счете не помогают комбинированные лекарственные терапии. Недостаточная сила воздействия лекарственного средства, несогласованнось в действии, ограниченное проникновение в ткани и ограничения, специфичные для лекарственного препарата, внутри определенных типов клеток (например большинство нуклеозидных аналогов не могут фосфорилироваться в покоящихся клетках) могут приводить к не полному подавлению чувствительных вирусов. Кроме того, высокая степень размножения и быстрый оборот ВИЧ-I вместе с частым возникновением мутаций ведет к появлению устойчивых к лекарственным средствам вариантам, а также к неспособности лечения, когда присутствуют сверх оптимальные концентрации лекарственного средства (Larder и Kemp; Gulick; Kuritzkes; Morris-Jones et al; Schinazi et al; Vacca и Condra; Flexner; Berkhout и Ren et al (Ссылки 6-14)). Таким образом, необходимы новые анти-ВИЧ агенты, демонстрирующие отчетливые устойчивые свойства и благоприятную фармакокинетику, так же как и обладающие безопасными профилями, чтобы обеспечить большее количество оптимальных вариантов лечения.
В настоящее время продаваемые ВИЧ-I препараты являются в основном либо нуклеозидными ингибиторами обратной транскриптазы или пептидомиметическими ингибиторами протеазы. Ненуклеозидные ингибиторы обратной транскриптазы (NNRTI), полученные недавно, играют все более и более важную роль в терапии ВИЧ инфекций (Pedersen & Pedersen, Ссылка 15). По крайней мере 30 различных классов NNRTI были описаны в литературе (De Clercq, Ссылка 16), и несколько NNRTI прошли клинические испытания. Производные дипиридодиазепинона (невирапин), бензоксазинона (эфавиренц) и бис(гетероарил) пиперазина (делавирдин) были одобрены для клинического применения. Однако главный недостаток в разработке и применении NNRTIs заключается в их склонности к быстрому появлению штаммов, устойчивых к лекарственным средствам, как в клеточной культуре ткани, так и у лечащихся больных, особенно при проведении монотерапии. Как последствие, имеется значительный интерес в определении NNRTI, менее склонного к развитию устойчивости (Pedersen & Pedersen, Ссылка 15).
Несколько производных индола, включая производные индол-3-сульфонов, пиперазиноиндолов и 5Н-индол[3,2-b][1,5]бензотиазепина, были описаны как ингибиторы обратной транскриптазы ВИЧ-1 (Greenlee et al, Ссылка 1; Williams et al, Ссылка 2; Romero et al. Ссылка 3; Font et al, Ссылка 17; Romero et al. Ссылка 18; Young et al, Ссылка 19; Genin et al. Ссылка 20; Silvestri et al, Ссылка 21). Индол 2-карбоксамиды также были описаны как ингибиторы клеточной адгезии и ВИЧ инфекции (Boschelli et al, US 5,424,329, Ссылка 4). Наконец, 3-замещенные индольные природные продукты (Семикохлиодинол А и В, дидеметиластеррихинон и изокохлиодинол) были выявлены как ингибиторы протеазы ВИЧ-1 (Fredenhagen et al. Ссылка 22). Другие производные индола, проявляющие противовирусную активность, пригодную для лечения ВИЧ, раскрыты в PCT WO 00/76521 (Ссылка 93). Также производные индола раскрыты в РСТ WO 00/71535 (Ссылка 94).
Структурно связанные азаиндольные амидные производные ранее были раскрыты (Kato et al, Ссылка 23; Levacher et al, Ссылка 24; Dompe Spa, WO-09504742, Ссылка 5(а); SmithKline Beecham PLC, WO-09611929, Ссылка 5(b); Sobering Corp., US-05023265, Ссылка 5(с)). Однако эти структуры отличаются от заявленных в настоящем изобретении, поскольку они являются азаиндольным моноамидом, а не асимметричными диамидными азаиндолпиперазиновыми производными, и нет никакого упоминания о применении этих соединений для лечения вирусных инфекций, в частности ВИЧ инфекции. Другие азаиндолы были также раскрыты Wang et al. Ссылка 95. Однако ничто в этих библиографических ссылках, а также иных, представленных далее, не может быть рассмотрено как раскрытие или предложение новых соединений по настоящему изобретению и их применению для ингибирования ВИЧ инфекции.
ПРОЦИТИРОВАННАЯ БИБЛИОГРАФИЯ
Патентные документы:
1. Greenlee, W.J.; Srinivasan, P.С. Indole reverse transcriptase inhibitors. U.S. Patent 5,124,327.
2. Williams, T.M.; Ciccarone, T.M.; Saari, W.S.; Wai, J.S.; Greenlee, W.J.; Balani, S.K.; Goldman, M.E.; Theohrides, A.D. Indoles as inhibitors of HIV reverse transcriptase. European Patent 530907.
3. Romero, D.L.; Thomas, R.C.; Preparation of substituted indoles as anti-AIDS Pharmaceuticals. PCT WO 93/01181.
4. Boschelli, D.H.; Connor, D.T.; Unangst, P.C. Indole-2-carboxamides as inhibitors of cell adhesion. U.S. Patent 5,424,329.
5. (a) Mantovanini, M.; Melillo, G.; Daffonchio, L. Tropyl 7-azaindol-3-ylcarboxyamides as antitussive agents. PCT WO 95/04742 (Dompe Spa), (b) Cassidy, F.; Hughes, I.; Rahman, S.; Hunter, D. J. Bisheteroaryl-carbonyl and carboxamide derivatives with 5HT 2C/2B antagonists activity. PCT WO 96/11929. © Scheriock, M.H.; Tom, W.C. Substituted 1H-pyrrolopyridine-3-carboxamides. U.S. Patent 5,023,265.
Публикации:
6. Larder, B.A.; Kemp, S.D. Different mutations in the HTV-I reverse transcriptase confer high-level resistance до zidovudine (AZT). Science, 1989, 246, 1155-1158.
7. Gulick, R.M. Current antiretroviral therapy: An overview. Quality of Life Research, 1997, 6, 471-474.
8. Kuritzkes, D.R. HIV resistance to current therapies. Antiviral Therapy, 1997, 2 (Supplement 3), 61-67.
9. Morris-Jones, S.; Moyle, G.; Easterbrook, PJ. Antiretroviral therapies in HTV-I infection. Expert Opinion on Investigation! Drugs, 1997, 6(8), 1049-1061.
10. Schinazi, R.F.; Larder, B.A.; Mellors, J.W. Mutations in retroviral genes associated with drug resistance. International Antiviral News, 1997, 5, 129-142.
11. Vacca, J.P.; Condra, J.H. Clinically effective HIV-I protease inhibitors. Drug Discovery Today, 1997,2, 261-272.
12. Flexner, D. fflV-protease inhibitors. Drug Therapy, 1998, 338, 1281-1292.
13. Berkhout, B. HIV-I evolution under pressure of protease inhibitors: Climbing the stairs of viral fitness. J. Biomed. Sd, 1999, 6, 298-305.
14. Ren, S.; Lien, E. J. Development of HIV protease inhibitors: A survey. Prog. Drug Res., 1998, 57, 1-31.
15. Pedersen, O.S.; Pedersen, E.B. Non-nucleoside reverse transcriptase inhibitors: the NNRTI boom. Antiviral Chem. Chemother. 1999, 70, 285-314.
16. (a) De Clercq, E. The role of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV-I infection. Antiviral Research, 1998, 38, 153-179. (b) De Clercq, E. Perspectives of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV infection. IL. Farmaco, 1999, 54, 26-45.
17. Font, M.; Monge, A.; Cuartero, A.; Elorriaga, A.; Martinez-Irujo, J.J.; Alberdi, E.; Santiago, E.; Prieto, L; Lasarte, J.J.; Sarobe, P. and Borras, F. Indoles and pyrazino[4,5-6]indoles as nonnucleoside analog inhibitors of HTV-I reverse transcriptase. Eur. J. Med. Chem., 1995, 30, 963-971.
18. Romero, D.L.; Morge, R.A.; Genin, M.J.; Biles, C.; Busso, M,; Resnick, L.; Althaus, I.W.; Reusser, F.; Thomas, R.C and Tarpley, W.G. Bis(heteroaryl)piperazine (BHAP) reverse transcriptase inhibitors: structure-activity relationships of novel substituted indole analogues and the identification of 1-[(5-methanesulfonamido-1H-indol-2-yl)-carbonyl]-4-[3-[1-methylethyl)amino]-pyridinyl]piperazine momomethansulfonate (U-90152S), a second generation clinical candidate. J: Med Chem., 1993, 36, 1505-1508.
19. Young, S.D.; Amblard, M.C.; Britcher, S.F.; Grey, V.E.; Iran, L.O.; Lumma, W.C.; Huff, J.R.; Schleif, W.A.; Emini, E.E.; O'Brien, J.A.; Pettibone, DJ. 2-Heterocyclic indole-3-sulfones as inhibitors of HTV-reverse transcriptase. Bioorg. Med. Chem. Lett., 1995, 5, 491-496.
20. Genin, M.J.; Poel, T.J.; Yagi, Y.; Biles, C.; Althaus, L; Keiser, B.J.; Kopta, L.A.; Friis, J.M.; Reusser, F.; Adams, W.J.; Olmsted, R.A.; Voorman, R.L.; Thomas, R.C. and Romero, D.L. Synthesis and bioactivity of novel bis(heteroaryl)piperazine (BHAP) reverse transcriptase inhibitors: structure-activity relationships and increased metabolic stability of novel substituted pyridine analogs. J. Med. Chem., 1996, 39, 5267-5275.
21. Silvestri, R.; Artico, M.; Bruno, В.; Massa, S.; Novellino, E.; Greco, G.; Marongiu, M.E.; Pani, A.; De Montis, A and La Colla, P. Synthesis and biological evaluation of 5H-indolo[3,2-6][1,5]benzothiazepine derivatives, designed as conformationally constrained analogues of the human immunodeficiency virus type 1 reverse transcriptase inhibitor L-737, 126. Antiviral Chem. Chemother. 1998, P, 139-148.
22. Fredenhagen, A.; Petersen, F.; Tintelnot-Blomley, M.; Rosel, J.; Mett, H and Hug, P. J. Semicochliodinol A and B: Inhibitors of HIV-1 protease and EGF-R protein Tyrosine Kinase related to Asterriquinones produced by the fungus Chrysosporium nerdarium. Antibiotics, 1997, 50, 395-401.
23. Kato, M.; Ito, K.; Nishino, S.; Yamakuni, H.; Takasugi, H. New 5-НТ3 (Serotonin-3) receptor antagonists. IV. Synthesis and structure-activity relationships of azabicycloalkaneacetamide derivatives. Chem. Pharm. Bull., 1995, 43, 1351-1357.
24. Levacher, V.; Benoit, R.; Duflos, J; Dupas, G.; Bourguignon, J.; Queguiner, G. Broadening the scope of NADH models by using chiral and non chiral pyrrolo [2,3-6] pyridine derivatives. Tetrahedron, 1991, 47, 429-440.
25. Shadrina, L.P.; Dormidontov, Yu.P.; Ponomarev, V.G.; Lapkin, I.I. Reactions of organomagnesium derivatives of 7-aza- and benzoindoles with diethyl oxalate and the reactivity of ethoxalylindoles. Khim. Geterotsikl. Soedin., 1987, 1206-1209.
26. Sycheva, T.V.; Rubtsov, N.M.; Sheinker, Yu.N.; Yakhontov, L.N. Some reactions of 5-cyano-6-chloro-7-azaindoles and lactam-lactim tautomerism in 5-cyano-6-hydroxy-7-azaindolines. Khim. Geterotsikl Soedin., 1987, 100-106.
27. (a) Desai, M.; Watthey, J.W.H.; Zuckerman, M. A convenient preparation of 1-aroylpiperazines. Org. Prep. Proced. Int., 1976, 8, 85-86. (b) Adamczyk, M.; Fino, J.R. Synthesis of procainamide metabolites. N-acetyl desethylprocainamide and desethylprocainamide. Org. Prep. Proced. Int. 1996, 28, 470-474. © Rossen, К.; Weissman, S.A.; Sager, J.; Reamer, R.A.; Askin, D.; Volante, R.P.; Reider, PJ. Asymmetric Hydrogenation of tetrahydropyrazines: Synthesis of (S)-piperazine 2-tert-butylcarboxamide, an intermediate in the preparation of the HIV protease inhibitor Indinavir. Tetrahedron Lett., 1995, 36, 6419-6422. (d) Wang, Т.; Zhang, Z.; Meanwell, N.A. Benzoylation of Dianions: Preparation of mono-Benzoylated Symmetric Secondary Diamines. J. Org. Chem., 1999, 64, 7661-7662.
28. Li, H.; Jiang, X.; Ye, Y.-H.; Fan, C.; Romoff, Т.; Goodman, M. 3-(Diethoxyphosphoryloxy)-1,2,3-benzotriazin-4(3/T)-one (DEPBT): A new coupling reagent with remarkable resistance to racemization. Organic Lett., 1999, 7, 91-93.
29. Harada, N.; Kawaguchi, Т.; Inoue, I.; Ohashi, M.; Oda, K.; Hashiyama, Т.; Tsujihara, K. Synthesis and antitumor activity of quaternary salts of 2-(2'-oxoalkoxy)-9-hydroxyellipticines. Chem. Pharm. Bull, 1997, 45, 134-137.
30. SchneIIer, S.W.; Luo, J.-K. Synthesis of 4-amino-l/f-pyrrolo[2,3-6]pyridine (1,7-Dideazaadenine) and 1H-pyrrolo[2,3-6]pyridin-4-ol (1,7-Dideazahypoxanthine). J. Org. Chem., 1980, 45, 4045-4048.
31. Shiotani, S.; Tanigochi, K. Furopyridines. XXII [I]. Elaboration of the C-substitutents alpha to the heteronitrogen atom of furo[2,3-o]-, -[3.2-6]-, -[2.3-c]- and -[3,2-c]pyridine. J. Het. Chem., 1997, 34, 901-907.
32. Minakata, S.; Komatsu, M.; Ohshiro, Y. Regioselective functionalization of 1H pyrrolo[2,3-o]pyridine via its N-oxide. Synthesis, 1992, 661-663.
33. Klemm, L.H.; Hartling, R. Chemistry of thienopyridines. XXTV. Two transformations of thieno[2,3-6]pyridine 7-oxide (1). J: Het. Chem., 1976, 13, 1197-1200.
34. Antonini, I.; Claudi, F.; Cristalli, G.; Franchetti, P.; Crifantini, M.; Martelli, S. Synthesis of 4-amino-l-D-D-riboruranosyl-l//-pyrrolo[2,3-6]pyridine (1-Deazatubercidin) as a potential antitumor agent. J: Med. Chem., 1982, 25, 1258-1261.
35. (a) Regnouf De Vains, J.B.; Papet, A.L.; Marsura, A new symmetric and unsymmetric polyfunctionalized 2,2'-bipyridines. J. Het. Chem., 1994, 31, 1069-1077. (b) Miura, Y.; Yoshida, M.; Hamana, M. Synthesis of 2,3-fused quinolines from 3-substituted quinoline 1-oxides. Part II, Hetercycles, 1993, 36, 1005-1016. (c) Profft, V.E.; Rolle, W. Uber 4-merkaptoverbindungendes 2-methylpyridins. J. Prakt. Chem., 1960, 283 (11), 22-34.
36. Nesi, R.; Giomi, D.; Turchi, S.; Tedeschi, P., Ponticelli, F. A new one step synthetic approach to the isoxazolo[4,5-6]pyridine system. Synth. Comm., 1992, 22, 2349-2355.
37. (a) Walser, A.; Zenchoff, G.; Fryer, R.I. Quinazolines and 1,4-benzodiazepines. 75. 7-Hydroxyaminobenzodiazepines and derivatives. J. Med. Chem., 1976, 19, 1378-1381. (b) Barker, G.; Ellis, G.P. Benzopyrone. Part I. 6-Amino- and 6-hydroxy-2-subtituted chromones. J. Chem. Soc., 1970, 2230-2233.
38. Ayyangar, N.R.; Lahoti, R.J.; Daniel, T. Alternative synthesis of 3,4-diaminobenzophenone and mebendazole. Org. Prep. Proced. Int., 1991, 23, 627-631.
39. Mahadevan, I.; Rasmussen, M. Ambident heterocyclic reactivity: The alkylation of pyrrolopyridines (azaindoles, diazaindenes). Tetrahedron, 1993, 49, 7337-7352.
40. Chen, B.K.; Saksela, К.; Andino, R.; Baltimore, D. Distinct modes of human immunodeficiency type 1 proviral latency revealed by superinfection of nonproductively infected cell lines with recombinant luciferase-encoding viruses. J. Virol, 1994, 68, 654-660.
41. Bodanszky, M.; Bodanszky, A. «The Practice of Peptide Synthesis» 2nd Ed., Springer-Verlag: Berlin Heidelberg, Germany, 1994.
42. Albericio, F. et al. J. Org. Chem. 1998, 63, 9678.
43. Knorr, R. et al. Tetrahedron Lett. 1989, 30,1927.
44. (a) Jaszay Z.M. et al. Synth. Commun., 1998, 28, 2761 and references cited therein; (b) Bernasconi, S. et al. Synthesis, 1980, 385.
45. (a) Jaszay Z.M. et al. Synthesis, 1989, 745 and references cited therein; (b) Nicolaou, К.С. et al. Angew. Chem. Int. Ed. 1999, 35, 1669.
46. Ooi, T. et al. Synlett. 1999, 729.
47. Ford, R.E. et al. J. Med. Chem. 1986, 29, 538.
48. (a) Yeung, K.-S. et al. Bristol-Myers Squibb Unpublished Results, (b) Wang, W. et al. Tetrahedron Lett. 1999, 40, 2501.
49. Brook, M.A. et al. Synthesis, 1983, 201.
50. Yamazaki, N. et al. Tetrahedron Lett. 1972, 5047.
51. Barry A. Bunin «The Combinatorial Index» 1998 Academic Press, San Diego / London pages 78-82.
52. Richard С. Larock Comprehensive Organic Transormations 2nd Ed. 1999, John Wiley and Sons New York.
53. M.D.Mullican et.al. J. Med. Chem. 1991, 34, 2186-2194.
54. Protective groups in organic synthesis 3rd ed. / Theodora W. Greene and Peter G.M. Wuts. New York: Wiley, 1999.
55. Katritzky, Alan R. Lagowski, Jeanne M. The principles of heterocyclic Chemistry New York: Academic Press, 1968.
56. Paquette, Leo A. Principles of modem heterocyclic chemistry New York: Benjamin.
57. Katritzky, Alan R.; Rees, Charles W.; Comprehensive heterocyclic chemistry: the structure, reactions, synthesis, and uses of heterocyclic compounds 1st ed. Oxford (Oxfordshire); New York: Pergamon Press, 1984. 8 v.
58. Katritzky, Alan RHandbook of heterocyclic 1st edOxford (Oxfordshire); New York: Pergamon Press, 1985.
59. Davies, David I Aromatic Heterocyclic Oxford; New York: Oxford University Press, 1991.
60. Ellis, G.P. Synthesis of fused Chichester [Sussex]; New York: Wiley, 1987-1992. Chemistry of heterocyclic compounds; v.47.
61. Joule, J. A Mills, K., Smith, G.F. Heterocyclic Chemistry, 3rd ed London; New York Chapman & Hall, 1995.
62. Katritzky, Alan R., Rees, Charles W., Scriven, Eric F.V. Comprehensive heterocyclic chemistry II: a review of the literature 1982-1995.
63. The structure, reactions, synthesis, and uses of heterocyclic compounds 1st ed. Oxford; New York: Pergamon, 1996. 11 v. in 12: ill.; 28 cm.
64. Eicher, Theophil, Hauptmann, Siegfried. The chemistry of heterocycles: structure, reactions, syntheses, and applications Stuttgart; New York: G. Thieme, 1995.
65. Grimmett, M.R. Imidazole and benzimidazole Synthesis London; San Diego: Academic Press, 1997.
66. Advances in heterocyclic chemistry. Published in New York by Academic Press, starting in 1963 - present.
67. Gilchrist, T.L. (Thomas Lonsdale) Heterocyclic chemistry 3rd ed. Harlow, Essex: Longman, 1997. 414 p.: ill.; 24 cm.
68. Farina, Vittorio; Roth, Gregory P. Recent advances in the Stille reaction; Adv. Met.-Org. Chem. 1996, 5, 1-53.
69. Farina, Vittorio; Krishnamurthy, Venkat; Scott, William J. The Stille reaction; Org. React. (N.Y.) (1997), 50, 1-652.
70. Stille, J.К. Ange-w. Chem. Int. Ed Engl. 1986, 25, 508-524.
71. Norio Miyaura and Akiro Suzuki Chem Rev. 1995, 95, 2457.
72. Home, D.A. Heterocycles 1994, 39, 139.
73. Kamitori, Y. et. al. Heterocycles, 1994, 37(7), 153.
74. Shawali, J. Heterocyclic Chem. 1976, 13, 989.
75. a) Kende, A.S. et al. Org. Photochem. Synth. 1972, 1, 92. b) Hankes, L.V.; Biochem. Prep. 1966, 11, 63. с) Synth. Meth. 22, 837.
76. Hulton et. al. Synth. Comm. 1979, P, 789.
77. Pattanayak, B.K. et. al. Indian J. Chem. 1978, 16, 1030.
78. Chemische Berichte 1902, 35, 1545.
79. Chemische Berichte Ibid 1911, 44, 493.
80. Moubarak, I., Vessiere, R. Synthesis 1980, Vol.1, 52-53.
81. Ind J. Chem. 1973, 11, 1260.
82. Roomi et. al. Can J. Chem. 1970, 48, 1689.
83. Sorrel, T.N. J. Org. Chem. 1994, 59, 1589.
84. Nitz, T.J. et. al. J. Org. Chem. 1994, 59, 5828-5832.
85. Bowden, K. et. al. J. Chem. Soc. 1946, 953.
86. Nitz, T.J. et. al. J. Org. Chem. 1994, 59, 5828-5832.
87. Scholkopf et. al. Angew. Int. Ed. Engl. 1971, 10(5), 333.
88. (a) Behun, J.D.; Levine, R. J. Org. Chem. 1961, 26, 3379. (b) Rossen, K.; Weissman, S.A.; Sager, J.; Reamer, R.A.; Askin, D.; Volante, R.P.; Reider, P.J. Asymmetric Hydrogenation of tetrahydropyrazines: Synthesis of (5)-piperazine 2-tert-butylcarboxamide, an intermediate in the preparation of the HTV protease inhibitor Indinavir. Tetrahedron Lett., 1995, 36, 6419-6422. © Jenneskens, L. W.; Mahy, J.; den Berg, E. M. M. de B.-v.; Van der Hoef, I.; Lugtenburg, J. Red. Trav. Chim. Pays-Bas 1995, 114, 97.
89. Wang, Т.; Zhang, Z.; Meanwell, N.A. Benzoylation of Dianions: Preparation of mono-Benzoylated Symmetric Secondary Diamines. J. Org. Chem., 1999, 64, 7661-7662.
90. (a) Adamczyk, M.; Fino, J.R. Synthesis of procainamide metabolites. N-acetyl desethylprocainamide and desethylprocainamide. Org. Prep. Proced. Int. 1996, 28, 470-474. (b) Wang, Т.; Zhang, Z.; Meanwell, N.A. Regioselective mono-Benzoylation of Unsymmetrical Piperazines. J. Org. Chem., in press.
91. Masuzawa, K.; Kitagawa, M.; Uchida, H. Bull Chem. Soc. Jpn. 1967, 40, 244-245.
92. Furber, M.; Cooper, M.E.; Donald, D.K. Tetrahedron Lett. 1993, 34, 1351-1354.
Заявки:
93. Blair, W.S. et al, PCT WO 00/76521, published 21 December, 2000.
94. Mavunkel, B.J. et al, PCT WO 00/71535, published 30 November, 2000.
95. Wang, T. et al, PCT WO 01/62255, published 30 August, 2001.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает соединения формулы I или их фармацевтически приемлемые соли, которые являются эффективными антивирусными агентами, особенно в качестве ингибиторов ВИЧ инфекции, и фармацевтические композиции на их основе. Объектом изобретения являются соединения формулы I, включая их фармацевтически приемлемые соли,
где:
Q выбран из группы, состоящей из:
R1 представляет собой водород;
R2 и R3 являются независимо выбранными из группы, состоящей из водорода, галогена, XR57, где Х - кислород и R57 - (C1-6)алкил
R4 представляет собой группу C(O)R57, C(O)NR55R56 или группу В,
- - представляет собой углерод-углеродную связь;
m имеет значение 1 или 2;
R5 представляет собой водород;
R6 отсутствует;
А выбран из группы, состоящей из C1-6алкокси, арила и гетероарила; где указанный арил представляет собой фенил или нафтил; указанный гетероарил выбран из группы, состоящей из пиридинила и фуранила;
W представляет собой
В выбран из группы, состоящей из арила, гетероарила, гетероалициклического кольца, где указанный арил, гетероарил и гетероалициклическое кольцо являются необязательно замещенными от одного до трех одинаковыми или различными атомами галогена или от одного до трех одинаковыми или различными заместителями, выбранными из группы F; где арил представляет собой замещенный фенил; где гетероарил представляет собой моно или бициклическую систему, которая включает 5-6 атомов в кольце для моноциклической системы и до 12 атомов в конденсированной бициклической системе, включая от 1 до 4 гетероатомов; где гетероциклическое кольцо представляет собой 5-6 членное моноциклическое кольцо, которое может содержать от 1 до 2 гетероатомов в основе кольца и которое может быть сконденсировано с бензольным или пиридиновым кольцом;
F выбран из группы, состоящей из (C1-6)алкила, гетероарила, гидрокси, (C1-6)алкокси, галогена, C(O)R57, -NR42C(O)-(C1-6)алкила, -NR42S(O)2-(C1-6)алкила, NR42R43, C(O)NR42R43, COOR54, где гетероарил представляет собой моноциклическую систему, которая состоит из 5 атомов в кольце, включая 1 атом азота;
R9, R10, R11, R12, R13, R14, R15, R16 каждый является независимо выбранным из группы, состоящей из водорода и (C1-6)алкила;
R42 и R43 являются независимо выбранными из группы, состоящей из водорода и (С1-6)алкила;
R55 и R56 являются независимо выбранными из группы, состоящей из водорода и (C1-6)алкила; и
R57 выбран из группы, состоящей из водорода и (C1-6)алкила.
Наиболее предпочтительными являются соединения, сведенные в Таблицу 2 или Таблицу 4 описания настоящего изобретения.
Так как соединения настоящего изобретения могут обладать центрами асимметрии и поэтому встречаются как смеси диастомеров и энантиомеры, настоящее изобретение включает индивидуальные диастомерические и энантиомерические формы соединений формулы I в дополнение к их смесям.
ОПРЕДЕЛЕНИЯ
Термин "C1-6алкил", как используется в настоящем изобретении и в формуле изобретения (если не определено иначе), означает прямую или разветвленную цепь алкильных групп, таких как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, амил, гексил и им подобные.
"Галоген" относится к хлору, брому, иоду или фтору.
"Арильная" группа относится ко всем углеродным моноциклическим или конденсированным кольцевым полициклическим (то есть кольцам, которые обладают смежными парами атомов углерода) группам, имеющим полностью сопряженную электронную π-систему. Примерами, без ограничения, групп арила являются фенил, нафталинил и антраценил. Арильная группа может быть замещенной или незамещенной. В случае замещения замещающая группа(ы) предпочтительнее выбирается из одного или более алкила, циклоалкила, арила, гетероарила, гетероалициклического кольца, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, O-карбамоила, N-карбамоила, С-амидо, N-амидо, С-карбокси, O-карбокси, сульфинила, сульфонила, сульфонамидо, тригалогенметила, уреидо, амино и -NRxRy, где Rx и Ry являются независимо выбранными из группы, состоящей из водорода, алкила, циклоалкила, арила, карбонила, С-карбокси, сульфонила, тригалогенметила и объединенные в пяти- или шестичленное гетероалициклическое кольцо.
Как используется в настоящем изобретении, "гетероарильная" группа относится к моноциклической или конденсированной кольцевой (то есть кольца обладают совместной смежной парой атомов) группе, имеющей в кольце(ах) один или более атомов, выбранных из группы, состоящей из азота, кислорода и серы и дополнительно имеющей полностью сопряженную электронную π-систему. Должно быть отмечено, что термин гетероарил включает N-оксид исходного гетероарила, если такой N-оксид является химически пригодным, как известно из уровня техники в данной области. Примерами без ограничения, гетероарильной группы являются фурил, тиенил, бензотиенил, тиазолил, имидазолил, оксазолил, оксадиазолил, тиадиазолил, бензотиазолил, триазолил, тетразолил, изоксазолил, изотиазолил, пирролил, пиранил, тетрагидропиранил, пиразолил, пиридил, пиримидил, хинолинил, изохинолинил, пуринил, карбазолил, бензоксазолил, бензимидазолил, индолил, изоиндолил, пиразинил, диазинил, пиразин, триазинилтриазин, тетразинил и тетразолил. В случае замещения замещающая группа(ы) предпочтительно выбирается из одного или более алкила, циклоалкила, арила, гетероарила, гетероалициклического кольца, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, O-карбамоила, N-карбамоила, O-амидо, N-амидо, С-карбокси, O-карбокси, сульфинила, сульфонила, сульфонамидо, тригалогенметила, уреидо, амино и -NRxRy, в которой Rx и Ry определены выше.
Как используется в настоящем изобретении, "гетероалициклическая" группа относится к моноциклической или конденсированной кольцевой группе, имеющей в кольце(ах) один или более атомов, выбранных из группы, состоящей из азота, кислорода и серы. Кольца могут также иметь одну или более двойных связей. Тем не менее кольца не имеют полностью сопряженной электронной π-системы. Примерами без ограничения гетероалициклических групп являются азетидинил, пиперидил, пиперазинил, имидазолинил, тиазолидинил, 3-пирролидин-1-ил, морфолинил, тиоморфолинил и тетрагидропиранил. В случае замещения замещающая группа(ы) предпочтительно выбрается из одного или более алкила, циклоалкила, арила, гетероарила, гетероалициклического кольца, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоалкокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, тиокарбонила, O-карбамоила, N-карбамоила, O-тиокарбамоила, N-тиокарбамоила, С-амидо, С-тиоамидо, N-амидо, С-карбокси, O-карбокси, сульфинила, сульфонила, сульфонамидо, тригалогенметансульфонамидо, тригалогенметансульфонила, силила, гуанила, гуанидино, уреидо, фосфонила, амино и -NRxRy, в которой Rx и Ry определены выше.
Термин "Алкильная" группа относится к насыщенным алифатическим углеводородам, включая прямую и разветвленную цепь. Предпочтительно алкильная группа имеет от 1 до 20 атомов углерода (всякий раз, когда указан числовой диапазон; например, "1-20", это означает, что группа, в данном случае алкильная группа, может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и так далее, включая 20 атомов углерода). Более предпочтителен средний размер алкила, имеющего от 1 до 10 атомов углерода. Наиболее предпочтителен низший алкил, имеющий от 1 до 4 атомов углерода. Алкильная группа может быть замещенной или незамещенной. В случае замещения замещающая группа(ы) предпочтительно представляет собой однин или более выбранных из тригалогеналкила циклоалкила, арила, гетероарила, гетероалициклического кольца, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоалкокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, тиокарбонила, O-карбамоила, N-карбамоила, O-тиокарбамоила, N-тиокарбамоила, С-амидо, С-тиоамидо, N-амидо, С-карбокси, O-карбокси, сульфинила, сульфонила, сульфонамидо, тригалогенметансульфонамидо, тригалогенметансульфонила или их комбинацию в пяти- или шестичленное гетероалициклическое кольцо.
"Циклоалкильная" группа относится к полностью углеродной моноциклической или конденсированной кольцевой (то есть кольца имеют смежную пару атомов углерода) группе, в которой один или более колец не имеют полностью сопряженной электронной π-системы. Примерами без ограничения циклоалкильных групп являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексадиен, циклогептан, циклогептатриен и адамантан. Циклоалкильная группа может быть замещенной или незамещенной. В случае замещения замещающая группа(ы) предпочтительно индивидуально выбирается из одного или более алкила, арила, гетероарила, гетероалициклического кольца, гидрокси, алкокси, арилокси, гетероарилокси, гетероалициклокси, тиогидрокси, тиоалкокси, тиоарилокси, тиогетероарилокси, тиогетероалициклокси, циано, галогена, нитро, карбонила, тиокарбонила, O-карбамоила, N-карбамоила, O-тиокарбамоила, N-тиокарбамоила, С-амидо, С-тиоамидо, N-амидо, С-карбокси, O-карбокси, сульфинила, сульфонила, сульфонамидо, тригалогенметансульфонамидо, тригалогенметансульфонила, силила, гуанила, гуанидино, уреидо, фосфонила, амино и -NRxRy, Rx и Ry определены выше.
Термин "Алкенил" означает алкильную группу, как определено в настоящем изобретении, состоящую из, по крайне мере, двух атомов углерода и, по крайне мере, одной углерод-углеродной двойной связи.
Термин "Алкинил" означает алкильную группу, как определено в настоящем изобретении, состоящую из, по крайне мере, двух атомов углерода и, по крайне мере, одной углерод-углерод тройной связи.
Термин "Гидрокси" группа относится к -ОН группе.
Термин "Алкокси" группа относится к обеим -O-алкильной и -O-циклоалкильной группе, как определено в настоящем изобретении.
Термин "Арилокси" группа относится к обеим -O-арильной и -O-гетероарильной группе, как определено в настоящем изобретении.
Термин "Гетероарилокси" группа относится к гетероарил-O- группе с гетероарилом, как определено в настоящем изобретении.
Термин "Гетероалициклокси" группа относится к гетероалициклической-O- группе с гетероалициклическим кольцом, как определено в настоящем изобретении.
Термин "Тиогидрокси" группа относится к -SH группе.
Термин "Тиоалкокси" группа относится к обеим S-алкильной и -S-циклоалкильной группе, как определено в настоящем изобретении.
Термин "Тиоарилокси" группа относится к обеим -S-арильной и -S-гетероарильной группе, как определено в настоящем изобретении.
Термин "Тиогетероарилокси" группа относится к гетероарил-S- группе с гетероарилом, как определено в настоящем изобретении.
Термин "Тиогетероалициклокси" группа относится к гетероалициклической -S-группе с гетероалициклическим кольцом, как определено в настоящем изобретении.
Термин "Карбонил" относится к группе -C(=O)-R", в которой R" выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, циклоалкила, арила, гетероарила (связанных через углерод кольца) и гетероалициклического кольца (связанных через углерод кольца), как каждый определен в настоящем изобретении.
Термин "Альдегид" относится к углеродной группе, в которой R" представляет собой водород.
Термин "Тиокарбонил" относится к -C(=S)-R" группе с R", как определено в настоящем изобретении.
Термин "Кето" группа относится к -СС(=O)С- группе, в которой углерод на любой или обеих позициях С=O может быть алкилом, циклоалкилом, арилом или углеродом гетероарильной или гетероалиациклической группы.
"Тригалогенметанкарбонил" группа относится к Z3СС(=O)- группе с указанным Z, являющимся галогеном.
Термин "С-карбоксильная" группа относится к -C(=O)O-R" группе с R", как определено в настоящем изобретении.
Термин "O-карбокси" группа относится к R"C(-O)O-группе с R", как определено в настоящем изобретении.
"Карбокисльная" группа относится к С-карбоксильной группе, в которой R" представляет собой водород.
Термин "Тригалогенметил" группа относится к -CZ3 группе, в которой Z представляет собой галогеновую группу, как определено в настоящем изобретении.
Термин "Тригалогенметансульфонил" группа относится к Z3CS(=O)2- группам с Z, как определено выше.
Термин "Тригалогенметансульфонамидо" группа относится к Z3CS(=O)2NRx-группе с Z и Rx, как определено в настоящем изобретении.
Термин "Сульфинил" относится к -S(=O)-R" группе с R", как определено в настоящем изобретении и, в дополнение, только как связь; то есть -S(O)-.
Термин "Сульфонил" относится к -S(=O)2R" группе с R", как определено в настоящем изобретении и, в дополнение, только как связь; то есть -S(O)2-.
Термин "S-сульфонамидо" относится к -S(=O)2NRxRy, с Rx и Ry, как определено в настоящем изобретении.
Термин "N-сульфонамидо" относится к R"S(=O)2NRx- группе с Rx, как определено в настоящем изобретении.
Термин "O-карбамоил" относится к -ОС(=O)NRxRy, как определено в настоящем изобретении.
Термин "N-карбамоил" относится к RxOC(=O)NRy группе с Rx и Ry, как определено в настоящем изобретении.
Термин "O-тиокарбамоил" относится к -OC(=S)NRxRy группе с Rx и Ry, как определено в настоящем изобретении.
Термин "N-тиокарбамоил" относится к RxOC(=S)NRy- группе с Rx и Ry, как определено в настоящем изобретении.
Термин "Амино" относится к -NH2 группе.
Термин "С-амидо" относится к -C(=O)NRxRy группе с R" и Ry, как определено в настоящем изобретении.
Термин "С-тиоамидо" относится к -C(=S)NRxRy группе с R" и Ry, как определено в настоящем изобретении.
Термин "N-амидо" относится к RxC(=O)NRy- группе с R" и Ry, как определено в настоящем изобретении.
Термин "Уреидо" относится к -NRxС(=О)NRyRy2 группе с R" и Ry, как определено в настоящем изобретении, и Ry2, определенный так же, как Rx и Ry.
Термин "Гуанидино" относится к -RxNC(=N)NRyRy2 группе с Rx, Ry и Ry2, как определено в настоящем изобретении.
Термин "Гуанил" относится к RxRyNCC(=N)- группе с Rx и Ry, как определено в настоящем изобретении.
Термин "Циано" относится к -CN группе.
Термин "Силил" относится к -Si(R")3 с R", как определено в настоящем изобретении.
Термин "Фосфонил" относится к P(=O)(ORx)2 с Rx, как определено в настоящем изобретении.
Термин "Гидразино" относится к -NRxNRyRy2 группе с Rx, Ry и Ry2, как определено в настоящем изобретении.
Любые две смежных R группы могут объединяться, чтобы образовать дополнительное арильное, циклоалкильное, гетероарильное или гетероциклическое кольцо, сконденсированное с кольцом, первоначально несущее указанные R группы.
Известно в данной области знаний, что атомы азота в гетероарильных системах могут быть "участвующими в гетероарильной кольцевой двойной связи" и это относится к образованию двойных связей в двух таутомерных структурах, которые содержат пятичленное кольцо гетероарильных групп. Это определяет, могут ли атомы азота быть замещены, как хорошо понятно химикам в данной области знаний. Описание и формула изобретения настоящего изобретения основываются на известных общих принципах химического связывания. Понятно, что формула изобретения не охватывает структуры, известные, как нестабильные или не способные к существованию, как описано в литературе.
Физиологически приемлемые соли и пролекарства соединений, раскрытые в описании, находятся в рамках настоящего изобретения. Термин "фармацевтически приемлемая соль", как используется в настоящем изобретении и в формуле изобретения, предназначен, чтобы определить нетоксичные осново-аддитивные соли. Подходящие соли включают также производные органических и неорганических кислот, таких как, без ограничения, соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, метансульфокислота, уксусная кислота, винная кислота, молочная кислота, сульфиновая кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, сорбиновая кислота, аконитовая кислота, салициловая кислота, фталевая кислота и им подобные. Термин "фармацевтически приемлемая соль", как используется в настоящем изобретении, также предназначен, чтобы включать соли кислотных групп, таких как карбоксил, с такими противоионами, как аммоний, соли щелочного металла, особенно натрия или калия, соли щелочноземельного металла, особенно кальция или магния, и соли с соответствующими органическими основаниями, такими как низшие алкиламины (метиламин, этиламин, циклогексиламин и им подобные), или замещенными низшими алкиламинами (например, гидроксилзамещенные алкиламины, такие как диэтаноламин, триэтаноламин или трис(гидроксиметил)-аминометан), или с основаниями, такими как пиперидин или морфолин.
В описании к настоящему изобретению термин "эффективное противовирусное количество" означает общее количество каждого активного компонента способа, который представляет собой достаточное количество, чтобы обеспечить пациенту значительную пользу, то есть снятие острых состояний, характеризующихся ингибированием ВИЧ инфекции. Когда термин используют по отношению к индивидуальному активному ингредиенту, вводимому однократно, он относится к такому ингредиенту одному. Когда термин используют по отношению к комбинации, он относится к общему количеству активных ингредиентов, результат которых терапевтически эффективен, вводимому или в комбинации, последовательно или одновременно. Термины "лечить, очищение, лечение", как используется в настоящем изобретении и в формуле изобретения, означают предотвращение или прекращение болезни, связанной с ВИЧ инфекцией.
Настоящее изобретение также направлено на комбинации соединений с одним или более агентами, полезными при лечении СПИДа. Например, соединения по настоящему изобретению могут эффективно вводиться, либо предварительно и/или после, в комбинации с эффективными количествами противовирусных препаратов, иммуномодуляторов, антибактериальных препаратов или вакцин от СПИДА, таких как приведены в следующей Таблице.
Дополнительно, соединения по настоящему изобретению могут быть применены в комбинации с другим классом агентов лечения СПИДа, которые называют ингибиторами входа ВИЧ (входных ворот инфекции). Примеры таких ингибиторов входа ВИЧ рассмотрены в DRUGS OF THE FUTURE 1999, 24(12), pp.1355-1362; CELL, Vol.9, pp.243-246, Oct. 29, 1999; и DRUG DISCOVERY TODAY, Vol.5, No. 5, 2000, pp.183-194.
Будет понятно, что возможности комбинаций соединений по настоящему изобретению со СПИДовыми антивирусными препаратами, иммуномодуляторами, антибактериальными средствами, ингибиторами входа ВИЧ или вакцин не ограничиваются списком в приведенной выше Таблице, но включают в принципе любую комбинацию с любой фармацевтической композицией, полезной для лечения СПИДа.
Предпочтительные комбинации могут вводиться одновременно или чередоваться при лечении с соединением по настоящему изобретению и ингибитором протеазы ВИЧ и/или ненуклеозидным ингибитором обратной транскриптазы ВИЧ. Необязательно четвертым компонентом в комбинации является нуклеозидный ингибитор обратной транскриптазы ВИЧ, такой как AZT, 3ТС, ddC или ddl. Предпочтительно ингибитором протеазы ВИЧ является индинавир, который представляет собой сульфат N-(2(R)-гидрокси-1-(S)-инданил)-2(R)-фенилметил-4-(S)-гидрокси-5-(1-(4-(3-пиридил-метил)-2(S)-N'-(трет-бутилкарбоксамидо)-пиперазинил))-пентанамид етанолат, который синтезирован в соответствии с методикой, описанной в U.S. 5,413,999. Индинавир, как правило, вводят дозой в 800 мг три раза в день. Другими предпочтительными ингибиторами протеазы являются нелфинавир и ритонавир. Еще одним предпочтительным ингибитором протеазы ВИЧ является саквинавир, который вводят дозой в 600 или 1200 мг три раза в день. Предпочтительно ненуклеозидные ингибиторы обратной транскриптазы ВИЧ включают эфавиренц. Получение ddC, ddl и AZT также описаны в ЕРО 0,484,071. Эти комбинации могут иметь неожиданные результаты на ограничение распространения и уровень инфекции ВИЧ. Предпочтительно комбинации включают следующие: (1) индинавир с эфавирензом и, необязательно, AZT, и/или 3ТС, и/или ddl, и/или ddC; (2) индинавир и любой из AZT, и/или ddl, и/или ddC, и/или 3ТС, в особенности индинавир и AZT и 3ТС; (3) ставудин и 3ТС и/или зидовудин; (4) зидовудин и ламивудин и 141W94 и 1592U89; (5) зидовудин и ламивудин.
В таких комбинациях соединение по настоящему изобретению и другие активные агенты могут быть введены отдельно или совместно. В дополнение, введение отдельного агента может происходить раньше, одновременно или позже вводимого другого агента(ов).
Процессы получения и анти-ВИЧ-1 активность новых производных азаиндолпиперазиндиамида формулы I сведены в Схемах 1-64, приведенных ниже.
Сокращения
Следующие сокращ