Терапевтическое применение селективных ингибиторов pde10
Иллюстрации
Показать всеНастоящее изобретение относится к лечению определенных неврологических и психических расстройств у млекопитающих, включая человека, которое включает в себя введение селективного ингибитора PDE10, в частности настоящее изобретение относится к способам идентификации химического соединения, которое обладает эффективностью селективного ингибитора PDE10. Технический результат: разработка нового способа скрининга соединений на наличие способности селективно ингибировать PDE10. 2 н.п. ф-лы, 6 ил., 4 табл.
Реферат
Предпосылки изобретения
Настоящее изобретение относится к лечению расстройств центральной нервной системы. Более конкретно, изобретение относится к лечению неврологических и психических расстройств, например психоза и расстройств с симптомом когнитивного дефицита. Кроме того, настоящее изобретение относится к лечению нейродегенеративных расстройств и состояний. Изобретение также относится к ингибированию PDE10. Изобретение также относится к способам идентификации химических соединений, обладающих селективной ингибиторной активностью в отношении PDE10.
Циклические нуклеотиды, циклический аденозинмонофосфат (цАМФ) и циклический гуанозинмонофосфат (цГМФ) действуют как внутриклеточные вторичные посредники, регулирующие большое количество внутриклеточных процессов, в частности, в нейронах центральной нервной системы. В нейронах их действие заключается в активации цАМФ- и цГМФ-зависимых киназ и последующем фосфорилировании белков, участвующих в регуляции быстрой синаптической передачи, а также в дифференцировке и выживании нейронов. О сложности сигнального пути с участием циклических нуклеотидов говорит большое молекулярное разнообразие ферментов, участвующих в синтезе и деградации цАМФ и цГМФ. Существует десять семейств аденилилциклазы, два семейства гуанилилциклазы и одиннадцать семейств фосфодиэстеразы (PDE). Более того, известно, что в различных типах нейронов экспрессируются многочисленные изозимы каждого фермента этих классов, что является убедительным подтверждением компартментализации и функциональной специфичности различных изозимов в указанных нейронах.
цАМФ синтезируется семейством мембранных ферментов, аденилилциклазами, о которых упоминалось выше. Активность этих ферментов регулируется разнообразными рецепторами семейства серпина посредством механизма присоединения, опосредованного гетеротримерным G-белком. Увеличение концентрации внутриклеточного цАМФ приводит к активации цАМФ-зависимых протеинкиназ, которые регулируют активность других сигнальных киназ, факторов транскрипции и ферментов посредством их фосфорилирования. Кроме того, циклический АМФ может непосредственно влиять на активность ионных каналов, регулируемых циклическими нуклеотидами, активность фосфодиэстераз и факторов обмена гуанин - нуклеотид. Последние исследования также показали, что внутриклеточный цАМФ может действовать как предшественник нейромодулятора аденозина, контролируя его выход из клетки.
Гуанилилциклаза, которая синтезирует цГМФ, находится как в мембранно-связанной, так и в цитоплазматической форме. Мембранно-связанная форма представляет собой рецепторы, связанные с G-белком, как, например, рецептор атриального натрийуретического пептида (ANP), тогда как растворимая форма гуанилилициклазы активируется окисью азота (Wang, X. and Robinson, P.J. Journal of Neurochemistry 68(2):443-456, 1997). Как и в случае с цАМФ, медиаторы, участвующие в сигнальном пути цГМФ центральной нервной системы, включают в себя ионные каналы, чувствительные к цГМФ, цГМФ-специфические фосфодиэстеразы и цГМФ-зависимые протеинкиназы. Так как циклические нуклеотиды играют важную роль в сигнальной трансдукции в центральной нервной системе, применение соединений, которые влияют на регуляцию сигнального пути с участием циклических нуклеотидов, может иметь важное терапевтическое значение.
Основным механизмом регуляции сигнального пути с участием циклических нуклеотидов является катаболизм циклических нуклеотидов, катализируемый фосфодиэстразами. Известны одиннадцать семейств фосфодиэстераз (PDE), кодируемых 21 разными генами. Каждый ген экспрессирует различные сплайс-варианты, из которых затем образуется большое количество изозимов. Семейства PDE различаются по функциональной специфичности в отношении субстрата, то есть циклических нуклеотидов, по механизму(ами) регуляции и чувствительности к ингибиторам. Более того, PDE не одинаково экспрессируются в организме, в том числе в центральной нервной системе. В результате такого различия ферментной активности и локализации, разные изозимы PDE могут сильно отличаться по физиологическим свойствам. Кроме того, соединения, которые могут селективно ингибировать разные семейства PDE или изозимы, могут иметь особые терапевтические эффекты, меньше побочных эффектов или и то, и другое.
На основании первичной аминокислотной последовательности и особенной ферментативной активности семейство PDE10 идентифицировано как уникальное. Скрининг гомологов базы данных EST показал, что PDE10A мыши является первым членом семейства фосфодиэстрезы PDE10 (Fujishige et al., J. Biol. Chem. 274:18438-18445, 1999; Loughney, K. et al., Gene 234:109-117, 1999). Также были клонированы гомологи PDE мыши (Soderling, S. et al., Proc. Natl. Acad. Sci. USA 96:7071-7076, 1999) и идентифицированы N-концевые сплайс-варианты генов крыс и человека (Kotera, J. et al., Biochem. Biophys. Res. Comm. 261:551-557, 1999; Fujishige, K. et al., Eur. J. Biochem. 266:1118-1127, 1999). Степень межвидовой гомологичности очень велика. Мышиный PDE10A1 представляет собой белок из 779 аминокислот, который гидролизует как цАМФ, так и цГМФ, до АМФ и ГМФ, соответственно. Аффинность PDE10 в отношении цАМФ (Кm = 0,05 мкМ) выше аффинности в отношении цГМФ (Кm = 3 мкМ). Однако на основании того, что Vmax цГМФ приблизительно в 5 раз больше Vmax цАМФ, было сделано предположение, что PDE10 является уникальной цГМФазой, ингибируемой цАМФ (Fujishige et al., J. Biol. Chem. 274:18438-18445, 1999).
У млекопитающих PDE10 также имеет уникальную локализацию по сравнению с другими представителями семейства PDE. мРНК фермента PDE10 имеет высокую степень экспрессии только в яичках и мозге (Fujishige, K. et al., Eur J. Biochem. 266:1118-1127, 1999; Soderling, S. et al., Proc. Natl. Acad. Sci. USA 96:7071-7076, 1999; Loughney, K. et al., Gene 234:109-117, 1999). Эти первоначальные исследования показали, что в мозге экспрессия PDE10 выше в полосатом теле (хвостатом ядре и скорлупе), прилежащем ядре (n. accumbens) и обонятельных бугорках. Недавно был осуществлен подробный анализ характера экспрессии мРНК фермента PDE10 в мозге грызунов (Seeger, T.F. et al., Abst. Soc. Neurosci. 26:345.10, 2000) и PDE10 белка (Menniti, F.S., Stick, C.A., Seeger, T.F. и Ryan, A.M., Immunohistochemical localization of PDE10 in the rat brain. William Harvey Research Conference 'Phosphodiesterase in Health and Disease', Porto, Portugal, Dec. 5-7, 2001).
Краткое описание изобретения
Настоящее изобретение относится к способу лечения тревожного или психического расстройства у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанного тревожного или психического расстройства.
Изобретение также относится к способу лечения тревожного или психического расстройства у млекопитающего, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Примеры психических расстройств, лечение которых может осуществляться в соответствии с настоящим изобретением, включают в себя, но ими не ограничиваются, шизофрению, например, параноидальную, гебефреническую, кататоническую, недифференцированную или остаточную шизофрению; шизофреноподобное расстройство; шизоаффективное расстройство, например, параноидного типа или депрессивного типа; бредовое расстройство; психические расстройство, вызванное приемом веществ, например, психоз, вызванный приемом алкоголя, амфетамина, марихуаны, кокаина, галлюциногенов, форм для ингаляции, опиоидов или фенциклидина; расстройство личности параноидального типа и расстройство личности шизоидного типа.
Примеры тревожных расстройств, лечение которых может осуществляться в соответствии с настоящим изобретением, включают в себя, но ими не ограничиваются, паническое расстройство; агрофобию; специфические фобии; социальную фобию; обсессивно/компульсивное расстройство; посттравматическое стрессовое расстройство; острую реакцию на стресс и генерализованное тревожное расстройство.
Настоящее изобретение также относится к способу лечения двигательных расстройств, выбранных из болезни Гентингтона и дискинезии, связанной с терапевтическим применением агонистов допамина, у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанного расстройства.
Настоящее изобретение также относится к способу лечения двигательных расстройств, выбранных из болезни Гентингтона и дискинезии, связанной с терапевтическим применением агонистов допамина, у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Настоящее изобретение, кроме того, относится к способу лечения двигательного расстройства, выбранного из болезни Паркинсона, синдрома «беспокойных ног» и эссенциального тремора у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанного расстройства.
Настоящее изобретение также относится к способу лечения двигательного расстройства, выбранного из болезни Паркинсона, синдрома «беспокойных ног» и эссенциального тремора у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Настоящее изобретение также относится к способу лечения расстройства, выбранного из обсессивно/компульсивных расстройств, синдрома Туретта и других тиков у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанного расстройства.
Настоящее изобретение также относится к способу лечения обсессивно/компульсивных расстройств, синдрома Туретта и других тиков у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Настоящее изобретение также относится к способу лечения наркотической зависимости, например алкогольной, амфетаминовой, кокаиновой или опиоидной зависимости, у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанной лекарственной зависимости.
Настоящее изобретение также относится к способу лечения наркотической зависимости, например алкогольной, амфетаминовой, кокаиновой или опиоидной зависимости, у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Под «наркотической зависимостью» понимают патологическую потребность в приеме наркотика, которая обычно характеризуется нарушением мотивационной сферы, таким как компульсивность принятия желаемого наркотика и эпизоды непреодолимого влечения к нему.
Настоящее изобретение также относится к способу лечения расстройства, включающего в себя симптом нарушения внимания и/или когнитивной функции, у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения нарушения внимания и/или когнитивной функции.
Настоящее изобретение также относится к способу лечения расстройства, включающего в себя симптом нарушения внимания и/или когнитивных функций, у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Под использующейся здесь фразой «нарушение внимания и/или когнитивной функции» во фразе «расстройство, включающее в себя симптом нарушения внимания и/или когнитивной функции» понимают патологическую активность одной или нескольких когнитивных функций, таких как память, интеллект или способность к обучению и логическое мышление, у конкретного лица, по сравнению с лицами той же возрастной категории. «Нарушение внимания и/или когнитивной функции» также относится к снижению у любого конкретного лица активности одной или нескольких когнитивных функций, например происходящих при возрастном снижении когнитивных функций.
Примеры расстройств, включающих в себя в качестве симптома нарушение внимания и/или когнитивной функции, лечение которых может осуществляться в соответствии с настоящим изобретением, включают в себя деменцию, например деменцию при болезни Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или другую деменцию, вызванную приемом наркотических средств, деменцию, связанную с внутричерепной опухолью или травмой головного мозга, деменцию при болезни Гентингтона или болезни Паркинсона, деменцию при болезни, вызванной вирусом иммунодефицита человека (ВИЧ); делирий; амнестический синдром; посттравматическое стрессовое расстройство; умственную отсталость; расстройство развития учебных навыков, например расстройство чтения, расстройство арифметических навыков или расстройство развития экспрессивного письма; нарушение активности и внимания; возрастное снижение когнитивных функций.
Настоящее изобретение также относится к способу лечения расстройства настроения или депрессивного эпизода у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанного расстройства или эпизода.
Настоящее изобретение также относится к способу лечения расстройства настроения или депрессивного эпизода у млекопитающих, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
Примеры расстройств настроения и депрессивных эпизодов, лечение которых может осуществляться в соответствии с настоящим изобретением, включают в себя, но ими не ограничиваются, большой депрессивный эпизод легкой, умеренной или тяжелой степени, маниакальный или смешанный аффективный эпизод, гипоманию; депрессивный эпизод, атипический тип; депрессивный эпизод, меланхолический тип; депрессивный эпизод с кататоническими нарушениями; аффективный послеродовой эпизод; посттравматическое стрессовое расстройство; большую депрессию; дистимическое расстройство; малое депрессивное расстройство; предменструальное дисфорическое расстройство; постпсихотическую депрессию при шизофрении; депрессивный эпизод с психотическим расстройством, такой как бредовое расстройство или шизофрения; биполярное расстройство, например биполярное расстройство I типа, биполярное расстройство II типа и циклотимия.
Настоящее изобретение также относится к способу лечения нейродегенеративного расстройства или состояния у млекопитающего, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для лечения указанного расстройства или состояния.
Настоящее изобретение также относится к способу лечения нейродегенеративного расстройства или состояния у млекопитающего, включая человека, который заключается во введении указанному млекопитающему количества селективного ингибитора PDE10, эффективного для ингибирования PDE10.
В рамках изобретения, если не указано иное, к «нейродегенеративному расстройству или состоянию» относится расстройство или состояние, которое вызвано дисфункцией и/или гибелью нейронов центральной нервной системы. Эффективность лечения этих расстройств и состояний может быть повышена введением агента, который предупреждает дисфункцию или гибель нейронов, подверженных риску при этих расстройствах или состояниях, и/или усиливает функцию поврежденных или здоровых нейронов с тем, чтобы компенсировать потерю функции, вызванной дисфункцией или гибелью подверженных риску нейронов. Под используемым здесь термином «нейротрофический агент» понимают вещество или агент, который обладает всеми или частью этих свойств.
Примеры нейродегенеративных расстройств и состояний, лечение которых может осуществляться в соответствии с настоящим изобретением, включают в себя, но ими не ограничиваются, болезнь Паркинсона; болезнь Гентингтона; деменцию, например, при болезни Альцгеймера, мультиинфарктную деменцию, деменцию при СПИДе и фронто-темпоральную деменцию; нейродегенеративный процесс, связанный с травмой головного мозга; нейродегенеративный процесс, связанный с инсультом, нейродегенеративный процесс, связанный с инфарктом мозга; нейродегенеративный процесс, вызванный гипогликемией; нейродегенеративный процесс, связанный с эпилептическими припадками; нейродегенеративный процесс, связанный с нейротоксическим отравлением и множественную системную атрофию.
В одном из вариантов осуществления настоящего изобретения нейродегенеративное расстройство или состояние включает в себя нейродегенеративный процесс медиальных шиповатых нейронов полосатого тела у млекопитающих, включая человека.
В другом варианте осуществления настоящего изобретения нейродегенеративное расстройство или состояние представляет собой болезнь Гентингтона.
«Нейротоксическое отравление» относится к отравлению, вызванному нейротоксическим веществом. Нейротоксическое вещество представляет собой любое химическое вещество или вещество, которое может вызывать гибель нейронов и, таким образом, неврологическое повреждение. Примером нейротоксического вещества является алкоголь, злоупотребление которого беременными женщинами может привести к алкогольному отравлению и неврологическому повреждению, известному как синдром внутриутробного алкоголизма (FAS) новорожденных. Другие примеры нейротоксических веществ включают в себя, но ими не ограничиваются, каиновую кислоту, домоевую кислоту и акромеловую кислоту; некоторые пестициды, такие как DDT; некоторые инсектициды, такие как органофосфаты; летучие органические растворители, такие как гексакарбоны (например, толуол); тяжелые металлы (например, свинец, ртуть, мышьяк и фосфор); алюминий; некоторые химические соединения, используемые в качестве химического оружия, такие как реактив «эйджент орандж» и нервно-паралитический газ; и нейротоксические противоопухолевые агенты.
Под используемым здесь термином «селективный ингибитор PDE10» понимают вещество, например органическое вещество, которое более эффективно ингибирует ферменты семейства PDE10 по сравнению с ферментами семейств PDE 1-9 или семейства PDE11. В одном варианте осуществления селективный ингибитор PDE10 представляет собой соединение, например органическое вещество, имеющее Ki ингибирования PDE10, меньше или равное приблизительно одной десятой Ki ингибирования любого другого фермента PDE. Другими словами, это вещество ингибирует активность PDE10 в той же степени при концентрации, составляющей приблизительно одну десятую или меньше от концентрации, необходимой для ингибирования любого другого фермента PDE.
В общих чертах, считается, что вещество эффективно ингибирует активность PDE10, если его Ki меньше или приблизительно равно 10 мкМ, предпочтительно меньше или приблизительно равно 0,1 мкМ.
В одном из вариантов осуществления терапевтических способов, описанных в настоящем изобретении, селективным ингибитором PDE10 является папаверин.
«Селективный ингибитор PDE10» может быть идентифицирован, например, путем сравнения способности вещества ингибировать активность PDE10 с его способностью ингибировать ферменты PDE разных семейств PDE. Например, вещество может быть исследовано на способность ингибировать активность PDE10, а также PDE1, PDE2, PDE3A, PDE4A, PDE4B, PDE4C, PDE4D, PDE5, PDE6, PDE7, PDE8, PDE9 и PDE11.
В одном из вариантов осуществления терапевтических способов по изобретению селективным ингибитором PDE10 является папаверин.
Настоящее изобретение также относится к способу селективного ингибирования PDE10 у млекопитающих, включая человека, заключающемуся во введении указанному млекопитающему папаверина в количестве, эффективном для ингибирования PDE10.
Термин «лечение» в «способе лечения расстройства» относится к реверсированию, облегчению или ингибированию развития расстройства, к которому относится данный термин, или одного или нескольких симптомов этого расстройства. Используемый здесь термин также охватывает, в зависимости от состояния пациента, профилактику расстройства, включая профилактику возникновения расстройства или любого симптома с ним связанного, а также уменьшение тяжести расстройства или любого его симптома до его возникновения. «Лечение» в рамках настоящего изобретения также относится к профилактике рецидива расстройства.
Например, «лечение шизофрении, или шизофреноподобного, или шизоаффективного расстройства» в рамках изобретения включает в себя лечение одного или нескольких симптомов (положительных, отрицательных и других связанных симптомов) указанных расстройств, например лечение бреда и/или галлюцинации, с ними связанных. Другие примеры симптомов шизофрении и шизофреноподобных и шизоаффективных расстройств включают в себя спонтанную речь, эмоциональную тупость, алогичность, ангедонию, неуместную тревогу, дисфорическое настроение (в форме, например, депрессии, тревожности или раздражительности), и некоторые указания на когнитивную дисфункцию.
Использующийся здесь термин «млекопитающие» относится к любому представителю класса «Mammalia», включая, но ими не ограничиваясь, человека, собак и кошек.
Настоящее изобретение также относится к новому способу скрининга соединений на наличие способности селективно ингибировать PDE10.
Например, изобретение также относится к способу определения селективной ингибиторной активности в отношении PDE10 у химического соединения, который включает в себя: a) введение химического соединения в культуру медиальных шиповатых нейронов и b) измерение повышения фосфорилирования CREB в культуре; повышение фосфорилирования CREB, тем самым, показывает, что соединение, использованное в стадии (a) обладает селективной ингибиторной активностью в отношении PDE10.
В другом примере изобретение относится к способу определения селективной ингибиторной активности в отношении PDE10 у химического соединения, который включает в себя: a) введение химического соединения в культуру медиальных шиповатых нейронов и b) измерение повышения количества продуцируемого GABA медиальными шиповатыми нейронами в указанной культуре; повышение продукции GABA указанными медиальными шиповатыми нейронами, тем самым, показывает, что соединение, использованное в стадии (a) обладает селективной ингибиторной активностью в отношении PDE10.
Культура медиальных шиповатых нейронов может быть получена специалистом в данной области с использованием известных способов, например, но ими не ограничиваясь, способов, подробно описанных ниже.
Химические соединения могут вводиться в культуру медиальных шиповатых клеток одним из вышеуказанных способов, с использованием известных способов. Введение химических соединений может осуществляться автоматизировано или вручную. Более того, группы химических соединений можно скринировать в соответствии с любым из способов путем высокопроизводительного скрининга. Необязательно, для одновременного и/или последовательного анализа различных соединений на селективную ингибиторную активность в отношении PDE10 может быть использовано более одной культуры медиальных шиповатых нейронов и/или могут быть использованы аликвоты одной культуры медиальных шиповатых нейронов. Каждое из этих исследований может включать в себя одну или несколько автоматизированных, например компьютеризированных, стадий.
Фосфорилирование CREB в культуре(ах) шиповатых нейронов среднего размера может быть измерено способами, хорошо известными специалистам в данной области. Например, фосфорилирование CREB может быть измерено Вестерн-блоттингом белковой смеси, полученной в результате гомогенизирования обрабатываемой культуры шиповатых нейронов среднего размера, с антителами, специфичными в отношении CREB. Комплекс антитело-CREB может быть измерен в соответствии с одним или несколькими известными способами, например с использованием вторичных флуоресцентно-меченных антител, антител, меченных радиактивной меткой или антител, меченных ферментом или фермент-субстратом.
GABA в культуре(ах) медиальных шиповатых нейронов может быть измерена способами, известными специалисту в данной области. Например, нейроны в культуре медиальных шиповатых нейронов сначала могут быть обнаружены с помощью одного из нескольких известных ядерных красителей и тубулина для идентификации клеток, в которых происходит процесс. Вслед за этим для определения нейронов, экспрессирующих GABA, могут быть использованы флуоресцентно-меченные антитела. Число нейронов, экспрессирующих GABA, может быть определено любой автоматизированной системой или визуально. Могут быть использованы системы обработки нефлуоресцентного изображения, включая, например, но ими не ограничиваясь, изображения, полученные с помощью радиомеченных GABA-специфических антител. В качестве другого способа, обрабатываемая культура медиальных шиповатых нейронов может быть гомогенизирована и GABA в ней может быть количественно определена любым известным способом, включая, но ими не ограничиваясь, ВЭЖХ, ELISA или ферментативную реакцию.
Краткое описание чертежей
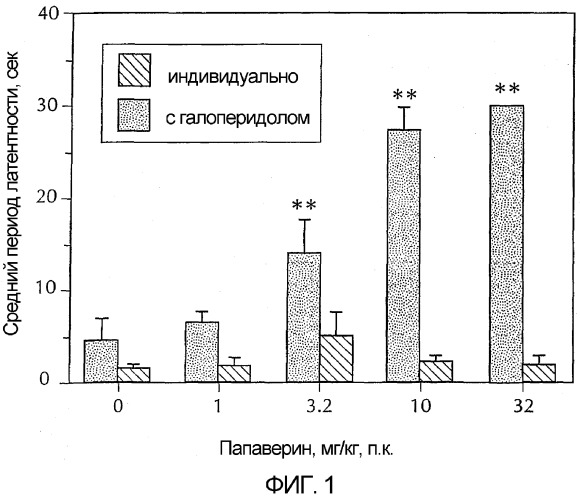
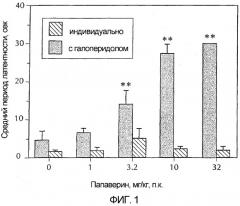
Фигура 1 - гистограмма, демонстрирующая каталепсию у животных в зависимости от возрастающих доз папаверина. Серые полосы представляют собой папаверин в сочетании с галоперидолом и показывают усиление папаверином вызванной галоперидолом каталепсии. Черные полосы представляют собой только папаверин. Эти черные полосы показывают, что папаверин самостоятельно не вызывает каталепсию в дозах до 32 мг/кг. Более конкретно, папаверин вводили в указанных дозах либо в чистом виде, либо с галоперидолом (0,32 мг/кг) за 30 минут до исследования. Каждая полоса обозначает средний латентный период до снятия передних лап с приподнятого барьера у шести сходно обрабатываемых животных. Для сравнения упорядоченных данных латентного периода папаверина в чистом виде против папаверина с галоперидолом использовали анализ изменения по Крускаллу-Уоллису. Post-hoc-анализ показал, что у животных, которым вводили 3,2, 10 и 32 мг/кг папаверина плюс галоперидол, длинный латентный период (**) был значительно больше, чем у животных, которым вводили только галоперидол.
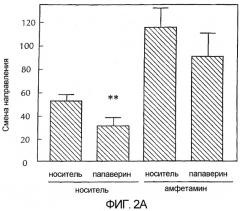
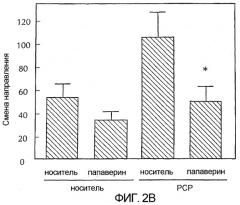
Фигура 2 - две графические полосы, каждая из которых показывает среднее + SEM число изменений направления у животных в эксперименте с челночной коробкой в течение первых 60 минут после введения препарата. На верхней диаграмме сравниваются эффекты папаверина, вводимого в чистом виде, на двигательную активность с эффектами папаверина на двигательную активность, вызванную амфетамином. На нижней диаграмме сравниваются эффекты папаверина, вводимого в чистом виде, на двигательную активность с эффектами папаверина на двигательную активность, вызванную PCP. Амфетамин вводили с дозой 1 мг/кг, внутрибрюшинно. PCP вводили с дозой 3,2 мг/кг, внутрибрюшинно. Папаверин вводили вместе с каждым препаратом с дозой 32 мг/кг, внутрибрюшинно. Данные показывают среднее + SEM число изменений направления в первые 60 минут после введения препарата у n = 8 крыс/группа.
** p < 0,01 по сравнению с контролем носитель/носитель;
* p < 0,05 по сравнению с носителем/PCP по критерию Стьюдента.
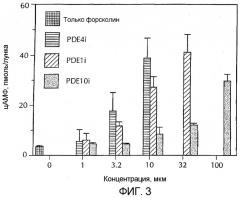
Фигура 3 - концентрация цАМФ в культуре медиальных шиповатых нейронов, стимулированных форсколином. Также показан эффект селективного ингибитора PDE 10, селективного ингибитора PDE 1B и селективного ингибитора PDE 4 на концентрацию цАМФ в стимулированных нейронах.
Фигура 4 - концентрация цГМФ в культуре медиальных шиповатых нейронов, стимулированных SNAP. Также показан эффект селективного ингибитора PDE 10, селективного ингибитора PDE 1B и селективного ингибитора PDE 4 на концентрацию цГМФ в стимулированных нейронах.
Фигура 5 - сравнение относительного эффекта селективного ингибитора PDE 10 и ролипрама (селективный ингибитор PDE 4) на фосфорилирование CREB (цАМФ-зависимый связывающий белок) в культуре медиальных шиповатых нейронов. Количество фосфорилированного CREB определяли с помощью Вестерн-блота.
Фигура 6 - относительное число GABA-позитивных медиальных шиповатых нейронов в сравнении с нейронами, обработанными селективным ингибитором PDE 10, селективным ингибитором PDE 4 (ролипрам) и селективным ингибитором PDE 1B.
Подробное описание изобретения
В настоящем изобретении авторы идентифицируют селективный ингибитор PDE10, используют этот и сходные селективные ингибиторы PDE10 для определения ингибиторов PDE10, обладающих характеристиками и уникальным эффектом на метаболизм циклических нуклеотидов в популяции нейронов, высокоэкспрессирующих PDE10, медиальных шиповатых нейронов полосатого ядра. Эти ингибиторы также увеличивают фосфорилирование фактора регуляции транскрипции цАМФ-зависимого связывающего белка (CREB) в этих нейронах. Фосфорилирование CREB связано с изменением транскрипции различных генов, что, в свою очередь, имеет функциональные последствия, которые включают в себя, но ими не ограничиваются, эффекты на выживание нейронов и дифференцировку, и изменяет симпатическую организацию, что влияет на увеличение времени действия препарата. Заявители в настоящем изобретении описывают ингибиторы PDE10, которые обладают такими эффектами на медиальные шиповатые нейроны, то есть стимулируют дифференцировку этих нейронов до фенотипа GABA. Более того, авторы описывают ингибиторы PDE10, которые оказывают функциональное влияние на центральную нервную систему интактных млекопитающих. Конкретно, описывают ингибиторы PDE10, которые усиливают каталепсию у крыс, вызванную антагонистом рецептора допамина D2 галоперидолом, но не вызывают каталепсию, при самостоятельном введении с той же дозой. Ингибиторы PDE10 также ингибируют гиперлокомоцию, вызванную антагонистом рецептора NMDA фенциклидином. Эти данные говорят о том, что ингибиторы PDE10 воздействуют на центральную нервную систему и могут быть терапевтически использованы для лечения расстройств центральной нервной системы, перечисленных в формуле изобретения.
PDE 2, 3 и 5, изозимы, включая PDE человека, могут быть, например, получены из трабекул пещеристых тел; PDE1, изозимы, включая человеческий, из желудочка сердца; и PDE4, изозимы, включая человеческий, из скелетных мышц. PDE6 может быть получен, например, из сетчатки собаки. Способ получения ферментов из нативной ткани описан, например, Boolell, M. et al., Int. J. Impotence Research 8:7-52, 1996, что приведено здесь в качестве ссылки.
PDE 7-11 могут быть получены аналогичным образом из нативной ткани. Альтернативно, изозимы семейств PDE 7-9 и 11 могут быть получены из рекомбинантных клонов первичного транскрипта человека, трансфицированных, например, в клетки SF9, как описано Fisher, D.A., et al., Biochem. Biophys. Res. Comm. 246, 570-577, 1998; Soderling, S.H. et al., PNAS 96: 7071-7076, 1999; Fisher, D.A. et al., J. Biol. Chem. 273, 15559-15564, 1998b; и Fawcett, L., et al., PNAS 97: 3702-3707, 2000; соответственно. PDE10 может быть также получен из рекомбинатного клона крысы, трансфицированного в клетки SF9 (Fujishige et al., European Journal of Biochemistry, Vol. 266, 1118-1127 (1999)). Затем ферменты получали с помощью ЖХБР из растворимой фракции клеточных лизатов, как описано для PDE6. Вышеуказанные ссылки приведены здесь в качестве ссылки в полном объеме.
В одном из способов вещество скринировали на ингибирование гидролиза циклического нуклеотида с помощью PDE10 и PDE других семейств генов. В этом способе концентрация субстрата циклического нуклеотида каждого отдельного PDE составляла 1/3 от концентрации Km, что давало возможность сравнения значений IC50 различных ферментов. Активность PDE измеряли с помощью способа на основе сцинциляционного анализа (SPA), как описано ранее (Fawcett et al., 2000). Эффект ингибиторов PDE определяли, исследуя постоянное количество фермента (PDE 1-11) в присутствии различных концентраций субстрата и низкой концентрации субстрата, так, чтобы IC50 был приблизительно равен Ki (цГМФ или цАМФ с отношением 3:1 немеченого к меченому [3H] с концентрацией 1/3 Km). Конечный объем в анализе доводили до 100 мкл буфером для анализа [20 мМ Tris-HCl pH 7,4, 5 мМ MgCl2, 1 мг/мл альбумин бычьей сыворотки]. Взаимодействие инициировали ферментом, инкубировали в течение 30-60 минут при 30°C с получением <30% метаболизма субстрата и заканчивали добавлением 50 мкл SPA бус из силиката иттрия (Amersham) (содержащий 3 мМ соответствующего немеченого циклического нуклеотида для PDE 9 и 11). Плашки закрывали и трясли в течение 20 минут, после чего бусы оставляли отстаиваться в течение 30 минут в темноте и затем подсчитывали на счетчике для плашек TopCount (Packard, Meriden, CT). Единицы радиоактивности могут быть преобразованы в процент активности неингибированного контроля (100%), представленного против концентрации ингибитора, и значения IC50 ингибитора могут быть получены с использованием «Эмпирической кривой» с разрешением Microsoft Excel.
Одним из примеров селективных ингибиторов PDE10 является папаверин (1-[(3,4-диметоксифенил)метил]-6,7-диметоксиизохинолин). Папаверин известен как эффективный релаксант гладких мышц, использующийся для лечения спазма сосудов мозга и сердца, а также для лечения эректильной дисфункции. Хотя механизм этой терапевтической активности до конца не понятен, обычно папаверину приписывают активность неселективного ингибитора фосфодиэстеразы (The Pharmacological Basis of Therapeutics; Sixth Edition; A.G. Gilman, L.S. Goodman, A. Gilman (eds.) Macmillan Publishing Co., New York, 1980, с. 830). Хотя папаверин представляет собой природный растительный алкалоид, его полный биосинтез описан, например, в Brochmann-Hanssen et al., J. Pharm. Sci. 60:1672, 1971, как приведено здесь в качестве ссылки.
Селективный ингибитор PDE10 может вводиться по настоящему изобретению либо самостоятельно, либо в сочетании с фармацевтически приемлемыми носителями, в виде одной дозы или множественными дозами. Подходящие фармакологические носители включают в себя инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции, полученные таким образом, могут затем легко вводиться в различных дозируемых формах, таких как таблетки, порошки, лепешки, сиропы, растворы для инъекций и тому подобное. Эти фармацевтические композиции могут, в случае необходимости, содержать дополнительные ингредиенты, такие как ароматизаторы, связующие агенты, эксципиенты и тому подобное.
Таким образом, для перорального введения могут использоваться таблетки, содержащие различные эксципиенты, такие как цитрат натрия, карбонат кальция и фосфат кальция, вместе с различными дезинтегрирующими агентами, такими как крахмал, метилцеллюлоза, альгиновая кислота и некоторые кремниевые комплексы, и связующими агентами, такими как поливинилпирролидон, сахароза, желатин и гуммиарабик. Кроме того, также часто при получении таблеток используют смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции сходного типа также могут использоваться в виде наполнителей в мягких и твердых наполняемых желатиновых капсулах. Предпочтительными веществами для этой цели является лактоза или молочный сахар и высокомолекулярные полиэтиленгликоли. Если для перорального введения желательны водные суспензии или эликсиры, то основной активный ингредиент в них может сочетаться с различными подсластителями или ароматизаторами, красящим веществом или красителями и, в случае необходимости, эмульгирующими или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и их сочетания.
Для парентерального введения могут использоваться растворы, содержащие селективные ингибиторы PDE10 в кунжутном или арахисовом масле, водном пропиленгликоле или в стерильном водном растворе. Такие водные растворы, в случае необходимости, могут быть подходящим образом забуферены, а жидкий растворитель изотонизирован с помощью подходящего солевого раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Используемую стерильную водную среду можно с легкостью получить стандартными спо