Антитела против миелин-ассоциированного гликопротеина (mag)
Иллюстрации
Показать всеНастоящее изобретение относится к области медицины и касается антител против миелин-ассоциированного гликопротеина (MAG). Сущность изобретения включает гуманизированное антитело или его функциональный фрагмент, которые связываются с MAG (миелин-ассоциированным гликопротеином), а также фармацевтическую композицию, содержащую их, и к применению таких антител в лечении и/или профилактики неврологических заболеваний/расстройств, особенно инсульта. Преимущество изобретения заключается в усилении нейропротекции в острой фазе. 2 н. и 4 з.п. ф-лы, 9 ил.
Реферат
Область изобретения
Настоящее изобретение относится к измененным антителам, которые связываются с миелин-ассоциированным гликопротеином (MAG) и нейтрализуют его функцию, полинуклеотидам, кодирующим такие антитела, фармацевтическим препаратам, содержащим указанные антитела, и к применению таких антител в лечении и/или профилактике неврологических заболеваний. Другие аспекты, объекты и преимущества настоящего изобретения станут понятны из следующего ниже описания.
Предшествующий уровень техники
Инсульт является важной причиной смерти и инвалидности в западном мире. Не существует зарекомендовавшего себя способа лечения инсульта за исключением t-PA (тканевого активатора плазминогена), который необходимо вводить не позже чем через 3 часа с момента начала, после CT (компьютерная томография) сканирования для того, чтобы избежать кровоизлияния. До сегодняшнего дня большая часть терапевтических агентов, направленных на лечение острого инсульта (т.е. нейропротекцию), преимущественно затрагивала целевые глутаматные рецепторы и нисходящие от них сигнальные пути, про которые известно, что они вовлечены в острый некроз клеток. Однако до настоящего времени эти стратегии оказывались неудачными при клинических испытаниях и часто бывают связаны с побочными действиями, ограничивающими дозу (Hill & Hachinski, The Lancet. 352: (suppi III) 10-14 (1998)). Следовательно, существует потребность в новых подходах, направленных на уменьшение гибели клеток после остановки кровотока.
После начала инсульта у многих пациентов наблюдается в некоторой степени спонтанное функциональное восстановление, что свидетельствует о том, что мозг обладает способностью (хотя и ограниченной) восстанавливаться и/или перестраиваться после повреждения. Агенты, которые могут усиливать это восстановление, могут, следовательно, позволить, чтобы вмешательство после начала ишемии мозга осуществлялось позднее (потенциально на несколько суток). Агенты, которые могут обеспечить как нейропротекцию в острой фазе, так и усиление функционального восстановления, могут иметь значительные преимущества по сравнению с другими имеющимися в настоящее время потенциальными стратегиями нейропротекции.
Механизмы, лежащие в основе функционального восстановления, в настоящее время не известны. В качестве одного из возможных механизмов предложен спрутинг поврежденных и неповрежденных аксонов. Однако хотя in vivo исследования показали, что лечение повреждения спинного мозга или инсульта нейротрофическими факторами приводит к усилению функционального восстановления и увеличению степени спрутинга аксонов, они не подтверждают прямую связь между степенью спрутинга аксонов и степенью функционального восстановления (Jakeman, et al. 1998, Exp. Neurol. 154: 170-184, Kawamata et al. 1997, Proc. Natl. Acad. Sci. USA. 94: 8179-8184, Ribotta, et al. 2000, J. Neurosci. 20: 5144-5152). Кроме того, для спрутинга аксонов требуется жизнеспособный нейрон. При таких заболеваниях, как инсульт, который связан с массовой гибелью клеток, усиление функционального восстановления, обеспечиваемое данным агентом после инсульта, следовательно, может осуществляться посредством механизмов, отличных от спрутинга аксонов, таких как дифференциация эндогенных стволовых клеток, активация резервных путей, изменения в распределении рецепторов или возбудимости нейронов или глии (Fawcett & Asher, 1999, Brain Res. Bulletin. 49: 377-391, Homer & Gage, 2000. Nature 407 963-970).
Предполагается, что ограниченная способность центральной нервной системы (ЦНС) восстанавливаться после повреждения частично объясняется наличием в ЦНС окружении молекул, которые обладают ингибиторным действием в отношении спрутинга аксонов (разрастания нейритов). Полагают, что миелин ЦНС содержит ингибиторные молекулы (Schwab M.E. and Caroni P. (1988) J. Neurosci 8, 2381-2193). Два миелиновых белка, миелин-ассоциированный гликопротеин (MAG) и Nogo были клонированы и идентифицированы как предполагаемые ингибиторы разрастания нейритов (Sato S. et al. (1989) Biochem. Biophys. Res. Comm. 163, 1473-1480; McKerracher L. et al. (1994) Neuron 13, 805-811; Mukhopadhyay G. et al. (1994) Neuron 13, 757-767; Torigoe K. and Lundborg G. (1997) Exp.Neurology 150, 254-262; Schafer et al. (1996) Neuron 16, 1107-1113; WO 9522344; WO 9701352; Prinjha R. et al. (2000) Nature 403, 383-384; Chen M.S. et al. (2000) Nature 403, 434-439; GrandPre Т. et al. (2000) Nature 403, 439-444; US 005250414 A; WO 200005364 A1; WO 0031235).
Миелин-ассоциированный гликопротеин представляет собой трансмембранную молекулу клеточной поверхности, экспрессируемую на поверхности миелина, состоящую из пяти внеклеточных иммуноглобулиновых доменов, одного трансмембранного домена и внутриклеточного домена. Экспрессия MAG ограничена миелинизированной глией в ЦНС и периферической нервной системе (ПНС). Предполагают, что MAG взаимодействует с рецептором(ами) нейронов, которые опосредуют воздействия на цитоскелет нейронов, включающие в себя фосфорилирование нейрофиламентов и ингибирование роста неврита in vitro. Хотя предполагалось, что антагонисты MAG полезны для активизации спрутинга аксонов после повреждения (WO 522344, WO 9701352 и WO 9707810), эти заявления не подтверждены in vivo данными. Кроме того, не доказана роль MAG в качестве ингибитора спрутинга аксонов ЦНС нейронов in vivo (Li C.M. et al. (1994) Nature 369, 747-750; Montag, D. et al. (1994) Neuron 13, 229-246; Lassmann H. et al. (1997) GLIA 19, 104-110; Li С et al. (1998) J. Neuro. Res. 51, 210-217; Yin X. et al. (1998) J. Neurosci. 18, 1953-1962; Bartsch U et al. (1995) Neuron 15 1375-1381; Li Metal (1996) 46, 404-414).
Антитела обычно включают в себя две тяжелые цепи, связанные друг с другом дисульфидными связями, и две легкие цепи. Каждая легкая цепь связана с соответствующей тяжелой цепью дисульфидными связями. На одном конце каждой тяжелой цепи имеется вариабельный домен, за которым следует некоторое количество константных доменов. У каждой легкой цепи имеется вариабельный домен на одном конце и константный домен на другом ее конце. Вариабельный домен легкой цепи совмещен с вариабельным доменом тяжелой цепи. Константный домен легкой цепи совмещен с первым константным доменом тяжелой цепи. Константные домены легкой и тяжелой цепей не вовлечены непосредственно в связывание антитела с антигеном.
Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий сайт. Вариабельные домены легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен включает в себя каркас, состоящий из четырех областей, последовательности которых являются относительно консервативными, соединенными тремя определяющими комплементарность областями (CDR), часто называемыми гипервариабельными областями. Четыре каркасные области в значительной степени принимают конформацию бета-складок, и CDR образуют петли, связывающие и в некоторых случаях образующие часть структуры бета-складок. CDR удерживаются в непосредственной близости каркасными областями и вместе с CDR из другого домена участвуют в образовании антигенсвязывающего сайта. CDR и каркасные области антител могут быть определены согласно ссылке Kabat et al. («Sequences of proteins of immunological interest» US Dept. of Health and Human Services, US Government Printing Office, 1987).
Теперь обнаружено, что анти-MAG моноклональное антитело, описанное (Poltorak et al. (1987) Journal of Cell Biology 105, 1893-1899, DeBellard et al. (1996) Mol. Cell. Neurosci. 7, 89-101; Tang et al. (1997) Mol. Cell. Neurosci. 9, 333-346; Torigoe K. and Lundborg G. (1997) Exp.Neurology 150, 254-262) и имеющееся в продаже (МАВ1567 (Chemicon)), при введении как непосредственно в головной мозг, так и внутривенно после очаговой церебральной ишемии у крыс (модель инсульта), обеспечивает нейропротекцию и усиливает функциональное восстановление. Таким образом, анти-MAG антитела представляют собой сильные терапевтические агенты как для нейропротекции в острой фазе, так и для активизации функционального восстановления после инсульта. Это антитело представляет собой мышиное антитело. Хотя мышиные антитела часто используются в качестве диагностических агентов, их полезность в качестве терапевтического средства была подтверждена только в нескольких случаях. Их ограниченное применение частично является следствием того, что повторное введение моноклональных мышиных антител людям обычно вызывает у людей иммунные ответы против этих молекул. Для того чтобы преодолеть эти нежелательные свойства, присущие моноклональным мышиным антителам, «измененные» антитела, сконструированные так, чтобы включать в себя области человеческих антител, были разработаны и получили общее признание в данной области техники. Например, гуманизированное антитело содержит определяющие комплементарность области (CDR), происходящие не от людей, а большая часть остальной структуры происходит от человеческого антитела.
Процесс нейродегенерации лежит в основе многих неврологических заболеваний/расстройств, включая острые заболевания, такие как инсульт, травматическое повреждение головного мозга и повреждение спинного мозга, а также хронические заболевания, включая болезнь Альцгеймера, лобно-височные деменции (таупатии), периферическую невропатию, болезнь Паркинсона, болезнь Гентингтона и рассеянный склероз. Следовательно, анти-MAG моноклональные антитела (mabs) могут быть полезны в лечении этих заболеваний/расстройств посредством уменьшения клеточной гибели, связанной с этими заболеваниями/расстройствами, и активизации функционального восстановления.
Все публикации, как журнальные, так и патентные, описанные в настоящей заявке, прямо и полностью включены в данное описание изобретения посредством ссылки.
Краткое описание сущности изобретения
В данном изобретении предложено измененное антитело или его функциональный фрагмент, которые связываются с MAG и нейтрализуют его, и включают в себя одну или более следующую CDR. CDR идентифицированы, как описано Kabat (Kabat et al. (1991) Sequences of proteins of immunological interest; Fifth Edition; US Department of Health and Human Services; NIH publication №91-3242). CDR предпочтительно являются такими, как определено Kabat, но в соответствии с принципами структуры и укладки белков, определенными Chothia и Lesk (Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p.877-883), очевидно, что дополнительные остатки также можно рассматривать в качестве фрагмента антигенсвязывающего центра, и они, таким образом, охваченные настоящим изобретением.
CDR легкой цепи
| CDR | Согласно Kabat |
| L1 | KSSHSVLYSSNQKNYLA (SEQUENCE ID NO: 1) |
| L2 | WASTRES (SEQUENCE ID NO: 2) |
| L3 | HQYLSSLT (SEQUENCE ID NO: 3) |
CDR тяжелой цепи
| CDR | Согласно Kabat |
| H1 | NYGMN (SEQUENCE ID NO: 4) |
| H2 | WINTYTGEPTYADDFTG (SEQUENCE ID NO: 5) |
| Н3 | NPINYYGINYEGYVMDY (SEQUENCE ID NO: 6) |
Настоящее изобретение также относится к антителу, которое связывается с тем же самым эпитопом, что и антитело, имеющее описанные выше CDR. Для картирования эпитопов антигена используют анализы конкурентного ингибирования. Таким образом, также предложено анти-MAG антитело (измененное или неизмененное), которое конкурентно ингибирует связывание с MAG, предпочтительно человеческим MAG, измененного антитела, имеющего описанные выше CDR.
В еще одном аспекте настоящего изобретения предложено измененное антитело или его функциональный фрагмент, которые содержат вариабельный домен тяжелой цепи, который включает в себя одну или более CDR, выбранную из CDRH1, CDRH2 и CDRH3, и/или вариабельный домен легкой цепи, который включает в себя одну или более CDR, выбранную из CDRL1, CDRL2 и CDRL3.
В данном изобретении также предложено измененное анти-MAG антитело или его функциональный фрагмент, которые содержат:
а) вариабельный домен тяжелой цепи (VH), который включает в себя последовательно CDRH1, CDRH2 и CDRH3,
и/или
б) вариабельный домен легкой цепи (VL), который включает в себя последовательно CDRL1, CDRL2 и CDRL3.
В еще одном аспекте данного изобретения предложена фармацевтическая композиция, содержащая измененное анти-MAG антитело по настоящему изобретению или его функциональный фрагмент вместе с фармацевтически приемлемым разбавителем или носителем.
В еще одном аспекте настоящего изобретения предложен способ лечения или профилактики инсульта и других неврологических заболеваний у человека, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества анти-MAG антитела по настоящему изобретению или его функциональных фрагментов.
В еще одном аспекте в данном изобретении предложено применение анти-MAG антитела по данному изобретению или его функционального фрагмента в изготовлении лекарства для лечения или профилактики инсульта и других неврологических заболеваний.
В еще одном аспекте настоящего изобретения предложен способ замедления нейродегенерации и/или активизации функционального восстановления у человека-пациента, страдающего инсультом или другим неврологическим заболеванием, или имеющего риск их развития, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества анти-MAG антитела по настоящему изобретению или его функционального фрагмента.
В еще одном аспекте данного изобретения предложено применение анти-MAG антитела по данному изобретению или его функционального фрагмента в изготовлении лекарства для замедления нейродегенерации и/или активизации функционального восстановления у человека-пациента, пораженного инсультом или другим неврологическим заболеванием, или имеющего риск их развития.
Другие аспекты и преимущества настоящего изобретения описаны ниже в подробном описании и его предпочтительных воплощениях.
Описание графических материалов
Фиг.1: Последовательность тяжелой цепи химерного мышиного/человеческого анти-MAG антитела (Seq ID No. 27).
Фиг.2: Последовательность легкой цепи химерного мышиного/человеческого анти-MAG антитела (Seq ID No. 28).
Фиг.3: Последовательность тяжелой цепи химерного мышиного/человеческого анти-MAG антитела (Seq ID No. 29).
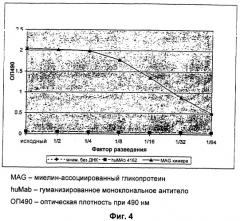
Фиг.4: Химерное анти-MAG антитело связывается с крысиным MAG.
Фиг.5: Последовательности гуманизированных анти-MAG антител.
Фиг.6: Гуманизированные анти-MAG антитела связываются с крысиным MAG.
Фиг.7: Гуманизированные анти-MAG антитела связываются с крысиным MAG.
Фиг.8: Гуманизированные анти-MAG антитела связываются с человеческим MAG.
Фиг.9: Конкурентный ELISA (твердофазный иммуноферментный анализ) с мышиными и гуманизированными анти-MAG антителами.
Подробное описание изобретения
Анти-MAG антитело
Измененное антитело по данному изобретению предпочтительно представляет собой моноклональное антитело (mAb) и предпочтительно является химерным, гуманизированным или переформированным, причем гуманизированное является особенно предпочтительным из перечисленных.
Измененное антитело предпочтительно имеет структуру природного антитела или его фрагмента. Следовательно, антитело может включать в себя полное антитело, (Fab1)2 фрагмент, Fab фрагмент, димер легкой цепи или димер тяжелой цепи. Антитело может представлять собой IgG1, IgG2, IIgG3 или IgG4; или IgM; IgA, IgE или IgD, или его модифицированный вариант. Соответственно может быть выбран константный домен тяжелой цепи антитела. Константный домен легкой цепи может представлять собой константный домен каппа или лямбда. Кроме того, антитело может включать в себя модификации всех классов, например, IgG димеры, Fc мутанты, которые больше не связываются с Fc-рецепторами или опосредуют Clq-связывание (блокирующие антитела). Антитело может также представлять собой химерное антитело описанного в WO 86/01533 вида, которое включает в себя антигенсвязывающую область и неиммуноглобулиновую область. Антигенсвязывающая область представляет собой вариабельный домен легкой цепи или вариабельный домен тяжелой цепи антитела. Обычно антигенсвязывающая область включает в себя вариабельные домены как легкой, так и тяжелой цепи. Неиммуноглобулиновая область слита на своем С-конце с антигенсвязывающей областью. Неиммуноглобулиновая область обычно представляет собой неиммуноглобулиновый белок и может представлять собой фермент, токсин или белок, обладающий известной специфичностью связывания. Две области этого типа химерного антитела могут соединяться через расщепляемую линкерную последовательность. Иммуноадгезины, имеющие описанные выше CDR, также рассматриваются в настоящем изобретении.
Константную область выбирают в соответствии с требуемой функциональностью. Обычно IgG1 демонстрирует литическую способность посредством связывания с комплементом и/или опосредует ADCC (антитело-зависимую клеточную цитотоксичность). Если требуется нецитотоксичное блокирующее антитело, предпочтительным является IgG4. Однако IgG4-антитела могут демонстрировать нестабильность продуцирования и, следовательно, может быть более предпочтительно модифицировать в общем случае более стабильный IgG1. Предложенные модификации описаны в ЕР 0307434, предпочтительные модификации включены в позиции 235 и 237. Таким образом, в данном изобретении предложена литическая и нелитическая формы антитела по данному изобретению.
В предпочтительном аспекте измененное антитело представляет собой IgG, более предпочтительно IgG1 класс.
Следовательно, в предпочтительных формах антитело по данному изобретению представляет собой полноразмерное нелитическое IgG1-антитело, имеющее описанные выше CDR. В наиболее предпочтительных формах авторы данного изобретения предлагают полноразмерное нелитическое IgG1-антитело, имеющее CDR с SEQ ID NO: 13 и 16, и полноразмерное нелитическое IgG1-антитело, имеющее CDR с SEQ ID NO: 15 и 18.
В еще одном аспекте данного изобретения предложены полинуклеотиды, кодирующие CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3. Предпочтительные полинуклеотидные последовательности представляют собой:
CDR легкой цепи
| CDR | |
| L1 | AAGAGCAGCCACAGCGTGCTGTACAGCAGCAACCAGAAGAACTACCTGGCC (SEQUENCE ID NO: 7) |
| L2 | TGGGCCAGCACCCGCGAGAGC (SEQUENCE IDS NO: 8) |
| L3 | CACCAGTACCTGAGCAGCCTGACC (SEQUENCE ID NO: 9) |
CDR тяжелой цепи
| CDR | |
| Н1 | AACTACGGCATGAAC (SEQUENCE ID NO: 10) |
| Н2 | TGGATCAACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGC (SEQUENCE ID NO: 11) |
| Н3 | AACCCCATCAACTACTACGGCATCAACTACGAGGGCTACGTGATGGACTAC(SEQUENCE ID NO: 12) |
В еще одном аспекте данного изобретения предложен полинуклеотид, кодирующий вариабельную область легкой цепи измененного анти-MAG антитела, включающий в себя по меньшей мере одну CDR, выбранную из CDRL1, CDRL2 и CDRL3, более предпочтительно включающий в себя последовательно все три CDR.
В еще одном аспекте данного изобретения предложен полинуклеотид, кодирующий вариабельную область тяжелой цепи измененного анти-MAG антитела, включающий в себя по меньшей мере одну CDR, выбранную из CDRH1, CDRH2 и CDRH3, более предпочтительно включающий в себя последовательно все три CDR.
В особенно предпочтительном аспекте анти-MAG антитело по данному изобретению представляет собой гуманизированное антитело.
Следовательно, в данном изобретении, кроме того, предложено гуманизированное антитело или его функциональный фрагмент, которое связывается с MAG и нейтрализует его, которое содержит вариабельную область тяжелой цепи, включающую в себя одну из следующих аминокислотных последовательностей:
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWI
NTYTGEPTYADDFTGRFVFSLDTSVSTAYLQISSLKABDTAVYYCARNPIN
YYGINYEGYVMDYWGQGTLVTVSS (SEQ ID No 13).
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWI
NTYTGEPTYADDFTGRFVFSLDTSVSTAYLQISSLKAEDTAVYFCARNPIN
YYGIMYEGYVMDYWGQGTLVTVSS (Sequence ID No 14)
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWI
NTYTGEPTYADDFTGRFVFSLDTSVSTAYLQISSLKAEDTATYFCARNPIN
YYGINYEGYVMDYWGQGTLVTVSS (sequence ID No 15)
В еще одном аспекте данного изобретения предложено гуманизированное антитело или его функциональный фрагмент, которое связывается с MAG, которое содержит вариабельную область тяжелой цепи с Sequence ID No 13, 14 или 15 вместе с вариабельной областью легкой цепи, включающей в себя аминокислотные последовательности Sequence ID No 16, 17, 18 или 19:
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSNQKHYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEPVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 16)
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSNQKNYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTIINLQABDVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 17)
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSYQKNYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTISSLHTEDVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 18)
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSNQKNYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTIINLHTEDVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 19)
В еще одном аспекте настоящего изобретения предложено гуманизированное антитело, содержащее:
вариабельный фрагмент тяжелой цепи, включающий в себя SEQ ID No 13, 14 или 15, и константную часть или ее фрагмент тяжелой цепи человека, и
вариабельный фрагмент легкой цепи, включающий в себя SEQ ID No 16, 17, 18 или 19, и константную область или ее фрагмент легкой цепи человека.
В предпочтительном аспекте гуманизированное антитело представляет собой класс IgG, более предпочтительно IgG1.
Предпочтительные антитела по данному изобретению содержат:
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 16;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 17;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 18;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 19.
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 16;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 17;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 18;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 19.
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 16;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 17;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 18;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 19.
В еще одном аспекте данного изобретения предложены полинуклеотиды, кодирующие вариабельную область тяжелой цепи, включающую в себя Sequence ID No 13, 14 и 15, и вариабельные области легкой цепи, включающие в себя Sequence ID No 16, 17, 18 и 19.
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 13, представляет собой:
CAGGTGCAGCTGGTGCAATCTGGGTCTGAGTTGAAGAAGCCTGGGGCCTCA
GTGAAGGTTTCGTGCAAGGCTTCTGGATACACCTTCACTAACTACGGCATG
AACTGGGTGCGACAGGCCCCTGGACAAGGGCTTGAGTGGATGGGATGGATC
AACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGCCGGTTT
GTCTTCTCCTTGGACACCTCTGTCAGCACGGCATATCTGCAGATCAGCAGC
CTAAAGGCTGAGGACACTGCCGTGTATTACTGTGCGAGAAACCCCATCAAC
TACTACGGCATCAACTACGAGGGCTACGTGATGGACTACTGGGGCCAGGGC
ACACTAGTCACAGTCTCCTCA (SEQ ID No 20)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность Sequence ID No 14, представляет собой:
CAGGTGCAGCTGGTGCAATCTGGGTCTGAGTTGAAGAAGCCTGGGGCCTCA
GTGAAGGTTTCCTGCAAGGCTTCTGGATACACCTTCACTAACTACGGCATG
AACTGGGTGCGACAGGCCCCTGGACAAGGGCTTGAGTGGATGGGATGGATC
AACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGCCGGTTT
GTCTTCTCCTTGGACACCTCTGTCAGCACGGCATATCTGCAGATCAGCAGC
CTAAAGGCTGAGGACACTGCCGTGTATTTCTGTGCGAGAAACCCCATCAAC
TACTACGGCATCAACTACGAGGGCTACGTGATGGACTACTGGGGCCAGGGC
ACACTAGTCACAGTCTCCTCA (SEQ ID No 21)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 15, представляет собой:
CAGGTGCAGCTGGTGCAATCTGGGTCTGAGTTGAAGAAGCCTGGGGCCTCA
GTGAAGGTTTCCTGCAAGGCTTCTGGATACACCTTCACTAACTACGGCATG
AACTGGGTGCGACAGGCCCCTGGACAAGGGCTTGAGTGGATGGGATGGATC
AACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGCCGGTTT
GTCTTCTCCTTGGACACCTCTGTCAGCACGGCATATCTGCAGATCAGCAGC
CTAAAGGCTGAGGACACTGCCACCTATTTCTGTGCGAGAAACCCCATCAAC
TACTACGGCATCAACTACGAGGGCTACGTGATGGACTACTGGGGCCAGGGC
ACACTAGTCACAGTCTCCTCA (SEQ ID No 22)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 16, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCACCATGCAACTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAG
GCTGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 23)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 17, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCCACCATCAACTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCATCAACCTGCAG
GCTGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 24)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 18, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCCACCATACGCTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAUTCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAC
ACCGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 25)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 19, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCCACCATCAAGTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCATCAACCTGCAC
ACCGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 26)
«Нейтрализующее» относится к общему или частичному ингибированию функции MAG, включая его связывание с нейронами и ингибирование роста нейрита.
«Измененное антитело» относится к белку, кодируемому областью кодирования измененного иммуноглобулина, который может быть получен посредством экспрессии в выбранной клетке хозяине. Такие измененные антитела включают в себя генно-инженерные антитела (например химерные, переформированные, гуманизированные или векторные антитела) или фрагменты антител, лишенные части или всей иммуноглобулиновой константной области, например Fv, Fab или F(ab)2 и т.п.
"Область, кодирующая измененный иммуноглобулин" относится к последовательности нуклеиновых кислот, кодирующей измененное антитело. Когда измененное антитело представляет собой CDR-трансплантированное или гуманизированное антитело, последовательности, которые кодируют определяющие комплементарность области (CDR) иммуноглобулина, не являющегося человеческим, встраивают в первого иммуноглобулинового партнера, содержащего человеческие вариабельные каркасные последовательности. Возможно, что первый иммуноглобулиновый партнер функциональным образом связан со вторым иммуноглобулиновым партнером.
«Первый иммуноглобулиновый партнер» относится к последовательности нуклеиновых кислот, кодирующей человеческую каркасную или человеческую иммуноглобулиновую вариабельную область, в которой природные (или встречающиеся в природе) CDR-кодирующие области заменены CDR-кодирующими областями донорного антитела. Человеческая вариабельная область может представлять собой тяжелую цепь, легкую цепь (или обе цепи) иммуноглобулина, ее аналог или функциональные фрагменты. Такие CDR области, расположенные в вариабельной области антител (иммуноглобулинов), могут быть известными в данной области техники способами. Например, в Kabat et al. (Sequences of Proteins of Immunological Interest. 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)) описаны правила расположения CDR. Кроме того, известны компьютерные программы, которые полезны для идентификации CDR областей/структур.
«Второй иммуноглобулиновый партнер» относится к другой нуклеотидной последовательности, кодирующей белок или пептид, с которой слит первый иммуноглобулиновый партнер внутри рамки считывания или посредством возможной общепринятой связывающей последовательности (т.е. связан функциональным образом). Предпочтительно он представляет собой ген иммуноглобулина. Второй иммуноглобулиновый партнер может содержать последовательность нуклеиновых кислот, кодирующую полную константную область того же самого (т.е. гомологичного - первое и второе измененное антитело получены из одного и того же источника) или дополнительного (т.е. гетерологичного) интересующего антитела. Он может представлять собой тяжелую или легкую цепь иммуноглобулина (или обе цепи как часть одного полипептида). Второй иммуноглобулиновый партнер не ограничен конкретным классом или изотипом иммуноглобулинов. Кроме того, второй иммуноглобулиновый партнер может содержать часть константной области иммуноглобулина, так как обнаружено в Fab или F(ab)2 (т.е. дискретную часть подходящей человеческой константной области или каркасной области). Такой второй иммуноглобулиновый партнер может также содержать последовательность, кодирующую интегральный мембранный белок, экспонированный на внешней поверхности клетки хозяина, например, как часть фаговой дисплейной библиотеки, или последовательность, кодирующую белок для аналитического или диагностического обнаружения, например, пероксидазу хрена, (3-галактозидазу, и т.д.
Термины Fv, Fc, Fd, Fab или F(ab)2 используются в соответствии со своими обычными значениями (смотри, например, Harlow et al., Antibodies A Laboratory Manual. Cold Spring Harbor Laboratory, (1988)).
В данном контексте термин «генно-инженерное антитело» описывает тип измененного антитела, т.е. полноразмерного синтетического антитела (например, химерного, переформированного или гуманизированного антитела в противоположность фрагменту антитела), в котором часть вариабельных доменов легких и/или тяжелых цепей выбранного акцепторного антитела заменена на аналогичные части одного или более донорных антител обладающих специфичностью в отношении выбранного эпитопа. Например, такие молекулы могут включать антитела, характеризующиеся гуманизированной тяжелой цепью в ассоцииации с немодифицированной легкой целью (или химерной легкой цепью), или наоборот. Генно-инженерные антитела могут также характеризоваться изменением последовательностей нуклеиновых кислот, кодирующих каркасные области легкого и/или тяжелого вариабельного домена акцепторного антитела, для сохранения связывающей специфичности донорного антитела. Эти антитела могут включать замену одной или более CDR (предпочтительно всех) акцепторного антитела на CDR донорного антитела, описанного здесь.
«Химерное антитело» относится к типу генно-инженерного антитела, которое содержит встречающуюся в природе вариабельную область (легкая цепь и тяжелые цепи), происходящую от донорного антитела, в ассоциации с константными областями легких и тяжелых цепей, происходящими от акцепторного антитела.
«Гуманизированное антитело» относится к типу генно-инженерного антитела, имеющего CDR, полученные из иммуноглобулинов донора, не являющегося человеком, причем остальные происходящие от иммуноглобулина фрагменты молекулы происходят от одного (или более) человеческого(их) иммуноглобулина(ов). Кроме того, остатки основы каркаса могут быть изменены для сохранения аффинности связывания (смотри, например, Queen et al., Proc. Natl Acad Sci USA. 86: 10029-10032 (1989), Hodgson et al., Bio/Technology. 9: 421 (1991)). Подходящим человеческим акцепторным антителом может быть выбранное из обычной базы данных, например, КАВАТ® базы данных, базы данных Лос Аламоса и шведской базы данных белков, в соответствии с гомологией нуклеотидной и аминокислотной последовательности донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на аминокислотной основе), может быть подходящим для обеспечения встраивания донорных CDR в константную область тяжелой цепи и/или вариабельную каркасную область тяжелой цепи. Подходящее акцепторное антитело, способное предоставлять константные или вариабельные каркасные области легкой цепи, может быть выбрано аналогично. Следует понимать, что тяжелые и легкие цепи акцепторного антитела не обязательно должны происходить от одного и того же акцепторного антитела. В предшествующем уровне техники были описаны несколько путей продуцирования таких гуманизированных антител - смотри, например, ЕР-А-0239499 и ЕР-А-054951.
«Переформированное человеческое антитело» относится к измененному антителу, в котором минимально по меньшей мере одну CDR первого человеческого моноклонального донорного антитела заменяет CDR во втором человеческом акцепторном антителе. Предпочтительно заменены все шесть CDR. Более предпочтительно вся антигенсвязывающая область (например Fv, Fab или F(ab')2) первого человеческого донорного моноклонального антитела заменяет соответствующую область во втором человеческом акцепторном моноклональном антителе. Наиболее предпочтительно Fab область первого человеческого донора функциональным образом связана с соответствующими константными областями второго человеческого акцепторного антитела с образованием полноразмерного моноклонального антитела.
«Векторное антитело» относится к антителу, к которому присоединен агент для улучшения транспорта через гематоэнцефалический барьер (ВВВ) (смотри обзор Pardridge; Advanced Drug Delivery Review 36, 299-321, 1999). Присоединение может быть химическим или, альтернативно, эта группировка может быть введена генно-инженерным путем в антитело. Одним из примеров является получение химеры с антителом, направленным на рецептор эндотелиальных клеток капилляров головного мозга, например, с антителом против рецептора инсулина или антителом против рецептора трансферрина (Saito et al. (1995) Proc. Natl. Acad. Sci. USA 92 10227-31; Pardridge et al. (1995) Pharm. Res. 12 807-816; Broadwell et al. (1996) Exp.Neurol. 142 47-65; Bickel et al. (1993) Proc. Natl. Acad. Sci. USA 90, 2618-2622; Friden et al. (1996) J. Pharm. Exp. Ther. 278 1491-1498, US 5182107, US 5154924, US 5833988, US 5527527). Связавшись с рецептором, оба компонента биспецифичного антитела проходят через ВВВ посредством процесса трансцитоза. Альтернативно агент может представлять собой лиганд, который связывается с такими рецепторами клеточной поверхности, например инсулин, трансферрин или липопротеин низкой плотности (Descamps et al. (1996) Am. J. Physiol. 270 H1149-H1158; Duffy et al., (1987) Brain Res. 420 32-38; Dehouck et al., (1997) J. Cell Biol. 1997 877-889). Также можно использовать встречающиеся в природе пептиды, такие как пенетратин и SynB1 и SynB3, про которые известно, что они улучшают транспорт через ВВВ (Rouselle et al. (2000) Mol. Pharm. 57, 679-686 и Rouselle et al. (2001) Journal of Pharmacology and Experimental Therapeutics 296, 124-131).
Термин «донорное антитело» относится к антителу (моноклональному или рекомбинантному), которое предоставляет аминокислотные последовательности своих вариабельных областей, CDR или другие функциональные фрагменты или их аналоги первому иммуноглобулиновому партнеру, так чтобы получить кодирующую область измененного иммуноглобулина и в результате экспрессию измененного антитела с антигенной специфичностью и нейтрализующей активностью, характерной для донорного антитела.
Термин «акцепторное антитело» относится к антителу (моноклональному или рекомбинантному), гетерологичному донорному антителу, которое предоставляет все (или любую часть, но предпочтительно все) аминокислотные последовательности, кодирующие его каркасные области тяжелых и/или легких цепей, и/или его константные области тяжелых и/или легких цепей, первому иммуноглобулиновому партнеру. Предпочтительно человеческое антитело представляет собой акцепторное антитело.
«CDR» определены как аминокислотные последовательности области антигена, определяющей комплементарность, представляющие собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. Смотри, например, Kabat et al., Sequences of Proteins of Immunological Interest. 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельной части иммуноглобулина имеются три CDR (или гипервариабельные области) с тяжелыми и три CDR с легкими цепями. Таким образом, в данном контексте «CDR» относится ко всем трем CDR с тяжелыми цепями или всем трем CDR с легкими цепями (или как к CDR с тяжелыми, так и ко всем CDR с легкими цепями, если это является подходящим). Структура и белковое сворачивание антитела может означать, что другие остатки рассматриваются как часть антигенсвязывающего центра, как должны понимать специалисты в данной области техники. Смотри, например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p.877-883. Для удобства CDR, как они определены Kabat в SEQ ID No 13-26, подчеркнуты.
CDR обеспечивает большую часть контактных остатков для связывания антитела с антигеном или эпитопом. Интересующие в данном изобретении CDR происходят от вариабельных последовательностей тяжелых и легких цепи донорного антитела и включают аналоги встречающихся в природе CDR, которые также обладают частью или сохраняют такую же антигенсвязывающую специфичность и/или нейтрализующую способность, что и донорное антитело, от которого они происходят.
«Функциональный фрагмент» представляет собой частичную вариабельную последовательность тяжелой или легкой цепи (например минорные делеции на амино- или карбокси