Тиоэфирзамещенные имидазохинолины и фармацевтическая композиция на их основе
Иллюстрации
Показать всеОписываются новые тиоэфирзамещенные имидазохинолины и их фармацевтически приемлемые соли. Соединения способны индуцировать биосинтез цитокинов в клетках человека, что позволяет использовать их в медицине. Описывается также фармацевтическая композиция на их основе. 2 н.п. ф-лы, 4 табл.
Реферат
Изобретение касается имидазохинолиновых соединений, содержащих тиоэфирную группу в положении 1, и фармацевтических композиций, включающих такие соединения. Изобретение касается также использования этих соединений в качестве иммуномодуляторов для индукции биосинтеза цитокинов у животных и для лечения разнообразных клинических расстройств, включая вирусные и онкологические заболевания.
Первое достоверное сообщение, касающееся 1Н-имидазо[4,5-с]хинолинового кольца (Backman et al., J. Org. Chem. 15, 1278-1284, 1950) описывает синтез 1-(6-метокси-8-хинолинил)-2-метил-1Н-имидазо[4,5-с]хинолина для потенциального использования в качестве лекарственного средства против малярии. В последующем появились сообщения о синтезе различных замещенных 1Н-имидазо[4,5-с]хинолинов. В частности, Jain et al., J. Med. Chem., 11, стр.87-92 (1968), синтезировали соединение 1-[2-(4-пиперидил)этил]-1Н-имидазо[4,5-с]хинолин для применения в качестве противосудорожного и сердечно-сосудистого средства. Другими примерами служат работы Baranov et al., Chem. Abs., 85, 94362 (1976), и Bereneyi et al., J. Heterocyclic Chem., 18, 1537-1540 (1981), в каждой из которых было синтезировано по несколько 2-оксоимидазо[4,5-с]хинолинов.
Позднее было установлено, что некоторые 1Н-имидазо[4,5-с]хинолин-4-амины и их 1- и 2-замещенные производные могут использоваться в качестве проивовирусных средств, бронходилятаторов и иммуномодуляторов. Они описаны, в частности, в Патентах США No 4689338; 4698348; 4929624; 5037986; 5346905 и 5389640.
Интерес к имидазохинолиновому кольцу сохраняется по-прежнему.
Известно несколько Н1-имидазо[4,5-с]нафтиридин-4-аминов, Н1-имидазо[4,5-с]пиридин-4-аминов и Н1-имидазо[4,5-с]хинолин-4-аминов, имеющих замещенную эфирную группировку в положении 1. Они описаны в Патентах США No 5268376; 5389640; 5494916 и WO 99/29693.
Несмотря на все попытки получить соединения, которые можно было бы использовать в качестве иммуномодуляторов, сохраняется потребность в препаратах, изменяющих функцию иммунной системы путем индукции биосинтеза цитокинов или посредством иных механизмов.
Краткое описание изобретения
Мы обнаружили новый класс соединений, индуцирующих биосинтез цитокинов у животных. Таким образом, изобретение касается имидазохинолин-4-аминов и тетрагидроимидазохинолин-4-аминов, содержащих заместитель тиоэфира в положении 1. Эти соединения соответствуют формулам (I) и (II), их подробное описание приведено ниже. Общей структурной формулой этих соединения является
где X, Z, R1, R2 и R даются в дальнейшем для каждого класса соединений, соответствующих формулам (I) и (II).
Соединения, соответствующие формулам (I) и (II), влияют на иммунные реакции благодаря способности индуцировать биосинтез цитокинов или вызывать иные эффекты при введении животным. Это позволяет использовать их для лечения разнообразных патологических состояний, чувствительных к изменениям активности иммунной системы, таких как вирусные заболевания или опухоли.
Изобретение касается также фармацевтических композиций на основе соединений, влияющих на иммунные реакции, и способов индукции биосинтеза цитокинов у животных, терапии вирусных инфекций у животных и/или лечения новообразований у животных посредством введения им того или иного соединения, имеющего формулу (I) или (II).
Кроме того, изобретение относится к способам синтеза указанных соединений.
Подробное описание изобретения
Как указывалось ранее, мы обнаружили несколько соединений, которые индуцируют биосинтез цитокинов и модифицируют иммунные реакции у животных. Эти соединения имеют общие структурные формулы (I) и (II), как описано ниже.
Имидазохинолиновые соединения, содержащие тиоэфирную группировку в положении 1, соответствуют формуле (I)
R1 выбран из группы, включающей
- алкил,
- арил, где X: -CHR3-, -CHR3-алкил или -CHR3-алкенил;
Z: -S-, -SO- -SO2-;
- гетероарил,
- гетероциклил,
- алкенил,
- R4-арил,
- R4-гетероарил и
- R4-гетероциклил;
R2 выбран из группы, включающей
- водород,
- алкил,
- алкенил,
- арил,
- гетероарил,
- гетероциклил,
- алкил-Y-алкил,
- алкил-Y-алкенил,
- алкил-Y-арил и
- алкил или алкенил, замещенный одним или несколькими заместителями, выбранными из группы, включающей
- ОН,
- галоген,
- N(R3)2,
- СО-N(R3)2,
- CO-C1-10 алкил,
- CO-O-C1-10 алкил,
- N3,
- арил,
- гетероарил,
- гетероциклил,
- СО-арил и
- СО-гетероарил.
Каждый R3 представляет собой независимо либо Н, либо С1-10 алкил,
R4 представляет собой или алкил или алкенил,
каждый Y представляет собой независимо -О- или -
S(O)0-2-,
n = от 0 до 4 и
каждый R независимо выбран из группы, включающей C1-10 алкил, С1-10 алкокси, гидрокси, галоген и трифторометил или их фармацевтически приемлемую соль.
Изобретение относится также к
тетрагидроимидазохинолинолиновым соединениям, содержащим заместитель тиоэфира в положении 1. Такие тетрагидроимидазохинолинолиновые соединения соответствуют структурной формуле (II)
где X: -CHR3-, -CHR3алкил или -CHR3алкенил;
Z: -S-, -SO- -SO2-;
R1 выбран из группы, включающей
- алкил,
- арил,
- гетероарил,
- гетероциклил,
- алкенил,
- R4-арил,
- R4-гетероарил и
- R4-гетероциклил;
R2 выбран из группы, включающей
- водород,
- алкил,
- алкенил,
- арил,
- гетероарил,
- гетероциклил,
- алкил-Y-алкил,
- алкил-Y-алкенил,
- алкил-Y-арил и
- алкил или алкенил, замещенный одним или несколькими заместителями, выбранными из группы, включающей
- ОН,
- галоген,
- N(R3)2,
- СО-N(R3)2,
- CO-C1-10 алкил,
- CO-O-C1-10 алкил,
- N3,
- арил,
- гетероарил,
- гетероциклил,
- СО-арил и
- СО-гетероарил.
Каждый R3 представляет собой независимо либо Н, либо C1-10 алкил,
R4 представляет собой или алкил, или алкенил,
каждый Y представляет собой независимо -О- или -S(O)0-2-,
n = от 0 до 4 и
каждый R независимо выбран из группы, включающей С1-10 алкил, C1-10 алкокси, гидрокси, галоген и трифторометил или их соль, пригодную для фармацевтического использования.
Получение соединений
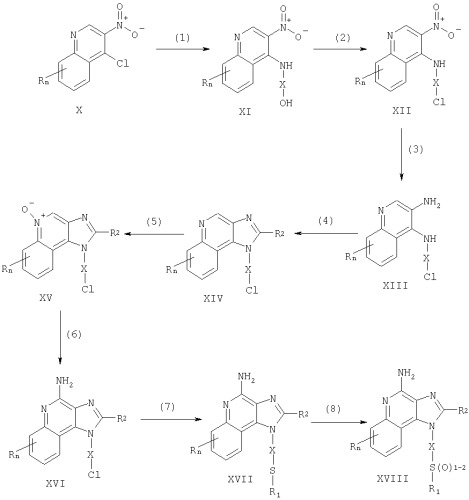
Соединения по данному изобретению могут быть получены посредством реакции по схеме I, где R, R1, R2, Х и n имеют указанные выше значения.
На стадии (1) схемы I 4-хлоро-3-нитрохинолин (X) взаимодействует с амином, имеющим формулу HO-X-NH2, что приводит к образованию 3-нитрохинолин-4-амина (XI). Для проведения этой реакции амин добавляют в раствор соединения (X) в подходящем растворителе, таком как хлороформ или дихлорометан, в присутствии триэтиламина. В случае необходимости полученную смесь можно подогреть. Многие хинолины, имеющие формулу X, хорошо известны (см., например, Патент США No 4689338 и прилагаемый к нему перечень литературы). Многие амины формулы HO-X-NH2 имеются в продаже, другие легко получить, используя известные способы синтеза.
На стадии (2) схемы I 3-нитрохинолин-4-амин (XI) хлорируют для получения 3-нитрохинолин-4-амина, имеющего формулу (XII). Используют обычные хлорирующие реагенты. Реакцию предпочтительно проводят, растворяя соединение (XI) и тионила хлорид в соответствующем растворителе, например в дихлорометане. Реакция протекает при комнатной температуре или в условиях нагревания. По альтернативному способу реагирующие соединения не разводят.
На стадии (3) схемы I 3-нитрохинолин-4-амин (XII) восстанавливают для получения хинолин-3,4-диамина (XIII). Для восстановления предпочтительно используют обычный гетерогенный гидрогенированный катализатор, например платину или уголь. Удобно проводить реакцию в аппарате Парра, в соответствующем растворителе (толуоле).
На стадии (4) схемы I 3-нитрохинолин-4-амин (XIII) реагирует с карбоксильной кислотой или эквивалентным реагентом, что приводит к образованию 1Н-имидазо[4,5-с]хинолина (XIV). К числу соединений, эквивалентных карбоксильной кислоте, относятся ортоэфиры и 1,1-диалкоксиалкил-алканоаты. Карбоксильную кислоту или ее эквивалент выбирают таким образом, чтобы ввести желаемый заместитель R2 в соединение (XIV). В частности, триэтилортоформиат является соединением, в котором R2 представлен водородом, а триметилортовалерат соединением, в котором R2 представлен бутилом. Реакция может проходить в отсутствие растворителя или в таком инертном растворителе, как толуол. Реакционную систему нагревают для упаривания спирта или воды, образующихся в качестве побочных продуктов взаимодействия. В случае необходимости используют катализатор, например пиридина гидрохлорид.
По альтернативной методике стадию (4) осуществляют в два этапа:
(1) смешивают диамин (XIII) с ацильным галидом, имеющим формулу R2C(O)C1 или R2C(O)Br, и (2) проводят циклизацию. На этапе (1) ацильный галид добавляют в раствор диамина в подходящем растворителе, например в пиридине. Реакция протекает при комнатной температуре в присутствии пиридина гидрохлорида.
На стадии (5) схемы I 1Н-имидазо[4,5]хинолин, имеющий общую формулу XIV, окисляют для получения 1Н-имидазо[4,5]хинолин-5N-оксида (XV), используя обычный окислитель, обеспечивающий образование 5N-оксида. Предпочтительно раствор соединения (XV) в подходящем растворителе, таком как хлороформ или дихлорометан, обрабатывают 3-хлоропероксибензойной кислотой при комнатной температуре.
На стадии (6) схемы I 1Н-имидазо[4,5]хинолин-5N-оксид (XV) аминируют для получения 1Н-имидазо[4,5]хинолин-4-амина (XVI). Стадия (6) включает два этапа: (1) реакцию соединения (XV) с ацилирующим реагентом и (2) реакцию полученного продукта с аминирующим реагентом.
На этапе (1) стадии (6) N-оксид (XV) реагирует с ацилирующим реагентом. В качестве последнего используют алкил- или арилсульфонилхлориды (например, бензолсульфонилхлорид, метанолсульфонилхлорид и п-толуолсульфонилхлорид). Предпочтение отдается арилсульфонилахлоридам. Наиболее предпочтителен п-толуолсульфонила хлорид. На этапе (2) стадии (6) продукт, полученный на предыдущем этапе (1), реагирует с избыточным количеством аминирующего соединения. К числу предпочтительных аминирующих реагентов относятся аммиак (в частности, в форме гидроокиси аммония) и соли аммония (например, аммония карбонат, аммония бикарбонат или аммония фосфат). Предпочтение отдается гидроокси аммония. Реакцию предпочтительно проводят, растворяя N-оксид (XV) в инертном растворителе, таком как дихлорометан или хлороформ. При этом в раствор сначала добавляют аминирующее соединение, а затем (медленно) ацилирующий реагент.
На стадии (7) схемы I 1Н-имидазо[4,5]хинолин-4-амин (XVI) взаимодействует с соединением, имеющим формулу R1-SNa, что приводит к образованию 1Н-имидазо[4,5]хинолин-амина формулы XVII, которая является подродом формулы I. Реакцию осуществляют, смешивая соединение (XVI) и соединение, имеющее формулу R1SNa, в подходящем растворителе, таком как N,N-диметилформамид или диметилсульфоксид, при комнатной температуре или при 60-80°С. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
На стадии (8) схемы I 1Н-имидазо[4,5]-4-амин (XVII) окисляют обычным окисляющим реагентом для получения 1Н-имидазо[4,5]-4-амина формулы XVIII, которая является подродом формулы I. Предпочтительно раствор соединения (XVII) в подходящем растворителе, таком как хлороформ или дихлорометан, обрабатывают 3-хлоропероксибензойной кислотой при комнатной температуре. Интенсивность окисления регулируют, подбирая нужное количество 3-хлоропероксибензойной кислоты (примерно один эквивалент дает сульфоксид, приблизительно два эквивалента дают сульфон). Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
Реакция по схеме I
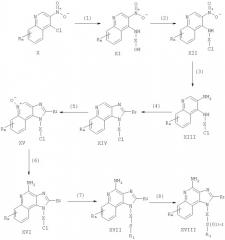
Соединения в соответствии с изобретением могут быть получены посредством реакции по схеме II, где R, R1, R2, X и n имеют указанные выше значения.
На стадии (1) схемы II осуществляют реакцию 3-нитрохинолин-4-амина (XII) с соединением, имеющим формулу R1-SNa, используя процедуру (7) схемы I и получая 3-нитрохинолин-4-амин (XIX).
На стадии (3) схемы II осуществляют циклизацию хинолин-3,4-диамина (XX), используя процедуру (4) схемы I и получая 1Н-имидазо[4,5-с]хинолин (XXI).
На стадии (4) схемы II 1Н-имидазо[4,5-с]хинолин (XXI) окисляют для получения 1Н-имидазо[4,5-с]хинолин-5N-оксида (XXII), используя обычный окисляющий реагент. Предпочтительно раствор соединения (XXI) в подходящем растворителе, например хлороформе или дихлорометане, по меньшей мере три раза обрабатывают эквивалентом 3-хлоропероксибензойной кислоты при комнатной температуре.
На стадии (5) схемы II 1Н-имидазо[4,5-с]хинолин-5N-оксид (XXII) аминируют, используя процедуру (6) схемы I, для получения 1Н-имидазо[4,5-с]хинолин-4-амина формулы XVIII, которая является подродом формулы (I). Реакция протекает при комнатной температуре или при 60-80°С. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
Реакция по схеме II
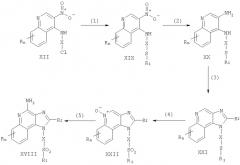
Соединения по данному изобретению могут быть получены посредством реакции по схеме III, где R, R1, R2, X и n имеют указанные выше значения.
На стадии (1) схемы III 3-нитро-4-аминохинолин-1-ил-алкоголь, имеющий формулу XI, защищают трет-бутилдиметилсилильной группой, используя обычную методику. Предпочтительно соединение (XI) вводят вместе с трет-бутилдиметилсилила хлоридом в подходящий растворитель, такой как хлороформ, в присутствии триэтиламина и каталитического количества 4-диметиламинопиридина.
На стадии (2) схемы III защищенный 3-нитро-4-аминохинолин-1-ил-алкоголь (XXIII) восстанавливают, используя процедуру (3) схемы I, для получения защищенного 3,4-диаминохинолин-1-ил-алкоголя, имеющего формулу (XXIV).
На стадии (3) схемы III осуществляют циклизацию защищенного 3,4-диаминохинолин-1-ил-алкоголя (XXIV), используя процедуру (4) схемы 1, для получения 1Н-имидазо[4,5-с]хинолина (XXV).
На стадии (4) схемы III 1Н-имидазо[4,5-с]хинолин (XXV) окисляют для получения 1Н-имидазо[4,5-с]хинолин-5N-оксида (XXVI), используя процедуру (5) схемы I.
На стадии (5) схемы III 1Н-имидазо[4,5-с]хинолин-5N-оксид (XXVI) аминируют используя процедуру (6) схемы I, для получения 1Н-имидазо[4,5-с]хинолин-4-амина (XXVII).
На стадии (6) схемы III из 1Н-имидазо[4,5-с]хинолин-4-амина (XXVII) удаляют защитную группировку и получают 1Н-имидазо[4,5-с]хинолин-4-амин (XXVIII). Предпочтительно раствор соединения (XXVII) в подходящем растворителе, таком как тетрагидрофуран, обрабатывают тетрабутиламмония фторатом. Некоторые соединения, имеющие общую формулу (XXVIII), хорошо известны (см., например, Gerster, U.S. Patent No 4689338, и Gerster et al., U.S. Patent No 5605899).
На стадии (7) схемы III 1Н-имидазо[4,5-с]хинолин-4-амин (XXVIII) хлорируют обычным способом для получения 1Н-имидазо[4,5-с]хинолин-4-амина (XVI). Неразбавленное соединение (XXVIII) можно нагревать в присутствии тионила хлорида. По альтернативному способу в раствор соединения XXVIII в подходящем растворителе, таком как N,N-диметилформамид, добавляют контролируемое количество фосфора оксихлорида вместе с триэтиламином.
Стадии (8) и (9) по схеме III осуществляют таким же образом, как соответственно стадии (7) и (8) по схеме I.
Реакция по схеме III
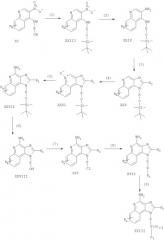
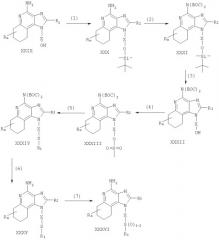
Соединения по данному изобретению могут быть получены посредством реакции по схеме IV где R, R1, R2, X и n имеют указанные выше значения, а ВОС - трет-бутоксикарбонил.
На стадии (1) схемы IV гидроксильную группу 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил-алкоголя (XXIX) защищают трет-бутилдиметилсилильной группой, используя процедуру (1) схемы III. Соединения, имеющие общую формулу (XXIX), описаны ранее и могут быть получены известными способами синтеза (см., например, Nikolaides et al., U.S. Patent No 5352784, и Lindtsrom, U.S. Patent No 5693811, а также перечни литературы, прилагаемые к этим документам).
На стадии (2) схемы IV аминогруппу 1Н-имидазо[4,5-с]хинолин-4-амина (XXX) защищают обычными способами для получения защищенного 1Н-имидазо[4,5-с]хинолина, имеющего формулу (XXXI). Предпочтительно соединение XXX обрабатывают ди-трет-бутилдикарбонатом в подходящем растворителе (например, в тетрагидрофуране) в присутствии триэтиламина и 4-диметиламинопиридина.
Реакция протекает в условиях повышенной температуры (60°С).
На стадии (3) схемы IV из соединения (XXXI) удаляют трет-бутилдиметилсилильную защитную группировку, используя процедуру (6) схемы III, и получают 1Н-имидазо[4,5-с]хинолин-1-ил-алкоголь (XXXII).
На стадии (4) схемы IV 1Н-имидазо[4,5-с]хинолин-1-ил-алкоголь (XXXII) преобразуют в метансульфонат (XXXIII). Предпочтительно раствор соединения (XXXII) в подходящем растворителе, таком как дихлорометан, обрабатывают метансульфонила хлоридом в присутствии триэтиламина.
Реакцию можно проводить при пониженной температуре (-10°С).
На стадии (5) схемы IV осуществляют реакцию метансульфонила (XXXIII) с тиолом, имеющим формулу R1SH, для получения тиоэфира (XXXIV). Предпочтительно раствор соединения (XXXIII) в подходящем растворителе, таком как N,N-диметилформамид, обрабатывают тиолом в присутствии триэтиламина. Реакция протекает в условиях повышенной температуры (80°С).
На стадии (6) схемы IV посредством гидролиза в кислой среде удаляют защитную трет-бутоксикарбонильную группировку и получают 1Н-имидазо[4,5-с]хинолин-4-амин формулы (XXXV), которая является подродом формулы II. Предпочтительно соединение XXXIV в подходящем растворителе, таком как дихлорометан, обрабатывают при комнатной температуре раствором соляной кислоты в диоксане. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
На стадии (7) схемы IV тиоэфир (XXXV) окисляют, используя процедуру (8) схемы I, для получения сульфона или сульфоксида формулы XXXVI, которая является подродом формулы II. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
Реакция по схеме IV
Соединения в соответствии с изобретением могут быть получены посредством реакции по схеме V, где R, R1, R2, X и n имеют указанные выше значения.
На стадии (1) схемы V 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил-алкоголь (XXIX) хлорируют, используя процедуру (7) схемы III, для получения соединения (XXXVII).
На стадии (2) схемы V осуществляют реакцию соединения (XXXVII) с соединением, имеющим формулу R1SNa, используя процедуру (7) схемы 1, для получения тиоэфира формулы XXXV, которая является подродом формулы II. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
На стадии (3) схемы V тиоэфир (XXXV) окисляют, используя процедуру (8) схемы I, для получения сульфона или сульфоксида формулы XXXVI, которая является подродом формулы II. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
Реакция по схеме V
Соединения в соответствии с изобретением могут быть получены посредством реакции по схеме VI, где R, R1, R2, Х и n имеют указанные выше значения.
В реакции по схеме VI 1Н-имидазо[4,5-с]хинолин, имеющий формулу (I) восстанавливают для получения 5,6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолина (II). С этой целью соединение (I) разводят в трифторуксусной кислоте, добавляют в полученный раствор каталитическое количество оксида платины (IV), после чего смесь подвергают давлению водорода. Реакцию удобно проводить в аппарате Парра. Продукт реакции или его пригодную для фармацевтического использования соль выделяют обычными способами.
Реакция по схеме VI
Соединения в соответствии с изобретением могут быть получены посредством реакции по схеме VII, где R, R1, R2, X и n имеют указанные выше значения; Ph - фенил.
На стадии (1) схемы VII 2,4-дигидро-3-нитро-6,7,8,9-тетрагидрохинолин, имеющий формулу (XXXVIII), хлорируют, используя обычные хлорирующие реагенты, для получения 2,4-дигидро-3-нитро-6,7,8,9-тетрагидрохинолина (XXXIX).
Предпочтительно осуществляют взаимодействие соединения (XXXVIII) с фосфора оксихлоридом при повышенной температуре. Некоторые соединения, имеющие общую формулу (XXXVIII), описаны ранее и могут быть получены известными способами синтеза (см., например, Nikolaides et al., U.S. Patent No 5352784, и перечень литературы, прилагаемый к этому документу).
На стадии (2) схемы VII осуществляют взаимодействие 2,4-дигидро-3-нитро-6,7,8,9-тетрагидрохинолина (XXXIX) с амином (XXX).
С этой целью амин добавляют в раствор соединения (XXXIX) в подходящем растворителе, таком как N,N-диметилформамид, в присутствии триэтиламина. В случае необходимости реакционную смесь можно нагреть.
На стадии (3) схемы VII осуществляют взаимодействие 2-хлоро-3-нитро-6,7,8,9-тетрагидрохинолина (ХХХХ) с натрия феноксидом для получения 3-нитро-2-фенокси-6,7,8,9-тетрагидрохинолина (XXXXI). С этой целью фенол добавляют к натрия гидриду в подходящем растворителе, таком как 1,2-диметоксиэтан, и получают феноксид. После этого осуществляют реакцию феноксида с соединением (ХХХХ) при повышенной температуре.
На стадии (4) схемы VII 3-нитро-2-фенокси-6,7,8,9-тетрагидрохинолин (XXXXI) хлорируют, используя обычные хлорирующие реагенты, для получения 3-нитро-2-фенокси-6,7,8,9-тетрагидрохинолина (XXXXII).
Предпочтительно осуществляют взаимодействие N-хлоросукцинимида с трифенилфосфином в подходящем растворителе, таком как тетрагидрофуран, и получают фосфинхлорид. После этого осуществляют реакцию фосфинхлорида с соединением (XXXXI).
На стадии (5) схемы VII 3-нитро-2-фенокси-6,7,8,9-тетрагидрохинолин (XXXXII) восстанавливают обычными способами для получения 3-амино-2-фенокси-6,7,8,9-тетрагидрохинолина (XXXXIII). Предпочтительная методика состоит в генерировании Ni2B in situ. Натрия борогидрид добавляют в смесь гексагидрата никеля(II) хлорида и соединения (XXXXII) в метаноле/хлороформе (50:50).
На стадии (6) схемы VII осуществляют циклизацию 3-амино-2-фенокси-6,7,8,9-тетрагидрохинолина (XXXXIII), используя процедуру (4) схемы I, для получения 4-фенокси-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолина формулы (III).
На стадии (7) схемы VII осуществляют взаимодействие 4-фенокси-6,7,8,9-тетрагидро- 1Н-имидазо[4,5-с]хинолина формулы (III) с соединением, имеющим формулу R1SNa, для получения 4-фенокси-6,7,8,9-тетрагидро-6,7,8,9-1Н-имидазо[4,5-с]хинолина формулы (XXXXIV), которая является подродом формулы (IV). Предпочтительно осуществляют реакцию тиола формулы R1SH с натрия гидридом в подходящем растворителе, таком как N,N-диметилформамид, для генерирования аниона, который затем реагирует с соединением формулы (III).
На стадии (8а) схемы VII 4-фенокси-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин (XXXXIV) аминируют для получения 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амина формулы XXXV, которая является подродом формулы (II). Реакцию осуществляют, смешивая соединение (XXXXIV) с аммония ацетатом при нагревании примерно до 150°С. В случае необходимости реакцию проводят в сосуде высокого давления. Полученный продукт или его пригодную для фармацевтического использования соль выделяют обычными способами.
На стадии (8б) схемы VII 4-фенокси-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолина формулы (XXXXIV) окисляют, используя процедуру (8) схемы I, для получения 4-фенокси-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолина формулы (XXXXV), которая является подродом формулы (IV).
На стадии (9) схемы VII 4-фенокси-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолина формулы (XXXXV) аминируют, используя процедуру (8а), для получения 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амина, имеющего формулу (XXXVI), которая является подродом формулы (II). Полученный продукт или его пригодную для фармацевтического использования соль выделяют обычными способами.
Реакция по схеме VII
Изобретение относится также к новым соединениям, которые являются промежуточными продуктами при биосинтезе соединений с общей формулой (II). Эти соединения имеют структурные формулы (III) и (IV), более подробная характеристика которых приводится ниже.
Один класс промежуточных продуктов имеет общую формулу III
где X: -CHR3-, -CHR3-алкил или -CHR3-алкенил;
R2 выбран из группы, включающей
- водород,
- алкил,
- алкенил,
- арил,
- гетероарил,
- гетероциклил,
- алкил-Y-алкил,
- алкил-Y-алкенил,
- алкил-Y-арил и
- алкил или алкенил, замещенный одним или несколькими заместителями, выбранными из группы, включающей
- ОН,
- галоген,
- N(R3)2,
- СО-N(R2)2,
- CO-C1-10 алкил,
- CO-O-C1-10 алкил,
- N3,
- арил,
- гетероарил,
- гетероциклил,
- СО-арил и
- СО-гетероарил.
Каждый R3 представляет собой независимо либо Н, либо C1-10 алкил,
Y представляет собой независимо -О- или -S(O)0-2-,
n = от 0 до 4 и
каждый R независимо выбран из группы, включающей C1-10 алкил, C1-10 алкокси, гидрокси, галоген и трифторметил или их соль, пригодную для фармацевтического использования.
Другой класс промежуточных соединений имеет общую формулу (IV)
где X: -CHR3-, -CHR3-алкил или -CHR3-алкенил;
Z: -S-, -SO-, -SO2-;
R1 выбран из группы, включающей
- алкил,
- арил,
- гетероарил,
- гетероциклил,
- алкенил,
- R4-арил,
- R4-гетероарил и
- R4-гетероциклил;
R2 выбран из группы, включающей
- водород,
- алкил,
- алкенил,
- арил,
- гетероарил,
- гетероциклил,
- алкил-Y-алкил,
- алкил-Y-алкенил,
- алкил-Y-арил и
- алкил или алкенил, замещенный одним или несколькими заместителями, выбранными из группы, включающей
- ОН,
- галоген,
- N(R3)2,
- СО-N(R3)2,
- CO-C1-10 алкил,
- CO-O-C1-10 алкил,
- N3,
- арил,
- гетероарил,
- гетероциклил,
- СО-арил и
- СО-гетероарил.
Каждый R3 представляет собой независимо либо Н, либо С1-10алкил,
R4 представляет собой или алкил или алкенил,
Y представляет собой независимо -О- или -S(O)0-2-,
n = от 0 до 4 и
каждый R независимо выбран из группы, включающей С1-10 алкил, C1-10 алкокси, гидрокси, галоген и трифторметил или их соль, пригодную для фармацевтического использования.
В данном описании термины "алкил", "алкенил" и приставка "алк-" применяются для обозначения как прямых, так и разветвленных цепей, а также циклических групп, в частности циклоалкильных и циклоалкенильных. Эти группы содержат от 1 до 20 атомов углерода, если не указано иначе. При этом алкенильные группы содержат от 2 до 20 углеродных атомов. Предпочтительные группы содержат в общей сложности до 10 атомов углерода. Циклические группы могут быть моноциклическими или полициклическими; предпочтительны циклические группы, содержащие в кольце от 3 до 10 углеродных атомов. Примерами циклических групп являются циклопропиловая, циклопропилметиловая, циклопентиловая, циклогексиловая и адамантиловая.
Кроме того, алкильные или алкенильные компоненты -Х- групп могут быть незамещенными или замещенными одним либо несколькими заместителями, выбранными из групп, включающих алкил, алкенил, арил, гетероарил, гетероциклил, арилалкил, гетероарилалкил и гетероциклилалкил.
Термин "галоалкил" используется для обозначения групп, замещенных одним или несколькими галогеновыми атомами, в том числе перфторированных групп. То же самое относится к группам, в названиях которых используется приставка "гало-". Примерами галоалкильных групп являются хлорметиловая, трифторметиловая и т.п.
Термин "арил" используется в данном описании для обозначения карбоциклических ароматических колец или их систем.
Примерами арильных группировок являюся фенил, нафтил, бифенил, флюоренил и инденил. Термин "гетероарил" распространяется на ароматические кольца или их системы, содержащие в кольце по меньшей мере один гетероатом (например, О, S, N). Примерами гетероарильных группировок служат фурил, тиенил, пиридил, хинолинил, изохинолинил, индолил, изоиндолил, триазолил, пирролил, тетразолил, имидазолил, пиразолил, оксазолил, тиазолил, бензофуранил, бензотиофенил, карбазолил, бензоксазолил, пиримидинил, бензимидазолил, хиноксалинил, бензотиазолил, нафтиридинил, изоксазолил, изотиазолил, пуринил, хиназолинил и т.д.
Термин "гетероциклил" используется для обозначения неароматических колец или их систем, которые содержат по меньшей мере один гетероатом кольца (например, О, S, N), и всех полностью или частично ненасыщенных производных вышеупомянутых гетероарильных группировок. Примерами гетероцикличных группировок являются пирролидинил, тетрагидрофуранил, морфолинил, тиоморфолинил, пиперидинил, пиперазинил, тиазолидинил, имидазолидинил, изотиазолидинил и т.п.
Арильные, гетероарильные и гетероцикличные группы могут быть незамещенными или замещенными одним или несколькими заместителями, независимо выбранными из группы, включающей алкил, алкокси, метилендиокси, этилендиокси, алкилтио, галоалкил, галоалкилтио, галоген, нитро, гидрокси, меркапто, циано, формил, арил, арилокси, арилтио, арилалкокси, арилалктио, гетероарил, гетероарилокси, гетероарилтио, гетероарилалкокси, гетероарилалкилтио, алкилкарбонил, гетероарилкарбонил, арилоксикарбонил, гетероарилоксикарбонил, арилтиокарбонил, гетероарилтиокарбонил, алканоилокси, алканоилтио, алканоиламино, арилкарбонилокси, арилкарбонилтио, алкиламиносульфонил, алкилсульфонил, арилсульфонил, гетероарилсульфонил, арилдиазинил, алкилсульфониламино, арилсульфониламино, арилалкилсульфониламино, алкилкарбониламино, алкенилкарбониламино, алкенилкарбониламино, арилкарбониламино, арилалкилкарбониламино, гетероарилкарбониламино, гетероарилалкенилкарбониламино, алкилсульфониламино, алкенилсульфониламино, арилсульфониламино, арилалкилсульфониламино, гетероарилсульфониламино, гетероарилалкилсульфониламино, алкиламинокарбониламино, алкениламинокарбониламино, ариламинокарбониламино, арилалкиламинокарбониламино, гетероариламинокарбониламино, гетероалкилкарбониламино и, в случае гетероциклила, оксо. Любые другие группы, идентифицируемые как "замещенные" или "факультативно замещенные", также могут включать в качестве заместителей одно или несколько вышеперечисленных соединений.
Некоторые заместители предпочтительны в принципе. Например, группы Х включают этилен и н-бутилен, предпочтительные группы R1 алкильная и арильная, а в арильной группе - фенильная или замещенная фенильная. Предпочтительно отсутствие R заместителей (т.е. n должно быть равно 0). Предпочтительные R2 группы включают водород, алкильные группы, содержащие от 1 до 4 углеродных атомов (т.е. метиловую, этиловую, пропиловую, изопропиловую, н-бутиловую, втор-бутиловую, изобутиловую и циклопропилметиловую), метилоксиэтиловую и этоксиметиловую. При наличии одного или нескольких таких предпочтительных заместителей они входят в состав соединений по данному изобретению в любой комбинации.
Изобретение касается описанных здесь соединений в любой приемлемой для фармацевтического использования форме, включая изомеры (например, диастереомеры и энантиомеры), соли, сольваты, полиморфные соединения и т.п. В частности, изобретение относится к оптически активным соединениям, включая их энантиомеры, а также рацемические смеси энантиомеров.
Фармацевтические композиции и биологическая активность
Фармацевтические композиции по данному изобретению содержат терапевтически эффективное количество одного из вышеперечисленных соединений в комбинации с фармацевтически приемлемым носителем.
Термин "терапевтически эффективное количество" означает количество того или иного соединения, достаточное для индукции терапевтического эффекта, в частности индукции биосинтеза цитокинов, противоопухолевой активности и/или противовирусной активности. Точное количество активного соединения, входящего в состав фармацевтических композиций по данному изобретению, вариирует (в зависимости от известных на настоящее время факторов, в том числе физической и химической природы соединения, природы носителя и ожидаемых дозировок). Однако любая такая композиция содержит активный ингредиент в количестве, достаточном, чтобы обеспечить ее терапевтическую дозу в диапазоне от 100 нг/кг до 50 мг/кг, предпочтительно от 10 мкг/кг до 5 мг/кг.
Композиции могут входить в состав любых существующих лекарственных форм, таких как таблетки, лепешки, препараты для парентерального введения, сиропы, кремы, мази, аэрозоли, пластыри для нанесения лекарственных средств на кожу и слизистые и т.п.
Соединения по данному изобретению предназначены в качестве лекарственных средств для монотерапии, а также для сочетанного использования друг с другом или с другими активными соединениями, включая иммуномодуляторы иной природы, противовирусные и противобактериальные препараты и т.п.
Соединения по данному изобретению индуцировали продукцию некоторых цитокинов в экспериментах, проводившихся для их тестирования, как описано ниже. Полученные результаты показывают, что эти соединения являются ценными модуляторами иммунных реакций и имеют разные механизмы действия, что позволяет использовать их для лечения разнообразных заболеваний.
К числу цитокинов, продукция которых индуцируется введением соединений в соответствии с изобретением, относятся интерферон-α (ИФН-α) и/или фактор некроза опухолей-α (ФНО-α), а также некоторые интерлейкины (ИЛ). Соединения по данному изобретению индуцируют биосинтез следующих цитокинов: ИФН-α, ФНО-α, ИЛ-1, ИЛ-6, ИЛ-10 и ИЛ-12, а также большого числа цитокинов иных типов. Клинические эффекты этих и других цитокинов включают ингибирование размножения вирусов и роста опухолевых клеток, что позволяет использовать их для лечения вирусных инфекций и новообразований. В связи с этим изобретение относится также к способу индукции биосинтеза цитокинов у животных, который состоит во введении им терапевтически эффективного количества соединения или композиции по данному изобретению.
Установлено, что отдельные соединения по данному изобретению преимущественно индуцируют экспрессию ФНО-α в популяции кроветворных клеток, таких как МКПК (моноядерные клетки периферической крови), содержащую клетки pDC2 (предшественники дендритов 2 типа). При этом они не вызывают сопутствующей продукции больших количеств воспалительных цитокинов.
В дополнение к способности индуцировать биосинтез цитокинов соединения по данному изобретению влияют на другие аспекты врожденной иммунной функции. В частности, они стимулируют активность природных клеток-убийц; это их действие может быть следствием индукции биосинтеза цитокинов. Указанные соединения могут также активировать макрофаги, что, в свою очередь, усиливает секрецию оксида азота и образование дополнительных цитокинов. Кроме того, эти соединения вызывают пролиферацию и дифференцировку В-лимфоцитов.
Соединения в соответствии с изобретением влияют также на приобретенные иммунные реакции. Не оказывая непосредственного действия на Т-клетки или продукцию цитокинов в Т-клетках, они косвенным образом индуцируют образование ИФН-γ в Т-хелперах 1 типа (ТХ1) и ингибируют продукцию ИЛ-4, ИЛ-5 и ИЛ-13 Т-хелперами 2 типа (ТХ2) после введения животным.
Такие проявления активности этих соединений означают, что они могут использоваться для лечения заболеваний, при которых необходимо усилить реакцию ТХ1 и ослабить реакцию ТХ2. В связи со способностью соединений по данному изобретению подавлять иммунные реакции, опосредуемые через ТХ2, они могут оказаться полезными для терапии атопических расстройств, таких как атопический дерматит, астма, аллергия, аллергический ринит и системная красная волчанка, а также в качестве вакцинных адъювантов для клеточного иммунитета и, возможно, для лечения рецидивирующих грибковых заболеваний и хламидиоза.
Модулирующее действие соединений по данному изобретению на иммунные реакции делает их перспективными средствами лечения многочисленных клинических расстройств. Благодаря способности индуцировать продукцию цитокинов, таких как ИФН-α и/или ФНО-α, эт