Композиции, подавляющие развитие кровеносных сосудов, и способы их использования
Иллюстрации
Показать всеКомпозиция, подавляющая развитие кровеносных сосудов, включает таксол в качестве фактора, подавляющего развитие кровеносных сосудов, и фармацевтически приемлемый полимерный носитель. Также описан способ эмболизации кровеносного сосуда, заключающийся в доставке в указанный сосуд терапевтически эффективного количества вышеуказанной композиции на основе таксола. Композиции по изобретению являются нетоксичными, тромбогенными, не изменяют свою форму или физические свойства во время хранения перед их использованием, не комкуются с образованием больших по размеру частиц как в растворе, так и после инъекции, приводят к медленному высвобождению фактора, подавляющего развитие кровеносных сосудов. 6 н. и 12 з.п. ф-лы, 22 ил., 3 табл.
Реферат
Область техники
Настоящее изобретение относится к композициям и методам лечения рака и других заболеваний, определяемых развитием кровеносных сосудов, а именно к композициям, включающим факторы, подавляющие развитие кровеносных сосудов, и полимерные носители, к устройствам для реконструкции просвета сосудов, покрытым указанными композициями, а также к способам использования указанных устройств для реконструкции просвета сосудов и к способам использования указанных композиций.
Предпосылки изобретения
Рак занимает второе место среди причин смертности в США и ответственен более чем за одну пятую часть от общей смертности. Если коротко, то рак характеризуется бесконтрольным делением популяций клеток, которое, как правило, приводит к образованию одной или большего количества опухолей. Хотя в настоящее время рак гораздо легче диагностируют, чем раньше, многие формы, даже при их раннем выявлении, все еще не поддаются лечению.
В настоящее время при лечении рака используется множество методов, в том числе, например, различные хирургические процедуры. Однако, если проводить лечение лишь хирургическим способом, то у многих пациентов (в частности, у тех, которые страдают от определенных типов рака, таких как рак груди, рак мозга, рак толстой кишки и рак печени) наблюдается рецидив рака. Помимо хирургического вмешательства многие виды рака лечат с применением комбинированной терапии, включающей использование цитотоксических химиотерапевтических средств (в частности, винкристина, винбластина, цисплатина, метотрексата, 5-FU и т.д.) и/или радиационную терапию. Одна из сложностей указанного подхода заключается в том, что радиотерапевтические и химиотерапевтические средства являются токсичными по отношению к нормальным тканям и часто вызывают опасные для жизни побочные эффекты. Далее, при таком подходе весьма часто наблюдаются неблагоприятные исходы или временное исчезновение симптомов заболевания.
Помимо хирургии, химиотерапии и радиотерапии предпринимались попытки использовать для уничтожения раковых клеток собственную иммунную систему пациента. Например, было предложено применять бактериальные или вирусные компоненты в качестве адъювантов с целью стимулировать иммунную систему для уничтожения опухолевых клеток (см. "Principles of Cancer Biotherapy", Oldham (ed.), Raven Press, New York, 1987). Подобные агенты обычно применяют в качестве адъювантов и неспецифичных стимуляторов в опухолевых моделях животных, однако еще не показано, что они в целом эффективны для лечения людей.
При лечении рака также использовали лимфокины. Если коротко, то лимфокины секретируются разными клетками и обычно оказывают воздействие на специфические клетки, вызывая ответную иммунную реакцию. Примерами лимфокинов являются интерлейкины (IL)-1, -2, -3 и -4, а также колониестимулирующие факторы, такие как G-CSF, GM-CSF и M-CSF. Недавно одна из групп исследователей применила IL-2 для стимулирования клеток периферической кровяной системы с целью их разрастания и выделения больших количеств клеток, которые являются цитотоксичными для опухолевых клеток (Rosenberg et al., N. Engl. J. Med., 313: 1485-1492,1985).
Другими группами исследователей для лечения рака предложено использовать антитела. Если коротко, то могут быть получены антитела, распознающие определенные антигены на поверхности клеток, которые либо уникальны для раковых клеток, либо превалируют у раковых клеток по сравнению с нормальными клетками. Указанные антитела, или "магические пули", могут использоваться сами по себе или в сочетании с токсином, с тем, чтобы они могли специфично нацелиться и поразить раковые клетки (Dilman, "Antibody Therapy", "Principles of Cancer Biotherapy", Oldham (ed.), Raven Press Ltd, New York, 1987). Трудность, однако, заключается в том, что большинство моноклональных антител имеют муриновое происхождение и, таким образом, гиперчуствительность по отношению к муриновому антителу может ограничивать их эффективность, особенно после повторных лечений. Обычные побочные эффекты включают жар, испарину и озноб, высыпания на коже, артрит и нервный паралич.
Дополнительная сложность существующих методов заключается в том, что локальный рецидив и локальный контроль остается важнейшей задачей при лечении злокачественных образований. В частности, в общей сложности 630000 пациентов (в США) ежегодно страдают от локальных заболеваний (не замечено распространение отдаленных метастазов); это составляет 64% от числа всех пациентов, у которых обнаружены злокачественные образования (в него не входит немеланомный рак кожи или карцинома in situ). Для подавляющего большинства этих пациентов хирургическое лечение болезни предоставляет наибольший шанс для выздоровления, и действительно 428000 из них вылечиваются после первичного лечения. К сожалению, у 202000 (или 32% пациентов с локальными заболеваниями) наблюдается рецидив после первичного лечения. Из пациентов, у которых наблюдается рецидив, число тех, у кого наблюдается рецидив локального заболевания, достигает 133000 ежегодно (или 21% от числа пациентов с локальными заболеваниями). Число тех, у кого рецидив связан с отдаленными метастазами, составляет 68000 пациентов ежегодно (11% из всех пациентов с локальными заболеваниями). Еще 102139 пациентов ежегодно умирают непосредственно в результате невозможности контролировать локальное распространение болезни.
Нигде эта проблема не проявляется так ярко, как при раке груди, который ежегодно поражает 186000 женщин в США, при этом уровень смертности сохраняется без изменения в течение 50 лет. Хирургическое иссечение по методу радикальной мастэктомии, модифицированной радикальной мастэктомии или удаление опухоли остаются главным оплотом при лечении этого состояния. К сожалению, у 39% пациентов, которым проведено одно лишь удаление опухоли, наблюдается локальный рецидив болезни и, что неожиданно, это же наблюдается у 25% пациентов, у которых, как показано, границы иссечения гистологически свободны от опухоли. Вплоть до 90% из этих рецидивов возникает на расстоянии не более 2 см от прежнего места иссечения.
Аналогично в 1991 только в Северной Америке сообщается о более чем 113000 смертных случаях и 238600 новых случаях метастаза печени. Среднее время жизни пациентов с метастазами в печени составляет всего 6,6 месяцев после развития поражений в печени. Нехирургическое лечение метастаза печени включает общую химиотерапию, облучение, химиоэмболизацию, химиотерапию печеночных артерий и внутриартериальное облучение. Однако, несмотря на то, что подобная обработка может временно привести к уменьшению размера поражений печени (в частности, общая химиотерапия и химиотерапия печеночных артерий первоначально уменьшает поражения на 15-20% и 80% соответственно), поражения неизбежно возобновляются. Хирургическое иссечение метастаза печени является единственным возможным способом лечения, однако, эта процедура возможна лишь для 5% пациентов с метастазами и для 15-20% пациентов с первичным раком печени.
Одним из методов, который опробован при лечении опухолей и имел ограниченный успех, является терапевтическая эмболизация. Если коротко, то кровеносные сосуды, которые питают опухоль, преднамеренно блокируют путем введения в сосуды эмболических веществ. С этой целью испытано большое количество материалов, в том числе аутогенных веществ, таких как жир, сгустки крови и измельченные фрагменты мышц, а также искусственные материалы, такие как шерсть, хлопок, стальные шарики, пластиковые или стеклянные шарики, порошок тантала, кремниевые соединения, радиоактивные частицы, стерильный поглощаемый губчатый желатин (Sterispon, Gelfoam), окисленная целлюлоза (Oxycel), стальная спираль, спирт, лиофилизованная твердая мозговая оболочка человека (Lyodura), микрофибриллярный коллаген (Avitene), фибриллы коллагена (Tachotop), губчатый поливиниловый спирт (PVA, Ivalon), импрегнированные барием кремниевые сферы (Biss) и съемные надувные шарики. При использовании указанных методов размер метастаза печени может быть временно уменьшен, однако опухоль отвечает тем, что стимулирует прорастание внутрь нее новых кровеносных сосудов.
Проблемой, связанной с образованием опухоли, является развитие вызванных раком блокад, которые препятствуют прохождению веществ по находящимся внутри организма каналам, таким как желчные протоки, трахея, пищевод, сосудистая система и мочеиспускательный канал. Чтобы держать открытыми проходы, блокированные опухолями или другими веществами, было разработано устройство для реконструкции органов - стент. Примерами обычных стентов являются стеночный стент, стент Штреккера, стент Жиантурко и стент Пальмаца. Основная проблема при использовании стентов заключается, однако, в том, что они не препятствуют проникновению опухоли или воспалительного вещества через щели стента. Если указанные вещества проникают внутрь стента и возникает опасность закупорки отверстия стента, то это может привести к блокаде расположенного внутри тела прохода, в который стент установлен. Далее, присутствие стента внутри организма может привести к тому, что активные или воспалительные ткани (в частности, кровеносные сосуды, фибробласты, белые кровяные тельца) попадают в проход стента, что приводит к частичной или полной закупорке стента.
В настоящем изобретении заявляются композиции и способы, пригодные для лечения рака и других заболеваний, связанных с развитием кровеносных сосудов, которые позволяют решить проблемы, возникшие при использовании вышеуказанных методов, а также предоставляют дополнительные преимущества.
Краткое описание изобретения
Если коротко, то в настоящем изобретении заявляются композиции, подавляющие развитие кровеносных сосудов, а также методы и устройства, в которых указанные композиции используются, для лечения рака и других заболеваний, связанных с развитием кровеносных сосудов. В соответствии с одним из аспектов настоящего изобретения заявляются композиции (далее называемые "композициями, подавляющими развитие кровеносных сосудов"), включающие (а) фактор, препятствующий развитию кровеносных сосудов и (b) полимерный носитель. В рамках настоящего изобретения в качестве факторов, препятствующих развитию кровеносных сосудов, может использоваться широкий круг молекул, в том числе, например, антиинвазивный фактор, ротеновые кислоты и их производные, таксол, аналоги таксола и производные таксола, и члены группы, включающей сурамин, тканевый ингибитор металлопротеиназы-1, тканевый ингибитор металлопротеиназы-2, ингибитор-1 плазминогенного активатора, ингибитор-2 плазминогенного активатора. Аналогично может использоваться широкий круг полимерных носителей, выборочными примерами которых являются поли(этилен-винилацетат), сшитый 40% винилацетата, сополимер молочной и гликолевой кислот, поликапролактон полимолочной кислоты, сополимеры полиэтилена и винилацетата, сшитые 40% винилацетата и молочной кислоты, сополимеры полимолочной кислоты и поликапролактона. В одном из вариантов осуществления настоящего изобретения средний размер частиц композиции составляет от 15 до 200 микрон.
В соответствии с другим аспектом настоящего изобретения заявляются способы эмболизации (закупорки сосудов с лечебной целью) кровеносных сосудов, включающие стадию доставки в сосуд терапевтически эффективного количества вышеописанной композиции, подавляющей развитие кровеносных сосудов, что приводит к эффективной закупорке кровеносного сосуда. В одном из вариантов осуществления настоящего изобретения композиция, подавляющая развитие кровеносных сосудов, вводится в кровеносный сосуд, который питает опухоль.
В соответствии с еще одним аспектом настоящего изобретения, заявляются стенты, имеющие в общем случае трубчатую структуру, а их поверхность покрыта одной или несколькими композициями, подавляющими развитие кровеносных сосудов. В соответствии с другим аспектом настоящего изобретения заявляются способы расширения просветов находящихся внутри организма проходов, которые заключаются в размещении стента внутри прохода, при этом стент имеет в общем случае трубчатую структуру, а его поверхность покрыта вышеуказанной композицией, подавляющей развитие кровеносных сосудов, так что проход расширяется. В рамках различных вариантов осуществления настоящего изобретения заявляются способы устранения закупорки желчных протоков, заключающиеся в размещении желчного стента в желчном протоке; способы устранения закупорки мочеиспускательных каналов, заключающиеся в размещении уретрального стента в мочеиспускательном канале; способы устранения закупорки пищевода, заключающиеся в размещении стента внутри пищевода, и способы устранения закупорки трахеи и бронхов, заключающиеся в размещении трахеально-бронхиального стента внутри трахеи или бронха. В каждом из этих вариантов осуществления настоящего изобретения стент имеет в общем случае трубчатую структуру, а его поверхность покрыта вышеуказанной композицией, подавляющей развитие кровеносных сосудов.
В соответствии с еще одним аспектом настоящего изобретения заявляются способы обработки мест иссечения опухолей, которые заключаются в нанесении вышеуказанной композиции, подавляющей развитие кровеносных сосудов, на границы иссечения опухоли после проведения хирургической операции, так что подавляется местный рецидив рака и образование новых кровеносных сосудов в этом месте. В соответствии с другим аспектом настоящего изобретения заявляются способы устранения образования новых кровеносных сосудов в роговице, заключающиеся во введении в роговицу терапевтически эффективного количества вышеуказанной композиции», подавляющей развитие кровеносных сосудов, так что образование новых кровеносных сосудов подавляется. В одном из вариантов осуществления настоящего изобретения композиция, подавляющая развитие кровеносных сосудов, дополнительно содержит кортикостероидный гормон местного действия.
В соответствии со следующим аспектом настоящего изобретения заявляются способы подавления образования новых кровеносных сосудов у пациентов с неонкогенными заболеваниями, определяемыми развитием кровеносных сосудов, которые заключаются в назначении пациенту с неонкогенными заболеваниями, определяемыми развитием кровеносных сосудов, терапевтически эффективного количества композиции, содержащей таксол, так что подавляется образование новых кровеносных сосудов. В соответствии с другими аспектами настоящего изобретения заявляются способы эмболизации кровеносных сосудов при неонкогенных заболеваниях, определяемых развитием кровеносных сосудов, которые заключаются во введении в кровеносный сосуд терапевтически эффективного количества композиции, содержащей таксол, так что кровеносный сосуд эффективно закупоривается.
В соответствии с еще одним аспектом настоящего изобретения заявляются способы расширения просветов находящихся внутри организма проходов, которые заключаются в размещении стента внутри прохода, при этом стент имеет в общем случае трубчатую структуру, а его поверхность покрыта композицией, содержащей таксол, так что проход расширяется. В рамках различных вариантов осуществления настоящего изобретения заявляются способы устранения закупорки желчных протоков, заключающиеся в размещении желчного стента в желчном протоке; способы устранения закупорки мочеиспускательных каналов, заключающиеся в размещении уретрального стента в мочеиспускательном канале; способы устранения закупорки пищевода, заключающиеся в размещении стента внутри пищевода, и способы устранения закупорки трахеи и бронхов, заключающиеся в размещении трахеально-бронхиального стента внутри трахеи или бронха. В каждом из этих вариантов осуществления настоящего изобретения стент, имеет в общем случае трубчатую структуру, а его поверхность покрыта композицией, содержащей таксол.
В соответствии с еще одним аспектом настоящего изобретения заявляются способы обработки мест иссечения опухолей, которые заключаются в нанесении содержащей таксол композиции на границы иссечения опухоли после проведения операции, так что подавляется местный рецидив рака и образование новых кровеносных сосудов в этом месте. В соответствии с другим аспектом настоящего изобретения заявляются способы устранения образования новых кровеносных сосудов в роговице, заключающиеся во введении в роговицу терапевтически эффективного количества композиции, содержащей таксол, так что образование новых кровеносных сосудов подавляется.
В соответствии с еще одним аспектом настоящего изобретения заявляются фармацевтические средства, включающие (а) таксол в контейнере и (b) размещенное на контейнере извещение, форма которого определяется правительственным учреждением, регулирующим производство, использование и продажу фармацевтических препаратов, и в этом извещении должно быть указано, что таксол разрешен к использованию при лечении неонкогенных заболеваний, связанных с развитием кровеносных сосудов у человека и животных. Если коротко, то Федеральное законодательство требует, чтобы использование фармацевтического средства при лечении людей было разрешено учреждением Федерального правительства. Обязанности по соблюдению законодательства возложены (в Соединенных Штатах) на Комитет по пищевым продуктам и лекарствам, который выпускает соответствующие инструкции, что подробно указано в материалах 21 Конгресса США в параграфах 301-392. Инструкции по использованию биологических веществ, включающих продукты, выделенные из тканей животных, содержатся в материалах 42 конгресса США в параграфе 262. Аналогичные разрешения требуются в большинстве стран, хотя инструкции в каждой стране могут отличаться друг от друга.
Эти и другие аспекты настоящего изобретения более подробно поясняются приведенным далее подробным описанием и прилагаемыми чертежами. Ниже указаны многочисленные ссылки, подробно описывающие некоторые методики и композиции, которые приводятся здесь для справок.
Краткое описание чертежей
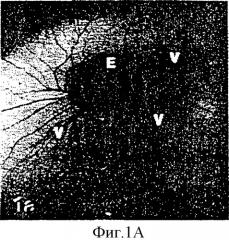
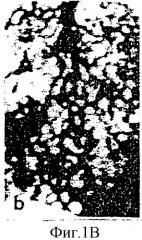
На фиг.1А представлена фотография, на которой изображена культура яйца без оболочки на 6-й день. На фиг.1В приведен после цифровой обработки на компьютере образ живых неокрашенных капилляров, полученный с помощью стереомикроскопа (1040х). На фиг.1С показаны микрососуды хорионалантоисной мембраны, которые питаются нижележащими более крупными сосудами (стрелки, 1300х). На фиг.1D показан разрез хорионалантоисной мембраны толщиной 0,5 мм, наблюдаемый в оптический микроскоп. На этой фотографии приведена композиция хорионалантоисной мембраны, включающая внешний двухслойный эктодерм (Ec), мезодерм (М), содержащий капилляры (стрелки) и разбросанные клетки адвентициальной оболочки, и однослойный эндодерм (En) (400х). Фиг.1Е представляет собой полученную с помощью электронного микроскопа (3500х) фотографию, на которой показана типичная капиллярная структура с тонкостеночными эндотелиальными клетками (острие стрелок) и связанным с ними перицитом.
Фиг.2А, 2 В, 2С и 2D представляют собой серию цифровых образов четырех различных неокрашенных хорионалантоисных мембран, полученные после 48-часового воздействия таксола.
Фиг.3А, 3 В и 3С представляют собой серию фотографий разрезов толщиной 0,5 мм, полученных от обработанных хорионалантоисных мембран в трех различных местах в пределах содержащей сосуды зоны.
Фиг.4А, 4 В и 4С представляют собой серию полученных на электронном микроскопе микрофотографий мест, близких к тем, которые показаны выше на фиг.3А, 3В и 3С (соответственно).
Фиг.5 представляет собой гистограмму, на которой приведено числовое распределение размеров микросфер (5% ELVAX с 10 мг сурамина натрия в 5% поливиниловом спирте).
Фиг.6 представляет собой гистограмму, на которой приведено весовое распределение размеров микросфер (5% ELVAX с 10 мг сурамина натрия в 5% поливиниловом спирте).
На фиг.7 приведен график, на котором показан вес инкапсулированного сурамина натрия в 1 мл 5%-ного ELVAX.
На фиг.8 приведен график, на котором указан процент инкапсулированного сурамина натрия в ELVAX.
На фиг.9 приведена гистограмма распределения размеров 5%-ных микросфер ELVAX, содержащих 10 мг сурамина натрия в 5%-ном поливиниловом спирте, включающем 10% NaCl.
На фиг.10 приведена гистограмма весового распределения размеров 5%-ных микросфер PLL, содержащих 10 мг сурамина натрия в 5%-ном поливиниловом спирте, включающем 10% NaCl.
На фиг.11 приведена гистограмма числового распределения размеров 5%-ных микросфер PLL, содержащих 10 мг сурамина натрия в 5%-ном поливиниловом спирте, включающем 10% NaCl.
Фиг.12 представляет собой график, который показывает количество высвобожденого сурамина натрия в зависимости от времени.
На фиг.13A, B приведен пример эмболизации опухоли печени.
Фиг.14A, B показывает выборочный пример размещения стента, покрытого композицией, подавляющей развитие кровеносных сосудов, по настоящему изобретению.
На фиг.15А приведен график, показывающий влияние отношения сополимер этилена и винилацетата : поли-1-молочная кислота в смеси полимеров на агрегацию микросфер. На фиг.15 В приведена микрофотография, полученная с помощью сканирующего электронного микроскопа, которая показывает размер "маленьких" микросфер. На фиг.15С приведена микрофотография, полученная с помощью сканирующего электронного микроскопа, которая показывает размер "больших" микросфер. На фиг.15D приведен график, который показывает выделение таксола с течением времени из сфер, изготовленных из полимерной смеси 50:50 сополимер этилена и винилацетата : поли-1-молочная кислота и наполненных 0,6%-ным (вес/об) раствором таксола, в забуференный фосфатом солевой физиологический раствор (рН 7,4) при температуре 37°С. Незакрашенные кружки соответствуют микросферам "маленького" размера, а закрашенные кружки соответствуют микросферам "большого" размера. На фиг.15Е приведена фотография хорионалантоисной мембраны, которая показывает результаты высвобождения таксола микросферами (MS). Фиг.15F соответствует фиг.15Е при большем увеличении.
На фиг.16А приведен график, показывающий профили высвобождения таксола из поликапролактоновых (PCL) микросфер, содержащих 1%, 2%, 5% или 10% таксола, в забуференный фосфатом солевой физиологический раствор при температуре 37°С. На фиг.16В представлена фотография, на которой показана хорионалантоисная мембрана, обработанная контрольными микросферами. На фиг.16С представлена фотография, на которой показана хорионалантоисная мембрана, обработанная микросферами, наполненными 5%-ным таксолом.
На фиг.17А и 17В соответственно представлены два графика, на которых показано высвобождение таксола из пленок сополимера этилена и винилацетата (EVA) и процент таксола, остающегося в тех же пленках с течением времени. На фиг.17С показано набухание пленок EVA/F127, не содержащих таксола, с течением времени, на фиг.17D показано набухание пленок EVA/Span 80, не содержащих таксола, с течением времени. На фиг.17Е приведена зависимость напряжения от деформации в различных смесях EVA/F127.
На фиг.18А и 18В приведена зависимость точки плавления полимерных смесей PCL/MePEG в зависимости от процентного содержания (18А) и процент увеличения времени, необходимого, чтобы паста PCL начала затвердевать при температуре 60°С в зависимости от количества MePEG (18В). На фиг.18С показана хрупкость различных полимерных смесей PCL/MePEG. На фиг.18D приведен график, показывающий изменение веса, выраженное в процентах, с течением времени для полимерных смесей с различным содержанием MePEG. На фиг.18Е представлен график, показывающий скорость высвобождения таксола с течением времени из различных полимерных смесей, нагруженных 1% таксола. Графики на фиг.18F и 18G показывают влияние различного содержания таксола на общее количество таксола, высвобождаемого из смеси 20% MePEG/PCL. График, приведенный на фиг.18Н, показывает влияние MePEG на прочность полимеров MePEG/PCL при пластической деформации.
На фиг.19А приведена фотография контрольной термопасты (ненагруженной) на хорионалантоисной мембране. На фиг.19 В приведена фотография термопасты, содержащей 20% таксола, на хорионалантоисной мембране.
Фиг.20А и 20В показывают две фотографии хорионалантоисной мембраны, содержащей опухоль, обработанную контрольной (ненагруженной) термопастой. Фиг.20С и 20D показывают две фотографии хорионалантоисной мембраны, содержащей опухоль, обработанную нагруженной таксолом термопастой.
График на фиг.21А показывает влияние таксола на поликапролактоне на рост опухоли. На фиг.21В и 21С приведены две фотографии, показывающие влияние контрольной термопасты и термопасты, содержащей 10% и 20% таксола, на рост опухоли.
На фиг.22А представлена фотография синовиальной мембраны из сустава после инъекции забуференного фосфатом солевого раствора. На фиг.22В представлена фотография синовиальной мембраны из сустава после инъекции микросфер. На фиг.22С представлена фотография хряща из сустава после инъекции забуференного фосфатом солевого раствора, а на фиг.22D представлена фотография хряща из сустава после инъекции микросфер.
Подробное описание изобретения
Как указано ранее, в настоящем изобретении заявляются способы и композиции, в которых используются факторы, подавляющие развитие кровеносных сосудов. Следует понимать, что в контексте настоящего изобретения под факторами, подавляющими развитие кровеносных сосудов, подразумеваются белковые, пептидные, химические или другие молекулы, действие которых приводит к ингибированию роста сосудов. Существует множество простых способов определения подавляющей развитие кровеносных сосудов активности данного фактора, в том числе, например, анализы с хорионалантоисной мембраной (САМ) цыплят, как показано ниже, в Примерах 2А и 2С, удаляют оболочку у свежеоплодотворенных куриных яиц и на мембрану помещают диск из метилцеллюлозы, содержащий образец фактора, подавляющего развитие кровеносных сосудов. Через несколько дней (в частности, через 48 час) ингибирование роста сосудов под действием испытуемого образца может быть легко замечено путем визуального изучения хорионалантоисной мембраны в области, окружающей диск из метилцеллюлозы. Ингибирование роста сосудов можно также оценить количественно, например, определяя количество и размер кровеносных сосудов, окружающих диск из метилцеллюлозы, по сравнению с контрольным диском из метилцеллюлозы. Наиболее предпочтительные факторы, подавляющие развитие кровеносных сосудов, пригодные для использования по настоящему изобретению, полностью подавляют образование новых кровеносных сосудов в указанном выше анализе.
Кроме того, может быть использовано множество способов определения в условиях in vivo эффективности факторов, подавляющих развитие кровеносных сосудов, в том числе, например, в мышиных моделях, которые были разработаны с этой целью (см. Roberston et al., Cancer. Res. 51:1339-1344, 1991). Кроме того, множество примеров анализов в условиях in vivo, относящихся к описываемым различным аспектам настоящего изобретения, более подробно рассматривается далее в Примерах 5-7 и 17-19.
Как указано ранее, в настоящем изобретении заявляются композиции, содержащие фактор, подавляющий развитие кровеносных сосудов, и полимерный носитель. Если коротко, то в соответствии с настоящим изобретением может использоваться множество факторов, подавляющих развитие кровеносных сосудов. Отдельные примеры включают антиинвазивный фактор, ретеновую кислоту и ее производные, таксол и члены группы, включающей сурамин, тканевый ингибитор металлопротеиназы-1, тканевый ингибитор металлопротеиназы-2, ингибитор-1 плазминогенового активатора, ингибитор-2 плазминогенового активатора. Эти и другие факторы, подавляющие развитие кровеносных сосудов, будут подробнее рассмотрены далее.
Если коротко, то антиинвазивный фактор, или AIF, который получают из экстрактов хрящей, как известно, содержит компоненты, которые отвечают за подавление роста новых кровеносных сосудов. Эти компоненты включают семейство из семи низкомолекулярных белков (<50000 дальтон) (Kuettner and Pauli, "Inhibition of neovascularization by cartilage factor" in: Development of the Vascular System, Pitman Books (Ciba Foundation Symposium 100), pp.163-173, 1983), в том числе различные белки, которые оказывают ингибирующее действие на различные протеиназы (Eisentein et al., Am. J. Pathol. 81: 337-346, 1975; Langer et al., Science 193: 70-72, 1976; Horton et al., Science 199: 1342-1345, 1978). Антиинвазивный фактор, пригодный для использования по настоящему изобретению, может быть легко получен по методам, известным из области техники (в частности, Eisentein et al., см. ранее, Kuettner and Pauli, см. ранее, и Langer et al., см. ранее). Очищенные компоненты антиинвазивного фактора, такие как выделенный из хряща ингибитор (GDI) (см. Moses et al., Science 248: 1408-1410, 1990), также могут быть легко получены и использоваться в соответствии с настоящим изобретением.
Ретеновые кислоты изменяют метаболизм внеклеточных компонентов матрицы, что приводит к подавлению развития кровеносных сосудов. Добавка аналогов пролина, подавляющих кровотечение стероидов или гепарина, может использоваться с целью синергического увеличения воздействия трансретеновой кислоты на подавление развития кровеносных сосудов. Ретеновая кислота или ее производные, которые также могут использоваться в соответствии с настоящим изобретением, могут быть легко получены из промышленных источников, в том числе из компании "Sigma Chemical Co." (No. R2625).
Таксол представляет собой содержащий большое количество заместителей дитерпеноид (Wani et ai., J. Am. Chem. Soc., 93: 2325, 1971), который получают после сбора и высушивания коры Taxus brevifolia (тиса тихоокеанского) и из Taxomyces Andreanae и Endophytic Fungus. (Stierle et al., Science 60: 214-216, 1993). В общем случае действие таксола приводит к стабилизации микротрубчатой структуры сосудов за счет присоединения тубулина с образованием ненормальных митотических веретен. Таксол (в контексте настоящего изобретения следует понимать, что этот термин включает аналоги и производные таксола, такие как, например, баккатин и таксотер) может быть легко получен с использованием методов, известных специалистам в данной области техники (см. также Международные заявки WO 94/07882, WO 94/07881, WO 94/07880, WO 94/07876, WO 93/23555, WO 93/10076, Патенты США с номерами 5294637, 5283253, 5279949, 5274137, 5202448, 5200534 и Европейскую патентную заявку 590267), или от различных промышленных источников, в том числе, например, компании "Sigma Chemical Co." (Сент-Луис, штат Миссури) (Т7402 - из Taxus brevifolia).
Сурамин представляет собой полисульфонированное производное нафтилмочевины, которое обычно применяют в качестве средства, уничтожающего трипаносом. Если коротко, то сурамин блокирует специфическое связывание поверхности клетки различными факторами роста, такими как фактор роста, полученный из тромбоцитов (PDGF), фактор роста эпидермиса (EGF), трансформирующий фактор роста (TGF-β), инсулиноподобный фактор роста (IGF-l) и фактор роста фибробластов (βFGF). Сурамин можно получить в соответствии с известными методиками или легко приобрести из различных промышленных источников, в том числе, например, из компании "Mobay Chemical Со." (Нью-Йорк) (см. Gagliardi et al., Canver Res. 52: 5073-5075, 1992, и Coifey, Jr., et al., J. of Cell. Phys. 132: 143-148, 1987).
Тканевый ингибитор металлопротеиназы-1 (TIMP) секретируется клетками эндотелия, которые секретируют также МТРазы. TIMP является гликозилированным и имеет молекулярный вес, равный 28,5 кДа. TIMP-1 регулирует развитие кровеносных сосудов путем присоединения к активированной металлопротеиназе, подавляя тем самым инвазию кровеносных сосудов во внеклеточную матрицу, для подавления развития кровеносных сосудов может также использоваться тканевый ингибитор металлопротеиназы-2 (TIMP-2). Если коротко, то TIMP-2 представляет собой негликозилированный белок весом 21 кДа, который присоединяется к протеиназе как в активной, так и латентной, проферментной форме, как TIMP-1, так и TIMP-2 могут быть получены из промышленных источников, таких как компания "Synergen" (Боулдер, штат Колорадо).
Ингибитор-1 плазминогенового активатора (РА) представляет собой гликопротеин весом 50 кДа, который присутствует в тромбоцитах, а также может синтезироваться клетками эндотелия и клетками мышц. Ингибитор-1 плазминогенового активатора ингибирует t-PA и плазминогеновый активатор урокиназы в базолатеральном месте эндотелия и дополнительно регулирует процесс фибринолиза. Ингибитор-2 плазминогенового активатора обычно обнаруживается в крови лишь при определенных обстоятельствах, таких как беременность, а также в случае опухолей. Если коротко, то ингибитор-2 плазминогенового активатора представляет собой белок с весом 56 кДа, который секретируется моноцитами и макрофагами, полагают, что он регулирует фибринолитическую активность, в частности ингибирует плазминогеновый активатор урокиназы и тканевый плазминогеновый активатор, тем самым препятствуя фибринолизу.
В соответствии с настоящим изобретением может использоваться большое разнообразие других факторов, подавляющих развитие кровеносных сосудов. Отдельными примерами являются фактор 4 тромбоцитов ("Sigma Chemical Co.", No. F1385), сульфат протамина (клупеин) ("Sigma Chemical Co.", No. P4505), сульфированные производные хитина (получают из оболочки самки краба) ("Sigma Chemical Co.", No. C3641; Murata et. al., Cancer Res. 51: 22-26, 1991); сульфированный полисахаридный пептидогликановый комплекс (SP-PG) (функции этого соединения могут быть усилены в присутствии стероидов, таких как эстроген и цитрат тамоксифена); ставроспорин ("Sigma Chemical Co.", No. S4400); модуляторы метаболизма матрицы, в том числе, например, аналоги пролина {[(L-азетидин-2-карбоновая кислота (LACA) ("Sigma Chemical Co.", No. AО760)), цисгидроксипролин, d,L-3,4-дегидропролин ("Sigma Chemical Co.", No. D0265); тиапролин ("Sigma Chemical Co.", No. Т0631)], альфа,альфа-дипиридил ("Sigma Chemical Co.", No. D7505), фумарат бета-аминопропионитрила ("Sigma Chemical Co.", No. A3134)]}; MDL 27032 (4-пропил-5-(4-пиридинил)-2(3Н)-оксазолон; "Merion Merrel Dow Research Institute), метотрексат ("Sigma Chemical Co.", No. A6770; Hirata et al., Arthritis arid Rheumatism 32: 1065-1073, 1989); митоксантрон (Polverini and Novak, Biochem. Biophys. Res. Comm. 140: 901-907); гепарин (Folkman, Bio. Phar. 34:905-909, 1985; "Sigma Chemical Co.", No. P8754); интерфероны (в частности, ("Sigma Chemical Co.", No. 13265); 2 макроглобулиновая сыворотка (" Sigma Chemical Co.", No. M7151); ChIMP-3 (Pavloff et al., J. Bio. Chem. 267: 17321-17326, 1992); химостатин ("Sigma Chemical Co.", No. C7268; Tomkinson et ai., Biochem. J. 286: 475-480, 1992); тетрадесульфат бета-циклодекстрина ("Sigma Chemical Co.", No. C4767); эпонемицин; эстрамустин (получают из компании "Sigma", Wang and Stearns, Cancer Res., 48: 6262-6271, 1988); фумагиллин ("Sigma Chemical Co.", No. F6771; Патент Канады 2024306; Ingber et al., Nature 348: 555-557, 1990); тиомалат золота-натрия ("Sigma Chemical Co.", No. G4022; Matsubara and Ziff: J. Ciin. Invest. 79: 1440-1446, 1987); D-пеницилламин ("Sigma Chemical Co.", No.P4875 или P5000(HCl)); бета-1-антиколлагеназовая сыворотка, альфа-2-антиплазмин ("Sigma Chemical Co.", No.AO914; Holmes et al., J. Biol. Chem. 262(4): 1659-1664, 1987); бизантрен (Национальный институт рака); динатриевая соль лобензарита (динатриевая соль N-(2)-карбоксифенил-4-хлорантраниловой кислоты; Takeuchi et al., Agents Actions 36: 312-316, 1992); талидомид, подавляющий развитие кровеносных сосудов стероид, AGM-1470, карбоксиаминолмидазол, ингибиторы металлопротеиназы, такие как ВВ94 и пептид CDPGYIGSR-NH2 (последовательность с номером идентификации 1) ("Iwaki Glass", Токио, Япония).
Композиции по настоящему изобретению, подавляющие развитие кровеносных сосудов, помимо фактора, ингибирующего развитие кровеносных сосудов, и полимерного носителя, могут дополнительно включать широкий круг соединений. Например, композиции, подавляющие развитие кровеносных сосудов, по настоящему изобретению в некоторых вариантах его осуществления могут также содержать один или большее количество антибиотиков, антивоспалительных средств, антивирусных средств, антигрибковых средств и/или средств, убивающих простейших. Отдельными примерами антибиотиков, которые включаются в приведенные в настоящем описании композиции, являются пенициллины; цефаллоспорины, такие как цефадроксил, цефазолин, цефаклор; аминогликозиды, такие как гентамицин и тобрамицин; сульфонамиды, такие как сульфаметоксазол, и метронидазол. Отдельными примерами антнвоспалптельных средств являются: стеронды, такие как преднизон, преднизолон, гидрокортизон, адренокортикотропный гормон и сульфазалазин, и нестероидные антивоспалительные средства, такие как аспирин, ибупрофен, напроксен, фенопорфен, индометацин и фенилбутазон. Отдельными примерами антивирусных средств являются ацикловир, ганцикловир, зидовудин. Отдельными примерами антигрибковых средств являются нистатин, кетоконазол, гризеофульвин, флуцитозин, миконазол, клотримазол. Отдельными примерами средств, убивающих простейших, являются изетионат пентамидина, хинин, хлорхинин и мефлохин.
Композиции по настоящему изобрет