Способ получения l-аминокислот с использованием бактерий, принадлежащих к роду escherichia
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ получения L-аминокислот, таких как L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин или L-глутаминовая кислота, с использованием бактерии рода Escherichia, причем бактерия модифицирована таким образом, что активность пермеазы D-ксилозы в указанной бактерии повышена. Изобретение позволяет получать L-аминокислоты с высокой степенью эффективности. 2 н. и 23 з.п. ф-лы, 2 ил, 4 табл.
Реферат
Область техники.
Настоящее изобретение относится к способу получения L-аминокислоты с помощью ферментации, более конкретно к генам, которые способствуют указанной ферментации. Эти гены положительно влияют на продукцию L-аминокислоты, например на продукцию L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина и L-глутаминовой кислоты.
Предшествующий уровень техники.
Традиционно в промышленных масштабах L-аминокислоты получают с помощью ферментации штаммов микроорганизмов, полученных из природных источников, или мутантов этих микроорганизмов. Обычно эти микроорганизмы являются модифицированными таким образом, что выход L-аминокислот у этих штаммов повышается.
Описано множество способов повышения продукции L-аминокислот, включая трансформацию микроорганизмов рекомбинантной ДНК (смотри, например, патент США 4,278,765). Другие способы повышения продуктивности микроорганизмов включают в себя повышение активностей ферментов, участвующих в биосинтезе аминокислоты, и/или уменьшение чувствительности целевого фермента к обратному ингибированию накапливаемой L-аминокислотой по типу обратной связи (смотри, например, WO 95/16042 или патент США 4346170, 5661012 и 6040160).
Известны различные штаммы, использующиеся для производства L-треонина методом ферментации. Это штаммы с увеличенными активностями ферментов, вовлеченных в биосинтез L-треонина (патенты США 5175107; 5661012; 5705371 и 5939307; Европейский патент 219027), штаммы, устойчивые к некоторым химических реагентам, таким как L-треонин и его аналоги (заявка РСТ 01/14525 А1, Европейская заявка 301572А2, патент США 5,661,012), штаммы, в которых устранена чувствительность целевого фермента к ингибированию продуцируемой аминокислотой или ее побочными продуктами по типу обратной связи (патенты США 5175107 и 5661012), штаммы с инактивированными ферментами системы деградации треонина (патенты США 5939307 и 6297031).
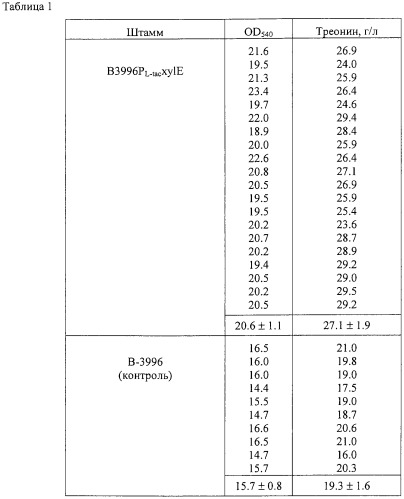
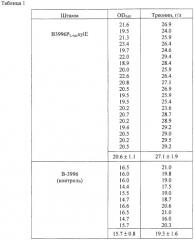
Известный штамм-продуцент треонина ВКПМ В-3996 (патенты США 5175107 и 5705371) в настоящее время является одним из лучших продуцентов треонина. Для создания штамма ВКПМ В-3996 несколько мутаций и плазмида, описанная ниже, были введены в родительский штамм Е.coli К-12 (ВКПМ В-7). Мутантный ген thrA (мутация thrA442) кодирует белок аспартокиназагомосериндегидрогеназу I, который устойчив к ингибированию треонином по типу обратной связи. Мутантный ген ilvA (мутация ilvA442) кодирует белок треониндеаминазу, обладающую пониженной активностью, которая выражается в пониженном уровне биосинтеза изолейцина и в фенотипе с недостатком по изолейцину типа "leaky". В бактерии с мутацией ilvA442 транскрипция оперона thrABC не репрессируется изолейцином, что является очень эффективным при продукции треонина. Инактивация гена tdh, кодирующего треониндегидрогеназу, приводит к предотвращению деградации треонина. В указанный штамм была введена генетическая детерминанта ассимиляции сахарозы (гены scrKYABR). Для увеличения экспрессии генов, контролирующих биосинтез треонина, в промежуточный штамм TDH6 была введена плазмида pVIC40, содержащая мутантный треониновый оперон thrA442BC. Количество треонина, накопленного в ходе ферментации этого штамма, достигало 85 г/л.
Для оптимизации основных путей биосинтеза целевого соединения дальнейшее совершенствование штаммов-продуцентов L-аминокислот может быть произведено благодаря усилению снабжения бактерии возрастающими количествами сахаров, служащих источником углерода, например глюкозой. Несмотря на эффективный PTS транспорт глюкозы, доступность источников углерода для клеток высокопродуктивного штамма может оставаться недостаточной.
Известно, что активный транспорт сахаров и других метаболитов в бактериальную клетку осуществляется несколькими транспортными системами.
В том числе, белок XylE из Е.coli является пермеазой D-ксилозы, одной из двух систем в Е.coli, ответственных за поступление D-ксилозы в клетку; другая система - это АТФ-зависимый АВС транспортер XylFGH. Было показано, что клонированный ген xylE комплементирует мутацию xylE in vivo (Davis E.O. and Henderson P.J., J. Biol. Chem., 262(29); 13928-32 (1987)). Транспорт, осуществляемый посредством XylE в интактной клетке, ингибируется протонофорами и вызывает смещение рН в сторону защелачивания (Lam, V.M. et al., J. Bacteriol. 143(1); 396-402 (1980)). Эксперименты с мутантами xylE и xylF показали, что у белка XylE KM к D-ксилозе равна 63-169 мкМ (Sumiya. M. et al. Receptors Channels, 3(2); 117-28 (1995)). Белок XylE является членом суперсемейства транспортеров Major Facilitator Superfamily (MFS) (Griffith, J.K. et al., Curr. Opin. Cell Biol. 4(4); 684-95 (1992)) и функционирует как симпортер D-ксилозы/протона. Возможно, ген xylE является частью моноцистроного оперона, экспрессия которого индуцируется D-ксилозой. Импортированная в клетку ксилоза катаболизируется до ксилулозо-5-фосфата при участии ферментов XylA (ксилозоизомеразы) и XylB (ксилулокиназы). При определенных условиях, ксилозоизомераза, кодируемая геном xylA, также способна к эффективному катализу реакции превращения D-глюкозы в D-фруктозу (Wovcha, M.G. et al., Appl Environ Microbiol. 45(4): 1402-4 (1983)).
Однако к настоящему времени нет сообщений об использовании бактерии семейства Enterobacteriaceae, обладающей повышенной активностью пермеазы D-ксилозы для увеличения продукции L-аминокислот.
Краткое описание чертежей
На фиг.1 показана структура нуклеотидной последовательности перед геном xylE на хромосоме Е.coli и структура интегрированного фрагмента ДНК, содержащего ген cat и гибридный промотор PL-tac.
На фиг.2 показаны кривые роста штаммов Е.coli MG1655, MG1655 ΔptsHI-crr и MG1655PL-tacxylE, выращиваемых на среде с глюкозой. Условные обозначения: MG=Е.coli MG1655; MG Δpts=Е.coli MG1655 ΔptsHI-crr; MG Δpts P xylE=Е.coli MG1655 ΔptsHI-crr PL-tacxylE.
Описание изобретения
Целью настоящего изобретения является повышение продуктивности штаммов-продуцентов L-аминокислоты и предоставление способа получения неароматических или ароматических L-аминокислот с использованием указанных штаммов.
Данная цель была достигнута путем обнаружения того факта, что увеличение экспрессии гена xylE, кодирующего пермеазу D-ксилозы, повышает продукцию L-аминокислоты, например L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина или L-глутаминовой кислоты. Таким образом, было совершено настоящее изобретение.
Целью настоящего изобретения является предоставление бактерии-продуцента L-аминокислоты семейства Enterobacteriaceae, где указанная бактерия модифицирована таким образом, что активность пермеазы D-ксилозы в клетках указанной бактерии повышена. Также целью настоящего изобретения является создание описанной выше бактерии, где активность указанной пермеазы D-ксилозы повышена за счет усиления экспрессии гена, кодирующего пермеазу D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где активность указанной пермеазы D-ксилозы повышена за счет модификации последовательности, контролирующей экспрессию гена, кодирующего пермеазу D-ксилозы таким образом, что экспрессия указанного гена усилена или увеличено количество копий гена, кодирующего пермеазу D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия дополнительно модифицирована таким образом, что активность глюкокиназы в клетках этой бактерии повышена.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия дополнительно модифицирована таким образом, что активность изомеразы ксилозы в клетках этой бактерии повышена.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия модифицирована таким образом, что в клетках этой бактерии усилена экспрессия локуса xylABFGHR.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия выбрана из группы, состоящей из родов Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Providencia, Salmonella, Serratia, Shigella и Morganella.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанный ген кодирует пермеазу D-ксилозы, выбранную из группы, состоящей из:
(A) белка, включающего в себя аминокислотную последовательность, представленную в Списке последовательностей под номером 2 (SEQ ID NO:2);
(B) вариант белка с аминокислотной последовательностью, представленной в Списке последовательностей под номером 2 (SEQ ID NO:2), который обладает активностью пермеазы D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанный ген, кодирующий пермеазу D-ксилозы включает в себя ДНК, выбранную из группы, состоящей из:
(a) ДНК, включающей в себя последовательность нуклеотидов с нуклеотидом 1 по нуклеотид 1476, представленную в Списке последовательностей под номером 1 (SEQ ID NO:1);
(b) ДНК, которая гибридизуется с последовательностью нуклеотидов с нуклеотидом 1 по нуклеотид 1476, представленной в Списке последовательностей под номером 1 (SEQ ID NO:1), или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, в жестких условиях и кодирует белок, обладающий активностью пермеазы D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанные жесткие условия включают в себя такие условия, при которых said отмывание производится при 60°С в течение 15 минут при концентрации солей 1×SSC и 0.1% SDS.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-треонина.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия дополнительно модифицирована таким образом, что повышена экспрессия гена, выбранного из группы, состоящей из:
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, кодирующего предполагаемый трансмембранный белок;
- любой комбинации вышеуказанных генов.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия модифицирована таким образом, что экспрессия указанного мутантного гена thrA, указанного гена thrB, указанного гена thrC и указанного гена rhtA в этой бактерии повысилась.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-лизина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-гистидина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-фенилаланина.
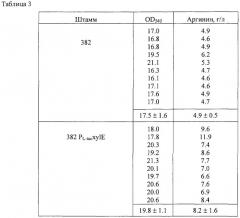
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-аргинина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-глутаминовой кислоты.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, который включает в себя выращивание описанной выше бактерии в ферментационной среде, что позволяет накапливать указанную L-аминокислоту в культуральной жидкости, а также выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление описанного выше способа, где питательная среда содержит ксилозу.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-треонином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-лизином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-гистидином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-фенилаланином.
Также целью настоящего изобретения является предоставление описанного выше метода, где L-аминокислота является L-аргинином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-глутаминовой кислотой.
Наилучший способ осуществления изобретения.
Согласно настоящему изобретению «бактерия - продуцент L-аминокислоты» означает бактерию, обладающую способностью к накоплению L-аминокислоты в питательной среде, в условиях, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Способность к продукции L-аминокислоты может быть придана или улучшена путем селекции. Используемый здесь термин «бактерия-продуцент L-аминокислоты» также означает бактерию, которая способна к продукции L-аминокислоты и вызывает накопление L-аминокислоты в ферментационной среде в больших количествах, по сравнению с природным или родительским штаммом Е.coli, таким как штамм Е.coli К-12 и предпочтительно обозначает микроорганизм, способный накапливать в среде целевую L-аминокислоту в количествах, не меньше, чем 0.5 г/л, более предпочтительно не менее чем 1.0 г/л целевой L-аминокислоты. "L-аминокислоты" включают в себя L-аланин, L-аргинин, L-аспарагин, L-аспартат, L-цистеин, L-глутаминовая кислота, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин. L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин и L-глутаминовая кислота более предпочтительны.
Семейство Enterobacteriaceae включает в себя бактерии, принадлежащие к родам Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и т.д. В частности, могут быть использованы бакетрии, классифицированные как относящиеся к семейству Enterobacteriaceae в соответствии с таксономической классификацией, приведенной в базе данных NCBI (Национальный Центр Биотехнологической Информации) (http://www.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Бактерия, принадлежащая к родам Escherichia или Pantoea, предпочтительна. Термин «бактерия, принадлежащая к роду Escherichia» означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в их число согласно настоящему изобретению.
Термин "бактерия, принадлежащая к роду Pantoea" означает, что бактерия относится к роду Pantoea в соответствии с классификацией, известной специалисту в области микробиологии. На основе анализа нуклеотидной последовательности 16S рРНК и т.д. некоторые виды Enterobacter agglomerans недавно были классифицированы как Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или подобны им (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Бактерия согласно настоящему изобретению включает в себя штамм семейства Enterobacteriaceae, обладающий способностью к продукции L-аминокислоты и который был модифицирован таким образом, что активность пермеазы D-ксилозы повышена. Кроме того, бактерия согласно настоящему изобретению включает в себя штамм бактерии семейства Enterobacteriaceae, который обладает способностью к продукции L-аминокислоты и не имеет природной активности пермеазы D-ксилозы и который трансформирован фрагментом ДНК, кодирующим пермеазу D-ксилозы.
Термин "активность пермеазы D-ксилозы" обозначает активность по транспорту сахаров, таких как ксилоза и глюкоза, в клетку. Активность пермеазы D-ксилозы может быть определена по комплементации задержки роста у бактерий с разрушенной PTS-системой транспорта сахаров (смотри, например, мутант ΔptsHI-crr, описанный в разделе Примеры) или по комплементации мутаций xylE in vivo (Davis, E.O. and Henderson, P.J., J. Biol. Chem., 262(29); 13928-32 (1987)).
Термин "бактерия модифицирована таким образом, что активность пермеазы D-ксилозы повышена" означает, что указанная удельная активность выше, чем эта же активность у немодифицированного, например у природного, штамма. Примеры такой модификации включают в себя увеличение количества молекул пермеазы D-ксилозы на клетку, повышение специфической активности в пересчете на молекулу пермеазы D-ксилозы, и так далее. Кроме того, примеры природного штамма, который можно использовать для сравнения, включают, например, штамм Escherichia coli К-12. В настоящем изобретении количество накопленной L-аминокислоты, например L-треонина или L-аргинина, может быть повышено в культуральной жидкости в результате повышения внутриклеточной активности пермеазы D-ксилозы.
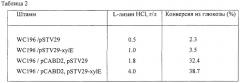
Повышение активности пермеазы D-ксилозы в бактериальной клетке может быть достигнуто за счет усиления экспрессии гена xylE, кодирующего пермеазу D-ксилозы. Любой ген xylE, полученный из бактерий, принадлежащих к роду Escherichia, как и любой ген xylE, полученный из других бактерий, таких как коринеформные бактерии, может быть использован как ген пермеазы D-ксилозы согласно настоящему изобретению. Гены xylE, полученные из бактерий, принадлежащих к роду Escherichia, предпочтительны.
Термин "усиление экспрессии гена" обозначает, что экспрессируемое количество данного гена выше по сравнению с экспрессией данного гена в немодифицированном, например природном, штамме. Примеры такой модификации включают повышение количества копий экспрессируемого гена в пересчете на клетку, повышение уровня экспрессии этого гена и так далее. Количество копий экспрессируемого гена измеряется, например, разрезанием хромосомной ДНК с последующей гибридизацией по Саузерну с использованием зонда, полученного на основе нуклеотидной последовательности данного гена, флуоресцентной гибридизацией in situ (FISH) и подобными им. Уровень экспрессии гена может быть измерен с помощью различных способов, включая гибридизацию по Нозерну, количественный обратный ПЦР (RT-PCR) и подобные им. Кроме того, примеры природного штамма, который может использоваться в качестве контроля, включают, например, штамм Escherichia coli К-12 или Pantoea ananatis PERM ВР-6614 (патентная заявка США US 2004180404 A1). Штамм Pantoea ananatis FERM ВР-6614 был депонирован в Национальном институте бионауки и человеческих технологий (National Institute of Bioscience and Human-Technology) Агентства по промышленной науке и технологиям (Agency of Industrial Science and Technology) Министерства международной торговли и промышленности (Ministry of International Trade and Industry) (в настоящее время, Международный депозитарий патентных организмов Национального института прогрессивной промышленной науки и технологии - International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology) 19 февраля 1998 г. под инвентарным номером FERM P-16644. Затем штамм был переведен на международное депонирование в соответствии с Будапештским договором 11 января 1999 под инвентарным номером FERM ВР-6614. Хотя указанный штамм на момент его выделения описан как Enterobacter agglomerans, он был переклассифицирован в Pantoea ananatis на основании анализа нуклеотидной последовательности 16S rRNA, как описано выше.
В результате повышения внутриклеточной активности пермеазы D-ксилозы повышается накопление в среде L-аминокислоты, например L-треонина, L-лизина, L-гистидина, L-фенилаланина или L-глутаминовой кислоты.
Нуклеотидная последовательность гена xylE, кодирующего пермеазу D-ксилозы, а именно D-ксилоза/протон симпортер из Escherichia coli, приведена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нуклеотидов с 4240277 по 4238802). Ген xylE расположен на хромосоме штамма Е.coli К-12 между открытой рамкой считывания yjbA ORF и геном malG. Нуклеотидные последовательности других генов xylE, кодирующих пермеазы D-ксилозы, также приведены в базе данных GenBank под номерами AAN45595. xylose-proton sym...[gi:24054686], ААМ41050. MFS transporter...[gi:21112853]: Xanthomonas campestris: XCC1759. В описании настоящего изобретения нуклеотидная последовательность гена xylE из Escherichia coli представлена в Списке последовательностей под номером 1 (SEQ ID NO.1).
При транспорте в клетку глюкоза фосфорилируется с помощью глюкокиназы, кодируемой геном glk. Следовательно, желательно модифицировать бактерию таким образом, чтобы активность глюкокиназы в клетках указанной бактерии была повышена. Нуклеотидная последовательность гена glk, который кодирует глюкокиназу из Escherichia coli, приведена в базе данных GenBank в последовательности с инвентарным номером NC_000913.1, gi:16127994 (номера нуклеотидов с 2506481 по 2507446). Ген glk расположен на хромосоме штамма Е.coli К-12 между открытыми рамками считывания b2387 и b2389 ORF.
В определенных условиях изомераза ксилозы, кодируемая геном xylA, также эффективно катализирует превращение D-глюкозы в D-фруктозу (Wovcha, M.G. et al., Appl Environ Microbiol. 45(4): 1402-4 (1983)). Следовательно, желательно модифицировать бактерию таким образом, чтобы активность изомеразы ксилозы в клетках указанной бактерии была повышена. Нуклеотидная последовательность гена xylA, который кодирует изомеразу ксилозы из Escherichia coli, приведена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нуклеотидов с 3728788 по 3727466). Ген xylA расположен на хромосоме штамма Е.coli К-12 между генами xylB и xylF.
В случае, когда питательная среда в качестве дополнительного источника содержит ксилозу, необходимо увеличить активность ферментов утилизации ксилозы. Термин «ферменты утилизации ксилозы» включает белки транспорта ксилозы, ферменты изомеризации и фосфорилирования ксилозы, а также регуляторные белки. Такие ферменты включают изомеразу ксилозы, ксилулокиназу, транспортеры ксилозы и транскрипционные активаторы, реагирующие на присутствие ксилозы. Изомераза ксилозы катализирует реакцию изомеризации D-ксилозы в D-ксилулозу. Ксилулокиназа катализирует реакцию фосфорилирования D-ксилулозы с помощью АТФ с образованием D-ксилулозо-5-фосфата и АДФ. Присутствие активности ферментов утилизации ксилозы, таких как изомераза ксилозы и ксилулокиназа, определяется по комплементации соответствующих минус-мутаций в изомеразе ксилозы и ксилулокиназе в мутантных штаммах Е.coli, соответственно.
Гены, кодирующие вышеуказанные ферменты утилизации ксилозы расположены в локусе xylABFGHR в хромосоме Escherichia coli. Ген, кодирующий ксилулокиназу (ЕС numbers 2.7.1.17), известен и обозначен как xylB (номера нуклеотидов с 3725546 по 3727000 в последовательности с номером NC_000913.1, gi:16131435 в базе данных GenBank). Ген, кодирующий белок связывания ксилозы системы транспорта, известен и обозначен как xylF (номера нуклеотидов с 3728760 по 3729752 в последовательности с номером NC_000913.1, gi:16131437 в базе данных GenBank). Ген, кодирующий предположительно АТФ-связывающий белок системы транспорта ксилозы, известен и обозначен как xylG (номера нуклеотидов с 3729830 по 3731371 в последовательности с номером NC_000913.1, gi:16131438 в базе данных GenBank). Ген, кодирующий компонент пермеазы в системе транспорта ксилозы типа АВС, известен и обозначен как xylH (номера нуклеотидов с 3731349 по 3732530 в последовательности с номером NC_000913.1, gi:16131439 в базе данных GenBank). Ген, кодирующий транскрипционный регулятор оперона xyl, известен и обозначен как xylR (номера нуклеотидов с 3732608 по 3733786 в последовательности с номером NC_000913.1, gi:16131440 в базе данных GenBank).
Таким образом, гены xylE, glk и локуса xylABFGHR могут быть получены с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)), с использованием праймеров, синтезированных на основе известных нуклеотидных последовательностей генов. Гены, кодирующие пермеазу D-ксилозы из других микроорганизмов могут быть получены сходным образом.
Ген xylE, полученный из Escherichia coli, представлен ДНК, которая кодирует следующий белок (А) или (В):
(А) белок, включающий в себя аминокислотную последовательность, представленную в Списке последовательностей под номером 2 (SEQ ID NO:2);
(В) вариант белка с аминокислотной последовательностью, представленной в Списке последовательностей под номером 2 (SEQ ID NO:2), и который обладает активностью пермеазы D-ксилозы.
Используемый в настоящем изобретении термин "вариант белка" обозначает белок с изменениями в его последовательности, которые могут быть делециями, вставками, добавлениями нуклеотидов или заменами аминокислот, но при этом сохраняет желаемую активность на необходимом уровне, например необходимом для повышения продукции L-аминокислоты. Количество изменений в варианте белка зависит от вида аминокислотного остатка или от положения в трехмерной структуре данного белка. Это количество может составлять от 2 до 30, предпочтительно от 2 до 15, и еще более предпочтительно от 2 до 5 для белка (А). Эти замены в вариантах белка могут происходить в областях данного белка, не являющихся критичными для функционирования этого белка. Это связано с тем, что некоторые аминокислоты обладают высокой гомологией друг к другу, и трехмерная структура белка и его активность не изменяются в результате такой замены. Такие замены в варианте белка могут происходить в областях данного белка, не являющихся критичными для функционирования этого белка. Таким образом, вариантом белка (В) может являться белок, обладающий гомологией не менее 70%, предпочтительно 80%, более предпочтительно 90% и еще более предпочтительно 95% по отношению к полной аминокислотной последовательности пермеазы D-ксилозы, приведенной в Списке последовательностей под номером 2 (SEQ ID NO.2), до тех пор, пока измеряется активность пермеазы D-ксилозы. Степень гомологии между двумя аминокислотными последовательностями может быть определена с помощью известных методов, например с помощью компьютерной программы BLAST 2.0, которая просчитывает следующие три параметра: счет (score), идентичность (identity) и схожесть (similarity).
ДНК, которая кодирует практически такой же белок, как описанная выше пермеаза D-ксилозы, может быть получена, например, путем модификации нуклеотидной последовательности ДНК, кодирующей пермеазу D-ксилозы (SEQ ID NO:1), например, с использованием сайт-направленного мутагенеза, таким образом, что в специфическом сайте происходит замена, делеция, вставка или добавления одного или более аминокислотных остатков. ДНК, модифицированная описанным выше способом, может быть получена с помощью традиционных способов мутагенеза. Такие способы включают обработку ДНК, кодирующей белок, согласно настоящему изобретению, гидроксиламином или обработку бактерии, содержащей указанную ДНК, УФ излучением или реагентом, таким как N-метил-N'-нитро-N-нитрозогуанидиная или азотистая кислота.
Замены, делеции, вставки и добавления одного или нескольких аминокислотных остатков должны быть консервативными мутациями(мутацией), для того, чтобы сохранялась активность белка. Примером консервативной мутации является консервативная замена. Примеры консервативных замен включают замены Ser или Thr на Ala, замены Gln, His или Lys на Arg, замены Glu, Gln, Lys, His или Asp на Asn, замены Asn, Glu или Gln на Asp, замены Ser или Ala на Cys, замены Asn, Glu, Lys, His, Asp или Arg на Gln, замены Asn, Gln, Lys или Asp на Glu, замену Pro на Gly, замены Asn, Lys, Gln, Arg или Tyr на His, замены Leu, Met, Val или Phe на Ile, замены Ile, Met, Val или Phe на Leu, замены Asn, Glu, Gln, His или Arg на Lys, замены Ile, Leu, Val или Phe на Met, замены Trp, Tyr, Met, Ile или Leu на Phe, замены Thr или Ala на Ser, замены Ser или Ala на Thr, замены Phe или Tyr на Trp, замены His, Phe или Trp на Tyr и замены Met, Ile или Leu на Val.
ДНК, кодирующая практически такой же белок, как пермеаза D-ксилозы, может быть получена в результате экспрессии ДНК, содержащей указанную мутацию, в соответствующей клетке-хозяине, с последующим определением активности экспрессируемого продукта. ДНК, кодирующая практически такой же белок, как пермеаза D-ксилозы, также может быть получена путем выделения ДНК, которая гибридизуется с зондом, нуклеотидная последовательность которого содержит, например, нуклеотидную последовательность, приведенную в Списке последовательностей под номером 1 (SEQ ID NO:1), в жестких условиях, и которая кодирует белок, обладающий активностью пермеазы D-ксилозы. Термин «жесткие условия», упомянутый здесь, означает условия, при которых образуются так называемые специфические гибриды, а неспецифические - не образуются. Например, к жестким условиям относятся условия, при которых гибридизуются ДНК, обладающие высокой степенью гомологии, к примеру ДНК, предпочтительно обладающие гомологией не менее 50% друг относительно друга, предпочтительно 80%, более предпочтительно 90% и наиболее предпочтительно 95%, но ДНК, имеющие гомологию менее 50% друг относительно друга, не гибридизуются. С другой стороны, примером жестких условий являются условия, при которых ДНК гибридизуются друг с другом, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS при 60°С. Продолжительность отмывки зависит от вида фильтра, используемого для блоттинга и, как правило, от рекомендаций изготовителя. Например, рекомендованная продолжительность отмывки нейлонового фильтра Hybond™ N+(Amersham) в жестких условиях составляет 15 минут. Предпочтительно, чтобы отмывку проводили 2-3 раза.
Также в качестве зонда может быть использована часть нуклеотидной последовательности, приведенной в списке последовательностей под номером 1 (SEQ ID NO:1). Зонды могут быть получены в результате ПЦР с использованием в качестве праймеров олигонуклеотидов, полученных на основе нуклеотидной последовательности под номером 1, и фрагмента ДНК, содержащего нуклеотидную последовательность под номером 1, в качестве матрицы. В случае, когда в качестве зонда используется фрагмент ДНК длиной около 300 пар оснований, условия отмывки при гибридизации соответствуют, например 50°С, 2×SSC и 0.1% SDS.
Описанные выше замены, делеции, вставки или добавления нуклеотидов также включают мутации, встречающиеся в природе (мутант или вариант), например, из-за природного разнообразия в пределах вида или рода бактерии, содержащей пермеазу D-ксилозы.
Термин «трансформация бактерии ДНК, кодирующей белок» означает введение указанной ДНК в бактерию, например, традиционными способами. Трансформация указанной ДНК приводит к повышению экспрессии гена, кодирующего белок и таким образом повышает активность указанного белка в бактериальной клетке. Методы трансформации включают в себя все описанные или известные к настоящему времени методы. Например, может быть использован метод обработки клеток-реципиентов с помощью хлорида кальция для увеличения проницаемости ДНК через клеточную мембрану, описанный для Escherichia coli K-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970)).
Способы усиления экспрессии гена включают увеличение количества копий гена. Введение гена в вектор, способный функционировать в бактерии семейства Enterobacteriaceae, повышает количество копий гена. Предпочтительно использование низкокопийных генов. Примеры низкокопийных векторов включают, но не ограничиваются векторами pSC 101, pMW 118, pMW 119 и подобными им. Термин "низкокопийный вектор" используется для векторов, количество копий которых в клетке не превышает 5.
Усиление экспрессии гена может также быть достигнуто за счет введения нескольких копий гена в бактериальную хромосому, например, с помощью методов гомологичной рекомбинации, Mu интеграции и подобных им. Например, один раунд Mu интеграции позволяет интегрировать до 3 копий целевого гена в бактериальную хромосому.
Увеличение количества копий гена пермеазы D-ксилозы может быть достигнуто путем интеграции нескольких копий гена пермеазы D-ксилозы в хромосомную ДНК бактерии. Для того чтобы интегрировать несколько копий этого гена в бактериальную хромосому, производится гомологичная рекомбинация с использованием последовательности, чьи многочисленные копии присутствуют в хромосомной ДНК и используются в качестве мишеней. Последовательности, присутствующие в виде нескольких копий в хромосомной ДНК включают, но не ограничиваются, повторами ДНК или инвертированными повторами, присутствующими на концах элементов транспозиции. Также, как описано в патенте США 5595889, возможно включение гена пермеазы D-ксилозы в состав транспозона, позволяющее интегрировать несколько копий этого гена в хромосомную ДНК.
Усиление экспрессии гена также достигается помещением ДНК согласно настоящему изобретению под контроль сильного промотора. Например, lac промотор, trp промотор, trc промотор, PR или PL промоторы фага лямбды известны как сильные промоторы. Усиление экспрессии гена также может быть достигнуто путем помещения сильного терминатора после ДНК согласно настоящему изобретению. Использование сильного промотора и/или терминатора может комбинироваться с увеличением количества копий гена.
С другой стороны, влияние промотора может быть усилено, например, введением мутации в промотор для повышения уровня транскрипции структурного гена (кодирующего участка гена), расположенного за промотором. Аналогично, эффект терминатора может быть усилен, например, путем введения мутации в терминатор для увеличения числа инициации транскрипции гена, расположенного перед терминатором.
Более того, известно, что замена нескольких нуклеотидов в промежутке между сайтом связывания рибосомы (RBS) и старт-кодоном, особенно последовательности, находящиеся непосредственно перед старт-кодоном, существенно влияют на транслируемость мРНК. Например, был обнаружен 20-кратный разброс уровней экспрессии, в зависимости от того, какие именно три нуклеотида предшествовали старт-кодону (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984). Ранее было показано, что rhtA23 мутация является заменой А-на-G в положении -1 относительно старт-кодона ATG (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract №457). Таким образом, можно предположить, что мутация rhtA23 усиливает экспрессию гена rhtA и, следовательно, повышает устойчивость к треонину, гомосерину и другим веществам, выбрасываемым из клетки.
Более того, также вполне возможно ввести нуклеотидную замену в промоторную или терминаторную область гена пермеазы D-ксилозы в бактериальной хромосоме, что приведет к усилению промотора. Может быть произведено изменение последовательности, регулирующей экспрессию гена, например, таким же способом, как замена гена с использованием температур - чувствительной плазмиды, как описано в опубликованной заявке РСТ WO 00/18935 и выложенной патентной заявке Японии 1-215280.
Способы получения плазмидной ДНК включают, но не ограничиваются разрезанием и лигированием ДНК, трансформацией, подбором олигонуклеотидов в качестве праймеров и подобные им способы, или другие способы, хорошо известные специалисту в данной области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Бактерия согласно настоящему изобретению может быть получена путем введения вышеупомянутых ДНК в бактерию, которая уже обладает наследственным признаком - способностью к продукции L-аминокислоты. С другой стороны, бактрия согласно настоящему изобретению может быть получена путем придания способности к продукции L-аминокислоты бактерии, которая уже содержит указанные ДНК.
Бактерии-продуценты L-треонина.
Примерами родительского штамма являются штаммы - продуценты треонина, принадлежащие к роду Escherichia, такие как штамм Е.coli TDH-6/pVIC40 (ВКПМ В-3996) (патенты США 5175107 и 5,705.371), штамм Е.coli NRRL-21593 (патент США 5939307), штамм Е.coli FERM BP-3756 (патент США 5474918), штаммы Е.coli FERM BP-3519 и FERM BP-3520 (патент США 5376538), штамм Е.coli MG442 (Гусятинер и др., Генетика, 14, 947-956 (1978)), штаммы Е.coli VL643 и VL2055 (Европейская патентная заявка ЕР 1149911 А) и подобные им, но не ограничиваются указанными штаммами.
Штамм TDH-6 является дефицитным по гену thrC, способен ассимилировать сахарозу и содержит ген ilvA с мутацией типа "leaky". Указанный штамм содержит мутацию в гене rhtA, которая обуславливает устойчивость к высоким концентрациям треонина и гомосерина. Штамм В-3996 содержит плазмиду pVIC40, которая была получена путем введения в вектор, производный от вектора RSF1010, оперона thrA*ВС, включающего мутантный ген thrA, кодирующий аспартокиназа-гомосериндегидрогеназу I, у которой существенно снижена чувствительность к ингибированию треонином по типу обратной связи. Штамм В-3996 был депонирован 19 ноября 1987 года во Всесоюзном научном центре антибиотиков (РФ, 113105 Москва, Нагатинская ул., 3-А) с инвентарным номером РИА 1867. Указанный ш