Способ получения 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилатов
Иллюстрации
Показать всеИзобретение относится к органической химии, конкретно, к способу получения 3-н-алкил-1 -гидроксициклопентан-н-алкилкарбоксилатов:
где R=н-C5H11, н-C6H13, н-C8H17
R′=C2H5, н-C4H9, которые могут найти применение в тонком органическом синтезе, в производстве лакокрасочных материалов, высокоэффективных противозадирных и противоизносных присадок к маслам, биологически активных веществ. Сущность способа заключается во взаимодействии α-олефинов с триэтилалюминием в присутствии катализатора в атмосфере аргона при комнатной температуре и атмосферном давлении в гексане в течение 8 часов с последующим добавлением к реакционной массе при температуре -15°С катализатора хлорида меди и диалкилового эфира щавелевой кислоты, после чего реакционную массу перемешивают при комнатной температуре в течение 8-10 часов. Выход конечного продукта после гидролиза реакционной массы составляет 70-92%. 1 табл.
Реферат
Предлагаемое изобретение относится к органической химии, в частности к способу получения 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилатов общей формулы (1):
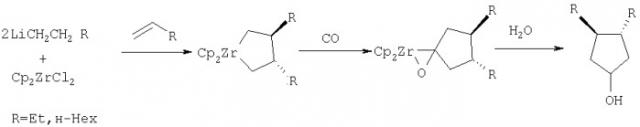
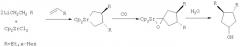
Циклоалканолы со сложноэфирными заместителями могут найти применение в тонком органическом синтезе, в производстве лакокрасочных материалов, высокоэффективных противозадирных и противоизносных присадок к маслам, биологически активных веществ. Известен способ ([1] Swanson D.R., Rousset C.J., Negishi E.I., Takahashi Т., Seki Т., Saburi M., Ushida I. Regioselektive and Diastereoselective Alkyl-Alkene and Alkene-Alkene Coupling Promoted by Zirconocene and Hafhocene // J. Org. Chem. 1989, v.54, №15, P.3521-3523) получения транс-3,4-диалкилциклопентан-1-олов взаимодействием цирконацендихлорида (Cp2ZrCl2) с двукратным избытком алкильных производных лития с последующей последовательной обработкой реакционной массы α-олефинами, окисью углерода (СО) и водой по схеме:
Известным способом не могут быть получены 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилаты (1).
Известен способ ([2] Патент РФ №2219157, 2003) получения циклопентанолов с алкильными заместителями взаимодействием α-олефинов с триэтилалюминием (AlEt3) в присутствии катализатора Cp2ZrCl2 с последующим добавлением этилацетата в присутствии медьсодержащих катализаторов по схеме:
Известный способ не позволяет получать 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилаты (1).
Предлагается новый способ получения 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилатов (1).
Сущность способа заключается во взаимодействии α-олефинов общей формулы RCH=CH2, где R=н-С5Н11, н-С6Н13, н-C8H17, с триэтилалюминием (AlEt3), взятыми в мольном соотношении RCH=CH2 : AlEt3=10:(12-16), предпочтительно 10-14, в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) в количестве 5-9 мол.%, предпочтительно 7 мол.%, в атмосфере аргона при комнатной температуре (20-21°С) и атмосферном давлении в алифатическом растворителе (гексан) в течение 8 часов с последующим добавлением к реакционной массе при температуре -15°С катализатора хлорида меди (CuCl) в количестве 10-14 мол.%, предпочтительно 12 мол.%, и диалкилового эфира щавелевой кислоты (ROCOCOOR), взятым в трехкратном избытке по отношению к AlEt3, с последующим перемешиванием реакционной массы при комнатной температуре (20-21°С) в течение 8-10 часов, предпочтительно 9 ч. Общий выход 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилатов (1) составляет после гидролиза реакционной массы 70-92%. Реакция протекает по схеме:
3-н-Алкил-1-гидроксициклопентан-н-алкилкарбоксилаты (1) образуются только лишь с участием AlEt3, алифатических α-олефинов и циркониевого катализатора Cp2ZrCl2. В присутствии других соединений алюминия (например, Bui 2AlCl, Bu2 iAl, Bui 2AlH, EtAlCl2, Et2AlCl) или других катализаторов (например, Zr(acac)4, ZrCl4, Cp2TiCl2, Pd(acac)2, Ni(acac)2, NiCl2, Fe(acac)2) целевые продукты (1) не образуются.
Проведение указанной реакции в присутствии катализатора Cp2ZrCl2 больше 9 мол.% или CuCl больше 14 мол.% по отношению к α-олефину не приводит к существенному увеличению выхода целевых продуктов (1). Использование катализатора Cp2ZrCl2 менее 5 мол.% и CuCl менее 10 мол.% снижает выход 3-к-алкил-1-гидроксициклопентан-н-алкилкарбоксилатов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре (20-21°С). При более высокой температуре (например, 60°С) не наблюдается существенного увеличения выхода целевых продуктов, а при меньшей температуре (например, 10°С) снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к исходному α-олефину не приводит к существенному повышению выхода целевых продуктов (1).
Реакции проводили с использованием алифатических растворителей (гексан). В других растворителях (например, эфирных) реакция не идет.
Существенные отличия предлагаемого способа.
В предлагаемом способе используется в качестве исходного соединения диалкиловый эфир щавелевой кислоты, а в известном способе в качестве исходного реагента используется этилацетат, что не позволяет получать 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилаты (1).
Способ поясняется следующими примерами.
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 10 мл гексана, 10 ммоль 1-гептена, 0.7 ммоль катализатора Cp2ZrCl2, при температуре ˜0°С 12 ммоль AlEt3, перемешивают 8 часов при комнатной температуре 20-21°С, затем при температуре -15°С добавляют 1,2 ммоль катализатора CuCl и 36 ммоль диэтилового эфира щавелевой кислоты, перемешивают 9 часов при температуре 20-21°С, реакционную массу гидролизуют водным раствором (8-10%) HCl. Из органического слоя выделяют 3-н-пентил-1-гидроксициклопентанэтилкарбоксилат с выходом 83%.
Спектральные характеристики 3-н-пентил-1-гидроксицикло-пентанэтилкарбоксилата (1):
Другие примеры, подтверждающие способ, приведены в таблице.
| №№ п/п | Исходный α-олефин, | Мольное соотношение :AlEt3: Cp2ZrCt2:R′OCOCOOR′: CuCl, ммоль | Общее время реакции, час | Выход 3-н-алкил-1-гидроксициклопентан-н-алкил-карбоксилата (1), % |
| 1 | 2 | 3 | 4 | 5 |
| R′=C2H5 | ||||
| 1-гептен | 10:14:0.7:42:1.2 | 17 | 83 | |
| 2. | -«- | 10:16:0.7:48:1.2 | 17 | 87 |
| 3. | -«- | 10:12:0.7:36:1.2 | 17 | 74 |
| 4. | -«- | 10:14:0.9:42:1.2 | 17 | 92 |
| 5. | -«- | 10:14:0.5:42:1.2 | 17 | 70 |
| 6. | -«- | 10:14:0.7:42:1.4 | 17 | 90 |
| 7. | -«- | 10:14:0.7:42:1.0 | 17 | 75 |
| 8. | -«- | 10:14:0.7:42:1.2 | 18 | 89 |
| 9. | -«- | 10:14:0.7:42:1.2 | 16 | 76 |
| 10. | 1-октен | 10:14:0.7:42:1.2 | 17 | 82 |
| 11. | 1-децен | 10:14:0.7:42:1.2 | 17 | 80 |
| 12. | 1-гептен | R′=н-C4H9 | ||
| 10:14:0.7:42:1.2 | 17 | 78 |
Опыты проводили на гексане при компантной температуре (20-21°С) температутере.
Способ получения 3-н-алкил-1-гидроксициклопентан-н-алкилкарбоксилатов (1):
где R=н-С5Н11, н-С6H13, H-C8H17;
R′=С2Н5, н-С4Н9,
отличающийся тем, что α-олефины общей формулы
RCH=CH2,
где R такое же, как определено выше,
подвергают взаимодействию с триэтилалюминием (AlEt3) при мольном соотношении RCH=CH2: AlEt3=10:(12-16) в присутствии катализатора цирконацендихлорида Cp2ZrCl2, взятого в количестве 5-9 мол.% по отношению к α-олефину, в атмосфере аргона при комнатной температуре и атмосферном давлении в гексане в течение 8 ч с последующим добавлением к реакционной массе при температуре -15°С катализатора хлорида меди CuCl в количестве 10-14 мол.% по отношению к α-олефину и диалкилового эфира щавелевой кислоты, взятого в трехкратном избытке по отношению к AlEt3, после чего реакционную массу перемешивают при комнатной температуре с последующим гидролизом реакционной массы.