Арилэфирзамещенные имидазохинолины, фармацевтические составы на их основе, способы лечения вирусного заболевания на их основе, способы лечения опухолевого заболевания на их основе
Иллюстрации
Показать всеИзобретение относится к арилэфирзамещенным имидазохинолинам и тетрагидроимидазохинолинам, которые могут быть использованы для индуцирования биосинтеза цитокинов. Описываются имидазохинолины, имеющие формулу (I):
где Х представляет собой -CHR3-; R1 выбран из группы, включающей: - арил; - R4-арил; R2 выбран из группы, включающей: - атом водорода; - алкил; - арил; - тетрагидрофуран; - алкил-Y-алкил; - алкил-Y-арил; и - алкил, замещенный одним или большим количеством заместителей, выбранных из арила; R4 представляет собой алкильную или алкенильную группу, которая может быть разделена одной или несколькими -O-группами; каждый R3 представляет собой независимо друг от друга атом водорода или С1-10алкильную группу; каждая группа Y независимо друг от друга представляет собой -О; значение п равно 0; и каждый R независимо выбран из группы, состоящей из C1-10 алкильной, С1-10алкоксильной, гидроксильной групп, атома галогена и трифторметильной группы; или соль фармацевтического качества на основе этих групп. Также описываются фармацевтические составы для индуцирования биосинтеза цитокинов, способы лечения вирусного заболевания, способы лечения опухолевого заболевания. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 20 н. и 19 з.п. ф-лы, 8 табл.
Реферат
Это изобретение относится к имидазохинолиновым соединениям, которые имеют эфирную и арильную или алкенильную функциональные группы в положении 1, а также к фармацевтическим составам, содержащим такие соединения. Дополнительный аспект этого изобретения относится к использованию указанных выше соединений в качестве иммуномодуляторов, для стимулирования биосинтеза цитокина в организме животного, а также для лечения различных болезней, включая вирусные и опухолевые заболевания.
Первые надежные данные по 1Н-имидазол[4,5-с]хинолиновой циклической системе приведены Бакманом с сотр. в журнале J. Orq. Chem.. 15, 1278-1284 (1950), которые сообщили о синтезе 1-(6-метокси-8-хинолинил)-2-метил-1Н-имидазо[4,5-с]хинолина с целью его возможного применения в качестве противомалярийного средства. В последующем появились сообщения о синтезе различных замещенных 1Н-имидазо[4,5-с]хинолина. Например, Джайн с сотр., J. Med. Chem. 11, 87-92 (1968), синтезировали 1-[2-4-пиперидил)этил]-1Н-имидазо[4,5-с]хинолин для его использования в качестве возможного противосудорожного и сердечно-сосудистого средства. Кроме того, Баранов с сотр., Chem. Abs. 85, 94362 (1976), сообщили о синтезе нескольких 2-оксоимидазо[4,5-с]хинолинов, а Берени с сотр., J. Heterocyclic Chem 18, 1537-1540 (1981), также сообщили о синтезе нескольких 2-оксоимидазо[4,5-с]хинолинов.
Позже было установлено, что некоторые 1H-имидазо[4,5-с]хинолин-4-амины и их 1- и 2-замещенные производные могут быть использованы в качестве противовирусных агентов, бронхолитических средств и иммуномодуляторов. Эти соединения описаны среди прочих химических продуктов в патентах США №№4689338, 4698348, 4929624, 5037986, 5268376, 5346905 и 5389640; все эти патенты приведены в списке цитируемой литературы.
Большой интерес к имидазохинолиновым циклическим системам не прекращается и в настоящее время. Известны некоторые 1Н-имидазо[4,5-с]нафтиридин-4-амины, 1Н-имидазо[4,5-с]пиридин-4-амины и 1Н-имидазо[4,5-с]хинолин-4-амины, имеющие эфирную группу, содержащую заместитель в положении 1. Эти соединения описаны в патентах США №№5268376, 5389640, 5494916, а также в WO 99/29693.
В настоящее время существует потребность в соединениях, обладающих способностью модулировать иммунную реакцию за счет стимулирования биосинтеза цитокина или с использованием других механизмов.
Краткое изложение сущности изобретения
Найден новый класс соединений, способных стимулировать биосинтез цитокина в организме животных. В соответствии с этим данное изобретение предлагает соединения имидазо[4,5-с]хинолин-4-амина и тетрагидроимидазо[4,5-с]хинолин-4-амина, которые содержат заместитель с эфирной группой в 1-положении. Согласно данным ИК-спектроскопии эти соединения имеют формулу (I), (II), (III) и (IV). Ниже приведена общая структурная формула этих соединений
причем природа заместителей X, R1, R2 и R определена ниже для каждого класса соединений, имеющих формулу (I), (II), (III) и (IV).
Соединения, имеющие общую формулу (I), (II), (III) и (IV), являются полезными модификаторами иммунной реакции благодаря их способности стимулировать биосинтез цитокина иным образом модулировать иммунную реакцию при введении в организм животных. Это делает указанные выше соединения полезными средствами для лечения различных заболеваний, таких как вирусные инфекции и опухолевые заболевания, которые вызывают такое изменение в иммунной реакции.
В изобретении также приводятся фармацевтические составы, содержащие соединения, изменяющие иммунную реакцию, и сообщается о способах стимулирования биосинтеза цитокина в организме животного, лечении вирусной инфекции и/или опухолевых заболеваний у животного путем введения в его организм соединений формулы (I), (II), (III) и (IV).
Кроме того, приводятся способы синтеза соединений, являющихся предметом изобретения, а также промежуточных продуктов, используемых при синтезе этих соединений.
Подробное описание изобретения
Как указывалось выше, мы обнаружили некоторые соединения, которые стимулируют биосинтез цитокина и тем самым модифицируют иммунную реакцию в организме животных. Такие соединения имеют общие формулы (I), (II), (III) и (IV), показанные ниже.
Предлагаемые в изобретении имидазохинолиновые соединения, содержащие эфирную и арильную или алкенильную функциональные группы, находящиеся в положении 1, имеют формулу (1):
где Х представляет собой -CHR3-, -CHR3-алкильную или -CHR3-алкенильную группу;
R1 выбран из группы, включающей:
- алкенил;
- арил;
- R4-арил;
R2 выбран из группы, включающей:
- атом водорода;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил; и
- алкил или алкенил, замещенные одним или большим количеством заместителей, выбранных из группы, включающей:
- ОН;
- атом галогена;
- N(R3)2;
- СО-N(R3)2;
- СО-С1-10алкил;
- СО-O-С1-10алкил;
- N3
- арил;
- гетероарил;
- гетероциклил;
- СО-арил; и
- СО-гетероарил;
каждый R4 представляет собой алкильную или алкенильную группы, причем обе эти группы могут быть разделены одной или несколькими -O-группами;
каждый R3 представляет собой независимо друг от друга атом водорода или С1-10алкильную группу;
каждая группа Y независимо друг от друга представляет собой -О- или S(O)0-2-;
значение n может изменяться от 0 до 4; и
каждый заместитель R независимо выбран из группы, состоящей из C1-10 алкильной, C1-10 алкоксильной, гидроксильной групп, атома галогена и трифторметильной группы;
или соль фармацевтического качества на основе этих групп.
В настоящем изобретении предлагаются также имидазохинолиновые соединения, содержащие эфирную группу в положении 1, причем заместитель с эфирной группой содержит также и алкинильную группу. Эти соединения имеют общую структурную формулу (II):
где
Х представляет собой -CHR3-, -CHR3-алкильную или -CHR3-алкенильную группу;
заместитель R10 выбран из группы, включающей:
- атом водорода
- алкил;
- алкенил; и
- арил;
R2 выбран из группы, включающей:
- атом водорода;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил; и
- алкил или алкенил, замещенные одним или большим количеством заместителей, выбранных из группы, включающей:
- ОН;
- атом галогена;
- N(R3)2;
- СО-N(R3)2;
- CO-C1-10алкил;
- CO-O-C1-10алкил;
- N3
- арил;
- гетероарил;
- гетероциклил;
- СО-арил; и
- СО-гетероарил;
значение n находится в интервале от 0 до 4;
каждая группа Y независимо друг от друга представляет собой -О- или S(O)0-2-;
каждый R3 представляет собой независимо друг от друга атом водорода или С1-10алкильную группу; и
каждый R независимо выбран из группы, состоящей из C1-10 алкильной, C1-10 алкоксильной, гидроксильной групп, атома галогена и трифторметильной группы;
или соль фармацевтического качества на основе этих групп.
Настоящее изобретение включает в себя также тетрагидроимидазохинолиновые соединения, содержащие эфирную и арильную или алкенильную группы в положении 1. Такие тетрагидроимидазохинолиновые соединения имеют формулу (III):
где Х представляет собой -CHR3-, -CHR3-алкильную или -CHR3-алкенильную группу;
заместитель R1 выбран из группы, включающей:
- арил;
- алкенил; и
- R4-арил;
R2 выбран из группы, включающей:
- атом водорода;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-арил;
- алкил-Y-алкенил; и
- алкил или алкенил, замещенные одним или большим количеством заместителей, выбранных из группы, включающей:
- ОН;
- атом галогена;
- N(R3)2;
- CO-N(R3)2;
- CO-C1-10алкил;
- СО-О-С1-10алкил;
- N3
- арил;
- гетероарил;
- гетероциклил;
- СО-арил; и
- СО-гетероарил;
R4 представляет собой алкильную или алкенильную группы, причем обе эти группы могут быть разделены одной или несколькими -О- группами;
каждый R3 представляет собой независимо друг от друга атом водорода или С1-10 алкильную группу;
каждая группа Y независимо друг от друга представляет собой -О- илиS(O)0-2-;
значение n может изменяться от 0 до 4; и
каждый R независимо выбран из группы, состоящей из C1-10 алкильной, С1-10 алкоксильной, гидроксильной групп, атома галогена и трифторметильной группы;
или соль фармацевтического качества на основе этих групп.
Дополнительным классом представленных в настоящем изобретении соединений, модифицирующих иммунную реакцию, являются соединения, включающие эфирсодержащий заместитель, находящийся в положении 1, причем этот эфирсодержащий заместитель содержит также и алкинильную группу. Эти соединения имеют общую структурную формулу (IV):
где
Х представляет собой -CHR3-, -CHR3-алкильную или -CHR3-алкенильную группу;
заместитель R10 выбран из группы, включающей:
- атом водорода
- алкил;
- алкенил; и
- арил;
R2 выбран из группы, включающей:
- атом водорода;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-арил;
- алкил-Y-алкенил; и
- алкил или алкенил, замещенные одним или большим количеством заместителей, выбранных из группы, включающей:
- ОН;
- атом галогена;
- N(R3)2;
- СО-N(R3)2;
- CO-C1-10алкил;
- CO-O-C1-10алкил;
- N3
- арил;
- гетероарил;
- гетероциклил;
- СО-арил; и
- СО-гетероарил;
каждый R3 представляет собой независимо друг от друга атом водорода или C1-10алкильную группу;
каждая группа Y независимо друг от друга представляет собой -О- или S(O)0-2-;
величина n находится в интервале от 0 до 4; и
каждый R независимо выбран из группы, состоящей из С1-10 алкильной, С1-10 алкоксильной, гидроксильной групп, атома галогена и трифторметильной группы;
или соль фармацевтического качества на основе этих групп.
Получение соединений
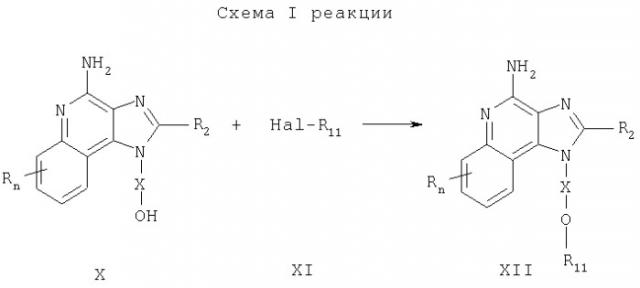
Предлагаемые в изобретении соединения могут быть получены в соответствии с приведенной ниже схемой I реакции, в которой значения R, R2, Х и n определены выше, а заместитель R11 представляет собой алкильную группу, содержащую арильный заместитель, причем арильная группа может быть незамещенной или замещенной, или R11 является замещенной арильной группой, при условии, что если R11 является замещенной арильной группой, по крайней мере, один заместитель представляет собой сильную электроно-акцепторную группу, расположенную в орто- или пара-положении по отношению к эфирной связи.
В соответствии со схемой I реакции 4-амино-1H-имидазо[4,5-с]хинолин-1-иловый спирт формулы Х подвергают алкилированию под действием галогенида формулы XI, в результате чего образуется 1Н-имидазо[4,5-с]хинолин-4-амин формулы XII, который является производным соединением продукта I. Спирт формулы Х обрабатывают гидридом натрия, диспергированным в подходящем растворителе, таком как N,N-диметилформамид, и в результате получают соответствующий алкоксид. После этого к реакционной смеси добавляют соответствующий галогенид и смесь выдерживают при температуре окружающей среды или при необходимости при слабом нагревании (около 50°С). Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Известны многие соединения формулы X, см., например, Герстер, Патент США №4689338 и Герстер с сотр., Патент США №5605899, а также цитируемые в этих патентах работы. Другие соединения такого типа могут быть легко получены с помощью известных способов синтеза, см., например, Андре с сотр. Патент США №5578727; Герстер, Патент США №5175296, Николайдес с сотр., Патент США №5395937 и Герстер с сотр., Патент США №5741908 и цитируемую в этих патентах литературу. Многие галогениды формулы XI являются коммерческими продуктами; другие можно легко синтезировать по известным способам.
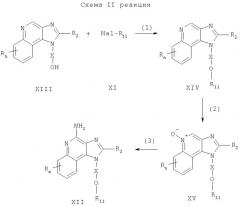
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой II реакции, в которой значения R, R2, R11, Х и n определены выше.
На стадии (1) процесса (схема II реакции) 1Н-имидазо[4,5-с]хинолин-1-иловый спирт формулы XIII подвергают алкилированию под действием галогенида формулы XI, в результате чего образуется 1H-имидазо[4,5-с]хинолин-1 -иловый эфир формулы XIV. Для получения алкоксида спирт XIII обрабатывают гидридом натрия, диспергированным в подходящем растворителе, таком как N,N-диметилформамид или тетрагидрофуран. К полученному алкоксиду добавляют галогенид. Альтернативный способ заключается в проведении реакции между спиртом и галогенидом в двухфазной смеси, состоящей из 50%-ного водного раствора гидроксида натрия и инертного растворителя, такого как дихлорметан, в присутствии катализатора межфазного переноса, такого как бензилтриметиламмоний хлорид. Реакцию можно проводить при температуре окружающей среды. Многие соединения формулы XIII известны, см., например, Герстер, Патент США №4689338, другие соединения такого типа могут быть легко получены с помощью известных синтетических способов, см., например, Герстер с сотр., Патент США №5605899 и Герстер с сотр., Патент США №5175296.
На стадии (2) процесса (схема II реакции) 1Н-имидазо[4,5-с]хинолин-1-иловый эфир формулы XIV под действием обычного окислителя, способного образовывать N-оксид, окисляют до 1H-имидазо[4,5-с]хинолин-5N-оксида формулы XV. Преимущественно раствор соединения формулы XIV в подходящем растворителе, таком как хлороформ или дихлорметан, окисляют при температуре окружающей среды под действием 3-хлорпероксибензойной кислоты.
На стадии (3) процесса (схема II реакции) 1H-имидазо[4,5-с]хинолин-5N-оксид формулы XV аминируют до 1H-имидазо[4,5-с]хинолин-4-амина формулы XII, который является производным соединением продукта I. Стадия (3) включает в себя (i) реакцию присоединения XV к ацилирующему агенту и (ii) взаимодействие образовавшегося продукта с аминирующим агентом. Часть (i) стадии (3) заключается во взаимодействии N-оксида формулы XV с ацилирующим агентом. Подходящими ацилирующими агентами являются алкил- или арилсульфонилхлориды (например, бензолсульфонилхлорид, метансульфонилхлорид, п-толуиленсульфонилхлорид). Предпочтительными ацилирующими агентами являются арилсульфонилхлориды, причем наиболее предпочтительным ацилирующим агентом является пара-толуиленсульфонилхлорид. В части (ii) стадии (3) продукт, полученный в части (i), обрабатывают избытком аминирующего агента. Подходящими аминирующими агентами являются аммиак (например, в виде гидроксида аммония) и соли аммония (например, карбонат аммония, бикарбонат аммония, фосфат аммония). Гидроксид аммония является предпочтительным аминирующим агентом. Реакцию преимущественно проводят, растворяя N-оксид формулы XV в инертном растворителе, таком как дихлорметан, добавляя к полученному раствору аминирующий агент и после этого медленно добавляя ацилирующий агент. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Альтернативным способом можно проводить стадию (3), (i) обрабатывая N-оксид формулы XV изоцианатом и (ii) подвергая образовавшийся продукт гидролизу. Часть (i) заключается во взаимодействии N-оксида XV с изоцианатом, в котором изоцианатная группа связана с карбонильной группой. Предпочтительными изоцианатами являются трихлорацетилизоцианат и ароилизоцианаты, такие как бензоилизоцианат. Реакцию между изоцианатом и N-оксидом проводят в безводных условиях, добавляя изоцианат к раствору N-оксида в инертном растворителе, таком как хлороформ или дихлорметан. Часть (ii) заключается в проведении гидролиза продукта, образовавшегося в части (i). Гидролиз можно проводить с помощью обычных способов, таких, например, как нагревание в присутствии воды или низших спиртов, желательно в присутствии катализатора, такого как гидроксид щелочного металла или низший алкоксид. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
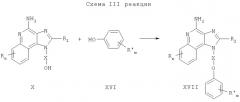
Соединения формулы I, в которой значения R, R2, Х и n определены выше, а заместитель R1 представляет собой замещенную фенильную группу, могут быть получены в соответствии со схемой III реакции. В этой схеме значение m находится в пределах от 0 до 3, а каждый заместитель R' независимым образом выбран из группы, содержащей следующие группы: алкил-, алкокси-, алкилтио-, галоидоалкил-, галоидоалкокси-, галоидоалкилтио-, атом галогена, нитро-, меркапто-, циано-, карбокси-, формил-, арил-, арилокси-, арилтио-, арилалкокси-, арилалкилтио-, гетероарил-, гетероарилокси-, гетероарилтио-, гетероарилалкокси-, гетероарилалкилтио-, амино-, алкиламино-, диалкиламино-, гетероциклил-, гетероциклоалкил-, алкилкарбонил-, алкенилкарбонил-, арилкарбонил-, алкоксикарбонил-, галоидоалкилкарбонил-, галоидоалкоксикарбонил-, алкилтиокарбонил-, арилоксикарбонил-, алканоилокси-, алканоилтио-, алканоиламино-, ароилокси- и ароиламино-.
В соответствии со схемой III реакции 4-амино-1Н-имидазо[4,5-с]хинолин-1-иловый спирт формулы Х подвергают конденсации с фенолом формулы XVI, в результате чего получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XVII, который является производным соединением продукта формулы I. Предпочтительно раствор соединения формулы Х и фенола в соответствующем растворителе, таком как N,N-диметилформамид, при температуре окружающей среды обрабатывают диэтилазодикарбоксилатом и трифенилфосфином. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой IV реакции, в которой значения R, R2, R11, X и n определены выше.
На стадии (1) процесса (схема IV реакции) гидроксильную группу 1Н-имидазо[4,5-с]хинолин-1-илового спирта формулы XIII защищают бензильной группой. Спирт формулы XIII обрабатывают гидридом натрия, диспергированным в подходящем растворителе, таком как N,N-диметилформамид, и получают соответствующий алкоксид. Этот алкоксид подвергают алкилированию под действием бензилбромида и в результате получают соединение формулы XVIII. Реакцию можно проводить при температуре окружающей среды.
На стадии (2) процесса (схема IV реакции) соединение формулы XVIII, используя метод, применяемый на стадии (2) процесса (схема II реакции), окисляют до 1H-имидазо[4,5-с]хинолин-5N-оксида формулы XIX.
На стадии (3) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин-5N-оксид формулы XIX хлорируют и в результате получают 4-хлор-1Н-имидазо[4,5-с]хинолин формулы XX. Предпочтительно раствор соединения формулы XIX в подходящем растворителе, таком как толуол, обрабатывают при температуре окружающей среды оксихлоридом фосфора.
На стадии (4) процесса (схема IV реакции) 4-хлор-1Н-имидазо[4,5-с]хинолин формулы XX обрабатывают фенолом и получают 4-фенокси-1H-имидазо[4,5-с]хинолин формулы XXI. Сначала фенол для получения феноксида обрабатывают гидридом натрия, диспергированным в соответствующем растворителе, таком как диглим. Затем феноксид при повышенной температуре обрабатывают соединением формулы XX.
На стадии (5) процесса (схема IV реакции) из соединения формулы XXI удаляют защитную бензильную группу и получают 4-фенокси-1H-имидазо[4,5-с]хинолин-1-иловый спирт формулы XXII. Реакцию предпочтительно проводят при температуре окружающей среды, медленно добавляя трифторметануксусную кислоту к раствору соединения формулы XXI в соответствующем растворителе, таком как дихлорметан.
На стадии (6) процесса (схема IV реакции) 4-фенокси-1H-имидазо[4,5-с]хинолин-1-иловый спирт формулы XXII подвергают алкилированию под действием галогенида Hal-R11 и в результате получают 4-фенокси-1H-имидазо[4,5-с]хинолин-1-иловый эфир формулы XXIII. Алкоксид соединения формулы XXII получают в присутствии катализатора переноса фаз, такого, например, как бензилтриметиламмонийхлорид, при добавлении спирта к двухфазной системе, состоящей из 50%-ного водного раствора гидроксида натрия и инертного растворителя, такого как дихлорметан. Затем проводят алкилирование алкоксида. Реакцию можно проводить при температуре окружающей среды.
На стадии (7) процесса (схема IV реакции) 4-фенокси-1H-имидазо[4,5-с]хинолин-1-иловый эфир формулы XXIII подвергают аминированию и получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XII, который является производным соединением продукта формулы I. Для проведения этой реакции соединение формулы XXIII смешивают с ацетатом аммония и эту смесь нагревают при температуре около 150°С. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Предлагаемые в изобретении тетрагидроимидазохинолины могут быть получены в соответствии со схемой V реакции, в которой значения R, R2, R11, X и n определены выше.
В соответствии со схемой V реакции 4-амино-6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-1 -иловый спирт формулы XXIV алкилируют с помощью галогенида XI до 6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-4-амина формулы XXV, который является производным соединением продукта формулы III. Для получения алкоксида спирт формулы XXIV обрабатывают гидридом натрия, диспергированным в соответствующем растворителе, таком как N,N-диметилформамид. Затем алкоксид соединяют с галогенидом, и реакцию проводят при температуре окружающей среды. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Известны многие тетрагидро-1H-имидазо[4,5-с]хинолины формулы XXIV, см., например, Николайдес с сотр., Патент США №5352784; другие подобные соединения можно получить с помощью известных синтетических способов, см., например Линдстром, Патент США №5693811 и цитируемую в нем литературу.
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой VI реакции, в которой значения R, R1, R2, Х и n определены выше.
На стадии (1) процесса (схема VI реакции) 4-хлор-3-нитрохинолин формулы XXVI обрабатывают амином формулы R1-O-X-NH2 для получения 3-нитрохинолин-4-амина формулы XXVII. Реакцию проводят, добавляя амин к раствору соединения формулы XXVI в соответствующем растворителе, таком как хлороформ или дихлорметан; в ряде случаев реакцию проводят при нагревании. Известны многие хинолины формулы XXVI (см., например, Патент США №4689338 и цитируемую в нем литературу).
На стадии (2) процесса (схема VI реакции) 3-нитрохинолин-4-амин формулы XXVII восстанавливают до хинолин-3,4-диамина формулы XXVIII. Предпочтительно восстановление проводят, используя обычный катализатор гетерогенного гидрирования, такой как нанесенный на активированный уголь палладий или нанесенная на активированный уголь платина. Реакцию обычно можно проводить в аппарате Парра в подходящем растворителе, таком как изопропиловый спирт или, предпочтительно, толуол.
На стадии (3) процесса (схема VI реакции) хинолин-3,4-диамин формулы XXVIII обрабатывают карбоновой кислотой или эквивалентным ей соединением и получают 1H-имидазо[4,5-с]хинолин формулы XXIX. Подходящими эквивалентами карбоновой кислоты являются сложные ортоэфиры и 1,1-диалкоксиалкилалканоаты. Карбоновую кислоту или ее эквивалент выбирают таким образом, чтобы они обеспечивали введение в соединение формулы XXIX желаемого заместителя R2. Например, при использовании для этой цели триэтилортоформиата в результате реакции будет получаться соединение, в котором R2 представляет собой атом водорода, а при использовании триметилортоацетата - R2 будет представлять собой группу СН3. Реакцию можно проводить в отсутствие растворителя или в инертном растворителе, таком как толуол. Реакцию проводят при достаточном нагревании, чтобы обеспечить удаление любого спирта или воды, образующихся в ходе этой реакции в качестве побочных продуктов. По желанию реакцию можно проводить в присутствии катализатора, такого как солянокислый пиридин.
Альтернативным образом стадию (3) можно проводить при (i) взаимодействии диамина формулы XXVIII с ацилгалогенидом формулы R2C(O)Cl и (ii) последующей циклизации полученного продукта. В части (i) ацилгалогенид добавляют к раствору диамина в подходящем растворителе, таком как ацетонитрил, пиридин или дихлорметан. Реакцию можно проводить при температуре окружающей среды. В части (ii) продукт, полученный в части (i), нагревают в пиридине в присутствии основания. Предпочтительно продукт, полученный в части (i), кипятят с обратным холодильником в этаноле в присутствии избытка триэтиламина или нагревают с метанольным раствором аммиака. Альтернативным образом, если часть (i) проводят в пиридине, часть (ii) после проведения анализа, который показывает, что реакция в части (i) полностью завершена, можно проводить просто нагреванием реакционной смеси.
На стадии (4) процесса (схема VI реакции) 1Н-имидазо[4,5-с]хинолин формулы XXIX окисляют, используя способ, применяемый на стадии (2) процесса (схема II реакции), и в результате получают 1H-имидазо[4,5-с]хинолин-5N-оксид формулы XXX.
На стадии (5) процесса (схема VI реакции) 1Н-имидазо[4,5-с]хинолин-5N-оксид формулы XXX, используя способ, применяемый на стадии (3) процесса (схема II реакции), подвергают аминированию и в результате получают 1H-имидазо[4,5-с]хинолин-4-амин формулы I.
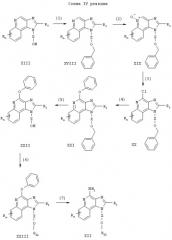
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой VII реакции, в которой значения R, R2, Х и n определены выше, а заместитель R12 представляет собой арильную группу, которая может быть либо незамещенной, либо содержать заместители, указанные выше.
На стадии (1) процесса (схема VII реакции) 1Н-имидазо[4,5-с]хинолин-1-иловый спирт формулы XIII подвергают алкилированию под действием галогенида формулы XXXI и получают 1H-имидазо[4,5-с]хинолин-1-иловый эфир формулы XXXII. Соединение XIII и галогенид формулы XXXI смешивают в двухфазной системе, состоящей из 50%-ного водного раствора гидроксида натрия и соответствующего растворителя, такого как дихлорметан, и проводят реакцию в присутствии катализатора переноса фаз, такого как бензилтриметиламмонийхлорид. Реакцию можно проводить при температуре окружающей среды.
На стадии (2) процесса (схема VII реакции) 1Н-имидазо[4,5-с]хинолин формулы XXXII окисляют, используя методику, применяемую на стадии (2) процесса (схема II реакции), и получают 1Н-имидазо[4,5-с]хинолин-5N-оксид формулы XXXIII.
На стадии (3) процесса (схема VII реакции) проводят реакцию между 1Н-имидазо[4,5-с]хинолин-5N-оксидом формулы XXXIII и трихлорацетилизоцианатом и получают 1Н-имидазо[4,5-с]хинолин-4-ил-трихлорацетамид формулы XXXIV. Предпочтительно изоцианат медленно добавляют при температуре окружающей среды к раствору 5N-оксида в соответствующем растворителе, таком как дихлорметан.
На стадии (4) процесса (схема VII реакции) 1Н-имидазо[4,5-с]хинолин-4-ил-трихлорацетамид формулы XXXIV подвергают гидролизу и в результате получают 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXV, который является производным соединением продукта формулы II. Гидролиз можно проводить, используя обычные способы, предпочтительно обрабатывая раствор соединения формулы XXXIV в метаноле метилатом натрия.
На стадии (5) процесса (схема VII реакции) проводят реакцию между 1H-имидазо[4,5-с]хинолин-4-амином формулы XXXV и галогенидом формулы Hal-R12 в присутствии соединения переходного металла, используемого в качестве катализатора. В результате получают 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXVI, который является производным соединением продукта формулы II. Предпочтительно взаимодействие соединения формулы XXXV с галогенидом проводят в присутствии иодида меди (I), дихлорбис(трифенилфосфина) палладия (II) и избытка триэтиламина в соответствующем растворителе, таком как N,N-диметилформамид или ацетонитрил. Реакцию предпочтительно проводят при повышенной температуре (60-80°С). Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой VIII реакции, в которой значения R, R2, R12, X и n определены выше. ВОС-трет-бутоксикарбонил.
На стадии (1) процесса (схема VIII реакции) амино-группу 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXXV защищают двумя mpem-бутокси карбонильными группами. Реакцию между соединением XXXV и ди-трет-бутилдикарбонатом проводят в соответствующем растворителе, таком как N,N-диметилформамид, в присутствии 4-(диметиламино)пиридина и триэтиламина. Реакцию проводят при повышенной температуре (80-85°С).
На стадии (2) процесса (схема VIII реакции) защищенный 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXVII обрабатывают галогенидом формулы Hal-R12 в присутствии соединения переходного металла, используемого в качестве катализатора, и получают защищенный 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXVIII. Предпочтительно соединение формулы XXXVII обрабатывают галогенидом в присутствии иодида меди (I), дихлорбис(трифенилфосфина) палладия (II) и избытка триэтиламина в соответствующем растворителе, таком как N,N-диметилформамид или ацетонитрил. Реакцию предпочтительно проводят при температуре окружающей среды или повышенной температуре (40-80°С).
На стадии (3) процесса (схема VIII реакции) защитные группы удаляют в результате гидролиза в кислотных условиях и в результате получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XXXVI, который является производным соединением продукта II. Предпочтительно соединение XXXVIII обрабатывают трифторуксусной кислотой в подходящем растворителе, таком как дихлорметан. Реакцию можно проводить при температуре окружающей среды или пониженной температуре (0°С). Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
На стадии (4) процесса (схема VIII реакции) алкиновую (тройную) связь защищенного 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXVIII восстанавливают и в результате получают защищенный 1H-имидазо[4,5-с]хинолин-4-амин формулы XXXIX. Предпочтительно восстановление проводят, используя обычный катализатор гетерогенного гидрирования, такой как нанесенный на активированный уголь палладий или нанесенная на активированный уголь платина. Реакцию обычно можно проводить в аппарате Парра в подходящем растворителе, таком как метанол.
На стадии (5) процесса (схема VIII реакции) защитные группы соединения формулы XXXIX удаляют, используя способ, применяемый на стадии (3). В результате этой реакции получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XL, который является производным соединением продукта формулы I. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой IX реакции, в которой значения R, R2, R12, Х и n определены выше. CBZ-бензилоксикарбонил.
На стадии (1) процесса (схема IX реакции) амино-группу 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXXV защищают бензилоксикарбонильными группами. Реакцию между соединением формулы XXXV и дибензилдикарбонатом проводят в соответствующем растворителе, таком как N,N-диметилформамид. Реакцию проводят при комнатной или несколько повышенной температуре (40°С).
На стадии (2) процесса (схема IX реакции) защищенный 1H-имидазо[4,5-с]хинолин-4-амин формулы XLI обрабатывают галогенидом формулы Hal-R12 в присутствии соединения переходного металла, используемого в качестве катализатора, и получают защищенный 1Н-имидазо[4,5-с]хинолин-4-амин формулы XLII. Предпочтительно соединение формулы XLI обрабатывают галогенидом в присутствии иодида меди (I), дихлорбис(трифенилфосфина) палладия (II) и избытка триэтиламина в соответствующем растворителе, таком как N,N-диметилформамид или ацетонитрил. Реакцию предпочтительно проводят при температуре окружающей среды или повышенной температуре (40-80°С).
На стадии (3) процесса (схема IX реакции) защитные группы удаляют за счет гидролиза и в результате получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XXXVI, который является производным соединением продукта формулы II. Предпочтительно соединение формулы XLII обрабатывают метилатом натрия в подходящем растворителе, таком как метанол. Реакцию можно проводить при температуре окружающей среды. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
На стадии (4) процесса (схема IX реакции) защитные группы соединения формулы XLII удаляют в результате восстановления под действием водорода и проводят восстановление алкиновой (тройной) связи. В результате получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XL, который является производным соединением продукта формулы I. Предпочтительно реакцию восстановления проводят, используя в качестве катализатора гидроксид палладия, нанесенный на активированный уголь. Реакцию обычно можно проводить в аппарате Парра в подходящем растворителе, таком как метанол. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой Х реакции, в которой значения R, R1, R2, X и n определены выше.
На стадии (1) процесса (схема Х реакции) 2,4-дихлор-3-нитрохинолин формулы XLIII обрабатывают амином формулы R1-O-X-NH2 и получают 2-хлор-3-нитрохинолин-4-амин формулы XLIV. Реакцию можно проводить, добавляя амин к раствору соединения XLIII в соответствующем растворителе, таком как хлороформ или дихлорметан. В ряде случаев реакцию можно проводить при нагревании. Многие хинолины формулы XLIII либо являются известными продуктами, либо их можно получить, используя известные синтетические способы (см., например, Андре с сотр., Патент США №4988815 и цитируемую в нем литературу).
На стадии (2) процесса (схема Х реакции) 2-хлор-3-нитрохинолин-4-амин формулы XLIV восстанавливают, используя для этой цели способ, применяемый на стадии (2) процесса (Схема VI реакции). В результате получают 2-хлорхинолин-3,4-диамин формулы XLV.
На стадии (3) процесса (схема Х реакции) 2-хлорхинолин-3,4-диамин формулы XLV подвергают циклизации, используя способ, применяемый на стадии (3) процесса (Схема VI реакции), и в результате получают 4-хлор-1Н-имидазо[4,5-финолин формулы XLVI.
На стадии (4) процесса (схема Х реакции) 4-хлор-1H-имидазо[4,5-с]хинолин формулы XLVI аминируют до 1Н-имидазо[4,5-с]хинолин-4-амина формулы I. Реакцию проводят при нагревании (например, при 125-175°С) соединения формулы XLVI в герметичном реакторе в присутствии раствора аммиака в алканоле. Продукт или соль фармацевтического качества можно выделить из реакционной смеси с помощью обычных способов.
Предлагаемые в изобретении соединения могут быть получены в соответствии со схемой XI реакции, в которой значения R, R1, R2, X и n определены выше.
В соответствии со схемой XI реакции 1Н-имидазо[4,5-с]хинолин-4-амин формулы XLVII под действием галогенида формулы XLVIII алкилируют до 1H-имидазо[4,5-с]хинолин-4-амина формулы I. Соединение формулы XLVII обрабатывают гидридом натрия, диспергированным в соответствующем растворителе, таком как N,N-диметилформамид, и после этого к реакционной смеси добавляют галогенид. Реакцию проводят при повышенной температуре (˜100°С). Алкилирование протекает как по атому азота N1, так и по N3; однако целевой продукт, которым является 1-изомер, может быть легко отделен от 3-изомера с помощью обычных способов, например при использовании хроматографических колонок или с помощью перекристаллизации.
Многие 1Н-имидазо[4,5-с]хинолин-4-амины формулы XLVII либо являются известными продуктами, либо их можно получить, используя известные синтети