Фенилсодержащие n-ацильные производные аминов, способ их получения, фармацевтическая композиция и их применение в качестве противовоспалительных и анальгетических средств
Иллюстрации
Показать всеИзобретение относится к фенилсодержащим N-ацильным производным аминам общей формулы I, где R1 представляет водород или гидроксигруппу; R2 представляет водород, -СООН, -COOR4, где R4 представляет C1-С6алкил; R3 представляет водород, гидроксигруппу; n равно 1; и их фармацевтически приемлемым солям. Изобретение относится к способу получения соединений общей формулы I (где n равно 1 или 2), осуществляемому за счет активации карбоксильной группы п-гидроксифенилуксусной кислоты или фенилуксусной кислоты, взаимодействием с дифенилфосфорилазидом и триэтиламином в органическом растворителе при охлаждении с последующим взаимодействием с аминосоединением. Изобретение относится к способу получения соединений формулы I (где n равно 1), осуществляемому за счет превращения п-гидроксифенилуксусной кислоты или фенилуксусной кислоты в активированный N-оксисукцинимидный эфир N'-дициклогексилкарбодиимидным методом, с последующим взаимодействием активированного N-сукцинимидного эфира с аминопроизводным. Изобретение относится к фармацевтической композиции и средству, обладающим ингибирующей циклооксигеназу активностью, включающим в качестве активного агента эффективное количество соединения общей формулы (I) (где n равно 1 или 2). Также изобретение относится к способу ингибирования циклооксигеназы, осуществляемому путем введения млекопитающему эффективного количества соединения общей формулы (I) (где n равно 1 или 2) или его фармацевтически приемлемой соли. Технический результат - получение фенилсодержащих N-ацильных производных аминов, обладающих ингибирующей циклооксигеназу активностью и применяемых для лечения болевых синдромов, воспалительных и воспалительно-дегенеративных заболеваний суставов и соединительной ткани, а также костно-мышечной системы, других заболеваний, сопровождающихся воспалением. 7 н. и 12 з.п. ф-лы, 9 табл.
Реферат
Настоящее изобретение относится к области биоорганической химии и касается новых соединений - фенилсодержащих N-ацильных производных биогенных аминов, а также способа синтеза новых и известных соединений, их применения в медицине в качестве потенциальных анальгетических и противовоспалительных средств.
Предшествующий уровень техники
В публикации международной заявки WO 97/23202 раскрыты фенилсодержащие N-ацильные производные аминов общей формулы (XV)
включающие, среди прочих, 3-(п-гидроксифенил) пропионилфенилэтиламин, 3-(п-гидроксифенил)пропионилтирамин и 3-фенилпропионилфенилэтиламин (соединения IX, X, XI настоящего изобретения, соответственно), в качестве промежуточных соединений, а также их синтез и применение в качестве селективных лигандов подтипов NMDA рецепторов, используемых для лечения хронической боли, мигреневой головной боли, а также анестетиков. Однако, ни в описании, ни в формуле изобретения указанной публикации не описаны и не охарактеризованы конкретные структуры, соответствующие соединениям X и XI настоящего изобретения, и отсутствуют какие-либо данные, подтверждающие заявленный вид активности, а соединение IX в качестве промежуточного соединения и его синтез раскрыты лишь в способе получения других производных аминов.
Соединения IX, X и XI настоящего изобретения также описаны в более ранних публикациях, ставших общедоступными до даты приоритета вышеуказанной международной заявки WO 97/23202, для использования по иному назначению.
3-(п-Гидроксифенил)пропионилфенилэтиламин (IX) раскрыт в Jacobson K.A., Kirk K.L. New high-performance liguid chromatographic procedure for the detection and quantification of β-phenyletylamine. // J. Chromatography. 1987. V.415. P. 124-128); (3-(п-гидроксифенил)пропионилтирамин (X) - в R.B. Herbert, A.E.Kattah. The biosynthesis of Sceletium alkaloids in Sceletiumsubvelutinum L. Bolus. // Tetrahedron. 1990. V.46. № 20. P.7105-7118 и (3-фенилпропионилфенилэтиламин (XI) - в Maldonado E., Hernandez E., Ortega A. Amides, coumarine and other constituents from simsia cronquistii. // Phytochem. 1992. P. 1413-1414.
В публикации международной заявки WO 97/23202 указана возможность использования соединений общей формулы (XV) для предотвращения лишь некоторых специфических видов боли, таких как мигреневая головная боль, хроническая боль, а также применение их для анестезии, обусловленная способностью данных соединений проявлять действие селективных лигандов подтипов NMDA рецепторов. Однако следует отметить, что в описании WO 97/23202 нет подтверждения заявляемой активности и, следовательно, возможности применения соединений по указанному назначению, на конкретных моделях на животных in vivo, и, таким образом, выводы о возможных фармакологических эффектах основаны исключительно на утверждении о том, что вообще все заявленные в патенте соединения являются селективными лигандами подтипов NMDA-рецепторов.
В публикации международной заявки WO 97/23202 описан способ синтеза 3-(п-гидроксифенил)пропионилфенилэтиламина (IX) с использованием 1-гидроксибензотриазола в присутствии N,N'- дициклогексилкарбодиимида (DCC). Не описан способ выделения и очистки данного соединения, из физико-химических констант приведены температура плавления и данные 1H-ЯМР-спектроскопии.
В статье Jacobson K.A., Kirk K.L. New high-performance liguid chromatographic procedure for the detection and quantification of β-phenyletylamine. // J. Chromatography. 1987. V.415. P.124-128 раскрыт синтез 3-(п-гидроксифенил)пропионилфенилэтиламина (IX) с применением модифицированного N-оксисукцинимидного эфира 3-(п-гидроксифенил)пропионовой кислоты. Реакцию проводят в смеси метанол- 1M Na2HPO4, pH 8 (1:1), используя сульфосукцинимидил-3-(п-гидроксифенил)пропионат (сульфатированный реагент Bolton-Hunte). Полученный продукт охарактеризован только температурой плавления. В соответствии с данной статьей, полученный 3-(п-гидроксифенил)пропионилфенилэтиламин используют в качестве внутреннего стандарта в электрохимическом детекторе при количественном определении уровня эндогенного фенилэтиламина в биологических жидкостях методом ВЭЖХ.
В статье Herbert R.B., Kattah A.E. The biosynthesis of Sceletium alkaloids in Sceletiumsubvelutinum L. Bolus. // Tetrahedron. 1990. V.46. № 20. P.7105-7118 описано применение 3-(п-гидроксифенил)пропионилтирамина (X) в качестве промежуточного продукта в синтезе алкалоидов Sceletium subvelutinum, а также его способ синтеза методом DCC. Недостатком данного способа является необходимость применения для очистки целевого продукта колоночной хроматографии, его сравнительно невысокий выход - около 48%.
В статье Maldonado E., Hernandez E., Ortega A. Amides, coumarine and other constituents from simsia cronquistii. // Phytochem. 1992. P.1413-1414 описано выделение 3-фенилпропионилфенилэтиламина (XI) из наземной части растений Simsia cronquistii и представлены данные масс-спектрометрии, 1Н-ЯМР-спектроскопии, температура плавления. Данных по биологической активности не приведено.
Синтез соединения XI с применением конденсирующего агента 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина хлорида (DMT-MM) описан в Kunishima M., Kawachi C., Hioki K. et al. Formation of carboxamides by direct condensation of carboxylic acids and amines in alcohols using a new alcohol- and water-soluble condensing agent: DMT-MM. // Tetrahedron. 2001. V.57. № 8. P.1551-1558. Недостатком данного способа синтеза является образование побочного продукта и необходимость применения препаративной тонкослойной хроматографии для очистки целевого продукта, что усложняет процесс и должно с неизбежностью приводить к снижению выхода. Несмотря на это, указывается высокий выход продукта (XI), составляющий 98%. Соединение XI было синтезировано с целью изучения применимости нового конденсирующего агента DMT-MM.
Синтез производных аминокислот тирозина и фенилаланина 3-(п-гидроксифенил)пропионилтирозина, фенилпропионилтирозина, фенилацетилтирозина, фенилпропионилфенилаланина и фенилпропионилтирозина метилового эфира (соединения XIV, XV, XVI XVIII и XXI настоящего изобретения, соответственно) и изучение их ингибирующего действия на нейрон TAN, идентифицированный в ганглии улитки Achatina fulica ferussac описаны в статьях Takeuchi H., Ariyoshi Y., Effects of N-beta-phenylpropionyl-L-tyrosine and its derivatives on the excitability of an identifiable giant neuron of Achatina fulica ferussac. // Comparative biochemistry and physiology. C: Comparative pharmacology. 1982. V.72. № 2. P. 225-229 и Y.Ariyoshi. H. Takeuchi. Structure-activity relationships of N-β-phenylpropionyl-L-tyrosine and its derivatives on the inhibition of an identifiable giant neurone of an identifiable giant neurone of an African giant snail. // Br. J. Pharmacol. 1982. V.77. P.631-639. В статье Y.Ariyoshi. H. Takeuchi. Structure-activity relationships of N-β-phenylpropionyl-L-tyrosine and its derivatives on the inhibition of an identifiable giant neurone of an identifiable giant neurone of an African giant snail. // Br. J. Pharmacol. 1982. V.77. P.631-639. Описана типичная методика синтеза соединений XIV, XV, XVI, XVIII, XXI методом активированных N-оксисукцинимидных эфиров с использованием в качестве аминопроизводного метилового эфира тирозина, с последующим его омылением (для соединений XIV, XV, XVI, XVIII), но физико-химические константы и выходы не приведены. Кроме того, синтез фенилацетилтирозина (XV) с высоким выходом (94%) с использованием 1-гидроксибензотриазола и этил-3(3-диметиламино)пропилкарбодиимида, с использованием в качестве исходных соединений этилового эфира тирозина и фенилпропионовой кислоты, с последующим омылением этилового эфира описан в Tangpasuthadol V., Pendharkar S.M., Kohn J. Hydrolytic degradation of tyrosine-derived polycarbonates, a class of new biomaterials. Part I: Study of model compounds. // Biomaterials. 2000. V. 21. № 23. P. 2371-2378. Приведены данные 1H-ЯМР-спектроскопии и температура плавления.
Синтез фенилпропионилфенилаланина (XVIII) хлорангидридным методом в присутствии KOH раскрыт в Lustig N., Spiegelstein-Klarfeld H., Schneider E., Lichtenstein N. Phenylacetyl and phenylpropionyl amino acids. Their inhibitory effect on glutamine synthetase and their resistance to acylase. I. // Israel Journal of Chemistry. 1974. V.12. № 3. P.757-763. Приведены температура плавления и элементный анализ. Синтез был проведен для изучения степени ингибирования данным соединением XVIII глутаминсинтетазы.
Фенилпропионилтирозин метиловый эфир (XXI) упоминается в качестве промежуточного соединения в патенте Японии JP 57193437, где его синтез осуществлен методом активированных N-оксисукцинимидных эфиров.
Снтез фенилацетилфенилаланина (XIX), подобный синтезу соединения XVIII, с использованием хлорангидрида фенилуксусной кислоты раскрыт в Chen H.M., Hsu M.S., Huang L.J., et al. Effect of N-phenylacetyl L-amino acids on the differentiation of HL-60 cells // Chinese Pharmaceutical Journal. 2001. V.53. №3. Р.157-167. Приведены физико-химические характеристики целевого соединения: температура плавления, данные 1H-ЯМР- и ИК-спектроскопии, масс-спектрометрии. Было установлено, что фенилацетилфенилаланин (XIX) является индуктором дифференцировки клеток.
3-(п-Гидроксифенил)пропионилтирозина метиловый эфир (XX) упоминается в публикации международной заявки WO 99/52962, однако методика синтеза и физико-химические характеристики не приведены. Соединение (XX) было синтезировано с целью его использования в качестве мономера для получения биоразлагаемых полимеров, совместимых с тканями.
Природное соединение, выделенное из симбиотической бактерии Xenorhabdus nematophilus, фенилацетилфенилэтиламин (XXIII) было синтезировано хлорангидридным методом и охарактеризовано физико-химическими данными 1H-ЯМР-, 13С-ЯМР- и ИК-спектроскопии, масс-спектрометрии, температурой плавления в Park S.H., Paik S.U., Suh S.I. et al. Novel aliphatic amide having anticancer property. Int pat. WO 01/49656 (PCT). С07С 255/60. 2001; Paik S.U., Park Y.H., Suh S.I. et al. Unusual cytotoxic phenethylamides from Xenorhabdus nematophilus. // Bulletin of the Korean Chemical Society. 2001. V.22. №4. Р.372-374. Приведены результаты исследований соединения, соответствующего структуре XXIII, на противоопухолевую активность in vitro.
Под общую формулу соединений, раскрытых в публикации международной заявки WO 01/49656, подпадают и другие соединения настоящего изобретения: п-гидроксифенилацетилтирамин, п-гидроксифенилацетилфенилэтиламин и фенилацетилтирамин (соединения VII, VIII и VI настоящего изобретения, соответственно). Однако, ни формул указанных соединений, ни методик синтеза, ни физико-химических констант, ни данных по биологической активности для них не приведено.
Фенилпропионилтирамин (XII) упоминается в статье Takeuchi Hiroshi; Tamura Hiroko. The effects of aromatic amino acid derivatives on the excitability of an identifiable giant neuron of the African giant snail (Achatina fulica Ferussac). // British Journal of Pharmacology. 1980. V.69. №1. Р.29-34, но без описания его синтеза, физико-химических характеристик и назначения.
В статье Garrett C.E., Jiang X., Prasad К., Repic О. New observations on peptide bond formation using CDMT. // Tetrahedron Letters. 2002. V.43. №23. Р.4161-4165 раскрыт фенилпропионилфенилаланина метиловый эфир (XXIV) и способ его синтеза с применением конденсирующего агента 2-хлор-4,6-диметокси-1,3,5-триазина (CDMT) в присутствии N-метилморфолина. Конкретной методики синтеза и физико-химических характеристик соединения XXIV не приведено, но сообщается, что данный способ синтеза имеет преимущества: синтез в одну стадию и выделение продукта путем высаживания водой приводят к хроматографически чистому продукту с высоким выходом 90%. Соединение, соответствующее структуре XXIV, было синтезировано с целью изучения применимости нового конденсирующего агента CDMT.
В статье Peric M., Vercek В., Petric А. ω-Diazoacetophenones as reagents for a mild and selective protection of an amino group. // Acta Chimica Slovenica. 1996. V.43. №2. Р.163-173 описан синтез фенилацетилтирозина метилового эфира (XXII), промежуточного соединения для синтеза пептидов, конденсацией фенилуксусной кислоты с метиловым эфиром тирозина через образование диазокетона. Для очистки соединения XXII обязательно использовали колоночную хроматографию. Приведены температура плавления, данные 1H-ЯМР спектроскопии и элементного анализа.
Фенилацетилфенилаланин метиловый эфир (XXV), в соответствии с Votano J. R., Altman J., Wilchek M., Potential use of biaromatic L-phenylalanyl derivatives as therapeutic agents in the treatment of sickle cell disease. // Proceedings of the National Academy of Sciences of the United States of America. 1984. V.81, №10. P. 3190-3194, был синтезирован методом активированных N-оксисукцинимидных эфиров, с последующей очисткой колоночной хроматографией. Физико-химических констант для него не приведено. В указанной статье соединение XXV является промежуточным в синтезе соединения XIX, которое исследуется в качестве потенциального средства для лечения серповидноклеточного заболевания.
Кроме того, известен ферментативный способ синтеза соединения XXV [Didziapetris R., Drabnig В., Schellenberger V., Jakubke H.D., Svedas V. Penicillin acylase-catalyzed protection and deprotection of amino groups as a promising approach in enzymic peptide synthesis. // FEBS Letters. 1991. V.287. №1-2. Р.31-33].
В статье Bok S., Lee S., Jeong Т., Phenolic acid derivatives and composition for preventing or treating blood lipid level-related diseases comprising the same. Pat. US. US 2003199566 описан синтез 3-(п-гидроксифенил)пропионилфенилаланина (XVII) и 3-(п-гидроксифенил)пропионилфенилаланина метилового эфира (XIII) с использованием 1-гидроксибензотриазола и 1-[3-(диметиламино)пропил]-3-этилкарбодиимида гидрохлорида в присутствии триэтиламина. В случае 3-(п-гидроксифенил)пропионилфенилаланина (XVII) далее проводили омыление с выходом 78%. Для обоих соединений приведены данные 1H-ЯМР- и 13С-ЯМР- спектроскопии. Соединения XVII и XIII предлагается использовать для предупреждения и лечения заболеваний, связанных с уровнем липидов в крови.
Известно, что анальгетическое действие может осуществляться в соответствии с различными механизмами, в частности, путем ингибирования фермента циклооксигеназы в каскаде арахидоновой кислоты [Машковский М.Д. Лекарственные средства. / М., Медицина, 1993, т.2].
Наиболее выраженным обезболивающим эффектом среди препаратов, снижающих синтез альгогенов, обладают ненаркотические анальгетики и нестероидные противовоспалительные средства. Ненаркотические анальгетики представлены салицилатами (аспирин), производными пиразолона (амидопирин, анальгин) и пара-аминофенола (парацетамол). К нестероидным противовоспалительным средствам относятся производные салициловой, уксусной, пропионовой и антраниловой кислот. Ненаркотические анальгетики и нестероидные противовоспалительные средства, наряду с болеутоляющим эффектом, обладают противовоспалительным и жаропонижающим действием [Кукушкин М.Л., Хитров Н.К. Общая патология боли. / Москва, Медицина, 2004, 142 с.]. Основным побочным эффектом нестероидных противовоспалительных средств является ульцерогенность.
Целью настоящего изобретения является синтез и применение новых и известных фенилсодержащих N-ацильных производных биогенных аминов и аминокислот в качестве нетоксичных, более эффективных анальгетиков и потивовоспалительных средств, без побочных эффектов, в частности ульцерогенности.
Краткое описание изобретения
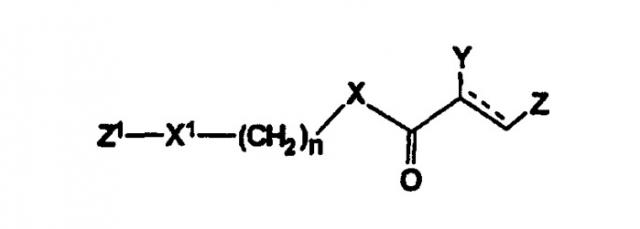
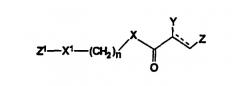
Настоящее изобретение относится к новым фенилсодержащим N-ацильным производным аминам общей формулы I:
где R1 представляет водород или гидроксигруппу;
R2 представляет водород, -COOH, -COOR4, где R4 представляет С1-С6алкил;
R3 представляет водород, гидроксигруппу;
n равно 1 или 2;
при условии, что
когда n равно 1, R1 представляет водород и R2 представляет -COOH, -COOR4, где R4 представляет метил, то R3 не является гидроксигруппой;
когда n равно 1, R1 и R3 одновременно представляют водород, то R2 не является -COOH, -COOR4, где R4 представляет метил; и
n не равно 2,
и их фармацевтически приемлемым солям, обладающим ингибирующей циклооксигеназу активностью, противовоспалительным и анальгетическим действием, не проявляющим побочного ульцерогенного эффекта.
Настоящее изобретение также относится к применению соединений общей формулы I:
где R1 представляет водород или гидроксигруппу;
R2 представляет водород, -СООН, -COOR4, где R4 представляет C1-С6алкил;
R3 представляет водород, гидроксигруппу;
n равно 1 или 2;
и их фармацевтически приемлемых солей в качестве ингибиторов циклооксигеназы, анальгетических и противовоспалительных средств.
Далее, настоящее изобретение относится к фармацевтической композиции или средству, обладающим ингибирующей циклооксигеназу активностью, противовоспалительным и анальгетическим действием, не проявляющим побочного ульцерогенного эффекта, содержащим эффективное количество соединения общей формулы I или его фармацевтически приемлемой соли, а также, если требуется фармацевтически приемлемый носитель.
Еще одним объектом изобретения является способ лечения болевых синдромов различного генеза, а также воспалительных заболеваний, включающий введение эффективного количества соединения общей формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение также относится к новым способам получения соединений общей формулы I.
Детальное описание изобретения
Предпочтительными соединениями формулы I являются соединения, в которых R2 представляет -СООН, -СООСН3.
Новые предпочтительные соединения общей формулы I представлены в Таблице 1.
| Таблица 1 | |||||
| Соединение | № соедин. | R1 | n | R2 | R3 |
| II | -ОН | 1 | -СООН | -ОН | |
| III | -ОН | 1 | -СООН | Н | |
| IV | -ОН | 1 | -СООСН3 | -ОН | |
| V | -ОН | 1 | -СООСН3 | Н | |
| VII | -ОН | 1 | Н | -ОН | |
| VIII | -ОН | 1 | Н | Н |
Известные предпочтительные соединения общей формулы I представлены в Таблице 2.
| Таблица 2 | |||||
| Соединение | № соед. | R1 | n | R2 | R3 |
| VI | Н | 1 | Н | -ОН | |
| IX | -ОН | 2 | Н | Н | |
| X | -ОН | 2 | Н | -ОН | |
| XI | Н | 2 | Н | Н | |
| XII | Н | 2 | Н | -ОН | |
| XIII | -ОН | 2 | -СООСН3 | Н | |
| XIV | -ОН | 2 | -СООН | -ОН | |
| XV | Н | 2 | -СООН | -ОН | |
| XVI | Н | 1 | -СООН | -ОН | |
| XVII | -ОН | 2 | -СООН | Н | |
| XIX | Н | 1 | -СООН | Н | |
| XX | -ОН | 2 | -СООСН3 | -ОН | |
| XXI | Н | 2 | -СООСН3 | -ОН | |
| XXII | Н | 1 | -СООСН3 | -ОН | |
| XXIII | Н | 1 | Н | Н | |
| XXIV | Н | 2 | -СООСН3 | Н | |
| XXV | Н | 1 | -СООСН3 | Н | |
| XVIII | Н | 2 | -СООН | Н |
Соединения общей формулы I получают активацией карбоксильной группы п-гидроксифенилуксусной кислоты или фенилуксусной кислоты взаимодействием с дифенилфосфорилазидом (DPPA) и триэтиламином (TEA) в органическом растворителе при охлаждении, с последующим осуществлением взаимодействия с аминопроизводным. Предпочтительно активацию карбоксильной группы осуществляют с использованием 1-1,2 эквивалентов DPPA и TEA. В качестве аминопроизводного могут быть использованы эфиры тирозина и фенилаланина. Для получения соединений II и III, в качестве исходного аминопроизводного используют бензиловые эфиры тирозина и фенилаланина, соответственно, с последующим удалением бензильной группы путем каталитического гидрогенолиза. В отличие от ранее используемых способов синтеза известных соединений общей формулы I, применение дифенилфосфорилазидного способа позволило уменьшить число стадий, а именно, исключить стадию выделения активированного производного карбоксильного компонента, ограничиться экстракцией для выделения целевых веществ и повысить выходы (≥90%).
Общая схема синтеза дифенилфосфорилазным методом представлена на Схеме 1.
Схема 1
Новые соединения II, III, IV, V, VII, VIII, в том числе, содержащие фенольные гидроксильные группы, могут быть получены также методом активированных N-оксисукцинимидных эфиров, преимуществами которого являются доступность реагентов, водорастворимость выделяющегося N-гидроксисукцинимида, быстрота протекания как реакции получения N-оксисукцинимидных эфиров карбоксильных компонентов, так и реакции образования амидной связи, и возможность достижения высоких выходов целевых продуктов (70-80%), несмотря на наличие в них фенольного гидроксила. В соответствии с предлагаемым способом синтез N-оксисукцинимидных эфиров карбоксильных компонентов осуществляется превращением п-гидроксифенилуксусной кислоты или фенилуксусной кислоты в активированный N-оксисукцинимидный эфир N,N'-дициклогексилкарбодиимидным методом (DCC-методом) с высоким выходом (около 90%), с последующим образованием амидной связи реакцией N-оксисукцинимидных эфиров с аминопроизводным, также с высокими выходами (70-80%), за короткое время (1-2 часа) и без применения хроматографической очистки. В качестве аминопроизводного могут быть использованы эфиры тирозина и фенилаланина. Аналогично могут быть получены известные соединения X, XI, XII, XIII, XV, XVII, XIX, XX, XXII, XXIII, XXIV, синтез которых методом активированных N-оксисукцинимидных эфиров не описан в литературе.
Общая схема синтеза соединений общей формулы I методом активированных N-оксисукцинимидных эфиров представлена на Схеме 2.
Схема 2
Синтез гидроксифенилпропионилтирозина (XIV) может быть осуществлен также методом активированных N-оксисукцинимидных эфиров, причем с целью уменьшения числа стадий может быть использован незащищенный по С-концу тирозин. Кроме того, это позволяет избежать длительного воздействия щелочи, которая была бы необходима для омыления метилового эфира тирозина и могла бы неблагоприятно отразиться на оптической чистоте получаемого соединения [Шредер Э., Любке К. // Пептиды. / М., Мир, 1967, 2 т.; Гросс Э., Майенхофер И.// Пептиды. Основные методы образования пептидной связи / Москва, Мир, 1983 г., с.422]. Проблема весьма низкой растворимости незащищенного тирозина как в органических растворителях, так и в воде решена путем его перевода в растворимую Na-соль в результате добавления к суспензии тирозина в DMF 2-х эквивалентов 1N раствора NaOH, в результате чего наблюдалось полное растворение аминокислоты. Реакция полученного таким образом раствора аминопроизводного с N-оксисукцинимидным эфиром 3-(п-гидроксифенил)пропионовой кислоты проходит практически полностью и быстро (за 2 часа). После выделения экстракцией без применения хроматографической очистки, выход целевого (XIV) продукта составил около 63%.
Соединения общей формулы I также могут быть получены в виде фармацевтически приемлемых аддитивных солей с нетоксичными кислотами, такими как фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, лимонная кислота, винная кислота, оксалиновая кислота и подобные, и солей с основаниями, такими как гидроксид натрия, гидроксид калия, карбонат натрия и подобные.
Соединения общей формулы I обладают ингибирующей циклооксигеназу активностью и могут быть использованы для лечения болевых синдромов различного генеза, воспалительных и воспалительно-дегенеративных заболеваний суставов и соединительной ткани, а также костно-мышечной системы, других заболеваний, сопровождающихся воспалением.
В частности, соединения настоящего изобретения могут быть использованы для лечения послеоперационной боли, посттравматической боли, а также болевых синдромов гинекологической, неврологической, онкологической, стоматологической природы, ревматоидного артрита, артропатии, болезни Бехтерева, неспецифических спондилоартритов, подагрического артрита, остеоартроза, внесуставного ревматизма и тромбофлебита.
Соединения настоящего изобретения вводятся в эффективном количестве, которое обеспечивает желаемый терапевтический результат.
Для лечения болевых синдромов различного генеза, таких как послеоперационные боли, посттравматические боли, а также болевых синдромов гинекологической, неврологической, онкологической, стоматологической природы, воспалительных и воспалительно-дегенеративных заболеваний суставов и соединительной ткани, а также костно-мышечной системы, таких как ревматоидный артрит, артропатия, болезнь Бехтерева, неспецифические спондилоартриты, подагрический артрит, остеоартроз, внесуставный ревматизм и тромбофлебит, других заболеваний, сопровождающихся воспалением, соединения формулы (I) могут быть введены перорально, местно, парентерально, путем ингаляций и ректально в виде стандартных лекарственных форм, содержащих нетоксичные фармацевтически приемлемые носители. Используемый в настоящем описании термин «парентеральное введение» означает подкожные, внутривенные, внутримышечные или внутригрудные инъекции или вливания.
Соединения настоящего изобретения могут быть введены пациенту в дозах, составляющих от 0,1 до 10 мг/кг веса тела в день, предпочтительно в дозах от 0,5 до 5 мг/кг один или более раз в день.
При этом следует отметить, что конкретная доза для каждого конкретного пациента будет зависеть от многих факторов, включая активность данного используемого соединения, возраст, вес тела, пол, общее состояние здоровья и режим питания пациента, время и способ введения лекарственного средства, скорость его выведения из организма, конкретно используемую комбинацию лекарственных средств, а также тяжесть заболевания, подвергаемого лечению.
Фармацевтические композиции по настоящему изобретению содержат соединение по настоящему изобретению в количестве, эффективном для достижения желаемого результата, и могут быть введены в виде стандартных лекарственных форм (например, в твердой, полутвердой или жидкой формах), содержащих соединения настоящего изобретения в качестве активного ингредиента в смеси с носителем или наполнителем, пригодным для внутримышечного, внутривенного, перорального, сублингвального, ингаляционного и интраректального введения. Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, драже, суппозиториев, эмульсий, суспензий, мазей, гелей и любых других лекарственных форм.
В качестве наполнителей могут быть использованы различные вещества, такие как сахариды, например глюкоза, лактоза или сахароза, манит или сорбит, производные целлюлозы и/или фосфаты кальция, например, трикальций фосфат или кислый фосфат кальция, в качестве связующего компонента могут быть использованы такие, как крахмальная паста, например кукурузный, пшеничный, рисовый, картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидон. При необходимости могут быть использованы разрыхляющие агенты, такие как вышеупомянутые крахмалы и карбоксиметилкрахмал, поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Могут быть использованы необязательные добавки, такие как агенты, регулирующие текучесть, и смазывающие агенты, такие как диоксид кремния, тальк, стеариновая кислота и ее соли, такие как стеарат магния или стеарат кальция и/или пропиленгликоль.
Ядро драже обычно покрывают слоем, который устойчив к действию желудочного сока. Для этой цели могут быть использованы концентрированные растворы сахаридов, которые могут необязательно содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, и подходящие органические растворители или их смеси.
В качестве добавок могут быть также использованы стабилизаторы, загустители, красители и отдушки.
В качестве мазевой основы могут быть использованы углеводородные мазевые основы, такие как вазелин белый и желтый (Vaselinum album, Vaselinum flavum), вазелиновое масло (Oleum Vaselini), мазь белая и жидкая (Unguentum album, Unguentum flavum), а в качестве добавок для придания более плотной консистенции, такие как твердый парафин и воск; абсорбтивные мазевые основы, такие как гидрофильный вазелин (Vaselinum hydrophylicum), ланолин (Lanolinum), кольдкрем (Unguentum leniens); мазевые основы, смываемые водой, такие как гидрофильная мазь (Unguentum hydrophylum); водорастворимые мазевые основы, такие как полиэтиленгликолевая мазь (Unguentum Glycolis Polyaethyleni), бентонитовые основы и другие.
В качестве основы для гелей могут быть использованы метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, оксипропилцеллюлоза, полиэтиленгликоль или полиэтиленоксид, карбопол.
В качестве основы для суппозитория могут быть использованы основы, нерастворимые в воде, такие как масло какао;
основы, растворимые в воде или смешиваемые с водой, такие как желатино-глицериновые или полиэтиленоксидные; комбинированные основы - мыльно-глицериновые.
При приготовлении стандартной лекарственной формы количество активного ингредиента, используемого в комбинации с носителем, может варьироваться в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства.
Так, например, при использовании соединений настоящего изобретения в виде растворов для инъекций, содержание активного агента в них составляет 0,01-5%. В качестве разбавителей могут быть использованы 0,9% раствор хлорида натрия, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы, специфические добавки для растворения. При введении в организм соединений настоящего изобретения в виде таблеток и суппозиториев, их количество составляет 5,0-500 мг на стандартную лекарственную форму.
Лекарственные формы настоящего изобретения получают по стандартным методикам, таким как, например, процессы смешивания, гранулирования, формирование драже, растворение и лиофилизация.
Следует отметить, что соединения настоящего изобретения проявляют биологическую активность в дозах на два-три порядка ниже по сравнению с известными препаратами, использованными для сравнения, при практически одинаковой эффективности, и для них не выявлено отрицательных побочных действий и не обнаружено противопоказаний к применению. При этом, при исследовании токсичности соединений настоящего изобретения в дозе 1000 мкг/кг, перорально, не зарегистрировали гибели экспериментальных животных.
Детальное описание соединений настоящего изобретения, их получения и исследования фармакологической активности представлено в нижеследующих примерах, предназначенных для иллюстрации предпочтительных вариантов изобретения и не ограничивающих его объем.
Примеры синтеза соединений настоящего изобретения
В качестве исходных соединений в синтезе использовали п-гидроксифенилуксусную кислоту, 3-(п-гидроксифенил)пропионовую кислоту, 3-фенилпропионовую кислоту ("Sigma", США), фенилэтиламин, тирамин ("Fluka", Швейцария).
Индивидуальность полученных соединений проверяли методом ТСХ на пластинках "Kieselgel 60 F254" ("Merck", Германия) в системе растворителей: хлороформ - метанол 9:1 (1).
Хроматограммы проявляли хлор-толидиновым реактивом, нингидрином, йодом и по свечению в УФ-свете.
1H-ЯМР регистрировали на приборе "АМХ-400 Bruker" (Германия).
ИК-Фурье спектры снимали в таблетках KBr на приборе "Magna 750" ("Nicolet" США).
Температуру плавления определяли на приборе "Boetius" (Германия).
Масс-спектры высокого разрешения получали на времяпролетном масс-спектрометре методом матриксной лазернодесорбционной ионизации, с использованием в качестве матрицы 2,5-дигидроксибензойной кислоты, на приборах и REFLEX™ III (Bruker, Германия).
Аналитическую обращенно-фазовую ВЭЖХ проводили на приборах:
- хроматограф "Breeze", детектор "Waters" (США), детекция при 214 нм, скорость элюирования 1 мл/мин, в условиях (1): колонка Symmetry 300 C18, 4,6×250 мм, 20 мкм, элюция 0,1%-ной TFA с градиентом 0,09% TFA в смеси 60:40 ацетонитрил-вода от 0% до 100% за 15 мин; в условиях (2): колонка Symmetry 300 C18, 3,9×150 мм, 5 мкм, элюция 0,1%-ной водной TFA с градиентом ацетонитрила от 0% до 60% за 18 мин;
- хроматографах "System Gold" ("Beckman", США), скорость элюирования 0,25 мл/мин, детекция при 220 нм, в условиях (3): колонка "Phenomenex" (США) C18, 2×250 мм, 5 мкм, элюция 0,1%-ной TFA с градиентом 0,08% TFA в 100% MeCN от 0% до 100% за 50 мин.
Пример 1
п-Гидроксифенилацетилтирамин (VII)
Методика А.
При перемешивании к раствору 0,40 г (2,63 ммоль) п-гидроксифенилуксусной кислоты в 3,5 мл DMF прибавляли 0,35 г (2,63 ммоль) тирамина. Раствор охлаждали до -10°С и прибавляли 0,68 мл (3,16 ммоль) дифенилфосфорилазида и 0,44 мл (3,16 ммоль) триэтиламина. Перемешивали 2 ч при -10°С и оставляли при 20°С на 15 ч. К реакционной массе прибавляли 35 мл воды, экстрагировали 20 мл этилацетата. Этилацетатный слой промывали 10 мл 5% раствора Na2CO3, водой до pH 7, 10 мл 5% раствора HCl, водой до pH 7. Этилацетатный слой сушили над Na2SO4, отфильтровывали Na2SO4, этилацетат удаляли в вакууме. Маслообразный остаток растирали со смесью эфир-гексан (1:1). Образующийся белый осадок отфильтровывали и сушили в вакууме над CaCl2. Выход 0,68 г (95%).
Rf 0,7 (1).
Тпл= 147-149°С.
[М]+ 271,6.
1H-ЯМР, CD3OD, δ, м.д.: 2,65 (т, J=7 Гц, 2H, α-CH2-TA), 3,29-3,32 (м, 4H, β-CH2-TA, CH2-(OH-PhAc)), 6,63-6,75 (м, 4H, o-CH-аром.), 6,90-7,06 (м, 4H, м-CH-аром.).
ИК-Фурье, см-1: 3276 (вал. OH); 3108 (вал., =C-H, аром.); 1612 (амид I); 1591 (амид II); 1515 (аром. -C-C-); 1226 (вал., -C-O, фенольный).
Найдено, %: С 70,57; H 6,43; N 5,50 C16H17NO3.
Вычислено, %: С 70,83; H 6,32; N 5,16.
ВЭЖХ в условиях (2): индивидуальный пик, время удерживания 8,71 мин.
Методика Б
К раствору 0,70 г (4,60 ммоль) п-гидроксифенилуксусной кислоты в 17 мл этилацетата при перемешивании прибавляли 0,53 г (4,60 ммоль) N-гидроксисукцинимида, раствор охлаждали до 0°С и прибавляли 0,95 г (4,60 ммоль) N,N'- дициклогексилкарбодиимид (DCC). Перемешивали 2 часа при 0°С и оставили на 20 часов при 4°С. Осадок N,N'- дициклогексилмочевины (DCU) отфильтровали. Растворитель удалили в вакууме. Маслообразный остаток растирали с гексаном. Образовавшийся белый твердый осадок отфильтровывали, промывали гексаном и сушили в вакууме над CaCl2. Получили 1,08 г (94,6%). Rf 0,58 (1).
При перемешивании к раствору 0,30 г (1,2 ммоль) N-оксисукцинимидного эфира п-гидроксифенилуксусной кислоты в 8 мл N,N-диметилформамида (DMF) прибавляли 0,16 г (1,2 ммоль) тирамина. Реакционную смесь перемешивали 2 часа при 20°С, оставляли при 4°С на 20 часов. DMF удаляли в вакууме. Маслообразный остаток растирали с водой. Образующийся белый осадок отфильтровывали, промывали водой. Выход 0,26 г (80%).
Rf 0,68 (1).
Тпл= 146-148°С.
[М+H]+ 272,3.
Найдено, %: С 71,05; H 6,10; N 5,25 C16H17NO3.
Вычислено, %: С 70,83; H 6,32; N 5,16.
Пример 2
п-Гидроксифенилацетилфенилэтиламин (VIII)
Синтез проводили в соответствии с методикой А, приведенной для соединения VII.
Выход 0,57 г (90,5%).
Rf 0,82 (1).
Тпл= 69-70°С.
[М]+ 255,5.
1Н-ЯМР DMSO-d6, δ, м.д.: 2,68 (т, J=8Гц, 2H, β-CH2-PEA), 3,22-3,26 (м, α-CH2- PEA), 3,36 (с, 2H, CH2-(OH-PhAc)), 6,66 (д, J=4Гц, 2H, м-CH-аром. OH-PhAc), 7,00 (д, J=4Гц, 2H, м-CH-аром. OH-PhAc), 7,14-7,28 (м, 5H, аром.-CH-PEA), 8,0 (уш с., 1H, NH-PEA), 9,20 (с, 1H, OH-(OH-PhAc)).
ИК-Фурье, см-1: 3332 (вал. OH); 3087 (вал., =C-H, аром.); 1626 (амид I); 1558 (амид II); 1515 (аром. -C-C-); 1249 (вал., -C-O, фенольный).
Найдено, %: С 75,57; H 6,80; N 5,77 C16H17NO2.
Вычислено, %: С 75,27; H 6,71; N 5,49.
ВЭЖХ в условиях (2): индивидуальный пик, время удерживания 11,17 мин.
Синтез проводили в соответствии с методикой Б, приведенной для соединения VII.
Выход 0,50 г (79,4%).
Rf 0,85 (1).
Тпл= 68-70°С.
[М]+ 255,7.
Найдено, %: С 75,17; H 6,87; N 5,75 C16H17NO2.
Вычислено, %: С 75,27; H 6,71; N 5,49.
Пример 3
3-(п-Гидроксифенил)пропионилтирамин (X)
Синтез проводили в соответствии с методикой А, приведенной для соединения VII.