Способ получения 7-замещенного-3-хинолин и 3-хинол-4-он карбонитрилов
Иллюстрации
Показать всеИзобретение относится к альтернативному способу получения 7-замещенных-3-хинолинкарбонитрилов, которые обладают большой эффективностью в качестве ингибиторов протеинкиназ. Способ включает взаимодействие соответствующего соединения формулы (IIA) с соединением формулы R2ХН с получением 7-замещенного-3-хинолина или хинолонкарбонитрила формулы (IA). 13 з.п. ф-лы.
Реферат
Предпосылки изобретения
Данное изобретение относится к способу получения 7-замещенных-3-хинолинкарбонитрилов и промежуточных соединений, используемых для получения 7-замещенных-3-хинолинкарбонитрилов и их фармацевтически приемлемых солей.
Протеинкиназы представляют собой ферменты, которые катализируют преобразование фосфатной группы при ATP до аминокислотного остатка белка, такого как тирозин, серин, треонин или гистидин. Регуляция этих протеинкиназ имеет огромное значение для контроля большого разнообразия клеточных событий, включая пролиферацию и миграцию. Специфические протеинкиназы вовлечены в различные состояния, включая рак [Traxler, P. M., Exp. Opin. Ther. Patents, 8,1599 (1998); Bridges, A. J., Emerging Drugs, 3,279 (1998)], рестеноз [Mattsson, E., Trends Cardiovas. Med. 5,200 (1995); Shaw, Trends Pharmacol. Sci. 16,401 (1995)], атеросклероз [Raines, E. W., Bioessays, 18,271 (1996)], ангиогенез [Shawver, L. K., Drug Discovery Today, 2,50 (1997); Folkman, J., Nature Medicine, 1,27 (1995)] и остеопороз [Boyce, J. Clin. Invest., 90,1622 (1992)] и инсульт (Paul, R. et al. Nature Medicine, 7 (2), 222 (2001). Эффективное получение соединений, которые ингибируют протеинтирозинкиназы и могут использоваться при лечении рака, имеет огромное значение.
Соединения, описанные в WО9843960 (патент США 6002008), представляют собой производные 3-хинолинкарбонитрила, которые ингибируют протеинтирозинкиназы и могут использоваться для лечения рака. Вышеуказанные соединения получали способами, которые эффективны для первоначального получения заданных соединений. Однако желателен новый, эффективный альтернативный источник важных промежуточных соединений, эффективных для получения производных 3-хинолинкарбонитрила. Кроме того, желателен альтернативный способ получения 7-замещенных-3-хинолинкарбонитрилов.
Дополнительный ряд новых 3-хинолинкарбонитрилов, которые также являются высокоэффективными ингибиторами протеинтирозинкиназ и эффективны для лечения рака, был описан в опубликованной заявке WO 00/18740. Также в ней были описаны подходящие способы получения 3-хинолинкарбонитрилов, однако в данной области до сих пор существует потребность в еще более подходящих способах получения важных промежуточных веществ и конечных продуктов, эффективных для получения 3-хинолинкарбонитрилов, которые могут использоваться при лечении рака.
Следовательно, способы получения 7-замещенных-3-хинолинкарбонитрилов и промежуточных соединений, способствующих их получению, имеют большую ценность.
Объектом данного изобретения является альтернативный способ получения 7-замещенных-3-хинолинкарбонитрилов и промежуточных соединений, которые могут использоваться в способе получения 7-замещенных-3-хинолинкарбонитрилов, которые обладают большой эффективностью в качестве ингибиторов протеинкиназ, которые могут использоваться для лечения рака.
Объектом данного изобретения является новый способ получения 7-замещенных-3-хинолинкарбонитрилов путем замещения 7-фторгруппы у 7-фтор-4-(замещенных амино)хинолинкарбонитрилов.
Дополнительным объектом настоящего изобретения является новый способ получения 7-замамещенных-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов путем замещения 7-фтор группы у 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов.
Краткое описание изобретения
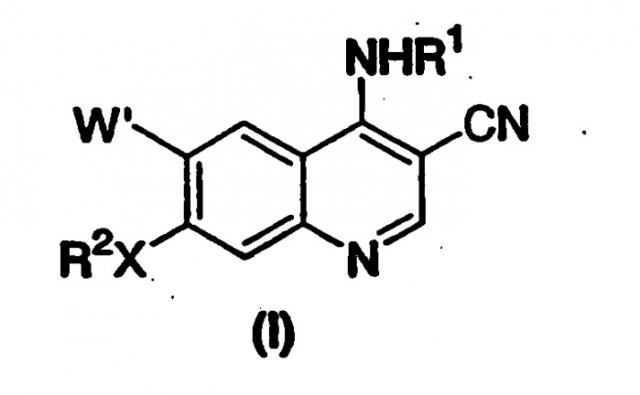
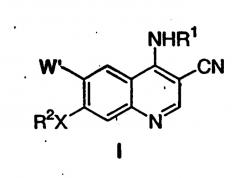
Настоящее изобретение относится к способу получения 7-замещенных-3-хинолинкарбонитрилов формулы (I)
где X выбран из -O-, -S-, -NH- и -NR2'-;
W' представляет собой H или -OR3;
q равно целому числу от 0 до 5;
m равно целому числу от 0 до 2;
n равно целому числу от 2 до 5;
R1 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, циклоалкильную группу, содержащую от 3 до 10 атомов углерода, или арил, содержащий от 6 до 12 атомов углерода, или гетероарильное кольцо, указанное арильное или гетероарильное кольцо необязательно конденсировано с дополнительным арильным или гетероарильным кольцом, где гетероарил определен как 5- или 6-членная ароматическая кольцевая группа, содержащий, по крайней мере, от одного до 4 гетероатомов, выбранных из O, S и N; указанные арильные или гетероарильные кольца, необязательно конденсированные, могут необязательно быть замещены от 1 до 4 заместителями, независимо выбранными из группы, состоящей из -J, -NO2, -NH2, -OH, -SH, -CN, -N3, -COOH, -CONH2, -NHC(O)nH2, -C(O)H, -CF3, -OCF3,
-R4, -OR4, -NHR4, -NR4R4, -S(O)mR4, -NHSO2R4, -R5OH, -R5OR4, -R5NH2, -R5NHR4,
-R5NR4R4, -R5SH, -R5S(O)mR4, -NHR6OH, -N(R4)R6OH, -N(R4)R6OR4, -NHR6NH2,
-NHR6NHR4, -NHR6NR4R4, -N(R4)R6NH2, -N(R4)R6NHR4, -N(R4)R6NHR4R4, -OR6OH,
-OR6OR4, -OR6NH2, -OR6NHR4, -OR6NR4R4, -OC(O)R4, -NHC(O)R4, -NHC(O)NHR4,
-OR6C(O)R4, -NHR5C(O)R4, -C(O)R4, -C(O)OR4, -C(O)NHR4, -C(O)NR4R4, -R5C(O)H,
-R5C(O)R4, -R5C(O)OH, -R5C(O)OR4, -R5C(O)NH2, -R5C(O)NHR4, -R5C(O)NR4R4,
-R5OC(O)R4, -R5OC(O)NH2, -R5OC(O)NHR4 и -R5OC(O)NR4R4, и -YR7 групп, где Y независимо выбран из -C(O)-, -C(O)O-, -OC(O)-, -C(O)NH-,
-NHC(O)-, -NHSO2-, -SO2NH-, -C(OH)H-, -Q(C(R8)2)q-,
-(C(R8)2)q-, -(C(R8)2)qQ-, -C≡-,
цис- и транс-CH=CH- и циклоалкила, содержащего 3-10 атомов углерода;
Q представляет собой -O-, -S(O)m-, -NH- или -NR9-;
J представляет собой галоген, выбранный из фтора, хлора, брома и йода;
R2, R2' и R3 каждый независимо выбран из алкильной группы, содержащей от 1 до 6 атомов углерода, алкенильной группы, содержащей от 2 до 6 атомов углерода или алкинильной группы, содержащей от 2 до 6 атомов углерода, где каждая алкильная, алкенильная или алкинильная группа независимо необязательно замещена -NO2, циано или -QR4, или каждый R2, R2' и R3 независимо выбран из -(C(R8)2)q-арила, -(C(R8)2)q-гетероарила, -(C(R8)2)q-гетероциклила, -(C(R8)2)n-Q-(C(R8)2)q-арила, -(C(R8)2)n-Q-(C(R8)2)q-гетероарила, -(C(R8)2)n-Q-(C(R8)2)q-гетероциклила, -(C(R8)2)n-Q-(C(R8)2)n-Q-арила, -(C(R8)2)n-Q-(C(R8)2)n-Q-гетероарила и -(C(R8)2)n-Q-(C(R8)2)n-Q-гетероциклила, где гетероциклильная группа может быть необязательно замещена на углероде или азоте группой, выбранной из -R4, -(C(R8)2)q-арила, -(C(R8)2)q-гетероарила, -(C(R8)2)q-гетероциклила, -(C(R8)2)q-QR4, или гетероциклильная группа может быть необязательно замещена на углероде -(C(R)2)q-QR4, или гетероциклильная группа может быть необязательно замещена на азоте -(C(R8)2)n-QR4, и также, где арильная или гетероарильная группа может быть необязательно замещена группой, выбранной из -NO2, циано, -R4, -(C(R8)2)q-арила,
-(C(R8)2)q-гетероарила, -(C(R8)2)q-гетероциклила, -(C(R8)2)q-SO2R4 и -(C(R8)2)q-QR4 и дополнительно предусматривается, что R2 и R2' могут быть необязательно, взятые вместе с атомом азота, к которому они присоединены, образовывать гетероциклическое кольцо, которое необязательно содержит дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанное образованное гетероциклическое кольцо может быть необязательно замещено на атоме углерода или азота группой -R4, или указанное гетероциклическое кольцо может быть необязательно замещено на атоме углерода -(C(R8)2)q-QR4, или указанное гетероциклическое кольцо может быть необязательно замещено на атоме азота -(C(R8)2)n-QR4; R4 представляет собой моновалентную группу, независимо выбранную из алкила, состоящего из 1-6 атомов углерода, алкенила, состоящего из 2-6 атомов углерода и алкинила, состоящего из 2-6 атомов углерода; R5 представляет собой бивалентную группу, независимо выбранную из алкила, состоящего из 1-6 атомов углерода, алкенила, состоящего из 2-6 атомов углерода, и алкинила, состоящего из 2-6 атомов углерода;
R6 представляет собой бивалентную алкильную группу, состоящую из 2-6 атомов углерода;
R7 представляет собой циклоалкильное кольцо, состоящее из 3-10 атомов углерода, необязательно замещенных одной или несколькими алкильными группами, состоящими из 1-6 атомов углерода, или арильное или гетероарильное кольцо, необязательно конденсированное с дополнительным арильным или гетероарильным кольцом, где указанное арильное или гетероарильное кольцо, необязательно конденсированное, может быть необязательно замещено от 1 до 4 заместителями, выбранными из группы, содержащей арил, -CH2-арил, -NH-арил, -O-арил, -S(O)m-арил, -J, -NO2, -NH2, -OH, -SH, -CN, -N3, -COOH, -CONH2, -NHC(O)NH2, -C(O)H, -CF3, -OCF3, -R4, -OR4, -NHR4, -NR4R4, -S(O)mR4, -NHSO2R4, -R5OH, -R5OR4, -R5NH2, -R5NHR4, -R5NR4R4, -R5SH, -R5S(O)mR4, -NHR6OH, -NHR6OR4, -N(R4)R6OH, -N(R4)R6OR4, -NHR6NH2, -NHR6NHR4, -NHR6NR4R4, -N(R4)R6NH2, -N(R4)R6NHR4, -N(R4)R6NHR4R4, -OR6OH, -OR6OR4, -OR6NH2, -OR6NHR4, -OR6NR4R4, -OC(O)R4, -NHC(O)R4,-NHC(O)NHR4, -OR5C(О)R4,
-NHR5C(O)R4, -C(О)R4, -С(О)OR4, -C(O)NHR4, -С(О)nR4R4, -R5C(O)H,
-R5C(O)R4, -R5C(O)OH, -R5C(O)OR4, -R5C(O)NH2, -R5C(O)NHR4,
-R5С(O)NR4R4, -R5OC(O)R4, -R5OC(О)NH2, -R5OC(O)NHR4 и -R5OC(O)NR4R4;
R8 представляет собой -Н или -R4;
R9 представляет собой моновалентную алкильную группу, содержащую от 1 до 6 атомов углерода; и
и их фармацевтически приемлемых солей;
который включает в себя стадию:
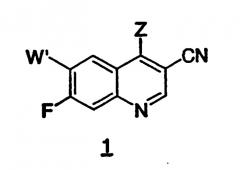
а) взаимодействия 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрила формулы (II)
с галогенирующим агентом формулы PO(Z)3 с получением 7-фтор-3-хинолинкарбонитрила 1, где Z представляет собой Cl или Br
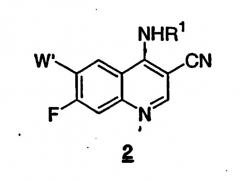
b) взаимодействия 7-фтор-3-хинолинкарбонитрила формулы 1 стадии a) с амином формулы R1NH2, например, в присутствии гидрохлорида пиридина, с получением 7-фтор-4-(замещенный амино)-3-хинолинкарбонитрила формулы 2
c) взаимодействия 7-фтор-4-(замещенный амино)-3-хинолинкарбонитрила формулы 2 стадии b) с соединением формулы R2XH, где X выбран из -S-, -O-, -NH-и -NR2'-, и где R2 и R2' такие, как определено выше, или R2 и R2', взятые вместе с атомом азота, к которому каждый из них присоединен, могут необязательно образовывать гетероциклическое кольцо, и в присутствии основания, если X представляет собой -O-или -S-, с получением 7-замещенного-3-хинолинкарбонитрила формулы (I)
и если желательно, стадию преобразования соединения формулы (I) в соответствующую фармацевтически приемлемую соль обычными способами, и, если желательно, преобразование соответствующей фармацевтической соли до соединения формулы (I) обычными способами.
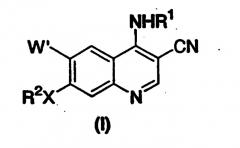
Данное изобретение также относится к способу получения 7-замещенных-3-хинолинкарбонитрилов формулы (I)
где переменные такие, как определено выше, который включает в себя стадию:
взаимодействия 7-фтор-4-(замещенный амино)-3-хинолинкарбонитрила формулы 2
С соединением формулы R2XH, где X выбран из -S-, -O-, -NH- и NR2'-, и где R2' и R2 такие, как определено выше, или R2 и R2' взятые вместе с атомом азота, к которому каждый из них присоединен, могут необязательно образовывать гетероциклическое кольцо, и в присутствии основания, если X представляет собой -O-или -S-, с получением 7-замещенного-3-хинолинкарбонитрила формулы (I),
и, если желательно, стадию преобразования соединения формулы (I) до соответствующей фармацевтически приемлемой соли обычными способами и, если желательно, преобразования соответствующей фармацевтически приемлемой соли до соединения формулы (I) обычными способами.
Данное изобретение также относится к способу получения 7-замещенных-3-хинолинкарбонитров формулы (I)
где переменные такие, как определено выше,
который включает в себя стадию:
a) взаимодействия 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрила формулы (II)
с соединением формулы R2XH, где X выбран из -S-, -O-, -NH- и -NR2'-, и где R2 и R2' такие, как определено выше, или R2 и R2', взятые вместе с атомом азота, к которому каждый из них присоединен, могут необязательно образовывать гетероциклическое кольцо, и в присутствии основания, если X представляет собой -O-или -S-, с получением 7-замещенного-4-оксо-1,4-дигидро-3-хинолинкарбонитрила формулы 3
b) взаимодействия 7-замещенного-4-оксо-1,4-дигидро-3-хинолинкарбонитрила стадии a) с галогенирующим агентом, например, формулы PO(Z)3, с получением 7-замещенного-4-галоген-3-хинолинкарбонитрила 4, где Z представляет собой Cl или Br
c) взаимодействия 7-замещенного-4-галоген-3-хинолинкарбонитрила стадии b) с амином R'NH2, например, в присутствии гидрохлорида пиридина, с получением 7-замещенного-3-хинолинкарбонитрила формулы (I)
и, если желательно, стадию преобразования соединения формулы (I) до соответствующей фармацевтически приемлемой соли обычными способами, и если желательно, преобразования соответствующее фармацевтически приемлемой соли до соединения формулы (I) обычными способами.
Данное изобретение также относится к способу получения 7-замещенного-4-оксо-1,4-дигидро-3-хинолинкарбонитрила формулы 3
где переменные такие, как определено выше,
который включает в себя стадию:
взаимодействия 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрила формулы (II)
с соединением формулы R2XH, где X выбран из -S-, -O-, -NH- и NR2'-, и где R2 и R2', взятые вместе с атомом азота, к которому каждый из них присоединен, могут необязательно образовывать гетероциклическое кольцо, и в присутствии основания, если X представляет собой -O- или -S-, с получением 7-замещенного-4-оксо-1,4-дигидро-3-хинолинкарбонитрила формулы 3
Подробное описание изобретения
Способ по настоящему изобретению проиллюстрирован нижеприведенными схемами реакций. Пути получения 7-замещенных-3-хинолинкарбонитрилов по данному изобретению, относящиеся к формуле (I), описаны ниже, начиная со схемы 1. 7-Фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилы формулы (II), где W' представляет собой -H или -OR3, преобразовывали до 7-фтор-3-хинолинкарбонитрилов 1, где Z представляет собой группу хлора или брома, путем обработки галогенирующим агентом, который включает в себя, но ими не ограничивается, оксихлорид фосфора и оксибромид фосфора, либо неразбавленным, либо, необязательно, в присутствии растворителя, который включает в себя, но ими не ограничивается, дихлорметан. Взаимодействие 7-фтор-3-хинолинкарбонитрила 1 с амином R1NH21a, где R1 такой, как определено здесь, может осуществляться в растворителе, таком как 2-этоксиэтанол в присутствии каталитического или эквивалентного количества гидрохлорида пиридина с образованием промежуточных 7-фтор-4-(замещенных амино)-3-хинолинкарбонитрилов 2, где W' такой, как определено здесь. Предпочтительно амин R1NH21a представляет собой замещенный анилин, где R1 представляет собой замещенный арил. Замещение 7-фторгруппы 7-фтор-4-(замещенный амино)-3-хинолинкарбонитрилов 2 алкоксидным или тиоалкоксидным анионом приводит к образованию 7-замещенных-3-хинолинкарбонитрилов формулы (I). Эту реакцию можно осуществлять, используя в качестве сорастворителя избыток R2OH или тиола R2SH, или, необязательно, можно использовать сорастворитель, такой как N,N-диметилформамид, диметилсульфоксид или N-метилпирролидон. Анион может быть получен из спирта или тиола 2a, где X представляет собой O или S, используя основания. Подходящие основания включают в себя натрий, гидрид натрия, калий и гидрид калия. Предпочтительными основаниями являются натрий и гидрид натрия. Если возможно, могут использоваться коммерчески доступные натриевые соли спирта или тиола 2a, где X представляет собой O или S. Взаимодействие соединения формулы R2XH 2a, где X представляет собой -NH-, -NR2'-, и где R2' и R2, взятые вместе с атомом азота, к которому они присоединены, могут, необязательно, образовывать гетероциклическое кольцо, приводит к получению 7-замещенных-3-хинолинкарбонитрилов формулы (I).
Схема 1
В данном случае примерами R1 в формуле являются 2,4-дихлор-5-метоксифенил; циклопентил; бутил; 3,4,5-триметоксифенил; 3-хлор-4-(1-метил-1H-имидазол-2-ил)сульфанил]фенил; 2,4-дихлорфенил; 2-хлор-5-метоксифенил; 5-метокси-2-метилфенил и 2,4-диметилфенил.
В данном случае примерами R2 в формуле являются: 2-бутинил; 3-диметиламино-2,2-диметилпропил; 3-(1,1-диоксидо-4-тиоморфолинил)пропил; 2-[2-(1-пиперазинил)этокси]этил; 2-тиенилметил; бензил; этил; фенил; 2-метоксиэтил; пиридин-4-ил; 2-(1-метилпиперидин-4-ил)этил; 2-(1-метил-3-пиперидинил)метил; 2-(1-метил-4-пиперидинил)метил; 2-(2-метокси)этил; 3-(диметиламино)пропил; 3-(4-этил-1-пиперазинил)пропил; (1-метилпиперидин-4-ил)метил; тетрагидро-2H-пиран-2-илметил; 3-(1-метилпиперидин-4-ил)пропил; (3-(диметиламино)пропил)метил-3-(4-метил)пиперазин-1-ил)пропил; 1-метилпиперидин-4-ил)метил; 1-метилпиперидин-4-ил)метил; 3-(1-метилпиперидин-4-ил)пропил; 3-(4-метил-1-пиперазинил)пропил; (1-этилпиперидин-4-ил)метил; (1-метилпиперидин-2-ил)метил; пиперидин-4-илметили и 3-(диметиламино)пропил.
Предпочтительное соединение формулы (I), полученное способом по настоящему изобретению, выбрано из группы, включающей:
7-(2-Бутинилокси)-4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-(3-диметиламино-2,2-диметилпропокси)-6-метокси-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-[3-(1,1-диоксидо-4-тиоморфолинил)пропокси]-6-метокси-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-{2-[2-(1-пиперазинил)этокси]этокси}-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-(2-тиенилметокси)-3-хинолинкарбонитрил;
7-Бензилокси-4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-этилсульфанил-6-метокси-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-фенилсульфанил-3-хинолинкарбонитрил;
4-Циклопентиламино-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбонитрил;
4-Бутиламино-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбонитрил;
7-Бензилтио-4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-(пиридин-4-илокси)-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[2-(1-метилпиперидин-4-ил)этокси]-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[2-метоксиэтокси]-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[2-(1-метил-3-пиперидинил)метокси]-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[2-(1-метил-4-пиперидинил)метокси]-3-хинолинкарбонитрил;
6-Метокси-7-[2-метоксиэтокси]-4-[(3,4,5-триметоксифенил)амино]-3-хинолинкарбонитрил;
6-Метокси-7-[(1-метилпиперидин-4-ил)метокси]-4-[(3,4,5-триметоксифенил)амино]-3-хинолинкарбонитрил;
4-({3-Хлор-4-[(1-метил-1H-имидазол-2-ил)сульфанил]фенил}аино)-6-метокси-7-[2-(2-метокси)этокси]-3-хинолинкарбонитрил;
4-({3-Хлор-4-[(1-метил-1H-имидазол-2-ил)сульфанил]фенил}аино)-7-[3-(диметиламино)пропокси]-6-(2-метоксиэтокси)-3-хинолинкарбонитрил;
4-({3-Хлор-4-[(1-метил-1H-имидазол-2-ил)сульфанил]фенил}аино)-7-[3-(4-этил-1-пиперазинил)пропокси]-6-(2-метоксиэтокси)-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-[2-метоксиэтокси]-7-[(1-метилпиперидин-4-ил)метокси]-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-(2-метоксиэтокси)-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-(тетрагидро-2H-пиран-2-идметокси)3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-(2-метоксиэтокси)-6-(2-морфолин-4-илэтокси)3-хинолинкарбонитрил;
4-[3-Хлор-4-(1-метил-1H-имидазол-2-илсульфанил)фениламино]-6-метокси-7-(4-метилпиперазин-1-ил)хинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-{[3-(1-метилпиперидин-4-ил)пропил]амино}хнолин-3-карбонитрил;
4-[3-Хлор-4-(1-метил-1H-имидазол-2-илсульфанил)фениламино]-7-{[3-(диметил)аминопропил]амино}-6-метоксихинолин-3-карбонитрил;
4-[3-Хлор-4-(1-метил-1H-имидазол-2-илсульфанил)фениламино]-7-{[3-(диметиламино)пропил]метиламино}-6-метоксихинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-[3-(4-метил)пиперазин-1-ил)пропокси]-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-[(1-метилпиперидин-4-ил)метокси]-3-хинолинкарбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-(2-метоксиэтокси)-3-хинолинкарбонитрил;
4-[(2,4-дихлорфенил)амино]-6-метокси-7-(2-метоксиэтокси)хинолин-3-карбонитрил;
4-[(2,4-диметил-5-метоксифенил)амино]-6-метокси-7-(2-метоксиэтокси)хинолин-3-карбонитрил;
4-[(2-Хлор-5-метоксифенил)амино]-6-метокси-7-(2-метоксиэтокси)хинолин-3-карбонитрил;
6-Метокси-7-(2-метоксиэтокси)-4-[(5-метокси-2-метилфенил)амино]хинолин-3-карбонитрил;
4-[(2,4-диметилфенил)амино]-6-метокси-7-(2-метоксиэтокси)хинолин-3-карбонитрил;
4-[(2,4-дихлорфенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил;
4-[(2,4-диметил-5-метоксифенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил;
6-Метокси-4-[(5-метокси-2-метилфенил)амино]-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил;
4-[(2-Хлор-5-метоксифенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил;
4-[(2,4-диметилфенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(1-метилпиперидин-4-ил)пропокси]хинолин-3-карбонитрил;
4-[(2-Хлор-5-метоксифенил)амино]-6-метокси-7-[3-(1-метилпиперидин-4-ил)пропокси]хинолин-3-карбонитрил;
6-Метокси-4-[(5-метокси-2-метилфенил)амино]-7-[3-(1-метилпиперидин-4-ил)пропокси]хинолин-3-карбонитрил;
4-[(2,4-диметилфенил)амино]-6-метокси-7-[3-(1-метилпиперидин-4-ил)пропокси]хинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]хинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-[(1-этилпиперидин-4-ил)метокси]-6-метоксихинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[(1-метилпиперидин-2-ил)метокси]хинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-(пиперидин-4-илметокси)хинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-{[3-(диметиламино)пропил]амино}-6-метоксихинолин-3-карбонитрил;
4-[(2,4-дихлор-5-метоксифенил)амино]-7-{[3-(диметиламино)пропил](метил)амино]-6-метоксихинолин-3-карбонитрил; и
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[(2-метоксиэтил)амино]хинолин-3-карбонитрил.
Альтернативный путь получения 7-замещенных-3-хинолинкарбонитрилов формулы (I), как описано в схеме 2. 7-Фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилы формулы (II) где W' такой, как определено здесь, преобразуют до 7-замещенных-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов 3, замещая 7-фторгруппу анионом алкокси или тиоалкокси. Это взаимодействие можно осуществлять, используя в качестве растворителя избыток спирта или тиола, или, необязательно, можно использовать сорастворитель, такой как N,N-диметилформамид, диметилсульфоксид или N-метилпирролидон. Анион может быть получен из спирта или тиола 2a, где X представляет собой O или S соответственно, используя основания. Подходящие основания включают в себя натрий, гидрид натрия, калий и гидрид калия. Предпочтительными основаниями являются натрий и гидрид натрия. Если возможно, могут использоваться коммерчески доступные натриевые соли спирта или тиола 2a, где X представляет собой O или S. Взаимодействие 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов формулы (II) с соединением формулы R2XH 2a, где X представляет собой -NH-, -NR2'-, и где R2' и R2, взятые вместе с атомом азота, к которому они присоединены, могут, необязательно, образовывать гетероциклическое кольцо, приводит к получению 7-замещенных-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов 3. Обработка 7-замещенных-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов 3 галогенирующим агентом PO(Z)3, где Z представляет собой группу хлора или брома, которая включает в себя, но ими не ограничивается, оксихлорид фосфора, оксибромид фосфора, либо неразбавленным, либо, необязательно, в присутствии сорастворителя, который включает в себя, но ими не ограничивается, дихлорметан, давала 7-замещенные-4-галоген-3-хинолинкарбонитрилы 4, которые затем взаимодействовали с амином 1a, где R1 такой, как определено здесь, может осуществляться в растворителе, таком как 2-этоксиэтанол, в присутствии каталитического или эквивалентного количества гидрохлорида пиридина с образованием промежуточных 7-замещенных-3-хинолинкарбонитрилов формулы (I). Предпочтительно амин R1NH21a представляет собой замещенный анилин, где R1 представляет собой замещенный арил.
Схема 2
Предпочтительное соединение формулы (I), полученное способом по настоящему изобретению, представляет собой:
4-[(2,4-дихлорфенил)амино]-7-(2-метоксиэтокси)хинолин-3-карбонитрил;
6-Бутокси-4-[(2,4-дихлор-5-метоксифенил)амино]-7-(2-метоксиэтокси)-3-хинолинкарбонитрил;
6-Метокси-7-(4-метилпиперазин-1-ил)-4-(4-феноксифениламино)хинолин-3-карбонитрил; и
6-Метокси-7-(1-метилпиперидин-4-илметокси)-4-{[4-(пиридин-3-илокси)фенил]амино}хнолин-3-карбонитрил.
Предпочтительное соединение формулы 3, полученное по способу по настоящему изобретению, выбрано из группы, включающей:
6-Метокси-7-(2-метоксиэтокси)-4-оксо-1,4-дигидро-3-хинолинкарбонитрил;
6-Метокси-7-(4-метил-пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбонитрил; и
7-(2-Метоксиэтокси)-4-оксо-1,4-дигидрохинолин-3-карбонитрил.
В соответствии с альтернативным подходом, как показано на схеме 3, для получения 7-замещенный-3-хинолинкарбонитрилов формулы (I) используется защитная группа для гидроксигруппы при C-6 3-хинолинкарбонитриле 5. Защитная группа обозначена как R3' и включает в себя, но этим не ограничивается, группы, включая бензил и изопропил, которые могут быть удалены с получением 6-гидроксипроизводного 6. В частности, если R3' представляет собой бензильную защитную группу, желаемая гидроксигруппа может быть получена обработкой трифторуксусной кислотой в присутствии тиоанизола. Кроме того, если R3' представляет собой изопропильную защитную группу, желаемое 6-гидроксипроизводное 6 может быть получено обработкой трихлоридом алюминия. Последующее взаимодействие 6-гидроксипроизводного 6 со спиртом R3OH 6a в присутствии трифенилфосфина (Ph3P), где Ph представляет собой фенил, и диэтилазодикарбоксилата (DEAD) в растворителе, таком как тетрагидрофуран, приводит к получению 4-галоген-3-хинолинкарбонитрилов 7.
Схема 3
Дополнительные промежуточные соединения могут быть получены, как показано на схеме 4, где 4-галоген-3-хинолинкарбонитрилы 8, в которых R2 и R3' такие, как определено здесь выше, подвергают защите, что приводит к получению 6-гидроксихинолинов 9, используя реакционные условия такие, как указаны для удаления защитных групп на схеме 3. Последующее взаимодействие 6-гидроксипроизводных 9 со спиртом R3OH 6a в присутствии трифенилфосфина (Ph3P), где Ph представляет собой фенил, и диэтилазодикарбоксилата (DEAD) в растворителе, таком как тетрагидрофуран, приводит к получению 4-галоген-3-хинолинкарбонитрилов 10, которые могут быть затем подвергнуты взаимодействию с амином R'NH21a, что приводит к получению 7-замещенных-3-хинолинкарбонитрилов 11. Предпочтительно амин R'NH2la представляет собой замещенный анилин, где R' представляет собой замещенный арил.
Схема 4
7-Замещенные-4-оксо-1,4-дигидро-3-хинолинкарбонитрилы 3 и 7-замещенные-4-галоген-3-хинолинкарбонитрилы 4 представляют собой ключевые промежуточные соединения, используемые при получении 7-замещенных-3-хинолинкарбонитрилов формулы (I). На схеме 5 показаны два альтернативных пути получения дополнительных ключевых промежуточных соединений, 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов формулы (II). Анилины 12 могут быть обработаны этил(этоксиметилен)цианоацетатом, либо самим по себе, либо, необязательно, в присутствии сорастворителя, такого как толуол, при температуре в области от приблизительно 60 до приблизительно 120°C, с последующей циклизацией при нагревании предпочтительно в эвтектической системе растворителей, которая включает смесь 3:1 дифенилового эфира (Ph-O-Ph) и бифенила (Ph-Ph) при температуре в области от приблизительно 240 до приблизительно 260°C, что приводит к получению 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов формулы (II). Альтернативно, анилин 12 подвергают взаимодействию с диэтил(этоксиметилен)малонатом, либо самим по себе, либо необязательно в присутствии сорастворителя толуола, при температуре в области от приблизительно 60 до приблизительно 120°C. Последующая циклизация при нагревании предпочтительно в эвтектической системе растворителей, которая включает смесь 3:1 дифенилового эфира и бифенила при температуре в области от приблизительно 240 до приблизительно 260°C, приводит к получению сложного эфира 13. Гидролиз сложного эфира 13 предпочтительно в щелочных условиях, таких как гидроксид натрия в спиртовом растворителе, таким как этанол, при температуре кипения с обратным холодильником, приводит к получению карбоновой кислоты 14. Преобразование карбоновой кислоты 14 в первичный амид 15 может быть осуществлено с помощью обработки активирующим агентом, который включает N,N-карбонилдиимидазол (CDI) или оксалилхлорид, с последующим добавлением либо газообразного аммиака, либо предпочтительно водного раствора гидроксида аммония. Дегидрирование первичного амида 15 с помощью реагента, такого как хлорангидрид циануроновой кислоты, в растворителе, таком как N,N-диметилформамид, что приводит к получению 7-фтор-4-оксо-1,4-дигидро-3-хинолинкарбонитрилов формулы (II).
Схема 5
Альтернативно соединения формулы (II) могут быть получены, как показано на схеме 6, исходя из соответствующей антраниловой кислоты или ее сложного эфира 16, где R10 представляет собой H или алкил, содержащий от 1 до 6 атомов углерода, путем взаимодействия с N,N-диметилформамид диметилацеталем или предпочтительно с N,N-диметилформамид диэтилацеталем необязательно в присутствии сорастворителя толуола при около 100-130°C с получением амидина 17. Взаимодействие аниона ацетонитрила, предпочтительно образующегося при взаимодействии н-бутиллития с ацетонитрилом в инертном растворителе, таком как тетрагидрофуран, при около -78°C, с амидином 17 приводит к получению соединений формулы (II).
Схема 6
Соединения по данному изобретению получают из следующих источников: (a) коммерчески доступные исходные продукты, (b) известные исходные продукты, которые могут быть получены методами, описанными в литературе, или (c) новые промежуточные соединения, описанные с помощью схем и представленных здесь экспериментальных методов.
Реакции осуществляют в растворителе, подходящем для реагентов и используемых продуктов и подходящем для осуществления необходимых преобразований. Специалисту в области органического синтеза понятно, что различные функциональные группы, представленные в молекулах, должны соответствовать предлагаемым химическим преобразованиям. Их необходимо оценивать с точки зрения последовательности стадий синтеза, защитных групп, если желательно, и условий удаления защитных групп. Заместители, имеющиеся у исходных продуктов, должны быть совместимы с некоторыми реакционными условиями. Такие требования к заместителям, которые должны соответствовать реакционным условиям, известны специалистам в данной области. Если необходимо, реакции проводят в атмосфере инертного газа.
Фармацевтически приемлемые соли являются производными таких органических и неорганических кислот, как уксусная, молочная, лимонная, винная, янтарная, яблочная, малоновая, глюконовая, хлористоводородная, бромистоводородная, фосфорная, азотная, серная, метансульфоновая и подобные известные приемлемые кислоты.
Алкил, как здесь используется, означает радикал с разветвленной или прямой цепью, содержащий от 1 до 6 атомов углерода, необязательно замещенную.
Алкенил, как здесь используется, означает радикал с разветвленной или прямой цепью, содержащий от 2 до 6 атомов углерода, необязательно замещенную. Цепь содержит по меньшей мере одну двойную связь.
Алкинил, как здесь используется, означает радикал с разветвленной или прямой цепью, содержащий от 2 до 6 атомов углерода, необязательно замещенную. Цепь содержит по меньшей мере одну тройную связь.
Алкокси, как здесь используется, означает алкил-O-группу, в которой алкильные группы такие, как описаны выше. Примеры алкоксигрупп включают в себя, но этим не ограничиваются, метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, и трет-бутокси.
Циклоалкил, как здесь используется, означает насыщенную кольцевую систему, содержащую от 3 до 10 атомов углерода. Предпочтительным является содержание 3 или 7 атомов углерода. Примеры циклоалкильных колец включают в себя, но этим не ограничиваются, циклопропил, циклобутил, циклопентил, циклогексил и тому подобное.
Арил, как здесь используется, означает моно- или бициклическое ароматическое кольцо, содержащее от 6 до 12 атомов углерода. Моноциклические кольца предпочтительно содержат 6 членов, и бициклические кольца предпочтительно содержат 8-, 9-, 10- или 12-членные кольцевые структуры. Примеры арильных групп включают в себя фенил, альфа-нафтил, бета-нафтил, инден и тому подобное, независимо замещенные одним или несколькими заместителями и более предпочтительно от 1 до 4 заместителями.
Гетероарил означает незамещенное или необязательно замещенное моноциклическое 5- или 6-членное кольцо, которое содержит от 1 до 4, или, в частности 1 или 2, гетероатома, которые могут быть одинаковыми или различными. Азот, кислород и сера являются предпочтительными гетероатомами, при условии, что гетероарил не содержит связи О-О, S-S или S-O. Конкретные примеры включают в себя тиофен, фуран, пиррол, пиразол, имидазол, 1,2,3-триазол, 1,2,4-триазол, тетразол, тиазол, оксазол, изотиазол, изоксазол, 1,3,4-оксадиазол, 1,2,4-оксадиазол, 1,3,4-тиадиазол, пиридин, пиримидин, пиразин, пиридазин и 1,3,5-триазин. Гетероарильное кольцо может быть окислено, когда гетероатом представляет собой атом азота, с получением соответствующего N-оксида, включая пиридин-N-оксид, или гетероциклическое кольцо может содержать карбонильную группу на одном из атомов углерода, например как в 1,3,4-оксадиазол-2-оне.
Бициклический гетероарил, как здесь используется, относится к насыщенным или частично ненасыщенным бициклическим конденсированным кольцам, содержащим от 8 до 20 кольцевых атомов, содержащих от 1 до 4 гетероатомов, которые могут быть одинаковыми или различными, независимо выбранными из азота, кислоро