3-фенилсульфонил-8-пиперазин-1-ил-хинолины, обладающие аффинностью к 5-ht6 рецептору, способы их получения (варианты)
Иллюстрации
Показать всеОписывается 3-фенилсульфонил-8-пиперазин-1-ил-хинолин формулы (I) или его фармацевтически приемлемая соль, где R1 и R2 представляют собой независимо водород или С1-6алкил или R1 связан с R2 с образованием группы (СН2)2, (СН2)3 или (СН2)4; R3, R4 и R5 представляют собой водород, галоген или С1-6алкил; m представляет целое число от 1 до 4, когда m представляет целое число, которое больше чем 1, две группы R2 могут быть связаны с образованием группы СН2, (СН2)2 или (СН2)3; n равно целому числу от 1 до 3; А представляет собой группу -Ar1, Ar1 представляет собой фенильную группу, которая может быть необязательно замещена одним или несколькими, одинаковыми или разными заместителями, выбранными из группы: галоген, трифторметил, трифторметокси, С1-6алкил, С1-6алкокси. Описываются 4 способа получения соединения формулы (I). Технический результат - соединения формулы (I) обладают аффинностью к 5-НТ6 рецептору. 5 н. и 18 з.п. ф-лы, 6 ил, 5 табл.
Реферат
Данное изобретение относится к новым производным хинолина, обладающим фармакологической активностью, способам их получения, содержащим их композициям и их использованию при лечении нарушений ЦНС и других нарушений.
В WO 98/27081 описан ряд арилсульфонамидных соединений, которые, как указывается, являются антагонистами 5-НТ6-рецептора и которые, как заявлено, являются полезными при лечении различных нарушений ЦНС. В патенте Великобритании 2341549 и в WO 99/47516 и WO 99/65906 описан ряд производных индола, которые, как заявлено, обладают аффинностью к 5-НТ6-рецептору. В патенте Японии 02262627 (Japan Synthetic Rubber Co) описан ряд замещенных производных хинолина, полезных в качестве элементов, преобразующих длину волны. В WO 00/42026 (Novo Nordisk) описан ряд производных хинолина и хиноксалина для использования в качестве агонистов GLP-1.
Теперь обнаружен структурно новый класс соединений, которые также обладают аффиностью к 5-НТ6-рецептору. В настоящем изобретении, таким образом, предложено в первом аспекте соединение формулы (I) или его фармацевтически приемлемая соль
где R1 и R2 представляют собой независимо водород или С1-6алкил или R1 связывается с R2 с образованием группы (СН2)2, (СН2)3 или (СН2)4;
R3, R4 и R5 представляют собой независимо водород, галоген, циано, -CF3, -CF3O, С1-6алкил, С1-6алкокси, С1-6алканоил или группу -CONR6R7;
R6 и R7 представляют собой независимо водород или С1-6алкил или могут быть соединены вместе с образованием 5-7-членного ароматического или неароматического гетероциклического кольца, необязательно прерываемого атомом О или S;
m представляет целое число от 1 до 4, так что, когда m представляет целое число, которое больше чем 1, две группы R2 могут быть связаны с образованием группы СН2, (СН2)2 или (СН2)3;
n равно целому числу от 1 до 3;
р равно 1 или 2;
А представляет собой группу -Ar1 или -Ar2Ar3;
Ar1, Ar2 и Ar3 представляют собой независимо арильную группу или гетероарильную группу, которые обе могут быть необязательно замещены одним или несколькими (например, 1, 2 или 3) заместителями, которые могут быть одинаковыми или разными и которые выбраны из группы, состоящей из галогена, гидрокси, циано, нитро, трифторметила, трифторметокси, С1-6алкила, трифторметансульфонилокси, пентафторэтила, С1-6алкокси,
арилС1-6алкокси, С1-6алкилтио, С1-6-алкоксиС1-6алкила,
С3-7циклоалкилС1-6алкокси, С1-6алканоила, С1-6алкоксикарбонила,
С1-6алкилсульфонила, С1-6алкилсульфинила, С1-6алкилсульфонилокси, С1-6алкилсульфонилС1-6алкила, арилсульфонила, арилсульфонилокси, арилсульфонилС1-6алкила, С1-6алкилсульфонамидо, С1-6алкиламидо,
С1-6алкилсульфонамидоС1-6алкила, С1-6-алкиламидоС1-6алкила, арилсульфонамидо, арилкарбоксамидо, арилсульфонамидоС1-6алкила, арилкарбоксамидоС1-6алкила, ароила, ароилС1-6алкила,
арилС1-6алканоила или группы CONR8R9 или SO2NR8R9, где R8 и R9 представляют собой независимо водород или С1-6алкил или могут быть связаны вместе с образованием 5-7-членного ароматического или неароматического гетероциклического кольца, необязательно прерываемого атомом О или S,
или его сольваты.
Алкильные группы, независимо от того, взяты ли они отдельно или как часть другой группы, могут иметь неразветвленную или разветвленную цепь и группы алкокси и алканоил должны быть интерпретированы аналогично. Алкильные фрагменты являются более предпочтительно С1-4алкилами, например метилом или этилом. Термин «галоген» используют здесь для описания, если не оговорено особо, группы, выбранной из фтора, хлора, брома или иода.
Термин «арил» включает фенил и нафтил.
Имеется в виду, что термин «гетероарил» означает 5-7-членное моноциклическое ароматическое или конденсированное 8-10-членное бициклическое ароматическое кольцо, содержащее 1-3 гетероатома, выбранных из атомов кислорода, азота и серы. Подходящие примеры таких моноциклических ароматических колец включают тиенил, фурил, пирролил, триазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиразолил, пиримидил, пиридазинил, пиразинил и пиридил. Подходящие примеры таких конденсированных ароматических колец включают бензоконденсированные ароматические кольца, такие как хинолинил, изохинолинил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил, индолил, индазолил, пирролопиридинил, бензофуранил, бензотиенил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензоксадиазолил, бензотиадиазолил и тому подобное. Гетероарильные группы, описываемые выше, могут быть связаны с остальной частью молекулы через атом углерода или, когда он присутствует, подходящий атом азота, за исключением тех случаев, когда указано иначе.
Должно быть понятно, что, когда указанные выше арильные или гетероарильные группы имеют более чем один заместитель, эти заместители могут быть связаны с образованием кольца, например карбоксильная и аминная группы могут быть связаны с образованием амидогруппы.
R1 предпочтительно представляет собой водород, метил, этил, изопропил, изобутил или 2,2-диметилпропил. Более предпочтительно R1 представляет собой водород или метил, особенно водород. Предпочтительно R2 представляет собой водород, метил (например, 3-метил, 2-метил, 3,3-диметил или 2,5-диметил) или связывается с R1 с образованием группы (СН2)3. Более предпочтительно R2 представляет собой водород или метил (например, 3-метил), особенно водород. Предпочтительно R3 представляет собой водород, метил (например, 6-метил) или галоген (например, 7-хлор). Более предпочтительно R3 представляет собой водород. Предпочтительно R4 и R5 представляют собой независимо водород или метил, особенно водород. Предпочтительно n равно 1. Предпочтительно m и р независимо равны 1 или 2, более предпочтительно m и р, оба, равны 1. В одном предпочтительном варианте осуществления m равно 2 и обе группы R2 связаны с образованием СН2-группы, связывающей С-2 и С-5 кольца пиперазина. Когда А представляет собой группу -Ar1, Ar1 предпочтительно представляет собой необязательно замещенный фенил или пиридил, более предпочтительно фенил, необязательно замещенный галогеном (например, хлором, фтором или бромом), циано, трифторметилом или трифторметокси. Особенно предпочтительный Ar1 представляет собой незамещенный фенил или фенил, замещенный галогеном (например, 2-хлором, 3-хлором, 4-хлором, 2-фтором, 3-фтором, 4-фтором или 4-бромом), С1-6алкилом (например, 2-метилом или 4-метилом), С1-6алкокси (например, 2-метокси), трифторметилом (например, 2-трифторметилом или 3-трифторметилом) или трифторметокси (например, 2-трифторметокси). Когда А представляет собой группу -Ar2-Ar3, Ar2 и Ar3 предпочтительно, оба независимо, представляют собой фенил или моноциклическую гетероарильную группу, определяемую выше. Предпочтительно А представляет собой группу -Ar1. Наиболее предпочтительно -Ar1 представляет собой незамещенный фенил.
Предпочтительные соединения согласно изобретению включают соединения примеров Е1-Е50, как показано ниже, или их фармацевтически приемлемые соли.
Соединения формулы (I) могут образовывать кислотно-аддитивные соли. Должно быть понятно, что для использования в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли должны быть известны специалисту в данной области и включают в себя соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с неорганическими кислотами, например хлористоводородной, бромистоводородной, серной, азотной или фосфорной кислотой, и с органическими кислотами, например янтарной, малеиновой, уксусной, фумаровой, лимонной, винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы.
Соединения формулы (I) могут быть получены в кристаллической или некристаллической форме и, если они получены в кристаллической форме, они могут быть необязательно сольватированы, например, в виде гидрата. Данное изобретение включает в свой объем стехиометрические сольваты (например, гидраты), а также соединения, содержащие изменяющиеся количества растворителя (например, воды).
Некоторые соединения формулы (I) способны существовать в стереоизомерных формах (например, в форме диастереомеров и энантиомеров), и изобретение включает в себя каждую из этих стереоизомерных форм и их смеси, в том числе рацематы. Различные стереоизомерные формы могут быть разделены (друг от друга) обычными способами или любой данный изомер может быть получен стереоспецифическим или асимметрическим синтезом. Изобретение включает в себя также любые таутомерные формы и их смеси.
Более предпочтительные соединения в соответствии с изобретением включают в себя 3-фенилсульфонил-8-пиперазин-1-ил-хинолин или его фармацевтически приемлемую соль (например, хлористоводородную соль (гидрохлорид)), наиболее предпочтительно это соединение в виде свободного основания (например, 3-фенилсульфонил-8-пиперазин-1-ил-хинолин).
Обнаружено, что свободное основание 3-фенилсульфонил-8-пиперазин-1-ил-хинолина существует в более чем одной полиморфной форме. Настоящее изобретение включает в себя все такие формы независимо от того, находится ли оно в виде чистой полиморфной форме или смешано с другим материалом, таким как другая полиморфная форма. Здесь полиморфные формы свободного основания называются формой I и формой II. Каждая из указанных форм может быть также указана, когда это удобно, как свободное основание.
В подходящем случае изобретение предлагает свободное основание, подходящим образом характеризованное приводимыми здесь данными, полученными, по меньшей мере, одним из следующих способов: инфракрасной спектроскопией, Рамановской спектроскопией (комбинационное рассеяние), порошковой рентгенограммой или спектроскопией ядерного магнитного резонанса, и данными точки плавления, включая приведенные здесь частичные спектральные данные.
В следующем аспекте изобретения предложена форма I 3-фенилсульфонил-8-пиперазин-1-ил-хинолина.
В другом аспекте изобретения предложена форма II 3-фенилсульфонил-8-пиперазин-1-ил-хинолина.
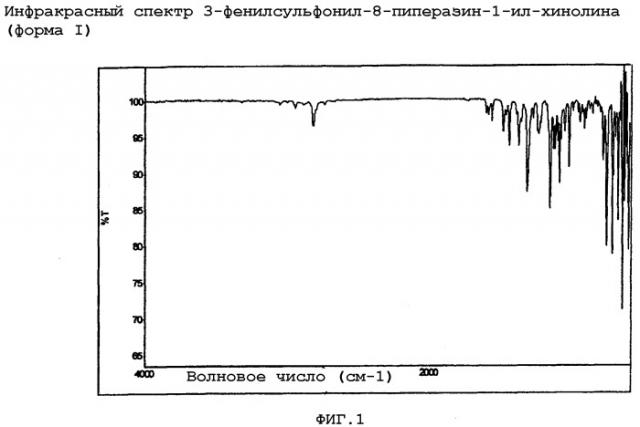
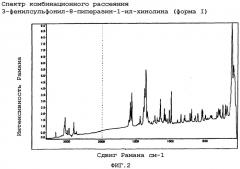
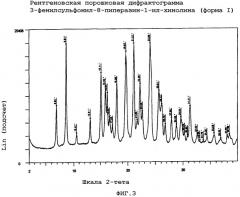
Особым аспектом настоящего изобретения является 3-фенилсульфонил-8-пиперазин-1-ил-хинолин (форма I), охарактеризованный
(i) инфракрасным спектром, по существу в соответствии с фиг.1, и/или
(ii) спектром комбинационного рассеяния, по существу в соответствии с фиг.2, и/или
(iii) порошковой рентгенограммой (XRPD), по существу в соответствии с фиг.3.
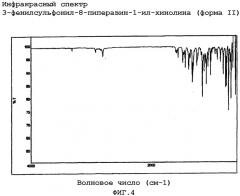
Особым аспектом настоящего изобретения является 3-фенилсульфонил-8-пиперазин-1-ил-хинолин (форма II), охарактеризованный
(i) инфракрасным спектром, по существу в соответствии с фиг.4, и/или
(ii) спектром комбинационного рассеяния, по существу в соответствии с фиг.5, и/или
(iii) порошковой рентгенограммой (XRPD), по существу в соответствии с фиг.6.
Как следствие более высокой стабильности, обеспечиваемой более высокой точкой плавления, 3-фенилсульфонил-8-пиперазин-1-ил-хинолин (форма II) является предпочтительной формой 3-фенилсульфонил-8-пиперазин-1-ил-хинолина.
Настоящее изобретение предлагает также способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает:
(а) взаимодействие соединения формулы (II)
где R1a имеет значения, указанные для R1, или представляет собой N-защитную группу, R2, R3, R4, R5, m, n и р имеют значения, указанные выше, и L1 представляет собой удаляемую группу, такую как иод или трифторметилсульфонилокси, с соединением формулы А-SO2H (или А-SH с последующей стадией окисления), где А имеет значения, указанные выше, с последующим, если необходимо, удалением R1aN-защитной группы;
(b) удаление защитных групп у соединения формулы (I), которое защищено, с последующим необязательным
(с) взаимопревращением в другие соединения формулы (I) и/или образованием фармацевтически приемлемой соли и/или сольвата.
Настоящее изобретение предлагает также следующий способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который содержит:
(d) взаимодействие соединения формулы (IV)
c соединением формулы (V)
где R1а, R2, R3, R4, R5, А, m, n и р имеют значения, указанные выше, и L3 представляет собой подходящую удаляемую группу, такую как атом галогена, с последующим, если необходимо, удалением R1aN-защитной группы или
(е) взаимодействие соединения формулы (VI)
с соединением формулы (VII)
где R1а, R2, R3, R4, R5, А, m, n и р имеют значения, указанные выше, и L3 представляет собой подходящую удаляемую группу, такую как атом галогена (например, атом брома или иода) или трифторметисульфонилоксигруппа, с последующим, если необходимо, удалением R1aN-защитной группы. Используемой N-защитной группой может быть общепринятая группа, например трет-бутилоксикарбонил (Вос) или бензилоксикарбонил. Другие N-защитные группы, которые могут быть использованы, включают метил.
Способ (а), в котором соединение формулы (II) подвергают взаимодействию с соединением формулы А-SO2H, обычно включает использование основных условий и может быть наиболее удобно проведен с использованием подходящей соли соединения A-SO2H (например, натриевой соли) в подходящем растворителе, таком как N,N-диметилформамид, в присутствии соли переходного металла, такого как иодид меди (I).
Способ (а), в котором соединение формулы (II) подвергают взаимодействию с соединением формулы А-SH, обычно включает использование основных условий, например, посредством применения подходящей соли соединения А-SH (например, натриевой соли) в подходящем растворителе, таком как N,N-диметилформамид, в присутствии соли переходного металла, такого как иодид меди (I), с последующим использованием подходящего окислителя, такого как 3-хлорпербензойная кислота, перуксусная кислота или моноперсульфат калия.
В способах (а) и (b) примеры защитных групп и средств для их удаления могут быть найдены в T.W. Greene. "Protective Groups in Organic Synthesis" (J. Wiley and Sons, 1991). Подходящие аминозащитные группы включают в себя сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые могут быть удалены гидролизом (например, с использованием кислоты, такой как хлористоводородная кислота) или восстановительным способом (например, гидрогенолизом бензильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте), в зависимости от того, какой из них является подходящим. Другие подходящие аминозащитные группы включают в себя трифторацетил (-COCF3), который может быть удален катализируемым основанием гидролизом, или связанная с твердофазной смолой бензильная группа, такая как связанная со смолой Merrifield 2,6-диметоксибензильная группа (линкер Ellman), которая может быть удалена гидролизом, катализируемым кислотой, например трифторуксусной кислотой. Следующие аминозащитные группы включают в себя метил, который может быть удален с использованием стандартных способов N-деалкилирования (например, 1-хлорэтилхлорформиатом в основных условиях с последующей обработкой метанолом).
Способ (с) может быть проведен с использованием общепринятых методик взаимопревращений, таких как эпимеризация, окисление, восстановление, восстановительное алкилирование, алкилирование, нуклеофильное или электрофильное ароматическое замещение, гидролиз сложного эфира или образование амидной связи. Например, N-деалкилирование соединения формулы (I), где R1 представляет собой алкильную группу, дает соединение формулы (I), где R1 представляет собой водород. Должно быть очевидно, что такое взаимопревращение может быть взаимопревращением защищенных производных формулы (I), которые могут быть затем освобождены от защитных групп после взаимопревращения.
Кроме того, способ (с) может включать, например, взаимодействие соединения формулы (I), где R1 представляет собой водород, с альдегидом или кетоном в присутствии восстанавливающего агента с получением соединения формулы (I), где R1 представляет собой С1-6алкил. Это взаимодействие может быть проведено с использованием агента, являющегося донором гидрида, такого как цианоборогидрид натрия, триацетоксиборогидрид натрия или связанная со смолой форма цианоборогидрида, в спиртовом растворителе, таком как этанол, и в присутствии кислоты, такой как уксусная кислота, или в условиях каталитического гидрирования. В альтернативном случае такое превращение может быть проведено взаимодействием соединения формулы (I), где R1 представляет собой водород, с соединением формулы R1-L, где R1 имеет значения, указанные выше, и L представляет собой удаляемую группу, такую как атом галогена (например, брома или иода) или метилсульфонилоксигруппу необязательно в присутствии подходящего основания, такого как карбонат калия или триэтиламин, с использованием подходящего растворителя, такого как N,N-диметилформамид или С1-4алканол.
Способ (d) может быть проведен в присутствии подходящего основания, такого как карбонат натрия, и с использованием подходящего растворителя, такого как н-бутанол.
Способ (е) может быть проведен в присутствии палладиевого, никелевого или медного катализатора, например смеси источника палладия, такого как Pd2(dba)3, и подходящего лиганда, такого как (R)-, (S)- или (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP) или (2-дициклогексилфосфанилфенил)диметиламин или 1,1'-бисдифенилфосфиноферроцен, вместе с подходящим основанием, таким как трет-бутоксид натрия, в инертном растворителе, таком как 1,4-диоксан.
Соединения формулы (II) могут быть получены взаимодействием соединения формулы (III)
где R3, R4, R5, n и L' имеют значения, указанные выше, с соединением формулы (IV), как указано выше. Этот способ обычно включает использование подходящего основания, такого как карбанат натрия, и использование подходящего растворителя, такого как н-бутанол.
Соединения формулы (V) могут быть получены в соответствии со следующей схемой:
где R3, R4, R5, n, А и L' имеют значения, указанные выше.
Стадия (i) обычно включает взаимодействие соединения формулы (VIII) с соединением формулы A-SO2-M, где А имеет значения, указанные выше, и М представляет собой остаток металла, такого как натрий или калий, в присутствии соли меди (I), например трифторметансульфоната меди (I) или иодида меди (I), в подходящем растворителе, таком как безводный N,N-диметилформамид или 1,4-диоксан, необязательно включающим в свой состав лиганд, такой как N,N'-диметилэтилен-1,2-диамин.
В альтернативном варианте превращение, показанное в стадии (i), может быть проведено с использованием двустадийной процедуры, обычно включающей стадии (iii) и (iv).
Стадия (iii) обычно включает взаимодействие соединения формулы (VIII) с соединением формулы A-SH, где А имеет значения, указанные выше, в присутствии основания, такого как гидрид натрия или фосфат калия, в подходящем растворителе, таком как безводный N,N-диметилформамид или этиленгликоль, необязательно в присутствии катализатора иодида меди (I).
Стадия (iv) обычно включает окисление с использованием подходящего окислителя, такого как мономагнийпероксифталат, 3-хлорпербензойная кислота, перуксусная кислота или моноперсульфат калия.
Стадию (ii) обычно проводят с использованием подходящего восстанавливающего агента, например хлорида титана (III) или порошка железа, в подходящей системе растворителей, например в водном тетрагидрофуране и/или уксусной кислоте соответственно.
Соединения формулы (VI), где L3 представляет собой атом галогена, могут быть получены в соответствии со следующей схемой:
где R3, R4, R5, n и А имеют значения, указанные выше, и Hal представляет собой атом галогена.
Стадия (i) обычно включает диазотирование по известным способам (например, с использованием нитрита натрия с водной неорганической кислотой в качестве растворителя или алкилнитритного эфира с использованием подходящего растворителя, такого как ацетонитрил, в присутствии безводной кислоты, например трифторуксусной кислоты) с последующей обработкой образовавшейся диазониевой соли подходящей галогенидной солью, такой как бромид меди (I), иодид калия или иодид тетрабутиламмония. Такая процедура может быть проведена в водном растворе или с использованием безводных условий, например с использованием трифторуксусной кислоты в качестве растворителя.
Соединения формулы (VI), где L3 представляет собой атом галогена, могут быть также получены в соответствии со следующей схемой:
где R3, R4, R5, А и n имеют значения, указанные выше, и Hal представляет собой атом галогена.
Стадию (i) обычно проводят с использованием подходящего восстанавливающего агента, такого как порошок железа, получая при этом соединение формулы (XI).
Стадия (ii) обычно включает реакцию диазотирования, проводимую с использованием водного или неводного источника ионов нитрозония, как описано выше, с последующим превращением продукта в галогенид.
Стадию (iii) обычно проводят с использованием подходящего окислителя, такого как мономагнийпероксифталат.
Соединения формулы (VI), где L3 представляет собой трифторметилсульфонилоксигруппу, могут быть получены из соединений формулы (V), как описаны выше, диазотированием по известным методам с последующим нагреванием в кислотных условиях и затем обработкой трифторметилсульфоновым ангидридом в присутствии основания, такого как пиридин.
Соединения формулы (III), (IV), (VII) и (VIII) являются известными в литературе или могут быть получены аналогичными способами.
Фармацевтически приемлемые соли могут быть получены, как обычно, взаимодействием с подходящей кислотой или производным кислоты.
Полагают, что соединения формулы (I) и их фармацевтически приемлемые соли, обладающие аффинностью к 5-НТ6-рецептору, являются потенциально пригодными при лечении некоторых нарушений ЦНС, таких как тревога, депрессия, эпилепсия, обсессивно-компульсивные нарушения, мигрень, нарушения памяти и познавательной способности (например, болезнь Альцгеймера, связанное с возрастом снижение когнитивной способности и слабое когнитивное расстройство), болезнь Паркинсона, ADHD (расстройство, выражающееся в синдроме дефицита внимания и повышенной активности), нарушения сна (в том числе нарушения циркадного ритма), нарушения питания, такие как анорексия и булимия, панические приступы, синдром отмены при злоупотреблении лекарственными веществами, такими как кокаин, этанол, никотин и бензодиазепины, шизофрения (особенно, когнитивная недостаточность при шизофрении), удар и также нарушения, связанные с травмой позвоночника и/или повреждением головы, таким как гидроцефалия. Предполагается также, что соединения изобретения найдут применение при лечении некоторых GI (желудочно-кишечных) нарушений, таких как IBS (синдром раздраженной толстой кишки). Предполагается также, что соединения изобретения найдут применение при лечении ожирения.
Таким образом, изобретение относится также к соединению формулы (I) или его фармацевтически приемлемой соли для использования в качестве терапевтического средства, особенно при лечении или профилактике вышеуказанных нарушений. В частности, изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли при лечении депрессии, тревоги, болезни Альцгеймера, связанного с возрастом снижения когнитивной способности, ADHD, ожирения, слабого когнитивного расстройства, шизофрении, когнитивной недостаточности при шизофрении и удара.
Изобретение далее предлагает способ лечения или профилактики вышеуказанных нарушений у млекопитающих, в том числе у людей, который включает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В другом аспекте изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли при изготовлении лекарственного средства для использования при лечении или профилактике вышеуказанных нарушений.
5-НТ6-антагонисты обладают потенциальной способностью повышать уровень базальных и индуцированных обучением полисиалилированных нейронов в областях головного мозга, таких как средняя височная доля крыс и ассоциированный с ней гиппокамп, как описано в Международной патентной заявке № РСТ/ЕР03/00462. Таким образом, в соответствии со следующим аспектом настоящего изобретения авторами предложен способ стимуляции роста нервных клеток в центральной нервной системе млекопитающего, который включает стадию введения соединения формулы (I) или его фармацевтически приемлемой соли.
Для использования соединений формулы (I) в терапии их обычно вводят в состав фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Настоящее изобретение предлагает также фармацевтическую композицию, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Фармацевтическая композиция изобретения, которая может быть получена смешиванием подходящим образом при температуре окружающей среды и атмосферном давлении, обычно адаптирована для перорального, парентерального или ректального введения и как таковая она может быть в форме таблеток, капсул, пероральных жидких препаратов, порошков, гранул, лепешек, пересоздаваемых порошков, инъецируемых и инфузируемых растворов или суспензии или суппозиториев. Обычно предпочтительными являются перорально вводимые композиции.
Таблетки и капсулы для перорального введения могут быть в дозированной лекарственной форме и могут содержать общепринятые эксципиенты, такие как связующие агенты, наполнители, применяемые при таблетировании смазывающие вещества, дезинтеграторы и приемлемые смачивающие агенты. Таблетки могут быть покрыты в соответствии со способами, хорошо известными в обычной фармацевтической практике.
Пероральные жидкие препараты могут быть в форме, например, водной или масляной суспензии, растворов, эмульсий, сиропов или эликсиров или могут быть в форме сухого продукта для разведения водой или другим подходящим наполнителем перед использованием. Такие жидкие препараты могут содержать общепринятые добавки, такие как суспендирующие агенты, эмульгирующие агенты, неводные наполнители (которые могут включать съедобные масла), консерванты и, если необходимо, общепринятые корригенты или красители.
Для парентерального введения жидкие дозированные лекарственные формы получают с использованием соединения изобретения или его фармацевтически приемлемой соли и стерильного наполнителя. Соединение, в зависимости от наполнителя и используемой концентрации, может быть либо суспендировано либо растворено в наполнителе. При получении растворов для инъекции соединение может быть растворено и стерилизовано при помощи фильтра перед заполнением в подходящий флакон или ампулу и герметизацией. Вспомогательные средства, такие как местный анестетик, консерванты и буферные агенты, преимущественно растворяют в наполнителе. Для повышения стабильности композиция может быть заморожена после заполнения в пузырек и вода может быть удалена в вакууме. Парентеральные суспензии получают по существу таким же образом, за исключением того, что соединение суспендируют в наполнителе вместо растворения и стерилизация не может быть выполнена фильтрованием. Соединение может быть стерилизовано воздействием на него этиленоксида перед суспендированием в стерильном наполнителе. Поверхностно-активное вещество или смачивающий агент, преимущественно включают в композицию для облегчения однородного распределения соединения.
Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.%, активного материала в зависимости от способа введения.
Доза соединения, используемого при лечении вышеуказанных нарушений, будет варьировать обычно в зависимости от серьезности нарушений, массы пациента и других подобных факторов. Однако в качестве основного принципа подходящими стандартными дозами могут быть 0,05-1000 мг, более подходящими 0,05-200 мг, например 20-40 мг, и такие стандартные дозы будут вводить предпочтительно один раз в день, хотя может требоваться введение более чем однократное; такая терапия может продолжаться в течение нескольких недель или месяцев.
Все публикации, включающие патенты и заявки на патенты, но не ограничивающиеся ими, и цитированные в данном описании, включены здесь в качестве ссылок, как если бы каждая отдельная публикация конкретно и индивидуально была указана, как включенная здесь в качестве ссылки во всей ее полноте.
Следующие описания и примеры иллюстрируют получение соединений по изобретению.
Описание 1
3-Бром-8-(4-метилпиперазин-1-ил)хинолин (D1)
Гидрохлорид бис-(2-хлорэтил)амина (3,7 г, 19,2 ммоль) и карбонат натрия (9,0 г, 85 ммоль) добавляют к суспензии 3-бромхинолин-8-ил-амина (3,9 г, 17,5 ммоль) (синтез см. в Gershon et al., Monatsh. Chem., 1991, 122, 935) в н-бутаноле (70 мл). Перемешиваемую суспензию нагревают при температуре образования флегмы с обратным холодильником в течение 72 час. Реакционную смесь охлаждают до температуры окружающей среды, разбавляют дихлорметаном (300 мл) и раствор промывают водой (300 мл), сушат (MgSO4) и концентрируют в вакууме с образованием масла. Масло очищают хроматографией на силикагеле при элюировании смесью метанол/дихлорметан с градиентом, получая при этом указанное в заголовке соединение (D1) в виде масла (2,6 г, 8,5 ммоль, 49%).
δН (CDCl3): 2,43 (3Н, с), 2,78 (4Н, ушир. с), 3,44 (4Н, ушир. с), 7,14 (1Н, д, J = 6,8 Гц), 7,33 (1Н, д, J = 7,4 Гц), 7,47 (1Н, дд, J = 7,8 Гц), 8,25 (1Н, д, J = 2,3 Гц), 8,85 (1Н, д, J = 2,3 Гц).
Масс-спектр: для С14Н16BrN3 требуется 305/307; найдено 306/308 (МН+).
Описание 2
3-Иод-8-(4-метилпиперазин-1-ил)хинолин (D2)
Смесь 3-бром-8-(4-метилпиперазин-1-ил)хинолина (D1) (1,75 г, 5,7 ммоль), иодида меди (I) (5,4 г, 28,5 ммоль) и иодида калия (9,6 г, 57,8 ммоль) в гексаметилфосфорамиде (20 мл) нагревают на масляной бане при 150°С в течение 21 час в атмосфере аргона. К охлажденной реакционной смеси добавляют толуол (120 мл) и 1 М хлористоводородную кислоту (120 мл) и всю смесь энергично встряхивают в течение 5 минут. Нерастворимое коричневое твердое вещество затем собирают фильтрованием, промывают метанолом (3×40 мл) и снова суспендируют в смеси дихлорметана (150 мл) и 2 М гидроксида натрия (150 мл). После энергичного встряхивания смеси нерастворенный материал отфильтровывают, промывают дихлорметаном (2×50 мл) и выгружают. Фильтрат и промывочную жидкость переносят в делительную воронку и слои разделяют. Водную фазу экстрагируют дихлорметаном (2×100 мл) и объединенные органические экстракты сушат (MgSO4) и концентрируют до образования коричневого масла (1,5 г), которое идентифицируют ЯМР-спектроскопией как смесь указанного в заголовке соединения (D2) и 3-бром-8-(4-метилпиперазин-1-ил)хинолина (D1) в отношении 4:1. Смесь используют непосредственно в следующей стадии (см. пример 1).
3-Иод-8-(4-метилпиперазин-1-ил)хинолин (D2): δН (CDCl3) 2,41 (3Н, с), 2,76 (4Н, ушир. с), 3,42 (4Н, ушир. с), 7,14 (1Н, д, J =6,8 Гц), 7,29 (1Н, д, J = 7,4 Гц), 7,44 (1Н, дд, J = 7,8 Гц), 8,47 (1Н, д, J = 2,3 Гц), 8,98 (1Н, д, J = 2,3 Гц);
масс-спектр: для С14Н16IN3 требуется 353; найдено 354 (МН+).
Описание 3
3-Иод-8-нитрохинолин (D3)
Перемешиваемую смесь 8-нитрохинолина (100 г, 0,57 моль) в уксусной кислоте (500 мл) обрабатывают порциями N-иодсукцинимида (155 г, 0,69 моль) на протяжении 10 минут и нагревают до 62°С в течение 6 час. Вводят дополнительную порцию N-иодсукцинимида (25 г, 0,14 моль) и смесь перемешивают в течение дополнительных 16 час перед охлаждением до температуры окружающей среды. Растворитель удаляют в вакууме, поддерживая температуру ниже 35°С. Остаток растворяют в дихлорметане (2 л) и промывают последовательно насыщенным водным раствором бикарбоната натрия (2×1 л), 10% водным раствором тиосульфата натрия (1 л), водой (1 л), насыщенным раствором соли (100 мл), затем органическую фазу сушат над сульфатом магния. Смесь фильтруют и растворитель удаляют, получая при этом желтое твердое вещество, которое перекристаллизовывают из этилацетата с получением указанного в заголовке соединения (D3) (168 г, 97%) в виде желтого твердого вещества.
δН (CDCl3): 7,65 (1Н, прибл. т), 7,94 (1Н, дд), 8,07 (1Н, дд), 8,66 (1Н, д, J = 2 Гц), 9,19 (1Н, д, J = 2 Гц);
масс-спектр: для С9Н5IN2 требуется 300; найдено 301 (МН+).
Описание 4
8-Нитро-3-фенилсульфонилхинолин (D4)
3-Иод-8-нитрохинолин (D3) (135 г, 0,45 моль) суспендируют в диметилформамиде (2,4 л) в 3-горлой колбе на 5 л, снабженной помещенной сверху мешалкой, в атмосфере аргона. Смесь обрабатывают последовательно безводным фенилсульфинатом натрия (99,6 г, 0,608 моль) и комплексом бис(медь (I) трифторметилсульфонат)бензол (170 г, 0,338 моль). Образовавшуюся суспензию нагревают до 65°С в течение 18 час. Смесь охлаждают, фильтруют и растворитель выпаривают в вакууме. К остатку добавляют ацетон (2,5 л) и раствор фильтруют. Фильтрат упаривают в вакууме, добавляют еще 2,5 л ацетона и смесь снова фильтруют. Растворитель выпаривают в вакууме и остаток растворяют в хлороформе (3 л) и промывают 10% водным аммиаком (2×2 л), органическую фазу сушат над сульфатом магния и растворитель выпаривают в вакууме. Темный коричневый остаток очищают с использованием хроматографа Biotage flash-150 (5 кг силикагеля) при элюировании гексаном с увеличивающимися пропорциями этилацетата, получая при этом указанное в заголовке соединение (D4) (81,5 г, 58%) в виде желтого твердого вещества.
δН (d6-ДМСО): 7,67 (2Н, т), 7,57 (1Н, д), 7,96 (1Н, т), 8,13 (2Н, д), 8,51 (1Н, д), 8,59 (1Н, д), 9,42 (1Н, д), 9,50 (1Н, д);
масс-спектр: для С15Н10SO4N2 требуется 314; найдено 315 (МН+).
Описание 5
8-Амино-3-фенилсульфонилхинолин (D5)
Суспензию 8-нитро-3-фенилсульфонилхинолина (D4) (46,7 г, 172 ммоль) в тетрагидрофуране (750 мл) добавляют к перемешиваемому раствору 30% хлорида титана (III) в водной HCl (470 мл) [доставляется BDH], охлажденному на ледяной бане, при такой скорости, чтобы температура сохранялась ниже 35°С. После завершения добавления раствор перемешивают в течение дополнительных 10 минут, затем вводят воду (1,5 л) и смесь выливают в 5-литровой химический стакан. Быстро перемешиваемый раствор обрабатывают добавлением по порциям твердого карбоната калия, чтобы достичь значения рН ˜8,5. Добавляют этилендиаминтетрауксусную кислоту (EDTA) (250 г, 0,86 моль) с последующим дополнительным добавлением карбоната калия для поддержания рН ˜8,5. Смесь экстрагируют дихлорметаном (3×1 л) и объединенную органическую фазу пропускают через слой диоксида кремния (500 г) с элюированием дополнительным дихлорметаном (1 л) и 10% этилацетатом в дихлорметане (1 л). Объединенные органические фазы упаривают и остаток подвергают очистке с использованием хроматографа Biotage Flash-75 (2 кг силикагеля) и элюирования дихлорметаном и увеличивающимися пропорциями эфира, получая при этом указанное в заголовке соединение (D5) (34,5 г, 72%) в виде светло-коричневого твердого веще