Способ получения 4,17 (20)-z-прегнадиен-3,16-диона, способы получения соединений
Иллюстрации
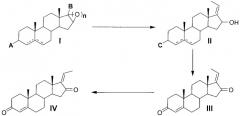
Показать всеИзобретение относится к улучшенному способу получения 4,17(20)-Е-прегнадиен-3,16-диона (Е-гуггулстерона) формулы III и 4,17(20)-Z-прегнадиен-3,16-диона (Z - гуггулстерона) формулы IV, включающий окисление соединения формулы II, где С-ОН или =O, ------- возможная двойная связь, хлорхроматом пиридиния, дихроматом пиридиния и др. с получением 4,17(20)-Е-прегнадиен-3,16-диона формулы (III) с последующими превращениями, включающими ряд реакций, в том числе фотохимическую, термохимическую, или с использованием кислотного катализатора. III и IV эффективно снижают повышенные уровни липопротеинов низкой плотности (LDL) и высокие уровни холестерина. 7 н.п. ф-лы.
Реферат
Настоящее изобретение относится к способу получения 4,17(20)-прегнадиен-3,16-диона (далее в описании он упоминается как гуггулстерон), который эффективно снижает повышенные уровни липопротеинов низкой плотности (LDL) и высокие уровни холестерина и повышает низкие уровни липопротеинов высокой плотности (HDL), к способу получения Z-изомера гуггулстерона из Е-изомера и к способу получения соединения формулы (II), промежуточного соединения для получения вышеуказанного соединения (III).
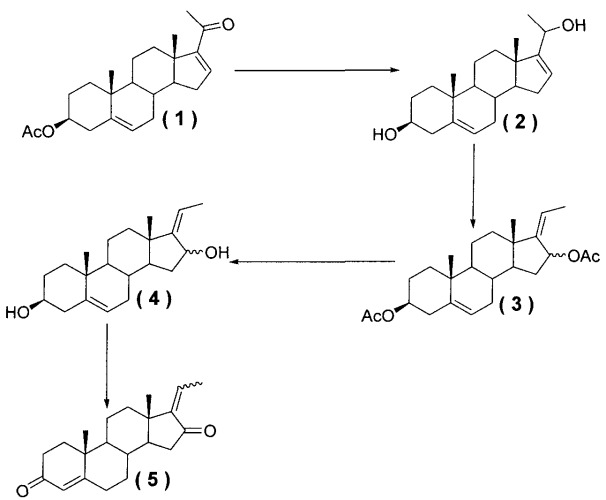
Гуггулстерон экстрагируют из индийского дерева гуггул (ботаническое название Commiphora mukul) и традиционно используют для лечения гиперлипидемии, он также известен как эффективный антагонист фарнезоидного орфанового рецептора (FXR), который регулирует метаболизм холестерина (Nature, 2002, June, 411; Science, 2002, May, 1703). Обычно в качестве гиполипидемического лекарственного средства используют Е-тип или Z-тип гуггулстерона, которые получают путем экстракции смолы дерева гуггул при необходимости с последующей очисткой методом ВЭЖХ и др. Способ синтеза смеси гуггулстеронов раскрыт в ЕР 0447706 А1. Как показано на приведенной ниже схеме, кетоновые и ацетатные группы 16-дегидропрегналонацетата (1) восстанавливают алюмогидридом лития (LiAlH4) с получением 5,16-прегнадиен-3β,20-диола (2), который взаимодействует с уксусным ангидридом и п-толуолсульфоновой кислотой с получением смеси 5,17(20)-транс-прегнадиен-3β,16β-диацетата и 5,17(20)-транс-прегнадиен-3β,16α-диацетата (3). Полученная смесь взаимодействует с гидроксидом калия в метаноле с получением смеси 5,17(20)-транс-прегнадиен-3β,16β-диола и 5,17(20)-транс-прегнадиен-3β,16α-диола (4), который окисляют изобутоксидом алюминия или феноксидом алюминия, получая смесь стереоизомеров (Z:E составляет приблизительно 8:2) гуггулстеронов.
Хотя известно, что вышеуказанное соединение (5), полученное по способу, описанному в ЕР 0447706 A1, обладает хорошей эффективностью, способ его промышленного получения не является удовлетворительным и экономически невыгоден. Другими словами,
1) исходное вещество, 16-дегидропрегналон, не относится к широко доступным стероидам и, следовательно, не подходит для применения в промышленности;
2) при воздействии влаги на алюмогидрид лития (LiAlH4), используемый на первой стадии восстановления, образуется газообразный водород, что может привести к взрыву, и, следовательно, его применение в промышленном масштабе является очень опасным;
3) уксусную кислоту, используемую в качестве растворителя во второй реакции, трудно удалять после завершения реакции, и, кроме того, время протекания реакции, 72 часа, является слишком длительным;
4) на третьей стадии реакции метанол нагревают с обратным холодильником в присутствии гидроксида калия относительно долго, в течение 6 часов;
5) выход на третьей стадии реакции составляет 114%, однако выход конечного продукта, гуггулстерона, не указан в описании патента;
6) способ синтеза, описанный в вышеуказанном патенте, не является надежным, поскольку данные анализа гуггулстерона и его промежуточного продукта не приведены в описании патента.
В соответствии со способом, описанным в J. Org. Chem., 1964, 29, 1142, 16α,17α-эпоксипрегненолон взаимодействует с гидразином 85% чистоты при 190°C в течение 5,5 часов с образованием диольного промежуточного соединения, которое представляет собой смесь транс- и цис-изомеров. Поскольку выход диольного соединения составляет 21,7%, конечный продукт, гуггулстерон, невозможно получить в промышленном масштабе.
Кроме того, способ, раскрытый в J. Org. Chem., 1964, 29, 1142, имеет нижеследующие недостатки.
1) Поскольку выход полученного диольного соединения (8а) составляет 21,7%, данный способ не подходит для применения в промышленности.
2) Диольное соединение (8а) получают в виде оптически неактивной смеси, поэтому требуется дополнительное выделение. Кроме того, конечный продукт обладает низкой эффективностью как лекарственное средство или пищевой продукт.
В свете вышесказанного в данной области существует потребность в новом, более простом и дешевом способе получения индивидуальных гуггулстеронов Е-типа или Z-типа.
Задачей настоящего изобретения является экономичный способ получения гуггулстерола, индивидуального гуггулстерона Е-типа (III) и индивидуального гуггулстерона Z-типа (IV) с высоким выходом, в течение короткого времени реакции, с использованием легкодоступного и дешевого исходного вещества.
С учетом вышесказанного авторы настоящего изобретения провели обширное исследование по синтезу гуггулстерона. Так, они обнаружили, что можно избирательно получить диольное соединение с выходом 91% путем взаимодействия 16,17-эпоксипрегненолона с гидразином 95% чистоты при 160°C в течение 2 часов. В результате они разработали эффективные способы получения соединения, представленного приведенной ниже формулой (II), из известного стероида, представленного приведенной ниже формулой (I), а также простые и экономичные способы синтеза гуггулстеронов, представленных приведенными ниже формулами (III) и (IV).
где А обозначает гидроксильную группу (-ОН) или оксогруппу (=О); В обозначает гидроксильную группу (-ОН), оксогруппу (=О) или метилкетоновую группу (-С(О)СН3); С обозначает гидроксильную группу (-ОН) или оксогруппу (=О); n обозначает число атомов кислорода, 0 или 1, а пунктирная линия обозначает присутствие двойной связи в положении С-4 (далее обозначается Δ4) или С-5 (далее обозначается Δ5).
Описание предпочтительного воплощения
Соединение формулы (III), объект настоящего изобретения, можно получить путем окисления соединения формулы (II), а соединение формулы (IV) можно получить путем изомеризации соединения формулы (III). Вышеуказанный способ получения разъясняется после описания способа получения соединения формулы (II) с использованием в качестве исходного вещества соединения формулы (I).
I. Синтез соединения формулы (II)
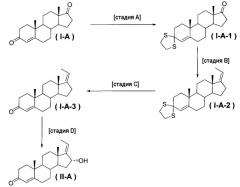
I-1. Синтез соединения формулы (II-A) из 4-андростен-3,17-диона (I-A) формулы (I), где А и В соответственно обозначают оксогруппу (=О), n равно 0, и присутствует Δ4
Соединение формулы (I-A) обрабатывают 1,2-этандитиолом, чтобы защитить только кетоновую группу в положении С-3, с получением соединения формулы (I-A-1), которое подвергают реакции Виттига по кетоновой группе в положении С-17, с получением соединения формулы (I-A-2). Соединение формулы (I-A-3) получают после удаления защиты с кетоновой группы в положении С-3 вышеуказанного соединения формулы (I-A-2). Соединение формулы (I-A-3) окисляют путем взаимодействия с диоксидом селена (SeO2), чтобы ввести спиртовую группу в положение С-16, и в результате получают гуггулстерол, представленный как соединение формулы (II-A).
Схема 1
[Стадия А] Получение соединения формулы (I-A-1)
Соединение формулы (I-A-1) можно получить путем взаимодействия соединения формулы (I-A) с алкандитиолом в растворителе в присутствии кислотного катализатора.
В качестве растворителя в данной реакции можно использовать дихлорметан, хлороформ, 1,2-дихлорэтан, диэтиловый эфир, ацетонитрил, тетрагидрофуран, толуол и ледяную уксусную кислоту. Данные растворители можно использовать по отдельности или в виде смеси двух или более растворителей. Среди указанных соединений особенно предпочтительны дихлорметан и ледяная уксусная кислота.
В качестве алкандитиола, который защищает селективно конъюгированную группу в положении С-3, можно использовать 1,2-этандитиол и 1,3-пропандитиол, предпочтительно 1,2-этандитиол.
В качестве кислоты Льюиса можно использовать трифторэфират бора (BF3·Et2O), иодид цинка (ZnI2), хлорид теллура (TeCl2), иодид магния (MgI2) и п-толуолсульфоновую кислоту (TsOH). Среди них особенно предпочтительны BF3·Et2O и п-толуолсульфоновая кислота. Количество кислоты Льюиса, используемое в данной реакции, как правило, составляет от 0,1 до 2,0 эквивалентов по отношению к количеству алкандитиола, предпочтительно от 0,5 до 1,0 эквивалента.
Температура реакции зависит от используемого растворителя. Однако реакцию предпочтительно проводят при температуре от -10 до 80°C, более предпочтительно от 0 до 25°C. Время реакции, в свою очередь, зависит от температуры реакции и используемого растворителя. Однако реакцию предпочтительно проводят в течение времени, составляющего от 30 минут до 12 часов, более предпочтительно менее 4 часов.
[Стадия В] Получение соединения формулы (I-A-2)
Чтобы получить соединение формулы (I-A-2), предпочтительно соединение формулы (I-A-1) подвергают взаимодействию с галогенидом этилтрифенилфосфония (Ph3P+CH2CH3X-) в неводном растворителе в присутствии сильного основания.
В качестве неводного растворителя можно использовать диэтиловый эфир, тетрагидрофуран, гексан, гептан, метанол, этанол, диметилсульфоксид, бензол, толуол и ксилол. Данные растворители можно использовать по отдельности или в виде смеси двух или более растворителей. Среди указанных соединений особенно предпочтительны диэтиловый эфир и тетрагидрофуран.
В качестве галогенида этилтрифенилфосфония в реакции Виттига можно использовать хлорид этилтрифенилфосфония (Ph3P+CH2CH3Cl-), бромид этилтрифенилфосфония (Ph3P+CH2CH3Br-) и иодид этилтрифенилфосфония (Ph3P+CH2CH3I-). Среди указанных соединений особенно предпочтительны бромид этилтрифенилфосфония и иодид этилтрифенилфосфония.
Сильное основание, используемое в реакции Виттига, включает гидрид лития, гидрид натрия, гидрид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, метоксид натрия, этоксид натрия или трет-бутоксид калия. Среди указанных соединений особенно предпочтительны н-бутиллитий и трет-бутоксид калия.
Количество основания, используемое для получения илида, как правило, составляет от 1,0 до 4,0 эквивалентов по отношению к галогениду этилтрифенилфосфония, предпочтительно от 1,0 до 1,5 эквивалентов.
Температура реакции варьирует в зависимости от типа используемого растворителя, однако обычно она находится в интервале от -10 до 120°C. Если галогенид этилтрифенилфосфония взаимодействует с сильным основанием в присутствии безводного растворителя с образованием илида, реакцию проводят при температуре от -10 до 20°C, если же в реакции Виттига используют соединение (I-A-1), реакцию проводят при температуре в интервале от -10 до точки кипения используемого растворителя, предпочтительно от -10 до 20°C, если растворителем является тетрагидрофуран.
Время реакции, в свою очередь, зависит от температуры реакции и используемого растворителя. Однако реакцию предпочтительно проводить в течение времени, составляющего от 30 минут до 1 дня, более предпочтительно менее 2 часов.
[Стадия С] Получение соединения формулы (I-A-3)
Соединение формулы (I-A-3) можно получить путем удаления защиты с кетоновой группы в положении С-3 соединения формулы (I-A-2).
Растворители, подходящие для реакции удаления защитной группы, включают дистиллированную воду, ацетон, хлороформ, дихлорметан, ацетонитрил, тетрагидрофуран и ледяную уксусную кислоту. Данные растворители можно использовать по отдельности или в виде смеси двух или более растворителей. Среди указанных соединений особенно предпочтительны тетрагидрофуран и ледяная уксусная кислота.
Для удаления защитной группы можно использовать такие реагенты, как нитрат серебра (AgNO2), N-бромсукцинимид (NBS), иод и диоксид селена (SeO2). Данные реагенты можно использовать по отдельности или в виде смеси двух или более реагентов. Среди указанных соединений особенно предпочтительны нитрат серебра с иодом и диоксид селена.
Количество реагента, необходимое для удаления защитной группы, зависит от используемого реагента. Однако предпочтительно используют от 0,5 до 3,0 эквивалентов по отношению к количеству соединения формулы (I-A-2), предпочтительно от 0,5 до 1,5 эквивалентов.
Температура реакции зависит от используемого растворителя и реагента. Однако реакцию предпочтительно проводить при температуре от -10 до 100°C, более предпочтительно от 10 до 65°C. Время реакции, в свою очередь, зависит от температуры реакции и типа используемого реагента, однако, как правило, оно находится в интервале от 30 минут до 1 дня, более предпочтительно оно составляет менее 3 часов.
[Стадия D] Получение гуггулстерола формулы (II-A)
Гуггулстерол формулы (II-A) можно получить путем взаимодействия соединения формулы (I-A-3) с оксидами селена (SeO2) и пероксидом водорода в растворителе.
Количество диоксида селена обычно находится в интервале от 0,1 до 2,0 эквивалентов по отношению к количеству соединения формулы (I-A-3), предпочтительно от 0,25 до 1,0 эквивалента.
В качестве пероксидов можно использовать пероксид водорода, трет-бутилпероксид, N-оксид N-метилморфолина (NMO) или N-оксид пиридина (C5H5N-O). Особенно предпочтительным среди них является трет-бутилпероксид. Количество пероксида водорода, как правило, составляет от 0,5 до 3,0 эквивалентов по отношению к количеству соединения формулы (I-A-3), предпочтительно от 1,0 до 2,0 эквивалентов.
В данном способе в качестве апротонных полярных растворителей можно использовать N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, пиридин, ацетонитрил, ацетон, этилацетат, тетрахлорэтан, хлороформ и дихлорметан. В качестве простых эфиров можно использовать тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир триэтиленгликоля. В качестве ароматических углеводородов можно использовать бензол, толуол и ксилол. Предпочтительными являются апротонные полярные растворители и простые эфиры. Более конкретно, предпочтительно использовать дихлорметан и диоксан.
Температура реакции зависит от используемого растворителя. Однако реакцию предпочтительно проводят при температуре от -10 до 80°C, более предпочтительно от 10 до 30°C. Время реакции, в свою очередь, зависит от температуры реакции и используемого растворителя, однако реакцию предпочтительно проводят в течение времени, составляющего от 30 минут до 12 часов, более предпочтительно менее 2 часов.
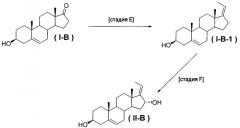
I-2. Синтез соединения формулы (II-В) из 5-андростен-3-ол-17-она [DHEA (I-B)] формулы (I), где А обозначает гидроксильную группу (-ОН), В обозначает оксогруппу (=О), n равно 0, и присутствует Δ5
Соединение формулы (I-B-1) можно получить путем проведения реакции Виттига по кетоновой группе в положении С-17 соединения формулы (I-B), без защиты спиртовой группы в положении С-3, как показано на приведенной ниже схеме 2. Соединение формулы (II-B) можно получить путем взаимодействия соединения формулы (I-B-1) с диоксидом селена (SeO2), в результате чего в положение С-16 вводится спиртовая группа.
Схема 2
[Стадия Е] Получение соединения формулы (I-В-1)
Чтобы получить соединение формулы (I-B-1), предпочтительно соединение формулы (I-B) подвергают взаимодействию с галогенидом этилтрифенилфосфония (Ph3P+CH2CH3X-) в неводном растворителе в присутствии сильного основания, без защиты спиртовой группы в положении С-3.
В качестве неводного растворителя можно использовать диэтиловый эфир, тетрагидрофуран, диметилсульфоксид, бензол, толуол и ксилол. Данные растворители можно использовать по отдельности или в виде смеси двух или более растворителей. Среди указанных соединений особенно предпочтительны тетрагидрофуран и диметилсульфоксид.
В качестве галогенида этилтрифенилфосфония в реакции Виттига можно использовать хлорид этилтрифенилфосфония (Ph3P+CH2CH3Cl-), бромид этилтрифенилфосфония (Ph3P+CH2CH3Br-) и иодид этилтрифенилфосфония (Ph3P+CH2CH3I-). Среди указанных соединений особенно предпочтительны бромид этилтрифенилфосфония и иодид этилтрифенилфосфония.
В качестве сильного основания можно использовать гидрид лития, гидрид натрия, гидрид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, этоксид натрия и трет-бутоксид калия. Среди указанных соединений особенно предпочтительны гидрид натрия, н-бутиллитий и трет-бутоксид калия.
Количество основания, используемое для получения илида, как правило, составляет от 1,0 до 4,0 эквивалентов по отношению к бромиду этилтрифенилфосфония, предпочтительно от 1,0 до 1,2 эквивалентов.
Температура реакции варьирует в зависимости от типа используемого растворителя, однако реакцию предпочтительно проводить при температуре от -10 до 120°C. Если бромид этилтрифенилфосфония взаимодействует в присутствии сильного основания в неводном растворителе с образованием илида, реакцию предпочтительно проводят при температуре от -10 до 20°C, если же в реакции Виттига участвует соединение (I-В), реакцию проводят при температуре в интервале от -10°C до точки кипения используемого растворителя. Предпочтительно реакцию проводят при температуре от 25 до 40°C, если растворителем является тетрагидрофуран, и от 25 до 80°C, если растворителем является диметилсульфоксид.
Время реакции, в свою очередь, зависит от температуры реакции и используемого растворителя, однако, как правило, оно находится в интервале от 30 минут до 1 дня, более предпочтительно оно составляет менее 2 часов.
[Стадия F] Получение соединения формулы (II-B)
Соединение формулы (II-В) можно получить путем взаимодействия соединения формулы (I-В-1) с оксидами селена (SeO2) и пероксидом водорода в растворителе.
Количество диоксида селена (SeO2) обычно находится в интервале от 0,1 до 3,0 эквивалентов по отношению к количеству соединения формулы (I-В-1), предпочтительно от 0,5 до 1,5 эквивалентов.
В качестве пероксидов можно использовать пероксид водорода, трет-бутилпероксид, N-оксид N-метилморфолина и N-оксид пиридина. Среди указанных соединений особенно предпочтителен трет-бутилпероксид. Количество пероксида водорода, как правило, составляет от 0,5 до 4,0 эквивалентов по отношению к количеству соединения формулы (I-В-1), предпочтительно от 1,0 до 2,0 эквивалентов.
В данной реакции в качестве апротонных полярных растворителей можно использовать N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, пиридин, ацетонитрил, ацетон, этилацетат, тетрахлорэтан, хлороформ и дихлорметан. В качестве простых эфиров можно использовать тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир триэтиленгликоля. В качестве ароматических углеводородов можно использовать бензол, толуол и ксилол. Предпочтительными являются апротонные полярные растворители и простые эфиры. Более конкретно, предпочтительны дихлорметан и диоксан.
Температура реакции зависит от типа используемого растворителя, однако реакцию обычно проводят при температуре от -10 до 80°C, предпочтительно от -10 до 10°C. Время реакции, в свою очередь, зависит от температуры реакции и типа используемого растворителя, однако реакцию обычно проводят в течение времени, составляющего от 30 минут до 12 часов, более предпочтительно менее 4 часов.
I-3. Синтез соединения формулы (II-А) из 5-андростен-3-ол-17-она [DHEA (I-B)] формулы (I), где А обозначает гидроксильную группу (-ОН), В обозначает оксогруппу (=О), n равно 0, и присутствует Δ5
Соединение формулы (I-B-1) можно получить путем проведения реакции Виттига по кетоновой группе в положении С-17 соединения формулы (I-B), без защиты спиртовой группы в положении С-3, с последующим окислением хлорхроматом пиридиния (РСС) с получением соединения формулы (I-B-2) с кетоновой группой в положении С-3. Двойная связь соединения формулы (I-B-2) сдвигается в присутствии основания с получением соединения формулы (I-B-3), которое затем подвергают взаимодействию с диоксидом селена, в результате чего в положение С-16 вводится спиртовая группа, и получают соединение формулы (II-A), гуггулстерол.
Схема 3
[Стадия G] Получение соединения формулы (I-B-2)
Соединение формулы (I-В-2) можно получить путем взаимодействия соединения формулы (I-В-1) с окисляющим реагентом.
В данном способе для окисления вторичной спиртовой группы в положении С-3 до кетоновой группы можно использовать хлорхромат пиридиния (РСС), дихромат пиридиния (PDC), реагент Джонса и окисляющий реагент Сверна (ДМСО+ClCOCOCl). Предпочтительным является хлорхромат пиридиния.
Используемый растворитель зависит от типа окисляющего реагента. Предпочтительно с хлорхроматом пиридиния (РСС) используют дихлорметан, с дихроматом пиридиния (PDC) - N,N-диметилацетамид, с реагентом Джонса - ацетон, а с окисляющим реагентом Сверна - дихлорметан.
Количество окисляющего реагента зависит от его типа. Количество хромсодержащего окисляющего реагента, как правило, составляет от 1,0 до 5,0 эквивалентов по отношению к количеству соединения формулы (I-В-1), предпочтительно от 1,2 до 2,0 эквивалентов.
В реакции окисления Сверна количество диметилсульфоксида, используемое для получения окисляющего реагента, предпочтительно составляет от 1,0 до 3,0 эквивалентов по отношению к количеству соединения формулы (I-В-1), а количество оксалилхлорида предпочтительно составляет от 1,0 до 1,5 эквивалентов по отношению к количеству соединения формулы (I-В-1).
Температура реакции зависит от типа окисляющего реагента, однако обычно она находится в интервале от -78 до 30°C. Предпочтительно в случае реакции, проводимой с использованием хромсодержащего окисляющего реагента, температура находится в интервале от -10 до 10°C, а в случае реакции окисления Сверна от -78 до 30°C.
Время реакции, в свою очередь, зависит от способа проведения реакции окисления, однако реакцию предпочтительно проводят в течение времени, составляющего от 30 минут до 12 часов, более предпочтительно менее 2 часов.
[Стадия H] Получение соединения формулы (I-B-3)
Соединение формулы (I-В-3) можно получить из соединения формулы (I-В-2) посредством реакции миграции двойной связи с использованием основания.
В данной реакции в качестве растворителя можно использовать метанол, этанол, диэтиловый эфир, тетрагидрофуран, диметилсульфоксид, бензол и толуол. Особенно предпочтительны метанол и тетрагидрофуран.
В качества основания в реакции удаления α-водорода кетоновой группы можно использовать гидроксид натрия, гидроксид калия, гидроксид лития, гидрид лития, гидрид натрия, гидрид калия, н-бутилилитий, втор-бутиллитий, трет-бутиллитий, метоксид натрия, этоксид натрия и трет-бутоксид калия. Среди них особенно предпочтительны гидроксид натрия, гидроксид калия и трет-бутоксид калия. Количество основания обычно составляет от 1,0 до 4,0 эквивалентов по отношению к количеству соединения формулы (I-В-2), предпочтительно от 1,0 до 1,5 эквивалентов.
Температура реакции зависит от типа основания и используемого растворителя, однако обычно реакцию проводят при температуре от -10 до 120°C, более предпочтительно от 10 до 50°C.
Время реакции зависит от температуры реакции и типа используемого основания и растворителя, однако обычно оно находится в интервале от 30 минут до 4 часов, предпочтительно оно составляет менее 1 часа.
I-4. Синтез соединения формулы (II-А) из тестостерона (I-С) формулы (I), где А обозначает оксогруппу (=О), В обозначает гидроксильную группу (-ОН), n равно 0, и присутствует Δ4:
В соответствии со схемой 4 соединение формулы (I-C) подвергают взаимодействию с 1,2-этандиолом в присутствии кислотного катализатора с получением соединения формулы (I-C-1). Данное соединение подвергают реакции Виттига с галогенидом этилтрифенилфосфония в присутствии сильного основания с получением соединения формулы (I-С-3). Затем получают соединение формулы (I-А-3) путем удаления защиты с кетоновой группы соединения формулы (I-С-3), окисляют его диоксидом селена, чтобы ввести спиртовую группу в положение С-16, и получают соединение формулы (II-A), гуггулстерол.
Схема 4
[Стадия I] Получение соединения формулы (I-C-1)
Чтобы получить соединение формулы (I-C-1), соединение формулы (I-C) подвергают взаимодействию с 1,2-этандиолом в присутствии кислотного катализатора в растворителе.
В качестве растворителя можно использовать хлороформ, дихлорметан, тетрахлорэтан, тетрагидрофуран, ацетонитрил, бензол и толуол. Среди них особенно предпочтительны дихлорметан и бензол.
В качестве алкандиолов можно использовать 1,2-этандиол (этиленгликоль) и 1,3-пропандиол. Особенно предпочтителен 1,2-этандиол.
Кислотные катализаторы, используемые в данной реакции, включают трифторэфират бора (BF3·Et2O), иодид цинка, щавелевую кислоту и п-толуолсульфоновую кислоту. Среди указанных соединений особенно предпочтительна п-толуолсульфоновая кислота. Используемое количество кислоты, как правило, составляет от 0,01 до 2,0 эквивалентов по отношению к количеству алкандиола, предпочтительно от 0,01 до 0,05 эквивалентов.
Температура реакции зависит от типа используемого растворителя, однако обычно реакцию проводят при температуре от -10 до 110°C, более предпочтительно от 70 до 100°C. Время реакции зависит от температуры реакции и типа используемого растворителя, однако обычно оно составляет от 30 минут до 12 часов, предпочтительно менее 3 часов.
[Стадия J] Получение соединения формулы (I-C-2)
Соединение формулы (I-C-2) получают путем взаимодействия соединения формулы (I-C-1) с оксидом хрома.
В данном способе для окисления вторичной спиртовой группы в положении С-17 до кетоновой группы можно использовать хлорхромат пиридиния (РСС) и дихромат пиридиния (PDC). Предпочтительным является хлорхромат пиридиния.
Используемый растворитель зависит от типа окисляющего реагента. Предпочтительно с хлорхроматом пиридиния (РСС) используют дихлорметан, с дихроматом пиридиния (PDC) - N,N-диметилацетамид.
Количество окисляющего реагента зависит от его типа, однако, как правило, оно составляет от 1,0 до 5,0 эквивалентов по отношению к количеству соединения формулы (I-С-1), предпочтительно от 1,5 до 2,0 эквивалентов.
Температура реакции зависит от типа окисляющего реагента, однако обычно она находится в интервале от -10 до 30°C. Время реакции, в свою очередь, зависит от типа окисляющего реагента, однако реакцию предпочтительно проводят в течение времени, составляющего от 30 минут до 12 часов, более предпочтительно менее 2 часов.
[Стадия K] Получение соединения формулы (I-C-3)
Чтобы получить соединение формулы (I-С-3), предпочтительно соединение формулы (I-С-2) подвергают взаимодействию с галогенидом этилтрифенилфосфония (Ph3P+CH2CH3X-) в неводном растворителе в присутствии сильного основания.
Неводные растворители, подходящие для данной реакции, включают диэтиловый эфир, тетрагидрофуран, гексан, гептан, метанол, этанол, диметилсульфоксид, бензол, толуол, ксилол и диметилсульфоксид. Данные растворители можно использовать по отдельности или в виде смеси двух или более растворителей. Среди указанных соединений особенно предпочтительны тетрагидрофуран и диметилсульфоксид.
Галогениды этилтрифенилфосфония, подходящие для реакции Виттига, включают хлорид этилтрифенилфосфония (Ph3P+CH2CH3Cl-), бромид этилтрифенилфосфония (Ph3P+CH2CH3Br-) или иодид этилтрифенилфосфония (Ph3P+CH2CH3I-). Среди указанных соединений особенно предпочтительны бромид этилтрифенилфосфония и иодид этилтрифенилфосфония.
Сильные основания, подходящие для реакции Виттига, включают гидрид лития, гидрид натрия, гидрид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, метоксид натрия, этоксид натрия или трет-бутоксид калия. Среди указанных соединений особенно предпочтительны гидрид натрия и трет-бутоксид калия.
Количество основания, используемое для получения илида, как правило, составляет от 1,0 до 4,0 эквивалентов по отношению к галогениду этилтрифенилфосфония, предпочтительно от 1,0 до 1,5 эквивалентов по отношению к галогениду этилтрифенилфосфония.
Температура реакции варьирует в зависимости от типа используемого растворителя, однако обычно она находится в интервале от -10 до 120°C. Если галогенид этилтрифенилфосфония взаимодействует в присутствии сильного основания в безводном растворителе с образованием илида, реакцию проводят при температуре от -10 до 20°C, если же соединение формулы (I-С-2) подвергают реакции Виттига, реакцию проводят при температуре в интервале от -25 до 100°C. Предпочтительно реакцию проводят при температуре от 50 до 70°C, если растворителем является тетрагидрофуран, и при температуре от 20 до 80°C, если растворителем является диметилсульфоксид.
Время реакции, в свою очередь, зависит от температуры реакции и типа используемого растворителя, однако реакцию предпочтительно проводить в течение времени, составляющего от 30 минут до 1 дня, более предпочтительно менее 2 часов.
[Стадия L] Получение соединения формулы (I-A-3)
Соединение формулы (I-A-3) можно получить путем удаления защиты с кетоновой группы в положении С-3 соединения формулы (I-С-3).
Растворители, подходящие для реакции удаления защитной группы, включают дистиллированную воду, ацетон, хлороформ, дихлорметан, ацетонитрил, тетрагидрофуран и ледяную уксусную кислоту. Данные растворители можно использовать по отдельности или в виде смеси двух или более растворителей. Среди указанных соединений особенно предпочтительны дистиллированная вода и ацетон.
Для удаления защитной группы можно использовать такие реагенты, как п-толуолсульфонат пиридиния (PPTS), п-толуолсульфоновая кислота (TsOH), хлористоводородная кислота и ледяная уксусная кислота. Особенно предпочтителен п-толуолсульфонат пиридиния (PPTS).
Количество реагента зависит от типа используемого реагента, однако обычно используют от 0,05 до 0,5 эквивалентов по отношению к количеству соединения формулы (I-С-3), предпочтительно от 0,1 до 0,3 эквивалентов.
Температура реакции зависит от типа используемого растворителя и реагента, однако обычно она составляет от 0 до 100°C, предпочтительно от 30 до 60°C. Время реакции, в свою очередь, зависит от температуры реакции и типа используемого реагента, однако, как правило, оно находится в интервале от 30 минут до 1 дня, предпочтительно оно составляет менее 3 часов.
I-5. Синтез соединения формулы (II-В) из 16α,17α-эпоксипрегненолона (I-D) формулы (I), где А обозначает гидроксильную группу (-ОН), В обозначает метилкетоновую группу (-С(О)СН3), n равно 0, и присутствует Δ5
В соответствии со схемой 5 соединение формулы (I-D) подвергают взаимодействию с гидразином (NH2NH2) в присутствии основания при высокой температуре с получением соединения формулы (II-B), где С обозначает гидроксильную группу (-ОН), и присутствует Δ5.
Схема 5
[Стадия М] Получение соединения формулы (II-B)
В данном способе можно использовать моногидрат гидразина (NH2NH2) и ангидрид гидразина (NH2NH2). Среди них предпочтителен моногидрат гидразина с чистотой 95-98%. Количество гидразина составляет от 1,0 до 40 эквивалентов по отношению к количеству соединения формулы (I-D), предпочтительно от 1,5 до 2,5 эквивалентов по отношению к металлорганическому реагенту, используемому в качестве основания, и от 10 до 20 эквивалентов по отношению к гидроксиду щелочного металла, используемому в качестве основания.
Подходящие для данной реакции растворители включают метанол, этанол, бутанол, этиловый эфир, тетрагидрофуран, 1,4-диоксан, диметилсульфоксид, бензол, толуол, ксилол, диметиловый эфир диэтиленгликоля, монометиловый эфир диэтиленгликоля и диэтиленгликоль. Среди указанных соединений особенно предпочтительны тетрагидрофуран и диэтиленгликоль.
В качестве основания можно использовать гидроксид натрия, гидроксид калия, гидроксид лития, н-бутилилитий, втор-бутиллитий, трет-бутиллитий, диизопропиламид лития, диизопропиламид калия, метоксид натрия, этоксид натрия и трет-бутоксид калия. Среди них особенно предпочтительны гидроксид натрия, гидроксид калия и диизопропиламид калия. Количество основания зависит от его типа, однако предпочтительно оно составляет от 2,0 до 15 эквивалентов в случае использования гидроксида щелочного металла, от 1,0 до 3,0 эквивалентов в случае использования гидрида щелочного металла, от 1,0 до 3,0 эквивалентов в случае использования металлорганического реагента, от 1,0 до 4,0 эквивалентов в случае использования алкоголята щелочного металла.
Температура реакции зависит от типа растворителя и используемого основания, однако обычно она составляет от -100 до 190°C, более предпочтительно от -100 до -78°C в случае использования гидрида щелочного металла и металлорганического реагента, от 20 до 100°C в случае использования алкоголята щелочного металла, от 80 до 160°C в случае использования гидроксида щелочного металла. Время реакции, в свою очередь, зависит от температуры реакции и типа используемого основания, однако обычно реакцию проводят в течение времени, составляющего от 30 минут до 48 часов, предпочтительно менее 4 часов.
I-6. Синтез соединения формулы (II-А) из прогестерона формулы (I-Е), где А обозначает оксогруппу (=О), В обозначает метилкетоновую группу (-С(О)СН3), n равно 0, и присутствует Δ4
В соответствии со схемой 6 кетоновые группы в положениях С-3 и С-20 соединения формулы (I-E) восстанавливают до спиртовых групп с получением соединения формулы (I-E-1), и затем данное соединение подвергают взаимодействию с селективным окисляющим средством для окисления спиртовой группы в положении С-3 в кетоновую группу с получением соединения формулы (I-E-2). После получения соединения формулы (I-E-3) путем введения п-толуолсульфонильной группы или метансульфонильной группы в качестве уходящей группы в спиртовую группу в положении С-20, его подвергают взаимодействию с основанием, получая соединение формулы (I-E-4), которое представляет собой смесь Е- и Z-изомеров. Смесь подвергают взаимодействию с диоксидом селена с получением гуггулстерола, соединения формулы (II-A), путем введения спиртовой группы в положение С-16.
Схема 6
[Стадия N] Получение соединения формулы (I-Е-1)
Соединение формулы (I-E-1) получают путем взаимодействия соединения формулы (I-E) с восстанавливающим реагентом.
Подходящие для данной реакции растворители включают метанол, этанол, диэтиловый эфир, тетрагидрофуран и дихлорметан. Среди указанных соединений особенно предпочтительны метанол и этанол.
Для восстановления кетона в качестве восстанавливающего средства в гидридной реакции восстановления можно использовать алюмогидрид лития (LAH), гидрид диизобутилалюминия (DIBAL-H), борогидрид натрия (NaBH4), борогидрид лития (LiBH4) и платиновый катализатор. Среди указанных соединений предпочтительны борогидридные восстанавливающие реагенты и особенно предпочтителен борогидрид натрия (NaBH4). Количество восстанавливающего средства обычно составляет от 0,5 до 4,0 эквивалентов по отношению к количеству соединения формулы (I-E), предпочтительно от 1,5 до 2,5 эквивалентов.
Температура реакции зависит от типа используемого растворителя и восстанавливающего средства, однако обычно она составляет от -100 до 60°C, предпочтительно от -78 до 25°C Время реакции зависит от температуры реакции и типа используемого растворителя, однако обычно реакцию проводят в течение времени, составляющего от 30 минут до 6 часов, предпочтительно менее 2 часов.
[Стадия О] Получение соединения формулы (I-Е-2)
Соединение формулы (I-E-2) можно получить путем взаимодействия соединения формулы (I-E-1) с селективным окисляющим реагентом.
Для селективного окисления спиртовой группы в данном способе можно использовать активированный диоксид марганца (MnO2). Количество окисляющего реагента, как правило, составляет от 1,0 до 40 эквивалентов по отношению к количеству соединения формулы (I-E-1), предпочтительно от 10 до 20 эквивалентов.
Подходящие растворители в данной реакции вк