2-аминобензотиазолилмочевины в качестве модуляторов аденозина
Иллюстрации
Показать всеНастоящее изобретение относится к медицине и касается применения соединений общей формулы (I)
и их фармацевтически приемлемых кислотно аддитивных солей для производства лекарственных средств для лечения заболеваний и состояний, связанных с системой аденозинового рецептора A2A, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, шизофрения, состояние тревоги, боль, депрессия, наркомания (привыкание к таким веществам, как амфетамин, кокаин, опиоиды, этиловый спирт, никотин, каннабиноиды) или гипоксия, ишемию, эпилептический припадок, а также данные соединения оказывают нейропротективное действие и могут быть использованы в качестве седативных, антипсихотических или противоэпилептических средств. 4 н. и 14 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к применению соединений общей формулы
в которой
R является низшей алкоксигруппой или атомом галогена;
R1 и R2 независимо друг от друга представляют собой атом водорода, низший алкил, тетрагидропиран-4-ил или циклоалкил, который является незамещенным или замещен одним или двумя заместителями, выбранными из группы, состоящей из атома галогена, низшей алкокси- или гидроксигруппы, или
R1 и R2, вместе с атомом азота N, с которым они связаны, образуют гетероциклические кольца, выбранные из группы, состоящей из
2-окса-5-азабицикло[2.2.1]гептана,
3-эндо-гидрокси-8-азабицикло[3.2.1]октана,
2-азабицикло[2.2.2]октана,
1-оксо-2,8-диазаспиро[4.5]декана,
3-азаспиро[5.5]ундекана,
8-азаспиро[4.5]декана,
1-окса-8-азаспиро[4.5]декана,
1,8,8-триметил-3-азабицикло[3.2.1]октана,
[1.4]оксазепана,
2-окса-5-азабицикло[2.2.2]октана,
8-окса-3-азабицикло[3.2.1]октана,
1,4-диазабицикло[3.2.1]октана,
2-азабицикло[2.2.1]гептана,
3-азабицикло[3.2.1]октана,
причем эти кольца могут быть незамещенными или замещенными низшим алкилом, или кольца выбирают из пиперазинила, незамещенного или замещенного одной или двумя группами низшего алкила, фенила или оксо-, или их выбирают из пиперидин-1-ила, замещенного группой -(CH2)n-NR′S(O)2-(низший)алкил, -C(O)NR′2 или -(СН2)n-фенил, в которой фенильное кольцо является незамещенным или замещено низшим алкилом;
R′ означает атом водорода или низший алкил, независимо друг от друга в случае R′2;
Х означает группы -О- или -СН2- и
n равно 0, 1, 2, 3 или 4,
и к фармацевтически приемлемым кислотно аддитивным солям этих соединений для получения лекарственных средств для лечения заболеваний, связанных с системой аденозинового рецептора А2. Такие заболевания включают болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейропротективное действие, шизофрению, состояние тревоги, боль, нарушения дыхания, депрессию, привыкание к наркотикам, (таким как амфетамин, кокаин, опиоиды, этиловый спирт, никотин, каннабиноиды), или астму, аллергические реакции, гипоксию, ишемию, эпилептический припадок и токсикоманию. Кроме того, соединения настоящего изобретения могут быть использованы в качестве седативных средств, мышечных релаксантов, антипсихотических, противоэпилептических, противосудорожных и кардиопротекторых средств при таких нарушениях, как заболевание коронарной артерии и сердечная недостаточность. В соответствии с настоящим изобретением наиболее предпочтительными являются те показания, которые основаны на активности антагониста рецептора A2A и которые включают нарушения центральной нервной системы, например, лечение или предупреждение болезни Альцгеймера, некоторые депрессивные нарушения, привыкание к наркотикам, нейропротективное действие, болезнь Паркинсона, а также ADHD (поражение внимания - гиперкинез).
Неожиданно было обнаружено, что соединения общей формулы I представляют собой лиганды аденозинового рецептора. Конкретно, соединения настоящего изобретения обладают хорошим сродством к А2A-рецептору и высокой избирательностью в отношении А1- и А3-рецепторов.
Аденозин модулирует широкий диапазон физиологических функций за счет взаимодействия со специфическими клетками поверхностных рецепторов. Потенциал аденозиновых рецепторов в качестве лекарственных средств впервые был рассмотрен в 1982 г. Аденозин в структурном, а также метаболическом отношении связан с биологически активными нуклеотидами - аденозинтрифосфатом (АТФ), аденозиндифосфатом (АДФ), аденозинмонофосфатом (АМФ) и циклическим аденозинмонофосфатом (цАМФ); с биохимическим метилирующим агентом
S-аденозил-L-метионом (SAM); и структурно связан с коферментами NAD, FAD и коферментом А; и с РНК. Аденозин вместе с этими родственными соединениями играет важную роль в регулировании многих видов клеточного обмена веществ и в модулировании различной деятельности центральной нервной системы.
Рецепторы для аденозина были классифицированы как A1, A2A, А2B и A3-рецепторы, принадлежащие к семейству рецепторов, спаренных с белком G. Активация аденозиновых рецепторов аденозином запускает механизм трансдукции (переноса) сигнала. Эти механизмы зависят от белка G, ассоциированного с рецептором. Каждый подтип аденозиновых рецепторов традиционно характеризуется системой нервных окончаний аденилатциклазы, в которой цАМФ используется в качестве второго РНК-посредника. Рецепторы A1 и A3, спаренные с белками Gi, ингибируют аденилатциклазу, что приводит к снижению содержания клеточного цАМФ, в то время как A2A и А2B рецепторы, спаренные с белками Gs, и активируют аденилатциклазу, что приводит к повышению содержания клеточного цАМФ. Известно, что рецепторная система A1 включает активацию фосфолипазы С и модулирование ионных каналов калия, а также кальция. Подтип A3, кроме ассоциации с аденилатциклазой, также стимулирует фосфолипазу С и, таким образом, активируются ионные каналы кальция.
Рецептор A1 (326-328 аминокислот) клонируется из различных видов (собака, человек, крыса, цыплята, корова, морская свинка) с 90-95% идентичностью последовательности среди этих видов млекопитающих. Рецептор A2A (409-412 аминокислот) клонируется от собаки, крысы, человека, морской свинки и мыши. Рецептор А2B (332 аминокислоты) клонируется от человека и мыши при 45% гомологичности человеческого рецептора А2B с человеческими рецепторами A1 и A2A. Рецептор A3 (317-320 аминокислот) клонируется от человека, крысы, собаки, кролика и овцы.
Полагают, что подтипы A1 и A2A рецепторов играют дополнительную роль при регулировании подачи энергии с помощью аденозина. Аденозин, который представляет собой продукт метаболизма АТФ, диффундирует из клетки и локально активирует аденозиновые рецепторы, снижая потребление кислорода (A1) или увеличивая поступление кислорода (А2A) и, таким образом, поддерживается баланс между поступлением и потреблением энергии внутри ткани. Оба подтипа выполняют следующие функции: увеличивают количество доступного кислорода в ткани и защищают клетки от повреждения, вызванного кратковременным дисбалансом кислорода. Одной из важных функций эндогенного аденозина является предотвращение повреждения при таких заболеваниях как гипоксия, ишемия, гипотония и эпилептический припадок.
Кроме того, известно, что связывание агониста аденозинового рецептора с тучными клетками, экспрессирующими А3 рецептор крысы, приводит к повышенным концентрациям трифосфата инозита и внутриклеточного кальция, что усиливает секрецию воспалительных медиаторов, индуцированную антигеном. Таким образом, А3 рецептор играет роль при передаче астматического приступа и других аллергических реакций.
Аденозин представляет собой нейромодулятор, который способен корректировать многие аспекты физиологической активности мозга. Эндогенный аденозин, являясь центральным связующим звеном между энергетическим обменом веществ и нейронной активностью, изменяется в соответствии с состоянием реакции и (пато)физиологическими условиями. В условиях повышенного потребления и пониженной доступности энергии (таких как гипоксия, гипогликемия, и/или избыточная нейронная активность), аденозин обеспечивает мощный защитный механизм с обратной связью. Взаимодействие с аденозиновыми рецепторами представляет перспективную цель для терапевтического вмешательства в ряде неврологических и психиатрических заболеваний, таких как эпилепсия, сонливость, нарушение движений (болезни Паркинсона или Хантингтона), болезнь Альцгеймера, депрессия, шизофрения или токсикомания. Такие заболевания, как гипоксия, ишемия и эпилептические припадки, прослеживаются увеличением выделения нейротрансмиттера. В конечном счете, эти нейротрансмиттеры ответственны за деградацию и гибель нерва, что вызывает повреждение мозга или смерть индивида. Следовательно, аденозиновые A1 агонисты, которые имитируют центральное ингибирующее действие аденозина, могут быть использованы в качестве нейропротекторных агентов. Аденозин был предложен в качестве эндогенного противосудорожного средства, ингибирующего выделение глютамата из стимулирующих нейронов и ингибирующего воспаление нейронов. Поэтому агонисты аденозина могут быть использованы в качестве противоэпилептических средств. Антагонисты аденозина стимулируют активность центральной нервной системы (ЦНС), причем установлено, что эти антагонисты являются эффективными средствами усиления познавательной деятельности. Избирательные А2а антагонисты обладают терапевтическим потенциалом при лечении различных форм слабоумия, например при болезни Альцгеймера, и нейродегенеративных нарушений, например инсульта. Антагонисты аденозинового A2a рецептора корректируют активность полосатых гамма-аминомаслянокислотно-эргических нейронов и регулируют плавные и хорошо координированные движения, обеспечивая, таким образом, потенциальную терапию симптомов болезни Паркинсона. Аденозин также вовлечен в ряд физиологических процессов, связанных с успокоением, гипнозом, шизофренией, состоянием тревоги, болью, дыханием, депрессией и наркоманией (привыкание к амфетамину, кокаину, опиоидам, этиловому спирту, никотину, каннабиноидам). Следовательно, лекарственные средства, воздействующие на аденозиновые рецепторы, обладают терапевтическим потенциалом в качестве седативных средств, мышечных релаксантов, антипсихотических средств, транквилизаторов, анальгетиков, стимуляторов дыхания, антидепрессантов, и при лечении токсикомании. Кроме того, они могут быть использованы при лечении ADHD (поражение внимания - гиперкинез).
Важная роль аденозина в сердечно-сосудистой системе заключается в его кардиозащитном действии. В ответ на ишемию и гипоксию возрастает содержание эндогенного аденозина, что защищает сердечную ткань в ходе и после повреждения (предобработка). Воздействуя на А1 рецептор, агонисты аденозина А1 могут защитить организм от повреждения, вызванного ишемией миокарда и реперфузией. Корректирующее влияние А2а рецепторов на адренергическую функцию может иметь значение при множестве нарушений, таких как ишемия коронарной артерии и сердечная недостаточность. Антагонисты A2a могут быть использованы терапевтически в таких ситуациях, когда желательна повышенная антиадренергическая реакция, как, например, при острой ишемии миокарда. Кроме того, избирательные антагонисты при рецепторах А2а могут повысить эффективность аденозина для прекращения наджелудочковой аритмии.
Аденозин корректирует многие факторы функции почек, включая выделение ренина, скорость клубочковой фильтрации и почечный кровоток. Соединения, которые оказывают сопротивление воздействию аденозина на почки, являются потенциальными агентами для защиты почек. Кроме того, аденозиновые А3 и/или А2В антагонисты могут быть использованы при лечении астмы и других аллергических реакций или (и) при лечении сахарного диабета и ожирения.
Современный уровень знаний об аденозиновых рецепторах отражен в многочисленных документах, например в следующих публикациях:
Bioorganic & Medicinal Chemistry, 6, (1998), 619-641,
Bioorganic & Medicinal Chemistry, 6, (1998), 707-719,
J.Med.Chem., (1998), 41, 2835-2845,
J.Med.Chem., (1998), 41, 3186-3201,
J.Med.Chem., (1998), 41, 2126-2133,
J.Med.Chem., (1999), 42, 706-721,
J.Med.Chem., (1996), 39, 1164-1171,
Arch.Pharm.Med.Chem., 332, 39-41, (1999),
Am.J.PhysioL, 276, H1113-1116, (1999) или
Naunyn Schmied, Arch. Pharmacol. 362, 375-381, (2000).
Кроме того, в заявке WO 01/57008 описаны производные бензотиазолилмочевины и их применение в качестве ингибиторов протеинкиназы. Эти соединения используются в качестве ингибиторов тирозинкиназы, что имеет значение при лечении гиперпролиферативных заболеваний, особенно рака, и в процессе ангиогенеза. Следующие ниже соединения формул IA и IB не входят в объем изобретения WO 01/57008,
Таким образом, настоящее изобретение также относится к новым соединениям формулы IA
в которой
R означает низшую алкоксигруппу или атом галогена;
R11 и R21 вместе с атомом азота, с которым они связаны, образуют гетероциклические кольца, выбранные из группы, состоящей из
2-окса-5-азабицикло[2.2.1]гептана,
3-эндо-гидрокси-8-азабицикло[3.2.1]октана,
2-азабицикло[2.2.2]октана,
1-оксо-2,8-диазаспиро[4.5]декана,
3-аза-спиро[5.5]ундекана,
8-аза-спиро[4.5]декана,
1-окса-8-азаспиро[4.5]декана,
1,8,8-триметил-3-аза-бицикло[3.2.1]октана,
[1.4]оксазепана,
2-окса-5-азабицикло[2.2.2]октана,
8-окса-3-азабицикло[3.2.1]октана,
1,4-диазабицикло[3.2.1]октана,
2-азабицикло[2.2.1]гептана,
3-азабицикло[3.2.1]октана,
причем эти кольца могут быть незамещеными или замещенными низшим алкилом,
или выбирают из
пиперидин-1-ила, замещенного группой -(СН2)n-NR′S(O)2-(низший)алкил, -C(O)NR′2 или -(СН2)n-фенил, в которой фенильное кольцо может быть незамещенным или замещенным низшим алкилом;
R′ означает атом водорода или низший алкил, независимо друг от друга в случае R′2;
Х означает -О- или СН2-; и
n равно 0, 1, 2, 3 или 4 и
к фармацевтически приемлемым кислотно аддитивным солям этих соединений.
Кроме того, настоящее изобретение относится к новым соединениям формулы IB
в которой
R означает низшую алкоксигруппу или атом галогена;
R12 является низшим алкилом и
R22 означает циклоалкил, замещенный одним или двумя заместителями, причем эти заместители выбирают из группы, состоящей из атома галогена, низшей алкоксигруппы или гидрокси-;
Х означает -О- или СН2-;
Новыми соединениями формулы IA, в которой Х означает -О-, являются, например, следующие:
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1S,4S)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид -эндо-гидрокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид -метил-1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид -оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид -бензил-4-гидроксиметилпиперидин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид -азаспиро[5.5]ундекан-3-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид -азаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-аза-бицикло[2.2.2]октан-2-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-окса-8-азаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (R)-4-(1-гидроксиэтил)пиперидин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (S)-4-(1-гидроксиэтил)пиперидин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-(метансульфониламинометил)-пиперидин-1-карбоновой кислоты,
4-амид-1-[(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид]пиперидин-1,4-дикарбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (1R)-1,8,8-триметил-3-азабицикло[3.2.1]октан-3-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-окса-5-азабицикло[2.2.2]октан-5-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1,4-диазабицикло[3.2.1]октан-4-карбоновой кислоты или
(4-метокси-7-морфолин-4-ил-бензотиазол-2-ил)амид (1S,4R)-2-азабицикло[2.2.1]гептан-2-карбоновой кислоты.
Кроме того, новыми соединениями формулы IA являются те, в которых Х означает группу -СН2, например, следующие:
(4-метокси-7-пиперидин-1-илбензотиазол-2-ил)амид 1-окса-8-азаспиро[4.5]декан-8-карбоновой кислоты,
(4-хлор-7-пиперидин-1-илбензотиазол-2-ил)амид 4-гидрокси-4-(4-метилбензил)пиперидин-1-карбоновой кислоты или
(4-хлор-7-пиперидин-1-илбензотиазол-2-ил)амид 4-бензилпиперидин-1-карбоновой кислоты.
Новыми соединениями формулы IB, в которой Х означает -О-, являются, например, следующие:
1-(4-цис-фторциклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
1-(4,4-дифторциклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(цис)-1-(4-метоксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(транс)-1-(4-гидроксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(цис)-1-(4-гидроксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина или
(транс)-1-(4-метоксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина.
Объектами настоящего изобретения являются сами соединения формулы IA или IB, применение соединений формулы I и их фармацевтически приемлемых солей для получения лекарственных средств для лечения заболеваний, связанных с аденозиновым А2 рецептором, их получение, лекарственные средства на основе соединений согласно изобретению и их получение, а также применение соединений формулы I для подавления или предупреждения заболеваний, на основе модулирования аденозиновой системы, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейропротективное действие, шизофрения, состояние тревоги, боль, нарушения дыхания, депрессия, наркомания (например, привыкание к таким веществам, как амфетамин, кокаин, опиоиды, этиловый спирт, никотин, каннабиноиды), или астма, аллергические реакции, гипоксия, ишемия, эпилептический припадок и токсикомания. Кроме того, соединения настоящего изобретения могут быть использованы в качестве седативных средств, мышечных релаксантов, антипсихотических, противоэпилептических, противосудорожных и кардиопротективных средств при таких нарушениях, как заболевание коронарной артерии и сердечная недостаточность. Согласно настоящему изобретению, наиболее предпочтительными показаниями являются те, которые основаны на активности антагониста А2А рецептора и которые включают нарушения центральной нервной системы, например лечение или предупреждение болезни Альцгеймера, некоторые депрессивные нарушения, наркоманию, нейропротективное действие и болезнь Паркинсона, а также ADHD.
Применяемый в этом изобретении термин "(низший) алкил" означает насыщенную алкильную группу с нормальной или разветвленной цепочкой, которая содержит от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил,
н-бутил, изобутил, 2-бутил, трет-бутил и т.п. Предпочтительные низшие алкильные группы содержат 1-4 атома углерода.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "(низший) алкокси-" означает группу, в которой алкильные остатки имеют указанные выше значения и которые соединяются через атом кислорода.
Термин "фармацевтически приемлемые кислотно аддитивные соли" охватывает соли неорганических и органических кислот, таких как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Предпочтительные соединения настоящего изобретения для применения против заболеваний, связанных с А2а рецептором, представляют собой соединения формулы I, в которой Х означает -О-, например следующие соединения:
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (1S,4S)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 3-эндо-гидрокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-метил-1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-бензил-4-гидроксиметилпиперидин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 3-азаспиро[5.5]ундекан-3-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 8-азаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-азабицикло[2.2.2]октан-2-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 1-окса-8-азаспиро[4.5]декан-8-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (R)-4-(1-гидроксиэтил)пиперидин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (S)-4-(1-гидроксиэтил)-пиперидин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-(метансульфониламинометил)-пиперидин-1-карбоновой кислоты,
4-амид-1-[(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид]пиперидин-1,4-дикарбоновой кислоты,
1-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-3-(тетрагидропиран-4-ил)мочевина,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-изопропилпиперазин-1-карбоновой кислоты,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 4-фенилпиперазин-1-карбоновой кислоты,
1-циклогексил-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
1-(4-цис-фторциклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
1-(4-цис-фторциклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(цис)-1-(4-метоксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(транс)-1-(4-гидроксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид[1.4]оксазепан-4-карбоновой кислоты,
(цис)-1-(4-гидроксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид 2-окса-5-азабицикло[2.2.2]октан-5-карбоновой кислоты,
(транс)-1-(4-метоксициклогексил)-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
(4-метокси-7-морфолин-4-илбензотиазол-2-ил)амид (1S,4R)-2-азабицикло[2.2.1]гептан-2-карбоновой кислоты,
3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метил-1-(тетрагидропиран-4-ил)мочевина,
1-циклогептил-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина,
1-циклопентил-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)-1-метилмочевина или
1-циклопентил-3-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)мочевина.
Кроме того, предпочтительными соединениями настоящего изобретения для применения против заболеваний, связанных с А2а рецептором, являются соединения формулы I, в которой Х означает группу -СН2-, например, следующие соединения:
(4-метокси-7-пиперидин-1-илбензотиазол-2-ил)амид 1-окса-8-азаспиро[4.5]декан-8-карбоновой кислоты,
(4-хлор-7-пиперидин-1-илбензотиазол-2-ил)амид 4-гидрокси-4-(4-метилбензил)пиперидин-1-карбоновой кислоты,
(4-хлор-7-пиперидин-1-илбензотиазол-2-ил)амид 4-бензилпиперидин-1-карбоновой кислоты,
(4-метокси-7-пиперидин-1-илбензотиазол-2-ил)амид 4-метил-3-оксопиперазин-1-карбоновой кислоты или
1-(4-хлор-7-пиперидин-1-илбензотиазол-2-ил)-3-циклогексилмочевина.
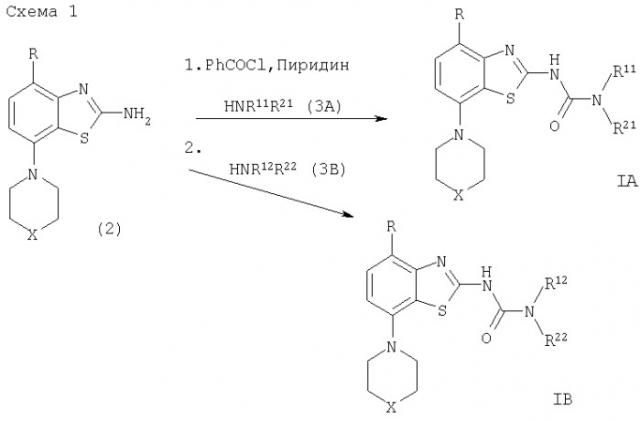
В настоящем изобретении соединения формулы IA или IB и их фармацевтически приемлемые соли могут быть получены, используя известные из уровня техники методы, например описанные ниже способы, которые заключаются в том, что
а) соединение формулы
взаимодействует с фенилхлорформиатом и затем с соединением формулы HNR11R21 (3А) или HNR11R22 (3В),
образуя соединение формулы
в которых являются такими, как указано выше, и R11 и R21 вместе с атомом азота, с которым они связаны, образуют гетероциклические кольца, выбранные из группы, состоящей из 2-окса-5-азабицикло[2.2.1]гептана, 3-эндо-гидрокси-8-азабицикло[3.2.1]октана, 2-азабицикло[2.2.2]октана, 1-оксо-2,8-диазаспиро[4.5]декана, 3-азаспиро[5.5]ундекана, 8-азаспиро[4.5]декана, 1-окса-8-азаспиро[4.5]декана, 1,8,8-триметил-3-азабицикло[3.2.1]октана, [1.4]оксазепана, 2-окса-5-азабицикло[2.2.2]октана, 8-окса-3-азабицикло[3.2.1]октана, 1,4-диазабицикло[3.2.1]октана, 2-азабицикло[2.2.1]-гептана или 3-азабицикло [3.2.1]октана, причем эти кольца могут быть незамещенными или замещенными низшим алкилом, или их выбирают из пиперидин-1-ила, замещенного группами -(СН2)n-фенил, -(СН2)n-NR′S(O)2-(низший) алкил, -C(О)NR′2 или -(СН2)n-фенил, и в которых фенильное кольцо является незамещенным или замещенным низшим алкилом и R′ означает атом водорода или низший алкил, независимо друг от друга в случае R′2, и значение n указано выше,
и R12 означает алкил и R22 представляет собой циклоалкил, замещенный одним или двумя заместителями, причем эти заместители выбраны из группы, состоящей из атома галогена, низшей алкокси- или гидрокси-группы; или
если это желательно, превращают полученные соединения в фармацевтически приемлемые кислотно аддитивные соли.
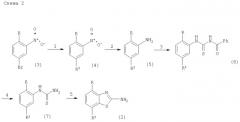
Соединения формулы IA и IB могут быть получены в соответствии с вариантом а) способа по следующей схеме 1. Схема 2 иллюстрирует получение промежуточного соединения формулы (2). Кроме того, получение соединений формулы IA и IB более подробно описано в 37 примерах.
в которой заместители такие, как описано выше.
Получение соединения формулы IA или IB
В раствор соединения формулы (2), например 4-метокси-7-морфолин-4-илбензотиазол-2-иламина, в дихлорметане последовательно добавляют пиридин и фенилхлорформиат и образовавшийся раствор перемешивают в течение 45 мин при температуре окружающей среды. Затем добавляют соединение формулы (3А) или (3В), например (1S,4S)-2-окса-5-азабицикло[2.2.1]гептан, и смесь перемешивают при температуре окружающей среды приблизительно 15 мин и при 40°С в течение 2,5 ч. После охлаждения до температуры окружающей среды добавляют насыщенный водный раствор карбоната натрия, органическую фазу отделяют и сушат.
Получение исходного соединения формулы (2) описано в патенте ЕР 00113219.0 следующим образом:
в которой цифры 1-5 имеют следующие значения:
1 морфолин или пиперидин, основание, Pd-катализатор,
2 Н2 и Pd-C, или Н2 и Ni Ренея, или TiCl3, или Fe,
3 Ph(CO)NCS,
4 метилат натрия,
5 Br2.
Здесь R означает низшую алкоксигруппу или атом галогена и R3 означает пиперидин-1-ил или морфолинил.
Выделение и очистка соединений
По желанию, выделение и очистка соединений и описанных в изобретении промежуточных соединений могут быть осуществлены с помощью любой подходящей методики разделения или очистки, например, такой как фильтрация, экстракция, кристаллизация, хроматография в колонке, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография при низком или высоком давлении или путем сочетания этих методик. Конкретные примеры подходящих методик разделения и выделения могут быть приведены ниже с помощью ссылки на Препараты и Примеры изобретения. Однако, разумеется, также могут быть использованы другие эквивалентные методики разделения или выделения.
Соли соединений формулы IA или IB
Основные группы соединений формулы IA или IB могут быть превращены в соответствующие кислотно аддитивные соли. Это превращение осуществляют путем обработки, по меньшей мере, стехиометрическим количеством подходящей кислоты, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этиловый спирт или метиловый спирт и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают между 0 и 50°С. Образовавшаяся соль осаждается самопроизвольно или может быть выведена из раствора с помощью менее полярного растворителя.
Кислотно аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания путем обработки, по меньшей мере, стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак, и т.п.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. Конкретно, обнаружено, что соединения настоящего изобретения представляют собой лиганды аденозинового рецептора и обладают высоким сродством к аденозиновому А2А рецептору и хорошей избирательностью в отношении рецепторов А1 и А3.
Соединения были исследованы в соответствии с процедурой испытания, приведенной ниже.
Аденозиновый А2А рецептор человека
Аденозиновый А2А рецептор человека рекомбинантно экспрессируется в клетках яичника китайского хомяка (СНО) с использованием системы экспрессии вируса semliki forest. Клетки собирают, дважды промывают путем центрифугирования, гомогенизируют и снова промывают путем центрифугирования. Окончательно промытый осадок центрифугирования суспендируют в буферном растворе Tris (50 ммоль/л), содержащем 120 ммоль/л (mM) NaCl, 5 mM KCl, 2 mM CaCl2 и 10 mM MgCl2 (pH 7,4) (буфер А). Анализ связывания проводят с меченым субстратом [3H]-SCH-58261 (Dionisotti et al., 1997, Brit.J.Pharmacol. 121, 353; 10-9 моль/л) в планшетах с 96-лунками в присутствии 2,5 мкг белка мембраны, 0,5 мг шариков антигенного комплекса Ysi-поли-1-лизин, защищающего строму, и 0,1 ед. аденозин-деаминазы в окончательном объеме 200 мкл буферного раствора А. Неспецифическое связывание определяют, используя ксантинаминный представитель того же рода (ХАС; 2 мкмоль/л). Испытания проведены для 10 концентраций соединений в интервале 10-5-0,3·10-9 моль/л. Все испытания проводят с дублированием и повторяют, по меньшей мере, два раза. Анализируемые планшеты выдерживают 1 час при комнатной температуре до центрифугирования и затем определяют количество связанного лиганда, используя сцинтилляционный счетчик Packard Topcount. Значения концентрации 50% ингибирования (IC50) рассчитывают, используя нелинейную программу построения эмпирической кривой, а величины Ki рассчитывают, используя уравнение Cheng-Prussoff.
Предпочтительные соединения имеют величину pKi>7,5.
| Пример № | hA2 (pKi) | Пример № | hA2 (pKi) |
| 1 | 8,5 | 19 | 8,4 |
| 2 | 7,9 | 20 | 8,5 |
| 3 | 8,1 | 21 | 8,6 |
| 4 | 8,2 | 22 | 7,8 |
| 5 | 8,2 | 23 | 8,1 |
| 6 | 7,7 | 24 | 8,0 |
| 7 | 8,1 | 25 | 7,7 |
| 8 | 8,4 | 27 | 7,9 |
| 9 | 7,9 | 28 | 7,9 |
| 10 | 8,0 | 29 | 7,9 |
| 11 | 8,2 | 30 | 8,3 |
| 12 | 8,6 | 32 | 7,6 |
| 13 | 8,6 | 33 | 8,3 |
| 14 | 8,1 | 34 | 7,8 |
| 15 | 8,1 | 35 | 7,9 |
| 16 | 7,8 | 36 | 8,1 |
| 17 | 7,7 | 37 | 8,1 |
| 18 | 7,7 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарственных средств, например в виде фармацевтических препаратов. Эти фармацевтические препараты могут вводиться орально, например, в виде таблеток, покрытых таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может быть также осуществлено ректально, например, в виде свечей, парэнтерально, например, в виде растворов для инъекций.
Для получения фармацевтических препаратов соединения формулы I могут перерабатываться с фармацевтически инертными, неорганическими или органическими носителями. В качестве таких носителей для таблеток, покрытых таблеток, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и т.п. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в зависимости от природы активного вещества, в случае мягких желатиновых капсул обычно не требуется никакой носитель. Для получения растворов и сиропов подходящими носителями являются, например, вода, полиолы, глицерин, растительное масло и т.п. Подходящими носителями для свечей являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизирующие вещества, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиокислители. Кроме того, они также могут содержать и другие терапевтически значимые вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом настоящего изобретения, как и способ их получения, который заключается в том, что вносят одно или несколько соединений формулы I и/или их фармацевтически приемлемых кислотно аддитивных солей и, по желанию, одно или несколько других терапевтически значимых веществ в фармацевтическую рецептуру вместе с одним или несколькими терапевтически инертными носителями.
Согласно изобретению соединения формулы I, а также их фармацевтически приемлемые соли используются при подавлении или предупреждении болезни, вызванной активностью антагониста аденозинового рецептора, такой как болезнь Альцгеймера, болезнь Паркинсона, нейропротективное действие, шизофрения, состояние тревоги, боль, нарушение дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, эпилептический припадок и токсикомания. Кроме того, соединения настоящего изобретения могут быть использованы в качестве седативных средств, мышечных релаксантов, антипсихотических, противоэпилептических, противосудорожных и кардиопротективных средств и для получения соответствующих лекарственных средств.
Согласно настоящему изобретению наиболее предпочтительными показаниями являются те, которые включают нарушения центральной нервной системы, например, лечение или предупреждение некоторых депрессивных нарушений, нейропротективное действие и болезнь Паркинсона.
Дозировка может варьироваться в широких пределах и, разумеется, обязательно будет соответствовать индивидуальным требованиям, в каждом конкретном случае. В случае орального назначения суточная дозировка для взрослых пациентов может изменяться приблизительно от 0,01 до 1000 мг соединения общей формулы I или соответствующего количества фармацевтически приемлемой соли этого соединения. Суточная дозировка может вводиться в виде однократной дозы или в раздельных дозах и, кроме того, верхний предел может быть превышен, когда это необходимо по медицинским показаниям.
| Рецептура таблетки (влажное гранулирование) | ||||
| Пункт Компоненты | в мг (на таблетку) | |||
| 5 мг | 25 мг | 100 мг | 500 мг | |
| 1. Соединение формулы I | 5 | 25 | 100 | 500 |
| 2. Безводная лактоза DTG | 125 | 105 | 30 | 150 |
| 3. Sta-Rx 1500 (крахмал) | 6 | 6 | 6 | 30 |
| 4. Микрокристаллическая целлюлоза | 30 | 30 | 30 | 150 |
| 5. Стеарат магния | 1 | 1 | 1 | 1 |
| Всего | 167 | 167 | 167 | 831 |
Методика приготовления
1. Смешивают компоненты 1, 2, 3 и 4 и смесь гранулируют с очищенной водой.
2. Сушат гранулы при 50°С.
3. Пропускают гранулы через соответствующее измельчающее устройство.
4. Добавляют компонент 5 и смешивают в течение 3 мин; таблетируют на соответствующем прессе.
| Рецептура капсул | ||||
| Пункт Компоненты | в мг (на капсулу) | |||
| 5 мг | 25 мг | 100 мг | 500 мг | |
| 1. Соединение формулы I | 5 | 25 | 100 | 500 |
| 2. Водная лактоза | 159 | 123 | 148 | - |
| 3. Кукурузный крахмал | 25 | 35 | 40 | 70 |
| 4. Тальк | 10 | 15 | 10 | 25 |
| 5. Стеарат магния | 1 | 2 | 2 |