Последовательность нуклеиновой кислоты, кодирующая белок gag вич-1, способ получения указанной последовательности, вектор, содержащий ее, белок, кодируемый ею, фармацевтическая композиция и их применение для профилактики и/или лечения вич-инфекции и спида
Иллюстрации
Показать всеИзобретение относится к нуклеиново-кислотным конструкциям, а также к вакцинным препаратам, содержащим такие конструкции, и к применению таких препаратов в медицине. Нуклеотидная последовательность, которая кодирует белок gag ВИЧ-1 (HIV-1) или его фрагмент, содержащий эпитоп gag, и белок Nef ВИЧ-1 или его фрагмент, содержащий эпитоп nef, и белок RT или его фрагмент, содержащий эпитоп RT, оперативно сцеплена с гетерологичным промотором, причем последовательность gag оптимизирована по кодонам. Данная последовательность входит в состав фармацевтической композиции и используется для лечения и/или профилактики ВИЧ-инфекции и СПИДа. 7 н. и 9 з.п. ф-лы, 3 табл., 24 ил.
Реферат
Область изобретения
Настоящее изобретение относится к нуклеиново-кислотным конструкциям, к клеткам-хозяевам, содержащим такие конструкции, и к их применению в нуклеиново-кислотных вакцинах. Кроме того, изобретение относится к вакцинным препаратам, содержащим такие конструкции, и к применению таких препаратов в медицине. В частности, изобретение относится к ДНК вакцинам, которые полезны при профилактике и лечении ВИЧ-инфекций, более конкретно при введении путем опосредованной частицами доставки.
Предпосылки изобретения
ВИЧ-1 (HIV-1) является главной причиной синдрома приобретенного иммунодефицита (СПИД), который рассматривают как одну из основных проблем мирового здравоохранения. Хотя во всем мире были предприняты широкомасштабные исследования по получению вакцины, такие усилия, тем не менее, не увенчались успехом.
Описаны необолочечные белки ВИЧ-1, которые включают, например, белки внутренней структуры, такие как продукты генов gag и pol, и другие неструктурные белки, такие как Rev, Nef, Vif и Tat (Green et al., New England J. Med., 324, 5, 308 et seq (1991) и Bryant et al. (Ed. Pizzo), Pediatr. Infect. Dis. J., 11, 5, 390 et seq (1992)).
Ген Gag транслируется с полноразмерной РНК с образованием полипротеина-предшественника, который потом расщепляется на 3-5 капсидных белков; белок матрикса, капсидный белок и белок, связывающий нуклеиновые кислоты, а также протеазу (1. Fundamental Virology, Fields BN, Knipe D.M. and Howley M., 1996; 2. Fields Virology, vol. 2, 1996).
Ген gag кодирует белок-предшественник Gag 55 килодальтон (кД), также называемый р55, который экспрессируется с несплайсированной вирусной мРНК. В процессе трансляции N-конец р55 подвергается миристоилированию, которое запускает его связывание с цитоплазматической частью клеточных мембран. Связанный с мембраной полипротеин Gag рекрутирует две копии вирусной геномной ДНК параллельно с другими вирусными и клеточными белками, которые запускают почкование вирусной частицы с поверхности инфицированной клетки. После почкования р55 расщепляется кодируемой вирусом протеазой (продукт гена pol) в процессе созревания вируса на четыре белка меньшего размера, обозначенных МА (матрикс [р17]), СА (капсид [р24]), NC (нуклеокапсид [р9]) и р6 (4).
Кроме трех основных белков Gag, все предшественники Gag содержат несколько других районов, которые отщепляются и остаются в вирионе в виде пептидов различных размеров. Эти белки играют различные роли, например белок р2 предположительно играет роль в регуляции активности протеазы и вносит вклад в правильное определение времени протеолитического процессинга.
Полипептид МА образуется из N-терминального миристоилированного конца р55. Большая часть молекул МА остается присоединенной к внутренней поверхности липидного бислоя вириона, стабилизируя частицу. Подгруппа МА рекрутируется внутри более глубоких слоев вириона, где она становится частью комплекса, который доставляет вирусную ДНК в ядро (5). Эти молекулы МА способствуют ядерному транспорту вирусного генома, поскольку кариофильный сигнал на МА распознается клеточным механизмом ядерного импорта. Это явление дает возможность ВИЧ инфицировать неделящиеся клетки, что является необычным свойством для ретровируса.
Белок р24 (СА) образует коническую сердцевину вирусных частиц. Продемонстрировано, что циклофилин А взаимодействует с районом р24 белка р55, приводя к его включению в частицы ВИЧ. Взаимодействие между Gag и циклофилином А существенно, поскольку прерывание этого взаимодействия циклоспорином А ингибирует вирусную репликацию.
Район NC Gag ответственен за специфичность распознавания так называемого сигнала упаковки ВИЧ. Сигнал упаковки состоит из четырех шпилечных структур, локализованных вблизи 5' конца вирусной РНК, и достаточен в качестве посредника включения гетерологичной РНК в вирионы ВИЧ-1. NC связывается с сигналом упаковки с помощью взаимодействий, опосредованных двумя мотивами «цинковые пальцы». NC также способствует обратной транскрипции.
Район полипептида р6 является посредником взаимодействий между р55 Gag и вспомогательным белком Vpr, приводящих к включению Vpr в собирающиеся вирионы. Район р6 также содержит так называемый поздний домен, который необходим для эффективного высвобождения почкующихся вирионов из инфицированной клетки.
Ген pol кодирует два белка, содержащих две активности, необходимые вирусу при ранней инфекции, белок RT (обратную транскриптазу) и белок интегразу, необходимый для интеграции вирусной ДНК в клеточную ДНК. Первичный продукт Pol расщепляется протеазой вириона с образованием амино-концевого пептида RT, который содержит активности, необходимые для синтеза ДНК (РНК и ДНК-зависимую ДНК-полимеразу, рибонуклеазу Н) и карбокси-концевого белка интегразы. RT ВИЧ представляет собой гетеродимер полноразмерной RT (р66) и продукта расщепления (р51), в котором отсутствует карбокси-концевой домен РНКазы и интегразы.
RT является одним из наиболее высококонсервативных белков, кодируемых ретровирусным геномом. Двумя основными активностями RT являются ДНК-полимераза и рибонуклеаза Н. Активность ДНК-полимеразы RT использует РНК и ДНК в качестве матриц взаимозаменяемо и, подобно всем известным ДНК-полимеразам, не способна инициировать синтез ДНК de novo, но ей необходима ранее существующая молекула, которая служит в качестве праймера (РНК).
Активность РНКазы Н, свойственная всем белкам RT, играет существенную роль удаления РНК генома по мере продолжения синтеза ДНК при ранней репликации. Она избирательно разрушает РНК из всех гибридных молекул РНК-ДНК. Структурно полимераза и РНКаза Н занимают отдельные неперекрывающиеся домены в пределах Pol, покрывая две трети аминокислотной последовательности Pol.
Каталитическая субъединица р66 упакована в 5 различных поддоменов. Ее амино-конец 23 обладает частью активности RT. На ее карбокси-конце находится домен РНКазы Н.
После инфекции клетки-хозяина ретровирусный РНК геном копируется обратной транскриптазой, которая присутствует в инфекционной частице, в линейную двунитевую (ds, double strand) ДНК. Интеграза (обзор приведен в Skalka AM'99 Adv in Virus Res, 52: 271-273) распознает концы вирусной ДНК, укорачивает их и сопровождает вирусную ДНК к сайту хромосомы хозяина, катализируя интеграцию. Мишенями для интеграции могут быть многие сайты ДНК хозяина. Хотя интеграза достаточна для катализа интеграции in vitro, она является не единственным белком, связанным с комплексом вирусная ДНК in vivo - большой белок - вирусная ДНК, выделенным из инфицированных клеток, был назван комплексом преинтеграции. Этот комплекс способствует приобретению генов клетки-хозяина вирусными геномами-потомками.
Интеграза состоит из 3 отдельных доменов, N-концевого домена, каталитической сердцевины и С-концевого домена. Каталитический сердцевинный домен содержит все необходимое для химии полинуклеотидильного переноса.
Известно, что белок Nef вызывает удаление CD4, рецептора ВИЧ, с клеточной поверхности, но биологическая значимость этой функции является предметом споров. Кроме того, Nef взаимодействует с биохимическим путем передачи сигнала Т-клеток и индуцирует активное состояние, которое, в свою очередь, может способствовать более эффективной генной экспрессии. Некоторые изоляты ВИЧ имеют мутации в этом районе, которые являются причиной отсутствия кодирования ими функционального белка, и у них несколько ослаблена репликация и патогенез in vivo.
ДНК вакцины обычно состоят из бактериального плазмидного вектора, в который встроены сильный промотор, целевой ген, который кодирует антигенный пептид, и последовательности полиаденилирования/терминации транскрипции. Целевой ген может кодировать полноразмерный белок или просто антигенную пептидную последовательность, родственную патогену, опухоли или другому агенту, против которого необходима защита. Эту плазмиду можно выращивать в бактериях, таких как, например, Е.coli, а затем выделять и получать ее препарат в подходящей среде в зависимости от предназначенного пути введения, после чего ее вводят хозяину. После введения эта плазмида захватывается клетками хозяина, где продуцируется кодируемый белок. Плазмидный вектор предпочтительно следует конструировать без точки начала репликации, которая является функциональной в эукариотических клетках, чтобы предотвратить репликацию плазмиды в млекопитающем-хозяине для ее участия в интеграции в хромосомную ДНК.
Существует ряд преимуществ ДНК вакцинации перед традиционными методиками вакцинации. Во-первых, предсказывают, что в связи с тем, что белки, которые кодируются последовательностью ДНК, синтезируются в хозяине, структура или конформация этого белка будет подобна нативному белку, связанному с болезненным состоянием. Вероятно также, что ДНК вакцинация будет предоставлять защиту против различных штаммов вируса посредством генерации ответа цитотоксических Т-лимфоцитов, которые распознают эпитопы из консервативных белков. Кроме того, поскольку плазмиды захватываются клетками хозяина, где может продуцироваться антигенный белок, можно вызвать продолжительный иммунный ответ. Эта методика также предоставляет возможность комбинирования различных иммуногенов в одном препарате, что способствует одновременной иммунизации в отношении ряда болезненных состояний.
Полезная информация по предпосылкам изобретения в отношении ДНК вакцинации представлена в Donnelly et al. "DNA vaccines". Ann. Rev. Immunol. 1997, 15: 617-648, описание которой включено здесь в полном объеме путем ссылки.
Краткое изложение сущности изобретения
В настоящем изобретении предложены новые конструкции для применения в нуклеиново-кислотных вакцинах для профилактики и лечения ВИЧ-инфекций и СПИДа.
Соответственно, в первом аспекте предложена молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую белок gag ВИЧ или его фрагмент, сцепленную с нуклеотидной последовательностью, кодирующей дополнительный антиген ВИЧ или его фрагмент, и оперативно сцепленную с гетерологичным промотором. Фрагмент указанной нуклеотидной последовательности будет кодировать эпитоп ВИЧ и типично кодирует пептид из по меньшей мере 8 аминокислот. Эта нуклеотидная последовательность предпочтительно представляет собой последовательность ДНК и предпочтительно содержится внутри плазмиды без точки начала репликации. Препарат таких молекул нуклеиновой кислоты готовят с фармацевтически приемлемыми эксципиентом, носителями, разбавителями или адъювантами для получения фармацевтической композиции, подходящей для лечения и/или профилактики ВИЧ-инфекции и СПИД.
В предпочтительном воплощении препарат последовательности ДНК готовят на поверхности инертных частиц или гранул, подходящих для опосредованной частицами доставки лекарства. Предпочтительно эти гранулы являются золотыми.
В предпочтительном воплощении изобретения предложена последовательность ДНК, которая с высокой экспрессией кодирует белок gag, причем эта последовательность оптимизирована таким образом, что использование кодонов подобно таковому для генов в клетках млекопитающих. В частности, белок gag оптимизирован таким образом, что оно подобно таковому для генов человека с высокой экспрессией.
Код ДНК имеет 4 буквы (А, Т, С и G) и использует их для записи трехбуквенных «кодонов», которые представляют аминокислоты белков, кодируемых в генах организма. Линейная последовательность кодонов на протяжении молекулы ДНК транслируется в линейную последовательность аминокислот в белке (белках), кодируемом этими генами. Код является высоковырожденным, поскольку 61 кодон кодирует 20 природных аминокислот и 3 кодона представляют собой «стоп»-сигналы. Таким образом, большинство аминокислот кодируется более чем одним кодоном - в действительности, некоторые из них кодируются четырьмя различными кодонами или большим их числом.
Если более чем один кодон доступен для кодирования данной аминокислоты, наблюдали, что паттерны использования кодонов организмов в высокой степени неслучайны. Различные виды проявляют различные тенденции в отборе кодонов, и, кроме того, использование кодонов может быть в значительной степени различным у одного вида между генами, которые экспрессируются на высоких и низких уровнях. Эта тенденция различается у вирусов, растений, бактерий и клеток млекопитающих, и некоторые виды проявляют более сильную тенденцию отличия от случайного выбора кодонов, чем другие. Например, люди и другие млекопитающие имеют менее сильную тенденцию, чем некоторые бактерии или вирусы. По этим причинам существует значительная вероятность того, что ген млекопитающего, экспрессирующийся в Е.coli, либо чужеродный или рекомбинантный ген, экспрессирующийся в клетках млекопитающих, будет иметь несоответствующее распределение кодонов для эффективной экспрессии. Считают, что присутствие гетерологичной последовательности кластеров кодонов ДНК или обилие кодонов, которые редко наблюдают у хозяина, в котором должна осуществляться экспрессия, позволяет предсказать низкие уровни гетерологичной экспрессии в этом хозяине.
В воплощении настоящего изобретения предложена полинуклеотидная последовательность gag, которая кодирует аминокислотную последовательность, где паттерн использования кодонов этой полинуклеотидной последовательности подобен таковому для генов млекопитающих с высокой экспрессией. Предпочтительно эта полинуклеотидная последовательность представляет собой последовательность ДНК. Желательно, чтобы паттерн использования кодонов этой полинуклеотидной последовательности был типичен для генов человека с высокой экспрессией.
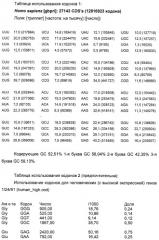
В полинуклеотидах по настоящему изобретению паттерн использования кодонов изменен по сравнению с таковым, типичным для вирусов иммунодефицита человека, в сторону смещения кодонов, более близкого для целевого организма, например, млекопитающего, в частности человека. «Коэффициент использования кодонов» является мерой того, насколько близко паттерн кодонов данной полинуклеотидной последовательности подобен таковому для целевого вида. Частоты кодонов можно узнать из литературных источников для генов многих видов с высокой экспрессией (см., например, Nakamura et al., Nucleic Acids Research, 1996, 24: 214-215). Частоты кодонов для каждого из 61 кодона (выраженные в виде числа кодонов, встречающихся на 1000 кодонов выбранного класса генов) нормализованы по каждой из двадцати природных аминокислот, так что значение для наиболее часто используемого кодона для каждой аминокислоты приведено к 1, и частоты для менее распространенных кодонов нанесены на шкалу между 0 и 1. Таким образом, для каждого из 61 кодонов определено значение 1 или ниже для генов целевого вида с высокой экспрессией. Чтобы вычислить коэффициент использования кодонов для конкретного полинуклеотида относительно генов данного вида с высокой экспрессией, отмечают значение на шкале для каждого кодона конкретного полинуклеотида и определяют геометрическое среднее всех этих значений (путем деления суммы натуральных логарифмов этих значений на суммарное число кодонов и взятия антилогарифма). Этот коэффициент будет иметь значение между 0 и 1, и, чем выше этот коэффициент, тем больше кодонов в полинуклеотиде являются часто используемыми кодонами. Если полинуклеотидная последовательность имеет коэффициент использования кодонов 1, то все кодоны являются «наиболее частыми» кодонами для генов целевого вида с высокой экспрессией.
В соответствии с настоящим изобретением паттерн использования кодонов полинуклеотида предпочтительно должен исключать кодоны со значением RSCU менее чем 0,2 по сравнению с генами целевого организма с высокой экспрессией. Альтернативно паттерн использования кодонов должен исключать кодоны, составляющие <10% кодонов, используемых для конкретной аминокислоты. Значение относительного использования кодонов-синонимов (RSCU) представляет собой наблюдаемое число кодонов, разделенное на ожидаемое число, если все кодоны для данной аминокислоты были использованы одинаково часто. Полинуклеотид по настоящему изобретению будет, как правило, иметь коэффициент использования кодонов (или RSCU) для генов человека с высокой экспрессией выше чем 0,3, предпочтительно выше чем 0,4, наиболее предпочтительно выше чем 0,5. Таблицы использования кодонов для человека можно также найти в Genebank.
Для сравнения высокоэкспрессирующийся ген бета-актина имеет RSCU 0,747. Таблица использования кодонов для Homo sapiens представлена ниже:
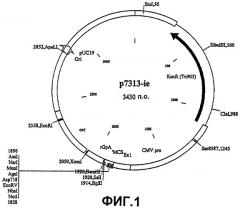
В соответствии со следующим аспектом изобретения предложен вектор экспрессии, который содержит и способен направлять экспрессию полинуклеотидной последовательности согласно первому аспекту изобретения, в частности паттерн использования кодонов полинуклеотидной последовательности gag типичен для генов млекопитающих с высокой экспрессией, предпочтительно для генов человека с высокой экспрессией. Этот вектор может быть подходящим для направления экспрессии гегерологичной ДНК в клетках бактерий, насекомых или млекопитающих, в частности в клетках человека. В одном воплощении этот вектор экспрессии представляет собой р7313 (см. фиг.1).
В третьем воплощении предложен ген gag под контролем гетерологичного промотора, слитого с последовательностью ДНК, кодирующей Nef или его фрагмент или обратную транскриптазу (RT) ВИЧ или ее фрагмент. Участок, представляющий собой ген gag, может составлять либо N, либо С-концевую часть слитой конструкции.
В предпочтительном воплощении ген gag не кодирует пептид gag p6. Предпочтительно ген NEF укорочен с удалением последовательности, кодирующей N-концевой район, то есть с удалением 30-85, предпочтительно 60-85, типично примерно 81, предпочтительно 65 N-концевых аминокислот.
В следующем воплощении ген RT также оптимизирован таким образом, что подобен гену человека с высокой экспрессией. RT предпочтительно кодирует мутацию, которая по существу инактивирует какую-либо активность обратной транскриптазы. Предпочтительная мутация инактивации включает замену W (триптофана) 229 на К (лизин).
Согласно следующему аспекту изобретения предложена клетка-хозяин, содержащая нуклеотидную последовательность согласно изобретению или вектор экспрессии согласно изобретению. Эта клетка-хозяин может представлять собой бактериальную клетку, например E.coli, клетку млекопитающего, например человеческую, либо она может представлять собой клетку насекомого. Клетки млекопитающих, содержащие вектор согласно настоящему изобретению, могут представлять собой культивируемые клетки, трансфицированные in vitro, либо они могут быть трансфицированы in vivo путем введения вектора млекопитающему.
Далее в настоящем изобретении предложена фармацевтическая композиция, содержащая полинуклеотидную последовательность согласно изобретению. Предпочтительно эта композиция содержит ДНК-вектор. В предпочтительных воплощениях эта композиция содержит множество частиц, предпочтительно золотых частиц, покрытых ДНК, содержащей вектор, кодирующий полинуклеотидную последовательность по изобретению. Предпочтительно эта последовательность кодирует аминокислотную последовательность gag ВИЧ, где паттерн использования кодонов этой полинуклеотидной последовательности типичен для генов млекопитающих с высокой экспрессией, особенно для генов человека. В альтернативных воплощениях эта композиция содержит фармацевтически приемлемый эксципиент и ДНК-вектор согласно второму аспекту настоящего изобретения. Эта композиция может также включать адъювант.
Таким образом, одно из воплощений изобретения является таким, что векторы по изобретению используют с иммуностимуляторными агентами. Предпочтительно иммуностимуляторный агент вводят одновременно с нуклеиново-кислотным вектором по изобретению и в предпочтительных воплощениях их включают в один препарат вместе. Такие иммуностимуляторные агенты включают (хотя этот перечень никоим образом не является исчерпывающим и не устраняет другие агенты) синтетические имидазохинолины, такие как имихимод [imiquimod, S-26308, R-837] (Harrison et al. 'Reduction of recurrent HSV disease using imiquimod alone or combined with a glycoprotein vaccine', Vaccine 19: 1820-1826, (2001)) и резихимод [resiquimod, S-28463, R-848] (Vasilakos et al. 'Adjuvant activities of immune response modifier R-848: Comparison with CpG ODN', Cellular Immunology 204: 64-74 (2000)), Шиффовы основания карбонилов и аминов, которые конститутивно экспрессируются на поверхностях антигенпрезентирующих клеток и Т-клеток (Rhodes, J. et al. Therapeutic potentiation of the immune system by costimulatory Schiff-base-forming drugs', Nature 377: 71-75 (1995)), молекулы цитокинов, хемокинов и кости муляторные молекулы либо в виде белка, либо в виде пептида, которые включают провоспалительные цитокины, такие как GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор), ИЛ-1 (интерлейкин-1)-альфа, ИЛ-1-бета, ФНО (фактор некроза опухоли)-альфа и ФНО-бета, индукторы Th1, такие как интерферон-гамма, ИЛ-2, ИЛ-12, ИЛ-15 и ИЛ-18, индукторы Th2, такие как ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10 и ИЛ-13, а также другие гены хемокинов и костимуляторов, такие как МСР-1, MIP-1-альфа, MIP-1-бета, RANTES, TCA-3, CD80, CD86 и CD40L, другие лиганды-мишени иммуностимуляции, такие как CTLA-4 и L-селектин, белки, стимулирующие апоптоз, и пептиды, такие как Fas (49), синтетические адъюванты на основе липидов, такие как ваксфектин [vaxfectin] (Reyes et al., 'Vaxfectin enhances antigen specific antibody titres and maintains Th1 type immune responses to plasmid DNA immunization', Vaccine 19: 3778-3786), сквален, альфа-токоферол, полисорбат 80, DOPC и холестерин, эндотоксин [LPS] (Beutler, В. 'Endotoxin, Toll-like receptor 4, and the afferent limb of innate immunity', Current Opinion in Microbiology 3: 23-30 (2000)); олиго- и динуклебтиды CpG, Sato, Y. et al., 'Immunostimulatory DNA sequences necessary for effective intradermal gene immunization', Science 273 (5273): 352-354 (1996), Hemmi, H. et al., 'A Toll-like receptor recognizes bacterial DNA', Nature 408: 740-745, (2000) и другие потенциальные лиганды, которые запускают рецепторы Toll для продуцирования Th-1-индуцирующих цитокинов, такие как синтетические микобактериальные липопротеины, микобактериальный протеин p19, пептидогликан, тейхоевая кислота и липид А.
Некоторые предпочтительные адъюванты, вызывающие ответ преимущественно Th-1-типа, включают, например, производное липида А, такое как монофосфориллипид А или предпочтительно 3-де-О-ацилированный монофосфориллипид А. Адъюванты MPL® можно получить от Corixa Corporation (Seattle, WA; см., например, патенты США №№4436727, 4877611, 4866034 и 4912094). CpG-содержащие олигонуклеотиды (в которых динуклеотид CpG не метилирован) также вызывают ответ преимущественно Th-1-типа. Такие олигонуклеотиды хорошо известны и описаны, например, в WO 96/02555, WO 99/33488 и в патентах США №№6008200 и 5856462. Иммуностимуляторные последовательности ДНК также описаны, например, Sato et al., Science 273: 352, 1996. Другой предпочтительный адъювант содержит сапонин, такой как Quil А, или его производные, включая QS21 и QS7 (Aquila Biopharmaceuticals Inc., Framingham, MA), эсцин, дигитонин или сапонины Gypsophila или Chenopodium quinoa.
Предложено также применение полинуклеотида согласно изобретению или вектора согласно изобретению при лечении или профилактике ВИЧ-инфекции.
В настоящем изобретении также предложены способы лечения или предупреждения ВИЧ-инфекций, любых симптомов или заболеваний, связанных с ними, при которых вводят эффективное количество полинуклеотида, вектора или фармацевтической композиции согласно изобретению. Введение фармацевтической композиции может принимать форму одной или более чем одной индивидуальной дозы, например, в виде повторных доз одной и той же ДНК-плазмиды, или в виде режима «первичная вакцинация - ревакцинация» терапевтической вакцинации. В некоторых случаях «первичную» вакцинацию можно осуществлять путем опосредованной частицами доставки ДНК полинуклеотида согласно настоящему изобретению, предпочтительно встроенного в вектор плазмидного происхождения, а ревакцинацию можно осуществлять путем введения рекомбинантного вирусного вектора, содержащего ту же полинуклеотидную последовательность, или путем ревакцинации белком в адъюванте. Наоборот, первичную вакцинацию можно осуществлять вирусным вектором или белковым препаратом, типично белковым препаратом в адъюванте, а ревакцинацию осуществлять ДНК-вакциной по настоящему изобретению. Можно использовать многократные дозы первичной вакцинации и/или ревакцинации.
В воплощениях изобретения рассматривают фрагменты белков gag, nef или RT. Например, полинуклеотид по изобретению может кодировать фрагмент белка gag, nef или RT ВИЧ. Полинуклеотид, который кодирует фрагмент по меньшей мере из 8, например из 8-10 аминокислот, либо вплоть до 20, 50, 60, 70, 80, 100, 150 или 200 аминокислот в длину, считают находящимся в пределах объема изобретения, если кодируемый олиго- или полипептид проявляет антигенные свойства ВИЧ. В частности, но не исключительно, данный аспект изобретения охватывает ситуацию, когда полинуклеотид кодирует фрагмент или полноразмерную последовательность белка ВИЧ и может представлять один или более чем один дискретный эпитоп данного белка. Такие фрагменты могут быть оптимизированными по кодонам, так что этот фрагмент имеет паттерн использования кодонов, который подобен таковому для гена млекопитающего с высокой экспрессией.
Предпочтительные конструкции согласно настоящему изобретению включают:
1. р17, р24, слитые с укороченным NEF (без нуклеотидов, кодирующих концевые аминокислоты 1-65);
2. р17, р24, RT, укороченный NEF (без нуклеотидов, кодирующих концевые аминокислоты 1-65);
3. р17, р24 (оптимизированный gag), укороченный NEF (без нуклеотидов, кодирующих концевые аминокислоты 1-65);
4. р17, р24 (оптимизированный gag), RT (оптимизированный), укороченный NEF (без нуклеотидов, кодирующих концевые аминокислоты 1-85);
5. р17, р24, RT (оптимизированный), укороченный NEF (без нуклеотидов, кодирующих концевые аминокислоты 1-65);
6. Укороченный NEF (без нуклеотидов 1-65), слитый с оптимизированным р17, p24gag;
7. Особенно предпочтительные конструкции по изобретению включают тройные слияния RT-NEF-Gag и RT-Gag-Nef, в частности:
8. Оптимизированный RT, укороченный NEF и оптимизированный р17, р24 (gag) (RNG);
9. Оптимизированный RT, оптимизированный р17, 24 (gag), укороченный Nef (без ак 1-65)(RGN).
Предпочтительно, чтобы конструкции ВИЧ имели происхождение от ВИЧ-изолята В или изолята С, особенно изолята В.
Как обсуждено выше, настоящее изобретение включает векторы экспрессии, которые содержат нуклеотидные последовательности по изобретению. Конструирование таких векторов экспрессии является рутинной методикой молекулярной биологии и включает использование плазмидной ДНК и соответствующих инициаторов, промоторов, энхансеров и других элементов, таких как, например, сигналы полиаденилирования, которые могут быть необходимы и которые расположены в правильной ориентации, чтобы дать возможность экспрессии белка. Другие подходящие векторы должны быть очевидны специалистам в данной области техники. В качестве дополнительного примера в этом отношении авторы изобретения ссылаются на Sambrook et al. Molecular Cloning: a Laboratory Manual, 2nd Edition, CSH Laboratory Press (1989).
Предпочтительно полинуклеотид по изобретению или для использования по изобретению в векторе оперативно сцеплен с регуляторной последовательностью, которая способна обеспечить экспрессию кодирующей последовательности клеткой-хозяином, то есть этот вектор представляет собой вектор экспрессии. Термин «оперативно сцеплен» относится к соседнему положению, где описанные компоненты находятся во взаимоотношениях, позволяющих им функционировать надлежащим образом. Регуляторная последовательность, такая как промотор, «оперативно сцепленная» с кодирующей последовательностью, расположена таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с этой регуляторной последовательностью.
Векторы могут представлять собой, например, плазмиды, искусственные хромосомы (например, ВАС, РАС, YAC), вирусные или фаговые векторы, снабженные точкой начала репликации, возможно, промотором для экспрессии полинуклеотида и, возможно, регулятором этого промотора. Векторы могут содержать один или более чем один селективный ген-маркер, например, ген устойчивости к ампициллину или канамицину в случае бактериальной плазмиды или ген устойчивости для вектора грибов. Векторы можно использовать in vitro, например, для продуцирования ДНК или РНК, либо использовать для трансфекции или трансформации клетки-хозяина, например клетки-хозяина млекопитающего, например, для продуцирования белка, кодируемого вектором. Векторы могут быть также адаптированы для использования in vivo, например, при способе ДНК-вакцинации или генотерапии.
Промотры и другие сигналы регуляции экспрессии могут быть выбраны таким образом, чтобы быть совместимыми с клеткой-хозяином, для которой предназначена экспрессия. Например, промоторы млекопитающих включают металлотионеиновый промотор, который можно индуцировать в ответ на тяжелые металлы, такие как кадмий, и промотор β-актина. Можно также использовать вирусные промоторы, такие как промотор большого Т-антигена SV40, быстрый ранний (IE, immediate early) промотор цитомегаловируса человека (CMV), промотор LTR вируса саркомы Рауса, аденовирусный промотор или промотор HPV, в частности, регуляторный район вверх по течению (URR, upstream regulatory region) HPV. Все эти промоторы хорошо описаны и легко доступны в данной области техники.
Предпочтительным промоторным элементом является быстрый ранний промотор CMV за исключением интрона А, но включая экзон 1. Промоторный элемент может представлять собой минимальный промоторный элемент или усиленный промотор, причем усиленный промотор предпочтителен. Соответственно, предложен вектор, содержащий полинуклеотид по изобретению под контролем раннего промотора IE HCMV.
Примеры подходящих вирусных векторов включают векторы вируса простого герпеса, векторы вируса осповакцины или альфа-вируса и ретровирусов, включая лентивирусы, аденовирусы и аденоассоциированные вирусы. Методики переноса генов, использующие эти вирусы, известны специалистам в данной области техники. Ретровирусные векторы, например, можно использовать для стабильной интеграции полинуклеотида по изобретению в геном хозяина, хотя такая рекомбинация не является предпочтительной. Аденовирусные векторы, дефектные по репликации, напротив, поддерживаются в эписомном состоянии и, следовательно, дают возможность транзитной экспрессии. Векторы, способные направлять экспрессию в клетках насекомых (например, бакуловирусные векторы), в клетках человека, в дрожжах или в бактериях, можно использовать для продуцирования количеств белка ВИЧ, кодируемого полинуклеотидами по настоящему изобретению, например, для использования в качестве субъединичных вакцин или в иммунологических анализах.
Полинуклеотиды согласно изобретению обладают пользой при продуцировании путем экспрессии кодируемых белков, причем эта экспрессия может иметь место in vitro, in vivo или ex vivo. Нуклеотиды, следовательно, могут быть вовлечены в синтез рекомбинантного белка, например, для повышения выходов, либо действительно могут находить применение в качестве терапевтических агентов как таковых, применяемых при методиках ДНК-вакцинации. Если полинуклеотиды по настоящему изобретению используют при продуцировании кодируемых белков in vitro или ex vivo, клетки, например, в клеточной культуре следует модифицировать таким образом, чтобы включить в них полинуклеотид, экспрессия которого необходима. Такие клетки включают транзитные или, предпочтительно, стабильные клеточные линии млекопитающих. Конкретные примеры клеток, которые можно модифицировать путем вставки векторов, кодирующих полипептид согласно изобретению, включают клетки млекопитающих НЕК293Т, СНО, HeLa, 293 и клетки COS. Предпочтительно выбранная клеточная линия должна быть не только стабильной, но такой, чтобы давать возможность гликозилирования и экспрессии зрелого полипептида на клеточной поверхности. Экспрессия может быть достигнута в трансформированных ооцитах. Полипептид можно экспрессировать с полинуклеотида по настоящему изобретению в клетках трансгенного животного, представляющего собой не человека, предпочтительно мыши. Трансгенное животное, представляющее собой не человека, экспрессирующее полипептид с полинуклеотида по изобретению, включено в объем изобретения.
Далее в изобретении предложен способ вакцинации субъекта млекопитающего, при котором ему вводят эффективное количество такой вакцины или вакцинной композиции. Наиболее предпочтительно векторы экспрессии для применения в ДНК-вакцинах, вакцинных композициях и иммунотерапевтических агентах будут представлять собой плазмидные векторы.
ДНК-вакцины можно вводить в форме «голой ДНК», например, в жидком препарате, который вводят, используя шприц или струю высокого давления, либо готовят препарат ДНК с липосомами или раздражающим усилителем трансфекции, либо вводят путем опосредованной частицами доставки ДНК (PMDD, particle mediated DNA delivery). Все эти системы доставки хорошо известны в данной области техники. Вектор можно вводить млекопитающему, например, с помощью системы доставки вирусных векторов.
Композиции по настоящему изобретению можно доставлять с помощью ряда путей, таких как внутримышечный, подкожный, внутрибрюшинный, внутривенный или введение в слизистую оболочку.
В предпочтительном воплощении композицию доставляют внутрикожно. В частности, композицию доставляют с помощью «генного ружья», в частности методик введения путем бомбардировки частицами, которые включают нанесение вектора в виде покрытия на гранулу (например, золотую), которую затем вводят под высоким давлением в эпидермис, например, так, как описано в Haynes et al., J. Biotechnology 44: 37-42 (1996).
В одном иллюстративном примере управляемое газом ускорение частиц может быть достигнуто с помощью таких устройств, которые выпускаются PowderJect Pharmaceuticals PLC (Oxford, UK) и PowderJect Vaccines Inc. (Madison, WI), и некоторые примеры таких устройств описаны в патентах США №№5846796, 6010478, 5865796, 5584807 и в Европейском патенте №0500799. Данный подход дает возможность безыгольной доставки, где сухой порошкообразный препарат микроскопических частиц, таких как полинуклеотид, ускоряют до высокой скорости внутри струи газа гелия, генерируемой ручным устройством, движущей частицы в целевую ткань-мишень, обычно в кожу.
Частицы предпочтительно представляют собой золотые гранулы 0,4-4,0 мкм, более предпочтительно 0,6-2,0 мкм, покрытые конъюгатом ДНК, а затем упакованные в картридж или кассету для помещения в «генное ружье».
В родственном воплощении другие устройства и способы, которые могут быть полезны для управляемой газом безыгольной инъекции композиций по настоящему изобретению, включают устройства, выпускаемые Bioject, Inc. (Portland, OR), и некоторые примеры таких устройств описаны в патентах США №№4790824, 5064413, 5312335, 5383851, 5399163, 5520639 и 5993412.
Векторы, которые содержат нуклеотидные последовательности, кодирующие антигенные пептиды, вводят в таком количестве, которое будет профилактически или терапевтически эффективным. Количество, которое следует вводить, как правило, находится в интервале от одного пикограмма до 1 миллиграмма, предпочтительно от 1 пикограмма до 10 микрограммов нуклеотида на дозу для опосредованной частицами доставки и от 100 нанограммов до 1 миллиграмма, предпочтительно от 10 микрограммов до 1 миллиграмма нуклеотида на дозу для других путей. Точное количество может значительно варьироваться в зависимости от массы пациента, подлежащего иммунизации, и от пути введения.
Для иммуногенного компонента, содержащего нуклеотидную последовательность, кодирующую антигенный пептид, возможно введение на однократной основе или повторное введение, например, от 1 до 7 раз, предпочтительно от 1 до 4 раз, через интервалы между примерно 1 сутками и примерно 18 месяцами. Однако данный режим будет значительно варьироваться в зависимости от размера подлежащего лечению пациента, от количества вводимой нуклеотидной последовательности, от пути введения и от других факторов, которые будут очевидны специалистам в области ветеринарии или практикующим врачам. Пациент может получать одно или более чем одно из других противовирусных лекарств против ВИЧ в виде части их общего режима введения. Кроме того, нуклеиново-кислотный иммуноген можно вводить с адъювантом.
Адъювантный компонент, описанный здесь, можно подобным образом вводить с помощью ряда различных путей введения, как, например, с помощью перорального, интраназального, легочного, внутримышечного, подкожног