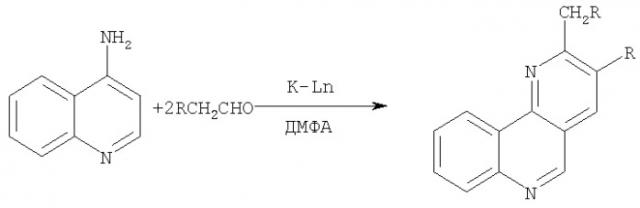
Способ получения 2,3-диалкил-7,8-бензо-1,6-нафтиридинов
Иллюстрации
Показать всеИзобретение относится к области органического синтеза, конкретно к способу получения 2,3-диалкил-7,8-бензо-1,6 нафтиридинов. Сущность способа заключается во взаимодействии 4-аминохинолина с алифатическими альдегидами в присутствии катализатора кристаллогидратов: трихлорида тербия TbCl3·6Н2О или нитрата тербия Tb(NO3)3·6Н2О при мольном соотношении 4-аминохинолина:RCH2CHO:Tb, равном 45:100:1.2, при атмосферном давлении, температуре 100°С в течение 4 ч в растворителе ДМФА. Замещенные 2,3-диалкил-7,8-бензо-1,6 нафтиридины используются как ингибиторы коррозии, а также в тонком органическом синтезе при получении физиологически активных веществ. 1 табл.
Реферат
Предлагаемое изобретение относится к способам получения гетероциклических соединений, конкретно к способу получения 2,3-диалкил-7,8-бензо-1,6-нафтиридинов общей формулы
где R=С2Н5, С3Н7, С4Н9,
которые могут найти применение в качестве ингибиторов коррозии металлов, а также в тонком органическом синтезе при получении физиологически активных веществ и антибактериальных препаратов.
Известен способ (Ф.А.Селимов, У.М.Джемилев, О.А.Пташко. Металлокомплексный катализ в синтезе пиридиновых оснований. М.: Химия, 2003, с.251-260) получения алкил(арил)производных 5,6-бензо-1,7-нафтиридинов в реакции конденсации 4-аминохинолина с алифатическими альдегидами под действием трехкомпонентной системы PrCl3:PPh3:диметилформамид (ДМФА) при мольном соотношении, равном 1:3:10 и температуре реакции 150-180°С, в автоклаве продолжительностью 6-8 ч. Выход 2,3-диалкил-7,8-бензо-1,6 нафтиридинов 39-42%.
К недостаткам данного способа относятся большие энергозатраты (высокая температура, давление, время), необходимость использования специального оборудования (автоклав) и лиганда активатора PPh3, а также высокая себестоимость безводного PrCl3 (малодоступного), что вызывает необходимость его предварительного получения (энергозатратный трудоемкий синтез в агрессивной среде).
Известен способ (патент РФ 2249477, опубликовано: 10.04.2005. Бюл. №10) получения 2,3-диалкил-7,8-бензо-1,6 нафтиридинов в реакции конденсации 4-аминохинолина с алифатическими альдегидами под действием катализатора - безводного комплекса [Pr(NO3)5]·[С5Н5NH]2. Реакция осуществляется в автоклаве при температуре 150°С продолжительностью 6 ч в смешанном растворителе, состоящем из этанола и ДМФА, взятых в соотношении 3:1 (объемные). Выход 2,3-диалкил-7,8-бензо-1,6-нафтиридинов 38-50%.
К недостаткам данного способа относятся большие энергозатраты (высокая температура, давление, время), необходимость использования специального оборудования (автоклав), а также высокая себестоимость безводного [Pr(NO3)5]·[C5H5NH]2, не производимого в России и за рубежом, что вызывает необходимость его предварительного получения (в агрессивной среде HNO3).
Предлагается новый способ получения 2,3-диалкил-7,8-бензо-1,6 нафтиридинов.
Сущность способа заключается во взаимодействии 4-аминохинолина с алифатическими альдегидами в присутствии катализатора кристаллогидратов: трихлорида тербия TbCl3·6Н2О или нитрата тербия Tb(NO3)3·6Н2O, взятыми в мольном соотношении 45:100:1.2. Реакцию проводят при атмосферном давлении, температуре 100°С в течение 4 ч в растворителе ДМФА.
Реакция протекает по схеме.
где R=С2Н5, С3Н7, С4Н9; K-Ln=TbCl3·6Н2O, Tb(NO3)3·6Н2O.
Существенные отличия предлагаемого способа
1. В предлагаемом способе в качестве катализатора используют коммерческие соли кристаллогидратов: трихлорид тербия TbCl3·6Н3О или нитрат тербия Tb(NO3)3·6Н2О. Реакция идет при атмосферном давлении с более высоким выходом целевого продукта. В известных способах используют автоклав и в качестве катализатора более дорогие соединения: безводные LnCl3 (малодоступные) или [Pr(NO3)5]·[С5Н5NH]2 (не выпускаемый промышленностью) и требующие предварительного специального синтеза.
Предлагаемый способ обладает следующими преимуществами:
1. Способ не требует предварительного получения безводных солей LnCl3 или комплекса [Sm(NO3)5]·[C5H5NH]2 (длительный синтез в агрессивной среде).
2. Способ позволяет за счет снижения температуры взаимодействия увеличить выход целевого продукта до 55-60%.
3. Способ позволяет уменьшить температуру (от 150 до 100°С), не требует специального оборудования (автоклава) и тем самым позволяет упростить синтез и снизить себестоимость целевого продукта.
Способ поясняется следующими примерами.
ПРИМЕР 1. К навеске катализатора TbCl3·6Н2О (0.54 ммоль) с 4-аминохинолином (20 ммоль) в стеклянной колбе с обратным холодильником при 20°С добавляют ДМФА (7 мл) и включают перемешивание. После полного растворения приливают масляный альдегид (44 ммоль), нагревают при температуре 100°С в течение 4 ч, охлаждают до комнатной температуры, реакционную массу трижды экстрагируют эфиром (3×50 мл), объединенные экстракты сушат над безводным MgSO4, отгоняют растворитель, а остаток хроматографируют на колонке с Al2О3 (гексан:эфир 1:10).
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | ||||||
| Пример | Альдегид | Катализатор | Т, °С | Время, ч | Выход, % | Целевой продукт |
| 1 | Масляный C4H8O | TbCl3·6Н2O | 100 | 4 | 60 | 2-Пропил-3-этил-7,8-бензо-1,6-нафтиридин |
| 2 | TbNO3·6Н2О | 100 | 4 | 58 | 2-Пропил-3-этил-7,8-бензо-1,6-нафтиридин | |
| 3 | Валерьяновый С5Н10О | TbCl3·6Н2О | 100 | 4 | 57 | 2-Бутил-3-протил-7,8-бензо-1,6-нафтиридин |
| 4 | Капроновый С6Н12О | TbCl3·6Н2О | 100 | 4 | 55 | 2-Амил-3-бутил-7,8-бензо-1,6-нафтиридин |
Все опыты проводили в ДМФА при мольном соотношении С6Н5NH2:RCH2CHO:Tb, равном 45:100:1.2
Полученные соединения имеют следующие физико-химические характеристики:
2-Пропил-3-этил-7,8-бензо-1,6-нафтиридин. Тпл.=86°С, Найдено, %: С 80.90; N 12.30; Н 6.80. C17H18N2. Вычислено, %: С 81.60; N 11.20; Н 7.20. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.12 т (3Н, СН3), 1.29 т (3Н, СН3), 1.76 м (2Н, СН2), 2.58 к (2Н, CH2), 3.17 м (2Н, СН2), 7.80-9.21 м (6Н, аром.). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.97 к, 14.97 к, 23.17 т, 25.37 т, 37.02 т, 120.14 д, 123.19 с, 127.13 с, 128.29 д, 129.03 д, 129.63 д, 131.12 д, 140.14 с, 142.15 с, 155.27 д, 162.16 с.
2-Бутил-3-пропил-7,8-бензо-1,6-нафтиридин. Тпл.=82°С, Найдено, %: С 82.50; N 10.00; Н 7.50. C19H22N2. Вычислено, %: С 82.00; N 10.10; Н 7.90. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.86 т (3Н, СН3), 0.98 т (3Н, СН3), 1.37-2.00 м (6Н, CH2), 2.57-2.83 м (4Н, CH2), 7.75-9.25 м (6Н, аром.).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 13.0 к, 13.0 к, 21.89 т, 22.45 т, 30.25 т, 33,77 т, 34.03 т, 120.15 д, 123.47 с, 124.70 д, 125.70 с, 126.82 д, 127.03 д, 129.13 д, 138.80 с, 142.13 с, 144.30 с, 153.20 д, 159.18 с.
2-Амил-3-бутил-7,8-бензо-1,6-нафтиридин. Тпл.=78°С. Найдено, %: С 82.0; N 9.3; Н 8.7. C21H26N2. Вычислено, %: С 82.4; N 9.1; Н 8.5. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.93 т (6Н, СН3), 1.01-1,97 м (10Н, СН2), 2.80 т (2Н, СН2), 3.05 т (2Н, СН2), 7.67-9.19 м (6Н, аром.). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.03 к, 14.03 к, 22.72 т, 28.39 т, 29.76 т, 31.98 т, 32.44 т, 35.70 т, 119.58 д, 123.63 с, 125.59 с, 127.09 д, 129.24 д, 129.58 д, 134.53 с, 135.83 с, 146.41 с, 152.12 с.
Способ получения 2,3-диалкил - 7,8-бензо-1,6 нафтиридинов общей формулы
где R=C2H5, С3Н7, С4Н9,
путем взаимодействия 4-аминохинолина с алифатическими альдегидами общей формулы RCH2CHO (где R имеет указанные выше значения), в присутствии катализатора, отличающийся тем, что в качестве катализатора используют кристаллогидраты: трихлорид тербия TbCl3·6Н2О или нитрат тербия Tb(NO3)3·6Н2O при мольном соотношении 4-аминохинолина:RCH2СНО:Tb равном 45:100:1.2 и реакцию проводят при атмосферном давлении, температуре 100°С, в течении 4 ч, в растворителе ДМФА.