Замещенные фенилнафталины в качестве эстрогенных агентов
Иллюстрации
Показать всеИзобретение относится к модуляторам рецепторов эстрогенов формулы I, где R1 и R2, каждый независимо, выбраны из водорода или галогена; R5, R6, R7, R8 и R9, каждый независимо, представляют собой водород, галоген или -CN; при условии, что, по меньшей мере, один из R5 или R9 не является водородом, или их фармацевтически приемлемым солям. Изобретение также относится к способу получения заявленных соединений, фармацевтической композиции, к применению соединения формулы (I) для производства лекарственного средства, обладающего активностью агониста или антагониста рецептора эстрогена, к способам лечения или ингибирования различных заболеваний. 9 н. и 11 з.п. ф-лы, 14 табл.
Реферат
Данное изобретение относится к замещенным фенилнафталинам, которые полезны в качестве эстрогенных агентов.
Плейотропные эффекты эстрогенов в тканях млекопитающих были хорошо документированы, и теперь признано, что эстрогены действуют на многие системы органов [Mendelsohn and Karas, New England Journal of Medicine 340: 1801-1811 (1999), Epperson, et al., Psychosomatic Medicine 61: 676-697 (1999), Crandall, Journal of Womens Health & Gender Based Medicine 8: 1155-1166 (1999), Monk and Brodaty, Dementia & Geriatric Cognitive Disorders 11: 1-10 (2000), Hurn and Macrae, Journal of Cerebral Blood Flow & Metabolism 20: 631-652 (2000), Calvin, Maturitas 34: 195-210 (2000), Finking, et al., Zeitschrift fur Kardiologie 89: 442-453 (2000), Brincat, Maturitas 35: 107-117 (2000), Al-Azzawi, Postgraduate Medical Journal 77: 292-304 (2001)]. Эстрогены могут оказывать действие на ткани несколькими путями, и наиболее хорошо охарактеризованным механизмом действия является их взаимодействие с рецепторами эстрогена, приводящее к изменению в транскрипции гена. Рецепторы эстрогена являются лиганд-активированными факторами транскрипции и принадлежат к суперсемейству ядерных рецепторов гормонов. Другие члены данного семейства включают рецепторы прогестерона, андрогена, глюкокортикоида и минералокортикоида. При связывании лиганда эти рецепторы димеризуются и могут активировать транскрипцию гена либо непосредственно связыванием со специфическими последовательностями на ДНК (известны как элементы реакции), либо взаимодействием с другими факторами транскрипции (такими как АР1), которые, в свою очередь, связываются непосредственно со специфическими ДНК-последовательностями [Moggs and Orphanides, EMBO Reports 2: 775-781 (2001), Hall, et al., Journal of Biological Chemistry 276: 36869-36872 (2001), McDonnell, Principles Of Molecular Regulation, р. 351-361 (2000)]. Класс «сорегуляторных» белков может также взаимодействовать с лиганд-связанным рецептором и далее модулировать его транскрипционную активность [McKenna, et al., Endocrine Reviews 20: 321-344 (1999)]. Обнаружено также, что рецепторы эстрогена могут подавлять NFkB-опосредованную транскрипцию как лигандзависимым, так и -независимым образом [Quaedackers, et al., Endocrinology 142: 1156-1166 (2001), Bhat, et al., Journal of Steroid Biochemistry and Molecular Biology 67: 233-240 (1998), Pelzer, et al., Biochemical and Biophysical Research Communications 286: 1153-7 (2001)].
Рецепторы эстрогена могут быть также активированы фосфорилированием. Такое фосфорилирование опосредуется факторами роста, такими как EGF, и вызывают изменения в транскрипции гена в отсутствие лиганда [Moggs and Orphanides, EMBO Reports 2: 775-781 (2001), Hall, et al., Journal of Biological Chemistry, 276: 36869-36872 (2001)].
Менее хорошо охарактеризованным средством, которым эстрогены могут воздействовать на клетки, считается так называемый мембранный рецептор. Наличие такого рецептора является дискуссионным, но хорошо было документировано, что эстрогены могут вызывать очень быстро негеномные реакции клеток. Молекулярная сущность, ответственная за трансдукцию этих эффектов, не была определенно выделена, но имеется доказательство, которое наводит на мысль, что она, по меньшей мере, относится к ядерным формам рецепторов эстрогена [Levin, Journal of Applied Physiology 91: 1860-1867 (2001), Levin, Trends in Endocrinology and Metabolism 10: 374-377 (1999)].
На сегодняшний день обнаружено два рецептора эстрогена. Первый рецептор эстрогена клонировали приблизительно 15 лет назад и теперь его обозначают ERα [Green, et al., Nature 320: 134-9 (1986)]. Вторая форма рецептора эстрогена была обнаружена сравнительно недавно, и ее называют ERβ [Kuiper, et al., Proceedings of the National Academy of Sciences of the United States of America 93: 5925-5930 (1996)]. Раннюю работу по ERβ сфокусировали на определении его аффинности для различных лигандов и фактически было показано некоторое отличие его от ERα. Распределение ERβ в тканях было хорошо картировано для грызунов, и оно не совпадает с распределением ERα. Ткани, такие как матка мышей и крыс, экспрессировали в основном ERα, тогда как легкие мышей и крыс экспрессировали в основном ERβ [Couse, et al., Endocrinology 138: 4613-4621 (1997), Kuiper, et al., Endocrinology 138: 863-870 (1997)]. Даже в одном и том же органе распределение ERα и ERβ может быть компартментализировано. Например, в яичнике мышей ERβ сильно экспрессируется в зернистых клетках и экспрессия ERα ограничивается оболочковыми клетками и клетками стромы [Sar and Welsch, Endocrinology, 140: 963-971 (1999), Fitzpatrick, et al., Endocrinology 140: 2581-2591 (1999)]. Однако имеются примеры, в которых эти рецепторы экспрессируются совместно и имеется доказательство из исследований in vitro, что ERα и ERβ могут образовывать гетеродимеры [Cowley, et al., Journal of Biological Chemistry 272: 19858-19862 (1997)].
Описано большое число соединений, которые либо имитируют, либо блокируют активность 17β-эстрадиола. Соединения, обладающие приблизительно такими же биологическими действиями, как 17β-эстрадиол, наиболее сильнодействующим эндогенным эстрогеном, называют «агонистами рецептора эстрогена». Те соединения, которые при введении в комбинации с 17β-эстрадиолом, блокируют его действия, называют «антагонистами рецептора эстрогена». В действительности здесь имеется непрерывность между активностью агониста рецептора эстрогена и антагониста рецептора эстрогена, и, действительно, некоторые соединения проявляются в качестве агониста рецептора эстрогена в некоторых тканях и антагониста рецептора эстрогена в других. Указанные соединения со смешанной активностью называют селективными модуляторами рецептора эстрогена (SERMS) и они являются терапевтически полезными агентами (например, EVISTA) [McDonnell, Journal of Society for Gynecologic Investigation 7: S10-S15 (2000), Goldstein, et al., Human Reproduction Update 6: 212-224 (2000)]. Точная причина, почему одно и то же соединение может обладать клетка-специфичными действиями, не разъяснялось, но различия в конформации рецептора и/или в окружающей среде корегуляторных белков допускались.
В течение некоторого последнего времени стало известно, что рецепторы эстрогена принимают различные конформации при связывании лигандов. Однако последовательность и тонкое различие этих изменений обнаружены только недавно. Трехмерные структуры ERα и ERβ были разрешены совместной кристаллизацией с различными лигандами, и четко было показано репозиционирование спирали 12 в присутствии антагониста рецептора эстрогена, который стерически затрудняет последовательности белков, требуемые для взаимодействия рецептор-сорегуляторный белок [Pike, et al., Embo 18: 4608-4618 (1999), Shiau, et al., Cell 95: 927-937 (1998)]. Кроме того, использовали способ фагового отображения для идентификации пептидов, которые взаимодействуют с рецепторами эстрогена в присутствии различных лигандов [Paige, et al., Proceedings of National Academy of Sciences of the United States of America 96: 3999-4004 (1999)]. Например, идентифицировали пептид, который проводит различие между ERα связью к полностью агонистам рецептора эстрогена 17β-эстрадиола и диэтилстильбестрола. Показано, что другой пептид различает связь кломифена с ERα и ERβ. Эти данные указывают, что каждый лиганд потенциально помещает рецептор в уникальную и непредсказуемую конформацию, которая, возможно, имеет определенные биологические активности.
Как упомянуто выше, эстрогены воздействуют на «доспехи» биологических процессов. Кроме того, в тех случаях, когда были описаны родовые различия (например, частота заболевания, ответные реакции на стимул и т.д.), возможно, что объяснение включает различие в уровнях эстрогена между мужскими и женскими особями.
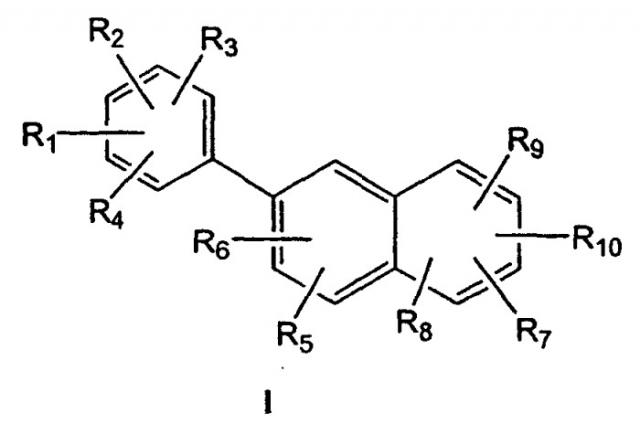
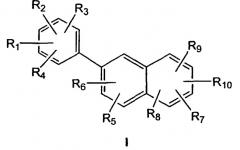
Данное изобретение относится к эстрогенному соединению формулы I, имеющему структуру
где
R1, R2, R3 и R4, каждый независимо, выбран из водорода, гидроксила, алкила, содержащего 1-6 атомов углерода, алкокси, содержащего 1-6 атомов углерода, или галогена;
R5, R6, R7, R8, R9 и R10, каждый независимо, представляют собой, водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-7 атомов углерода, алкинил, содержащий 2-7 атомов углерода, галоген, алкокси, содержащий 1-6 атомов углерода, -CN, -CHO, фенил или 5- или 6-членное гетероциклическое кольцо, имеющее 1-4 гетероатома, выбранных из О, N или S; где алкильные или алкенильные радикалы R5, R6, R7, R8, R9 или R10 могут быть, необязательно, замещены гидроксилом, -CN, галогеном, трифторалкилом, трифторалкокси, -NO2 или фенилом; где фенильный радикал R5, R6, R7, R8, R9 или R10 может быть, необязательно, моно-, ди- или тризамещен алкилом, содержащим 1-6 атомов углерода, алкенилом, содержащим 2-7 атомов углерода, галогеном, гидроксилом, алкокси, содержащим 1-6 атомов углерода, -CN, -NO2, амино, алкиламино, содержащим 1-6 атомов углерода, диалкиламино, содержащим 1-6 атомов углерода в каждой алкильной группе, тио, алкилтио, содержащим 1-6 атомов углерода, алкилсульфинилом, содержащим 1-6 атомов углерода, алкилсульфонилом, содержащим 1-6 атомов углерода, алкоксикарбонилом, содержащим 2-7 атомов углерода, алкилкарбонилом, содержащим 2-7 атомов углерода, или бензоилом;
при условии, что, по меньшей мере, один из R1, R2, R3, R4, R7,R8, R9 или R10 представляет собой гидроксил, или его фармацевтически приемлемую соль.
Фармацевтически приемлемые соли могут быть образованы из органических и неорганических кислот, например уксусной, пропионовой, молочной, лимонной, винной, янтарной, фумаровой, малеиновой, малоновой, миндальной, яблочной, фталевой, хлористо-водородной, бромисто-водородной, фосфорной, азотной, серной, метансульфоновой, нафталинсульфоновой, бензолсульфоновой, толуолсульфоновой, камфорасульфоновой и аналогично известных приемлемых кислот, когда соединение настоящего изобретения содержит основную часть. Соли могут также быть образованы из органических и неорганических оснований, такие как соли щелочных металлов (например, натрия, лития или калия), соли щелочно-земельных металлов, соли аммония, соли алкиламмония, содержащие 1-6 атомов углерода, или соли диалкиламмония, содержащие 1-6 атомов углерода в каждой алкильной группе, и соли триалкиламмония, содержащие 1-6 атомов углерода в каждой алкильной группе, когда соединение данного изобретения содержит кислотную часть.
Термины алкил и алкенил включают радикалы как с разветвленной, так и неразветвленной цепью, например, содержащие 1-6 и 2-7 атомов углерода, соответственно. Примеры их включают метил, этил, пропил, бутил, изопропил, втор-бутил, трет-бутил, винил, аллил, 1-метилвинил и тому подобное. Когда алкильные или алкенильные радикалы являются замещенными, они могут быть обычно моно-, ди-, три- или перзамещенными. Примеры галогензамещенного радикала включают 1-бромвинил, 1-фторвинил, 1,2-дифторвинил, 2,2-дифторвинил, 1,2,2-трифторвинил, 1,2-дибромэтан, 1,2-дифторэтан, 1-фтор-2-бромэтан, CF2CF3, CF2CF2CF3 и тому подобное. Термин галоген включает бром, хлор, фтор и йод.
Предпочтительные 5-6-членные гетероциклические кольца включают фуран, тиофен, пиррол, изопиррол, пиразол, имидазол, триазол, дитиол, оксатиол, изоксазол, оксазол, тиазол, изотиазол, оксадиазол, фуразан, оксатриазол, диоксазол, оксатиазол, тетразол, пиран, пиридин, пиридазин, пиримидин, пиразин, триазин, оксазин, оксатиазин или оксадиазин. Более предпочтительно, когда гетероциклическое кольцо представляет собой фуран, тиофен или пиридин.
Используемый в соответствии с данным изобретением термин «обеспечение» в связи с обеспечением соединения или вещества, включенного в данное изобретение, означает либо непосредственное введение такого соединения или вещества или введение пролекарства, производного или аналога, который будет образовывать эффективное количество соединения или вещества в организме.
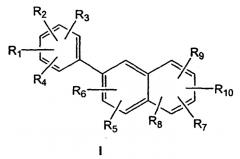
Из соединений данного изобретения предпочтительно, чтобы соединение формулы I имело структуру
где
R1 и R2, каждый независимо, выбраны из водорода, гидроксила, алкила, содержащего 1-6 атомов углерода, алкенила, содержащего 2-7 атомов углерода, и алкинила, содержащего 2-7 атомов углерода, алкокси, содержащего 1-6 атомов углерода, или галогена;
R5, R6, R7, R8 и R9, каждый независимо, представляют собой, водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-7 атомов углерода, алкинил, содержащий 2-7 атомов углерода, галоген, алкокси, содержащий 1-6 атомов углерода, -CN, -CHO, трифторметил, фенилалкил, содержащий 7-12 атомов углерода, фенил или 5- или 6-членное гетероциклическое кольцо, имеющее 1-4 гетероатома, выбранных из О, N или S; где алкильные или алкенильные радикалы R5, R6, R7, R8 или R9 могут быть, необязательно, замещены гидроксилом, -CN, галогеном, трифторалкилом, трифторалкокси, -NO2 или фенилом; где фенильный радикал R5, R6, R7, R8, R9 или R10 может быть, необязательно, моно-, ди- или тризамещен алкилом, содержащим 1-6 атомов углерода, алкенилом, содержащим 2-7 атомов углерода, галогеном, гидроксилом, алкокси, содержащим 1-6 атомов углерода, -CN, -NO2, амино, алкиламино, содержащим 1-6 атомов углерода, диалкиламино, содержащим 1-6 атомов углерода в каждой алкильной группе, тио, алкилтио, содержащим 1-6 атомов углерода, алкилсульфинилом, содержащим 1-6 атомов углерода, алкилсульфонилом, содержащим 1-6 атомов углерода, алкоксикарбонилом, содержащим 2-7 атомов углерода, алкилкарбонилом, содержащим 2-7 атомов углерода, или бензоилом;
при условии, что, по меньшей мере, один из R5 или R9 не является водородом, или было его фармацевтически приемлемой солью.
Более предпочтительно, чтобы соединение формулы I имело структуру
и еще более предпочтительно, чтобы 5- или 6-членное гетероциклическое кольцо, имеющее 1-4 гетероатома, выбранных из О, N или S, представляло собой фуран, тиофен или пиридин. Еще более предпочтительно, чтобы R5, R6, R7, R8 и R9 представляли собой, каждый независимо, водород, галоген, -CN или алкинил, содержащий 2-7 атомов углерода.
Примерами R1 и R2, каждого независимо, являются водород и фтор.
R5, R6, R7, R8 и R9, каждый независимо, может быть, например, водородом, галогеном, -CN или алкинилом, содержащим 2-7 атомов углерода.
R5 может быть, например, выбран из водорода, фтора или цианогруппы.
R9 может быть выбран из водорода, фтора или циано.
R6, R7 и R8, каждый независимо, может быть водородом.
5- или 6-членное гетероциклическое кольцо, имеющее 1-4 гетероатома, выбранные из О, N или S, представляет собой, например, фуран, тиофен или пиридин.
Примерами соединений данного изобретения, включающих вышеуказанную структуру (I), являются:
8-фтор-6-(3-фтор-4-гидроксифенил)-2-нафтол;
1-хлор-8-фтор-6-(3-фтор-4-гидроксифенил)-2-нафтол;
3-(3-фтор-4-гидроксифенил)-7-гидрокси-1-нафтонитрил;
3-(3,5-дифтор-4-гидроксифенил)-7-гидрокси-1-нафтонитрил;
6-(3-фтор-4-гидроксифенил)-2-нафтол;
1-хлор-6-(3-фтор-4-гидроксифенил)-2-нафтол;
1-хлор-6-(2-фтор-4-гидроксифенил)-2-нафтол;
1-хлор-6-(2,5-дифтор-4-гидроксифенил)-2-нафтол;
1-хлор-6-(2,6-дифтор-4-гидроксифенил)-2-нафтол;
6-(2,5-дифтор-4-гидроксифенил)-2-нафтол;
6-(3,5-дифтор-4-гидроксифенил)-2-нафтол;
1-хлор-6-(3,5-дифтор-4-гидроксифенил)-2-нафтол;
6-(2,6-дифтор-4-гидроксифенил)-2-нафтол или
8-хлор-3-(3-фтор-4-гидроксифенил)-7-гидрокси-1-нафтонитрил;
7-(4-гидроксифенил)-2-нафтол;
7-(3-гидроксифенил)-2-нафтол;
6-(4-гидроксифенил)-1-нафтол;
6-фенил-2-нафтол;
6-(3-гидроксифенил)-2-нафтол;
6-(3-хлорфенил)-2-нафтол;
2-фтор-4-(2-нафтил)фенол;
6-(3-хлор-4-гидроксифенол)-2-нафтол;
1-хлор-6-фенил-2-нафтол;
1-бром-6-(4-гидроксифенил)-2-нафтол;
1-хлор-6-(4-гидроксифенил)-2-нафтол;
1-фтор-6-(4-гидроксифенил)-2-нафтол;
2-гидрокси-6-(4-гидроксифенил)-1-нафтонитрил;
6-(4-гидроксифенил)-1-фенил-2-нафтол;
6-(4-гидроксифенил)-1-метил-2-нафтол;
1-хлор-6-(3-хлор-4-гидроксифенил)-2-нафтол;
6-(4-гидроксифенил)-1-нитро-2-нафтол;
1-хлор-6-(4-гидрокси-2-метилфенил)-2-нафтол;
6-(4-гидрокси-2-метилфенил)-2-нафтол;
6-(4-гидрокси-2-метоксифенил)-2-нафтол;
6-(2-хлор-4-гидроксифенил)-2-нафтол;
1-хлор-6-(2-хлор-4-гидроксифенил)-2-нафтол;
6-(2-фтор-4-гидроксифенил)-2-нафтол;
8-фтор-6-(4-гидроксифенил)-2-нафтол;
1-хлор-8-фтор-6-(4-гидроксифенил)-2-нафтол;
8-хлор-6-(4-гидроксифенил)-2-нафтол;
1,5-дихлор-8-фтор-6-(4-гидроксифенил)-2-нафтол;
2-хлор-4-(2-нафтил)фенол;
3-бром-8-хлор-6-(4-гидроксифенил)-2-нафтол;
1,8-дихлор-6-(4-гидроксифенил)-2-нафтол;
3-бром-1,8-дихлор-6-(4-гидроксифенил)-2-нафтол;
7-гидрокси-3-(4-гидроксифенил)-1-нафтонитрил;
8-хлор-3-(4-гидроксифенил)-7-гидрокси-1-нафтонитрил;
8-бром-7-гидрокси-3-(4-гидроксифенил)-1-нафтонитрил
или их фармацевтически приемлемые соли.
Настоящее изобретение относится также к способам получения соединений изобретения, включая соединения вышеуказанной структуры (I). В соответствии с этим, данное изобретение предлагает способ получения нафтилсоединения, как указано здесь выше, включая указанную выше структуру (I), который включает один из следующих способов:
а) деалкилирование или деаралкилирование соединения формулы
где R1-R10 имеют указанные выше значения, при условии, что, по меньшей мере, один из R1, R2, R3, R4, R7, R8, R9 или R10 представляет собой алкокси или аралкилокси, с получением соответствующего соединения формулы I, где, по меньшей мере, один из R1, R2, R3, R4, R7, R8, R9 или R10 представляет собой гидрокси;
{например, деалкилирование или деаралкилирование соединения формулы:
где, по меньшей мере, один из R и R' представляет собой алкил (содержащий, например, 1-6 атомов углерода) или аралкил (содержащий, например, 7-12 атомов углерода) с получением соответствующего соединения формулы (I)}
или
b) галогенирование соединения формулы I
где R10 представляет собой гидрокси;
такого как соединение формулы:
с получением соответствующего 1-галогеннафтола;
или
с) превращение основного соединения формулы I в его соль или наоборот.
В любой из реакций, описанных здесь, любая реакционноспособная группа или местоположение может быть защищено перед реакцией и защитная группа может быть удалена после реакции.
Реагенты, используемые при получении соединений данного изобретения, могут быть либо коммерчески получены, либо могут быть получены стандартными процедурами, описанными в литературе.
Получение нескольких репрезентативных примеров данного изобретения описаны в следующих схемах 1-15.
Стандартные процедуры фармакологического испытания являются легко доступными для определения профиля активности данного испытуемого соединения. Ниже кратко суммировано несколько репрезентативных процедур испытания, они могут включать данные для репрезентативных соединений изобретения. Все анализы, за исключением анализа связывания радиолиганда, могут быть использованы для обнаружения активности агониста или антагониста рецептора эстрогена соединений. В общем, активность агониста рецептора эстрогена измеряют сравнением активности этого соединения со ссылочным эстрогеном (например, 17β-эстрадиолом, 17α-этинил, 17β-эстрадиолом, эстроном, диэтилстилбестролом и т.д.). Активность антагониста рецептора эстрогена обычно измеряют совместной обработкой испытуемого соединения со ссылочным эстрогеном и сравнением результата с результатом, полученным только со ссылочным эстрогеном. Стандартные процедуры фармакологического испытания для SERM предложены также в патентах США 4418068 и 5998402, которые включены, таким образом, в качестве ссылки.
Оценка аффинностей связывания ERα и ERβ
Репрезентативные примеры изобретения оценивали на их способность конкурировать с 17β-эстрадиолом как за ERα, так и ERβ в общепринятом анализе связывания радиолиганда. Данная процедура испытания обеспечивает методологию определения относительных аффинностей связывания для рецепторов ERα или ERβ. Используемая процедура кратко описана ниже.
Получение экстрактов рецепторов для получения характеристики селективности связывания. Домены связывания лиганда, обычно определяемые здесь как все последовательности в прямом направлении от домена связывания ДНК, были получены ПЦР (полимеразной цепной реакцией) с использованием полноразмерной кДНК в качестве матриц и праймеров, которые содержали подходящие сайты рестрикции для субклонирования при поддержании подходящей рамки считывания для экспрессии. Эти матрицы содержали аминокислоты М250-V595 ERα человека [Green, et al., Nature 320: 134-9 (1986)] and М214-Q530 ERβ человека [Ogawa, et al., Biochemical and Biophysical Research Communications 243: 122-6 (1998)]. ERβ человека клонировали в pET15b (Novagen, Madison W1) как фрагмент NcoI-BamHI, имеющий С-концевую метку Flag. ERα человека клонировали, как для ERβ человека, за исключением того, что добавили метку N-концевую His. Последовательности всех используемых конструкций контролировали полным секвенированием обеих цепей.
Клетки BL21(DE3) использовали для экспрессии белков человека. Обычно 10 мл полученной культивированием в течение ночи культуры использовали для инокуляции 1 л культуры среды LB, содержащей 100 мкг/мл ампициллина. После инкубации в течение ночи при 37°С добавляли IPTG до конечной концентрации 1 мМ и инкубацию проводили при 25°С в течение 2 часов. Клетки собирали центрифугированием (1500 х g) и осадок в пробирке после центрифугирования промывали 100 мл 50 мМ Трис-Cl (рН 7,4), 150 мМ NaCl и снова суспендировали в 100 мл 50 мМ Трис-Cl (рН 7,4), 150 мМ NaCl. Клетки лизировали пропусканием два раза через пресс Френча при 12000 фунт/кв. дюйм. Лизат осветляли центрифугированием при 12000 х g в течение 30 минут при 4°С и хранили при -70°С.
Оценка экстрактов на специфическое связывание [3H]-эстрадиола. В качестве буфера для анализа использовали физиологический раствор Дульбекко, забуференный фосфатом (Gibco, конечная концентрация 1х) и дополненный 1 мМ ЭДТУ. Для оптимизации количества рецептора, который используют в анализе, к каждой лунке маскированного титровального микропланшета для высокого связывания (EG and G Wallac) добавляли [3H]-17β-эстрадиол (New England Nuclear; конечная концентрация = 2 нМ) ± 0,6 мкМ диэтилстильбэстрол и 100 мкл различных разведений лизата E. coli. Конечный объем для анализа был 120 мкл, и концентрация ДМСО была ≤ 1%. После инкубации при комнатной температуре в течение 5-18 часов несвязанный материал отсасывали и планшет промывали три раза приблизительно 300 мкл буфера для анализа. После промывания к лункам добавляли 135 мкл коктейля для сцинтилляционного счета (Optiphase Supermix, EG and G Wallac) и планшет герметизировали и перемешивали в течение, по меньшей мере, 5 минут для смешивания сцинтиллянта с остаточным буфером для промывания. Связанную радиоактивность оценивали сцинтилляционным счетчиком (ES and C Wallac Microbeta Plus).
После определения разведения каждого препарата рецептора, которое обеспечивает максимальное специфическое связывание, анализ далее оптимизировали оценкой IC50 немеченого 17β-эстрадиола с использованием различных разведений препарата рецептора. Выбирали конечное рабочее разведение для каждого препарата рецептора, для которого IC50 немеченого 17β-эстрадиола было 2-4 нМ.
Процедура испытания на конкуренцию связывания лигандов. Испытуемые соединения сначала растворяли в ДМСО, конечная концентрация ДМСО в анализе связывания была ≤ 1%. Восемь разведений каждого испытуемого соединения использовали в качестве немеченого конкурента для [3H]-17β-эстрадиола. Обычно набор разведений соединения может быть испытан одновременно на ERα и ERβ человека. Результаты наносили на график как измеренный DPM в зависимости от концентрации испытуемого соединения. Для вычерчивания по точкам кривой доза-реакция подбирали логистическую модель по четырем параметрам для трансформированных массовых данных, и IC50 определяли как концентрацию соединения, снижающего максимальное связывание [3H]-эстрадиола на 50%.
Аффинности связывания для ERα и ERβ (как измерено IC50) для репрезентативных примеров соединений изобретения показаны в таблице (1).
| Таблица 1Аффинности связывания ER репрезентативных соединений изобретения | ||
| Пример | IC50 ER-β (нМ) | IC50 ER-α (нМ) |
| 1а | 0,054 | 0,280 |
| 1b | 0,570 | 3,140 |
| 1c | 0,527 | 3,405 |
| 1d | 0,006 | 0,022 |
| 1e | 0,0175 | 0,180 |
| 1f | 0,245 | 0,638 |
| 1g | 0,374 | 1,345 |
| 1h | 0,030 | 0,230 |
| 1i | 0,519 | 1,360 |
| 1j | 0,242 | 2,120 |
| 1k | 0,006 | 0,092 |
| 1l | 0,011 | 0,107 |
| 1m | 0,468 | 1,785 |
| 1n | 1,360 | 3,070 |
| 1o | 0,0127 | 0,266 |
| 1p | 0,0025 | 0,091 |
| 1q | 0,114 | 0,884 |
| 1r | 0,007 | 0,077 |
| 1s | 0,081 | 1,402 |
| 1t | 0,657 | 1,720 |
| 1u | 0,017 | 0,282 |
| 1v | 0,004 | 0,143 |
| 1w | 0,032 | 0,356 |
| 1x | 0,206 | 0,802 |
| 1y | 0,013 | 0,140 |
| 1z | 0,0095 | 0,039 |
| 1aa | 0,027 | 0,074 |
| 1ab | 0,001 | 0,006 |
| 1ac | 0,0032 | 0,0032 |
| 1ad | 0,0020 | 0,024 |
| 1ae | 0,0027 | 0,018 |
| 1af | 0,002 | 0,008 |
| 1ag | 0,0012 | 0,058 |
| 1ah | 0,011 | 0,131 |
| 1ai | 0,0025 | 0,038 |
| 1aj | 0,0016 | 0,022 |
| 1ak | 0,0015 | 0,021 |
| 1al | 0,0011 | 0,040 |
| 1am | 0,0025 | 0,125 |
| 1an | 0,0035 | 0,029 |
| 1ao | 0,0016 | 0,012 |
| 1ap | 0,002 | 0,029 |
| 1aq | 0,002 | 0,017 |
| 1ar | 0,004 | 0,052 |
| 1as | 0,0085 | 0,043 |
| 1at | 0,010 | 0,160 |
| 1au | 0,0023 | 0,105 |
| 1av | 0,0028 | 0,208 |
| 1aw | 0,006 | 0,109 |
| 1ax | 0,011 | 0,299 |
| 1ay | 0,0084 | 0,092 |
| 1az | 0,058 | 0,548 |
| 1ba | 0,011 | 0,519 |
| 1bb | 0,0095 | 0,95 |
Результаты, полученные в стандартной процедуре фармакологического испытания, описанной выше, демонстрируют, что соединения данного изобретения связывают оба подтипа рецептора эстрогена. IC50 обычно ниже для ERβ, это указывает на то, что перечисленные соединения являются преимущественно ERβ-селективными лигандами, но все же считаются активными при ERα. Соединения данного изобретения будут проявлять диапазон активности, основанный, по меньшей мере, на их профилях селективности аффинности рецептора. Поскольку соединения изобретения связывают ER-β с более высокой аффинностью, чем ER-α, они могут быть полезными при лечении или подавлении заболеваний, которые могут быть модулированы посредством ER-β. Кроме того, поскольку каждый комплекс лиганда рецептора является специфическим и поэтому его взаимодействие с различными сорегуляторными белками является специфическим, соединения данного изобретения могут проявлять различные и непредсказуемые активности в зависимости от клеточного соответствия. Например, в некоторых типах клеток для соединений возможно поведение в качестве агониста рецептора эстрогена, тогда как в других тканях в качестве антагониста рецептора эстрогена. Соединения с такой активностью иногда обозначают SERM (Селективные модуляторы рецептора эстрогена). В отличие от многих эстрогенов, однако, многие из SERM не вызывают повышения массы матки в сыром состоянии. Эти соединения являются антиэстрогенными в матке и могут полностью создавать антагонизм трофическим действиям агонистов рецептора эстрогена в ткани матки. Эти соединения, однако, действуют в качестве агонистов рецептора эстрогена в костях, сердечно-сосудистой и центральной нервной системах. Вследствие селективной природы этих соединений указанным тканям, они могут быть полезными при лечении или подавлении патологических состояний или синдромов млекопитающих, которые вызваны дефицитом эстрогена или ассоциированы с ним (в некоторых тканях, таких как ткани костей или сердечно-сосудистой системы) или избытком эстрогена (в матке или молочных железах). Кроме того, соединения данного изобретения имеют также потенциал к поведению в качестве агонистов рецептора эстрогена на одном типе рецептора, в то же время имеют поведение в качестве антагонистов рецептора эстрогена на другом. Например, было показано, что соединения могут создать антагонизм действию 17β-эстрадиола посредством ERβ при проявлении активности агониста рецептора эстрогена с ERα [Sun, et al., Endocrinology 140: 800-804 (1999)]. Такая активность ERSAA (селективный агонист-антагонист рецептора эстрогена) обеспечивает фармакологически определенную эстрогенную активность в данной серии соединений.
Регуляция мРНК металлотионеина-II
Эстрогены, действующие через ERβ, но не через ERα, могут позитивно регулировать уровни мРНК металлотионеина II в клетках Saos-2, как описано Harris [Endocrinology 142: 645-652 (2001)]. Результаты данной процедуры испытания могут быть объединены с результатами процедуры испытания, описанной ниже (процедура испытания с репортером ERE), чтобы получить профиль селективности для соединения данного изобретения (см. также WO 00/37681). Данные для репрезентативных соединений изобретения показаны в таблице (2).
| Таблица 2Регуляция мРНК металлотионеина-II в клетках Saos-2 | |
| Пример 1е | 17,0 |
| Пример 1l | 5,5 |
| Пример 1o | 5,7 |
| Пример 1p | 6,0 |
| Пример 1s | 4,9 |
Оценка испытуемого соединения с использованием процедуры испытания с ERE-репортером в раковых клетках молочной железы MCF-7
Исходные растворы испытуемых соединений (обычно 0,1 М) получают в ДМСО и затем разводят в 10-100 раз ДМСО для получения рабочих растворов 1 или 10 мМ. Растворы в ДМСО сохраняют либо при 4°С (0,1 М), либо при -20°С (<0,1 М). Клетки MCF-7 пересевают два раза в неделю с питательной средой [среда D-MEM/F-12, содержащая 10% (об./об.) термоинактивированной фетальной бычьей сыворотки, 1% (об./об.) пенициллина-стрептомицина и 2 мМ GlutaMax-1]. Клетки сохраняют в вентилируемых склянках при 37°С внутри инкубатора с атмосферой 5% СО2/95% увлажненного воздуха. За один день до обработки клетки помещают с питательной средой в 96-луночные планшеты в количестве 25000 клеток/лунку и инкубируют при 37°С на протяжении ночи.
Клетки инфицируют в течение 2 ч при 37°С 50 мкл/лунку при разведении 1:10 5-ERE-tk-люциферазы аденовируса в экспериментальной среде [D-MEM/F-12-среда без фенола красного, содержащая 10% (об./об.) термоинактивированной, очищенной углем фетальной бычьей сыворотки, 1% (об./об.) пенициллина-стрептомицина, 2 мМ glutaMax-1, 1 мМ пируват натрия). Лунки затем промывают 150 мкл экспериментальной среды. Наконец, клетки обрабатывают в течение 24 ч при 37°С в повторностях 8 лунок/обработку 150 мкл/лунку наполнителя (≤0,1% об./об. ДМСО) или соединения, которое разводят ≥1000 раз в экспериментальной среде.
Начальный отбор испытуемых соединений проводят при одной дозе 1 мкМ, которую испытывают отдельно (способ агониста рецептора эстрогена) или в сочетании с 0,1 нМ 17β-эстрадиола (ЕС80; способ антагониста рецептора эстрогена). Каждый 96-луночный планшет включает также контрольную группу наполнителя (0,1% об./об. ДМСО) и контрольную группу с агонистом рецептора эстрогена (либо 0,1, либо 1 нМ 17β-эстрадиола). Эксперименты по зависимости доза-реакция проводят либо способом агониста рецептора эстрогена и/или способом антагониста рецептора эстрогена на активных соединениях в приращениях log от 10-14 до 10-5 М. Из этих кривых доза-реакция получают величины EC50 и IC50 соответственно. Конечная лунка в каждой группе обработки содержит 5 мкл 3 х 10-5 М ICI-182780 (конечная концентрация 10-6 M) в качестве контроля с антагонистом рецептора эстрогена.
После обработки клетки лизируют на встряхивателе в течение 15 мин с 25 мкм/лунку реагента лизиса клеточной культуры 1Х (Promega Corporation). Клеточные лизаты (20 мкл) переносят в 96-луночный планшет-люминометр и активность люциферазы измеряют в люминометре MicroLumat LB 96 P (ES and G Berthold) с использованием 100 мкл/лунку субстрата люциферазы (Promega Corporation). Перед инъекцией субстрата для каждой лунки проводят 1-секундное измерение фона. После инъекции субстрата активность люциферазы измеряют в течение 10 секунд после задержки 1 секунда. Данные переносят из люминометра в персональный компьютер Макинтоша и анализируют с использованием программного обеспечения JMP (SAS Institute); данная программа вычитает фоновое значение из измерения люцеферазы для каждой лунки и затем определяют среднее и стандартное отклонение для каждой обработки.
Данные люциферазы преобразуют с использованием логарифмов и оценочную формулу Hubert M используют для повторного взвешивания описываемых преобразованных измерений. Программное обеспечение JMP используют для анализа трансформированных и взвешенных данных для однофакторного анализа ANOVA (испытание Dunnett). Обработки соединениями сравнивают с результатами контроля с наполнителем в способе с агонистом рецептора эстрогена или результатами положительного контроля агониста рецептора эстрогена (0,1 нМ 17β-эстрадиола) в способе с антагонистом рецептора эстрогена. Для эксперимента с начальной одной дозой, если результаты обработки соединением значительно отличаются от соответствующего контроля (р<0,05), то результаты указывают как процент относительно контроля с 17β-эстрадиолом [т.е. ((соединение - контроль с наполнителем)/(контроль с 17β-эстрадиолом - контроль с наполнителем)) х 100]. Программное обеспечение используют также для определения величин ЕС50 и/или IC50 из нелинейных кривых доза-реакция.
Оценка утеротрофической активности
Утеротрофическая активность испытуемого соединения может быть измерена по следующим стандартным процедурам фармакологического испытания.
Процедура 1: Крыс Sprague-Dawley с половой незрелостью (возраст 18 дней) получали от Taconic и обеспечивали их неограниченным доступом к корму на основе казеина (Purina Mills 5K96C) и воде. На день 19, 20 и 21 крыс дозировали подкожным способом 17α-этинил-17β-эстрадиолом (0,06 мкг/крыса/день), испытуемым соединением или наполнителем (50% ДМСО/50% забуференный фосфатом физиологический раствор Дульбекко). Для определения антагониста рецептора эстрогена соединения вводили совместно с 17α-этинил-17β-эстрадиолом (0,06 мкг/крыса/день). Имелось шесть крыс/группу и их эутанизировали приблизительно через 24 часа после последней инъекции асфиксией CO2 и пневмотораксом. Матки удаляли и взвешивали после дополнительной обработки, связанной с жиром и экспрессией любой внутренней жидкости. Образец ткани может быть также подвергнут быстрому замораживанию для анализа экспрессии гена (например, мРНК фактора комплемента 3). Результаты, полученные от репрезентативных соединений изобретения, показаны в таблице (3).
| Таблица 3Оценка выбранных соединений по процедуре утеротрофического испытания на крысах | |
| Соединение | Средняя масса матки (мг) ± СКО |
| Наполнитель | 21,4 ± 1,6 |
| 17α-этинил-17β-эстрадиол (0,06 мкг/крыса/день) | 85,5 ± 3,1 |
| Пример 1аv (2 мг/крыса/день) | 23,3 ± 1,3 |
| Пример 1аv (2 мг/крыса/день) + 17α-этинил-17β-эстрадиол (0,06 мкг/крыса/день) | 81,9 ± 4,2 |
Процедура 2: Мышей 129 SvE с половой незрелостью (возраст 18 дней) получали от Taconic и обеспечивали их неограниченным доступом к корму на основе казеина (Purina Mills 5K96C) и воде. На день 22, 23, 24 и 25 мышей дозировали подкожным способом соединением или наполнителем (кукурузное масло). Имелось шесть мышей/группу и их эутанизировали приблизительно через 6 часов после последней инъекции асфиксией CO2 и пневмотораксом. Матки удаляли и взвешивали после дополнительной обработки, связанной с жиром