Антитела к человеческому мср-1
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Описаны варианты МСР-1-связывающих молекул. Одна из МСР-1-связывающих молекул содержит, по меньшей мере, одну вариабельную область тяжелой цепи (VН) иммуноглобулина, которая состоит из гипервариабельных участков CDR1, CDR2 и CDR3, тогда как другие содержат и легкую и тяжелую цепи. Предложены ДНК конструкции, кодирующие указанные МСР-1 связывающие молекулы и экспрессирующий вектор, несущий по меньшей мере одну из конструкций ДНК. Описан способ получения МСР-1 связывающей молекулы. Раскрыт также способ лечения опосредуемых МСР-1 или эотаксином-1 заболевания или нарушения на основе антитела к МСР-1, которое перекрестно связывает эотаксин-1. Описана фармацевтическая композиция на основе антитела к МСР-1, которое перекрестно связывает эотаксин-1, для лечения опосредуемых МСР-1 или эотаксином-1 болезни или нарушения у пациента. МСР-1-связывающие молекулы по изобретению ингибируют связывание МСР-1 с его рецептором. Иммобилизованное полное антитело по изобретению является высокоспецифичным, поскольку связывает рекомбинантный МСР-1 человека с KD(43±2,9)×10-12 и может найти применение далее в медицине. 9 н. и 4 з.п. ф-лы, 4 ил., 4 табл.
Реферат
Настоящее изобретение относится к антителам, к человеческому моноцитарному протеину хемотаксиса (МСР)-1 и к применению указанных антител для лечения заболеваний и нарушений, связанных с миграцией и активацией моноцитов и Т-клеток, например воспалительных заболеваний.
В опубликованной японской заявке на патент JP 05276986 (на имя Sumitomo Electric Co.) описано получение моноклональных антител грызунов к человеческому МСР-1, которые применяют для выявления МСР-1, лечения и диагностики заболеваний, связанных с инфильтрацией макрофагов. В опубликованной японской заявке на патент JP 09067399 (на имя Mitsui Toatsu) описано получение человеческих моноклональных антител к человеческому МСР-1 из человеческих периферических кровяных клеток (гемоцитов), трансформированных EBV (вирус Эпштейна-Барра), которые применяют для лечения воспаления. В опубликованной японской заявке на патент JP 11060502 (на имя Teijin) описано применение ингибитора МСР-1, прежде всего человеческого антитела к МСР-1, для лечения инфаркта головного мозга.
В настоящем описании представлены улучшенные антитела к человеческому МСР-1, предназначенные для лечения заболеваний и нарушений, связанных с миграцией и активацией моноцитов и Т-клеток.
Таким образом, изобретение относится к МСР-1-связывающей молекуле, которая содержит антигенсвязывающий центр антитела, включающий по меньшей мере одну вариабельную область тяжелой цепи (VH) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность His-Tyr-Trp-Met-Ser, CDR2 имеет аминокислотную последовательность Asn-Ile-Glu-Gln-Asp-Gly-Ser-Glu-Lys-Tyr-Tyr-Val-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотную последовательность Asp-Leu-Glu-Gly-Leu-His-Gly-Asp-Gly-Tyr-Phe-Asp-Leu; и ее непосредственным эквивалентам.
Изобретение относится также к МСР-1-связывающей молекуле, которая содержит антигенсвязывающий центр антитела, включающий по меньшей мере одну вариабельную область легкой цепи (vl) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Gly-Val-Ser-Ser-Ala-Leu-Ala, CDR2' имеет аминокислотную последовательность Asp-Ala-Ser-Ser-Leu-Glu-Ser и CDR3' имеет аминокислотную последовательность Gln-Gln-Phe-Asn-Ser-Tyr-Pro; и ее непосредственным эквивалентам.
Первым объектом изобретения является один домен МСР-1-связывающей молекулы, содержащий выделенную тяжелую цепь иммуноглобулина, которая включает указанную выше вариабельную область тяжелой цепи (VH).
Вторым объектом изобретения является также МСР-1-связывающая молекула, которая содержит вариабельные области и тяжелой (VH), и легкой цепи (vl), при этом указанная МСР-1-связывающая молекула содержит по меньшей мере один антигенсвязывающий центр антитела, включающий:
а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая стоит из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность His-Туг-Trp-Met-Ser, CDR2 имеет аминокислотную последовательность Asn-Ile-Glu-Gln-Asp-Gly-Ser-Glu-Lys-Tyr-Tyr-Val-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотную последовательность Asp-Leu-Glu-Gly-Leu-His-Gly-Asp-Gly-Tyr-Phe-Asp-Leu, и
б) вариабельную область легкой цепи (vl) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Gly-Val-Ser-Ser-Ala-Leu-Ala, CDR2' имеет аминокислотную последовательность Asp-Ala-Ser-Ser-Leu-Glu-Ser и CDR3' имеет аминокислотную последовательность GIn-Gln-Phe-Asn-Ser-Tyr-Pro; и ее непосредственные эквиваленты.
Если не указано иное, любая представленная в описании полипептидная цепь имеет аминокислотную последовательность, которая начинается на N-конце и заканчивается на С-конце.
Если антигенсвязывающий центр антитела содержит и vh-, и VL-области, то они могут быть расположены на одной и той же полипептидной молекуле или предпочтительно каждая область может располагаться на разных цепях, VH-область может быть частью тяжелой цепи иммуноглобулина или ее фрагмента, а VL-область - частью легкой цепи иммуноглобулина или ее фрагмента.
Понятие «МСР-1-связывающая молекула» относится к любой молекуле, которая обладает способностью связываться с антигеном МСР-1 либо индивидуально, либо в сочетании с другими молекулами. Реакцию связывания можно идентифицировать с помощью стандартных методов (качественные анализы), которые включают, например, биологический анализ ингибирования связывания МСР-1 с его рецептором, т.е. с рецептором хемокина (CCR)-2, например CCR2B, или любой тип анализов связывания, в сравнении с отрицательным контролем, в котором используют антитело неродственной специфичности, но предпочтительно относящееся к тому же изотипу.
Связывание МСР-1-связывающих молекул по изобретению с МСР-1 можно легко продемонстрировать, например, с использованием BIAcore-анализа.
Примеры антигенсвязывающих молекул включают антитела, продуцируемые В-клетками или гибридомами, и химерные антитела, антитела со встроенными путем трансплантации гипервариабельными участками (CDR) или человеческие антитела, или любые их фрагменты, например, F(ab')2- и Fab- фрагменты, а также одну цепь или один домен антитела.
Одноцепочечное антитело состоит из вариабельных областей тяжелых и легких цепей антитела, ковалентно связанных с пептидным линкером, который, как правило, состоит из 10-30 аминокислот, предпочтительно из 15-25 аминокислот. Таким образом, эта структура не включает константную область тяжелых и легких цепей и можно предположить, что небольшой пептидный спейсер должен обладать менее выраженными антигенными свойствами, чем вся константная область. Понятие «химерное антитело» относится к антителу, в котором константные области тяжелых и легких цепей или и тех и других цепей, получают из антитела человека, а вариабельные области как тяжелых, так и легких цепей получают из антитела организма кроме человека (например, мыши) или из антитела организма человека, но которое является другим человеческим антителом. Понятие «антитело со встроенным путем трансплантации гипервариабельным участком» обозначает антитело, в котором гипервариабельные участки (CDR) происходят из антитела-донора, такого как антитело организма кроме человека (например, мыши) или другое человеческое антитело, в то время как все или практически все другие части иммуноглобулина, например, константные области и высококонсервативные участки вариабельных областей, т.е. каркасные участки, происходят из антитела-акцептора, например человеческого антитела. Однако антитело с встроенным путем трансплантации гипервариабельным участком может включать небольшое количество аминокислот последовательности-донора в каркасных участках, например в частях каркасных участков, примыкающим к гипервариабельным участкам. Понятие «человеческое антитело» обозначает антитело, в котором все константные и вариабельные области как тяжелых, так и легких цепей, происходят из антитела человека или практически идентичны последовательностям антитела человека, но необязательно получены из этого же антитела, и включают полученные в мыши антитела, в которых мышиные гены вариабельных и константных областей иммуноглобулина заменены их человеческими копиями, например, как в целом описано в ЕР 0546073 В1, патентах US 5545806. 5569825, 5625126, 5633425,5661016, 5770429, ЕР 0438474 В1 и ЕР 0463151 В1.
Наиболее предпочтительными МСР-1-связывающими молекулами по изобретению являются человеческие антитела, прежде всего антитела AAV293, AAV294 и ABN912, описанные ниже в примерах. (Антитело AAV293 представляет собой человеческое антитело IgG3/κ, a ABN912 представляет собой человеческое антитело IgG4/κ, но они практически идентичны в других аспектах. Антитело AAV294 представляет собой человеческое антитело IgGl/κ, вариабельные области которого идентичны вариабельным областям AAV293 за исключением замен одной аминокислоты в FR1, CDR2 и FR3 vh и CDR1' и FR3' vl, что описано ниже в примерах.)
Таким образом, в предпочтительных химерных антителах вариабельные области как тяжелых, так и легких цепей, получают из антитела человека, например из антитела ABN912, последовательность которого представлена в Seq. Id. No. 1 и Seq. Id. No. 2. Участки константных областей также содержат приемлемые участки человеческих константных областей, например, как это описано в «Sequences of Proteins of Immunological Interest», Kabat E.A. и др., US Department of Health и Human Services, Public Health Service, National Institute of Health.
Гипервариабельные участки могут быть связаны с любым типом каркасных участков, хотя предпочтительно их получают из антител человека. Приемлемые каркасные участки описаны у Kabat E.A. и др., там же. Предпочтительный каркасный участок тяжелой цепи представляет собой каркасный участок человеческой тяжелой цепи, например антитела ABN912, последовательность которого представлена в Seq. Id. No. 1. Она состоит из расположенных в указанной последовательности FR1-, FR2-, FR3- и FR4-областей. Аналогично этому последовательность, приведенная в Seq. Id. No. 2, является предпочтительной в качестве каркасного участка легкой цепи ABN912 и состоит из расположенных в указанной последовательности FR1'-, FR2'-, FR3'- и FR4'-участков. Помимо каркасных участков, приведенных в Seq. Id. No. 1 и Seq. Id. No. 2, можно использовать другие каркасные участки, предпочтительно человеческие каркасные участки, например, описанные у Kabat и др., там же. Несколько аминокислотных остатков каркасных участков, в частности, в тех частях каркасного участка, которые примыкают к гипервариабельным участкам, могут отличаться от аминокислотных остатков соответствующей области каркасного участка, например, для того, чтобы оказывать воздействие на способности к связыванию.
Таким образом, изобретение относится также к МСР-1-связывающей молекуле, которая содержит по меньшей мере один антигенсвязывающий центр антитела, включающий либо первый домен, аминокислотная последовательность которого практически идентична последовательности, представленной в Seq. Id. No. 1, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 122, либо описанный выше первый домен и второй домен, аминокислотная последовательность которого практически идентична последовательности, представленной в Seq. Id. No. 2, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 109.
Моноклональные антитела, которые вырабатываются против протеина, который встречается у всех людей, как правило, получают в организме кроме человека, например, мышах. Непосредственным результатом этого является то, что полученное с помощью гибридомы ксеногенное антитело при введении людям вызывает нежелательный иммунный ответ, который главным образом опосредуется константной областью ксеногенного иммуноглобулина. Это заметно ограничивает применение таких антител, поскольку их нельзя вводить в течение длительных периодов времени. Вследствие этого особенно предпочтительно применять одноцепочечные, несущие один домен, химерные антитела, антитела со встроенным путем трансплантации гипервариабельным участком или, прежде всего, человеческие антитела, которые при введении людям не должны вызывать выраженную аллогенную реакцию.
В свете вышеизложенного более предпочтительную МСР-1-связывающую молекулу по изобретению выбирают их группы, включающей человеческое антитело к МСР-1, которое содержит по меньшей мере
а) тяжелую цепь иммуноглобулина или ее фрагмент, который включает (I) вариабельную область, состоящую из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, и (II) константную область человеческой тяжелой цепи или ее фрагмент, где CDR1 имеет аминокислотную последовательность His-Tyr-Trp-Met-Ser, CDR2 имеет аминокислотную последовательность Asn-Ile-Glu-Gln-Asp-Gly-Ser-Glu-Lys-Tyr-Tyr-Val-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотнаую последовательность Asp-Leu-Glu-Gly-Leu-His-Gly-Asp-Gly-Tyr-Phe-Asp-Leu, и
б) легкую цепь иммуноглобулина или ее фрагмент, который включает (I) вариабельную область, содержащую гипервариабельный участок CDR3' и необязательно также гипервариабельные участки CDR1', CDR2', и (II) константную область человеческой легкой цепи или ее фрагмент, где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Gly-Val-Ser-Ser-Ala-Leu-Ala, CDR2' имеет аминокислотную последовательность Asp-Ala-Ser-Ser-Leu-Glu-Ser и CDR3' имеет аминокислотную последовательность GIn-Gln-Phe-Asn-Ser-Tyr-Pro; и его непосредственные эквиваленты.
В другом варианте МСР-1-связывающую молекулу по изобретению можно выбирать из группы, включающей одноцепочечную связывающую молекулу, которая содержит антигенсвязывающий центр антитела, включающий
а) первый домен, который состоит из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, где гипервариабельные участки имеют аминокислотные последовательности, представленные в Seq. Id. No. 1,
б) второй домен, содержащий гипервариабельные участки CDR1', CDR2' и CDR3', где гипервариабельные участки имеют аминокислотные последовательности, представленные в Seq. Id. No. 2, и
в) пептидный линкер, который связан либо с N-концом первого домена и с С-концом второго домена или с С-концом первого домена и с N-концом второго домена; и ее непосредственные эквиваленты.
Как хорошо известно, минорные замены в аминокислотной последовательности, такие как делеция, добавление или замещение одной, небольшого количества или даже нескольких аминокислот, могут приводить к получению аллельной формы исходного протеина, которая обладает практически идентичными свойствами.
Таким образом, понятие «непосредственные эквиваленты» обозначает либо любой один домен МСР-1-связывающей молекулы (молекула X),
(I) в котором гипервариабельные участки CDR1, CDR2 и CDR3, взятые в целом, гомологичны по меньшей мере на 80%, предпочтительно гомологичны по меньшей мере на 90%, более предпочтительно гомологичны по меньшей мере на 95% гипервариабельным участкам, последовательность которых представлена в Seq. Id. No. 1, и
(II) который обладает способностью ингибировать связывание МСР-1 с его рецептором практически в такой же степени, что и молекула, с которой проводится сравнение, несущая каркасные участки, идентичные каркасным участкам молекулы X, но имеющая гипервариабельные участки CDR1, CDR2 и CDR3, идентичные указанным участкам, последовательность которых представлена в Seq. Id. No. I, либо любую МСР-1-связывающую молекулу, имеющую по меньшей мере два домена в сайте связывания (молекула X')
(I) в которой гипервариабельные участки CDR1, CDR2, CDR3, CDR1', CDR2' и CDR3', взятые в целом, гомологичные по меньшей мере на 80%, предпочтительно гомологичны по меньшей мере на 90%, более предпочтительно гомологичны по меньшей мере на 95% гипервариабельным участкам, последовательность которых представлена в Seq. Id. No. 1 и 2, и
(II) которая обладает способностью ингибировать связывание МСР-1 с его рецептором практически в такой же степени, что и молекула, с которой проводится сравнение, несущая каркасные участки и константные области, идентичные каркасным участкам и константным областям молекулы X', но имеющая гипервариабельные участки CDR1, CDR2, CDR3, CDR1', CDR2' и CDR3', идентичные указанным участкам, последовательность которых представлена в Seq. Id. No. 1 и 2.
В контексте настоящего описания подразумевается, что аминокислотные последовательности по меньшей мере на 80% гомологичны друг другу, если они имеют по меньшей мере 80% идентичных аминокислотных остатков в аналогичном положении, по данным оптимального сравнительного анализа, при котором бреши или вставки в аминокислотных последовательностях рассматриваются как неидентичные остатки.
Ингибирование связывания МСР-1 с его рецептором удобно тестировать с помощью различных анализов, включая анализы, которые описаны ниже. Понятие «в такой же степени» обозначает, что молекула, с которой проводится сравнение, и эквивалентная молекула дают практически одинаковые с точки зрения статистики кривые ингибирования связывания МСР-1 при исследовании с помощью одного из указанных выше анализов. Например, для МСР-1-связывающих молекул по изобретению, как правило, получают значения IC50 для ингибирования связывания МСР-1 с его рецептором (CCR2B), которое находится в пределах +/- х 5 (т.е. предпочтительно является практически одинаковым) относительно IC50 соответствующей молекулы, с которой проводится сравнение, при анализе с помощью описанных выше методов.
Например, применяемый анализ может представлять собой анализ конкурентного ингибирования связывания МСР-1 мембранным связывающим МСР-1 рецептором (CCR2B) и МСР-1-связывающими молекулами по изобретению, например, с использованием сцинтилляционного анализа сходства (SPA), описанного ниже в примерах.
Наиболее предпочтительно человеческое антитело к МСР-1 содержит по меньшей мере
а) одну тяжелую цепь, которая несет вариабельную область, аминокислотная последовательность которой практически идентична последовательности, представленной в Seq. Id. No. 1, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 122, и константную область человеческой тяжелой цепи; и
б) одну легкую цепь, которая несет вариабельную область, аминокислотная последовательность которой практически идентична последовательности, представленной в Seq. Id. No. 2, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 109, и константную область человеческой легкой цепи.
Константная область человеческой тяжелой цепи может быть γ1-, γ2-, γ3-, γ4-, γ-, α1-, α2-, δ- или ε-типа, предпочтительно γ-типа, более предпочтительно γ4-типа, а константная область человеческой легкой цепи может быть κ- или λ-типа (включая подтипы λ1, λ2 и λ3), но предпочтительно κ-типа. Аминокислотные последовательности всех указанных константных областей приведены у Kabat и др., там же.
МСР-1-связывающую молекулу по изобретению можно получать с помощью методов рекомбинантной ДНК. При этом надо сконструировать одну или несколько молекул ДНК, кодирующих связывающую молекулу, поместить под контроль соответствующих последовательностей и трансформировать организм-хозяин, в котором может происходить экспрессия.
Таким образом, в наиболее широком смысле изобретение относится к
(I) молекулам ДНК, кодирующим один домен МСР-1-связывающей молекулы по изобретению, одноцепочечную МСР-1-связывающую молекулу по изобретению, тяжелую или легкую цепь МСР-1-связывающей молекулы по изобретению или их фрагменты и
(II) применению молекул ДНК по изобретению для получения рекомбинантным путем МСР-1-связывающей молекулы по изобретению.
Существующий уровень техники является таким, что позволяет специалистам в данной области синтезировать молекулы ДНК по изобретению на основе представленной в настоящем описании информации, т.е. аминокислотных последовательностей гипервариабельных участков и кодирующих их последовательностей ДНК. Метод конструирования гена вариабельной области описан, например, в EPA 239400 и в целом состоит в следующем: клонируют ген, кодирующий вариабельную область МАт, независимо от его специфичности. Определяют сегменты ДНК, кодирующие каркасный участок и гипервариабельные участки, и сегменты ДНК, кодирующие гипервариабельные участки удаляют таким образом, чтобы сегменты ДНК, кодирующие каркасные участки, сливать в стыках с приемлемыми сайтами рестрикции. Сайты рестрикции можно создавать в требуемых положениях путем мутагенеза молекулы ДНК с использованием стандартных процедур. Кассеты, несущие двухцепочечные синтетические CDR, получают путем синтеза ДНК на основе данных о последовательностях, представленных в Seq. Id. No. 1 или 2. Эти кассеты конструируют так, чтобы они имели «липкие» концы для встраивания путем лигирования в стыки каркаса.
Кроме того, для получения конструкции ДНК, кодирующей МСР-1-связывающие молекулы по изобретению, не требуется использовать мРНК из продуцирующей гибридому линии клеток. Так, в заявке РСТ WO 90/07861 представлены полные инструкции по получению антитела с помощью методов рекомбинантной ДНК на основе только письменной информации, такой как нуклеотидная последовательность гена. Метод заключается в синтезе нескольких олигонуклеотидов, их амплификации с помощью ПЦР и их сплайсинга с получением требуемой последовательности ДНК.
Научной общественности известны экспрессионные векторы, содержащие приемлемые промоторы или гены, кодирующие константные области тяжелой и легкой цепи. Так, после получения молекулы ДНК по изобретению ее можно принятым образом переносить в соответствующий экспрессионный вектор. Молекулы ДНК, кодирующие одноцепочечные антитела, можно также получать стандартными методами, например, описанными в WO 88/1649.
В свете вышеизложенного для удовлетворения критериям полноты описания не требуется использовать депонированные гибридомы или линии клеток.
Конкретным вариантом осуществления изобретения являются описанные ниже первая и вторая конструкции ДНК, предназначенные для получения МСР-1-связывающей молекулы.
Первая конструкция ДНК кодирует тяжелую цепь или ее фрагмент и включает а) первый фрагмент, который кодирует вариабельную область, содержащую альтернативные каркасный и гипервариабельные участки, где гипервариабельные участки состоят из последовательно расположенных CDR1, CDR2 и CDR3, аминокислотные последовательности которых представлены в Seq. Id. No. 1; этот первый фрагмент начинается с кодона, который кодирует первую аминокислоту вариабельной области, и заканчивается кодоном, который кодирует последнюю аминокислоту вариабельной области, и б) второй фрагмент, кодирующий константную область тяжелой цепи или ее фрагмент, который начинается с кодона, который кодирует первую аминокислоту константной области тяжелой цепи, и заканчивается кодоном, который кодирует последнюю аминокислоту константной области или ее фрагмента, после которого расположен стоп-кодон.
Предпочтительно указанный первый фрагмент кодирует вариабельную область, аминокислотная последовательность которой практически идентична аминокислотной последовательности, представленной в SEQ ID No. 1, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 122. Более предпочтительно первый фрагмент имеет нуклеотидную последовательность, представленную в SEQ ID No. 1, которая начинается с нуклеотида в положении 1 и заканчивается нуклеотидом в положении 366. Предпочтительно также, чтобы второй фрагмент кодировал константную область человеческой тяжелой цепи, более предпочтительно константную область человеческой цепи γ4-типа. Этот второй фрагмент представляет собой фрагмент ДНК геномного происхождения (который содержит интроны) или фрагмент кДНК (без интронов).
Вторая конструкция ДНК кодирует легкую цепь или ее фрагмент и содержит
а) первый фрагмент, который кодирует вариабельную область, содержащую альтернативные каркасный участок и гипервариабельные участки; где гипервариабельные участки представляют собой CDR1', CDR2' и CDR3', аминокислотные последовательности которых представлены в Seq. Id. No. 2;
этот первый фрагмент начинается с кодона, который кодирует первую аминокислоту вариабельной области и заканчивается кодоном, который кодирует последнюю аминокислоту вариабельной области, и
б) второй фрагмент, кодирующий константную область легкой цепи или ее фрагмент, который начинается с кодона, кодирующего первую аминокислоту константной области легкой цепи, и заканчивающуюся кодоном, который кодирует последнюю аминокислоту константной области или ее фрагмента, после которого расположен стоп-кодон.
Предпочтительно, указанный первый фрагмент кодирует вариабельную область, аминокислотная последовательность которой практически идентична аминокислотной последовательности, представленной в SEQ ID No. 2, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 109. Более предпочтительно первый фрагмент имеет нуклеотидную последовательность, представленную в SEQ ID No. 2, которая начинается с нуклеотида в положении 1 и заканчивается нуклеотидом в положении 327. Предпочтительно также, чтобы второй фрагмент кодировал константную область человеческой легкой цепи, более предпочтительно константную область человеческой цепи κ-типа.
Изобретение относится также к МСР-1-связывающим молекулам, в которых один или более, как правило, лишь небольшое количество остатков CDR1, CDR2, CDR3, CDR1, CDR2' или CDR3' заменены по сравнению с остатками последовательностей, представленных в SEQ ID No. 1 и SEQ ID No. 2; например, в результате мутации, например, сайт направленного мутагенеза соответствующих последовательностей ДНК. Изобретение относится к последовательностям ДНК, кодирующим такие измененные МСР-1-связывающие молекулы. Изобретение относится также к связывающим молекулам, в которых один или более, как правило, лишь небольшое количество остатков каркасных участков заменены по сравнению с остатками последовательностей, представленных в SEQ ID No. 1 и SEQ ID No. 2.
В обеих конструкциях ДНК первый и второй фрагменты могут быть разделены интроном, а также целесообразно, когда в интроне между первым и вторым фрагментом находится энхансер. Наличие энхансера, который является транскрибируемым, но не транслируемым, может повышать эффективность транскрипции. Согласно конкретным вариантам осуществления обе конструкции ДНК содержат энхансер гена тяжелой цепи, предпочтительно человеческого гена.
Каждую конструкцию ДНК помещают под контроль приемлемых контролирующих экспрессию последовательностей, прежде всего, под контроль приемлемого промотора. Можно использовать любой тип промотора при условии, что он адаптирован к организму-хозяину, в который конструкции ДНК должны быть перенесены для экспрессии. Однако, если экспрессия происходит в клетке млекопитающего, то особенно предпочтительно применять промотор гена иммуноглобулина.
Требуемое антитело можно получать в клеточной культуре или в трансгенном животном. Соответствующее трансгенное животное можно получать с помощью стандартных методов, которые включают микроинъекцию в яйцеклетки первой и второй конструкций ДНК, помещенных под контроль приемлемых контролирующих последовательностей, перенос полученных таким образом яйцеклеток в соответствующих псевдобеременных самок и отбор потомства, экспрессирующего требуемое антитело.
Когда цепи антитела получают в клеточной культуре, конструкции ДНК должны быть сначала встроены либо в один экспрессирующий вектор, либо в два различных, но совместимых экспрессирующих вектора, причем последний вариант является предпочтительным.
Таким образом, изобретение относится также к экспрессионному вектору, который может реплицироваться в линии прокариотических или эукариотических клеток и содержит по меньшей мере одну из описанных выше конструкций ДНК.
Каждый экспрессионный вектор, содержащий конструкцию ДНК, затем переносят в приемлемый организм-хозяин. Когда конструкции ДНК встроены индивидуально в два экспрессионных вектора, их можно переносить по отдельности, т.е. по одному типу вектора на клетку, либо посредством котрансформации, указанный последний вариант является предпочтительным. Приемлемый организм-хозяин может представлять собой линию клеток бактерий, дрожжей или млекопитающих, указанный последний вариант является предпочтительным. Более предпочтительно линию клеток млекопитающего получают из лимфомы, например миеломы, гибридомы или здоровых иммортализованных В- клеток, которые предпочтительно не экспрессируют тяжелую или легкую цепи никаких эндогенных антител, например, линию клеток SP 2/0.
Для экспрессии в клетках млекопитающих кодирующие последовательности МСР-1-связывающих молекул предпочтительно интегрируют в ДНК клетки-хозяина в локус, в котором может быть обеспечен высокий уровень экспрессии МСР-1-связывающей молекулы или который является предпочтительным для обеспечения высокого уровня экспрессии МСР-1-связывающей молекулы. Клетки, в которых существуют такие локусы, предпочтительные для интеграции кодирующей последовательности МСР-1-связывающей молекулы, можно выявлять и отбирать на основе данных о уровнях экспрессии МСР-1-связывающей молекулы. Для получения клеток-хозяев, содержащих кодирующую последовательность МСР-1-связывающей молекулы, можно применять любой селектируемый маркер; например, можно использовать ген dhfr/метотрексат, или эквивалентную систему отбора. Системы для экспрессии МСР-1-связывающих молекул по изобретению включают системы амплификации/селекции, основанные на применении GS, например, описанные в ЕР 0256055 В, ЕР 0323997 В и ЕР-А 89303964.4.
Еще одним объектом изобретения является способ получения МСР-1-связывающей молекулы, который предусматривает (I) культивирование организма, трансформированного описанным выше экспрессионным вектором, и (II) выделение МСР-1-связывающей молекулы из культуры.
Наиболее предпочтительно МСР-1-связывающая молекула по изобретению представляет собой человеческое антитело, например, антитела AAV293, AAV294 или ABN912, и ее можно получать культивированием соответствующей линии клеток гибридомы или предпочтительно из рекомбинантной линии клеток, которая содержит ДНК, кодирующую человеческое антитело, включая ДНК, измененную с целью кодирования измененного изотипа антитела или другой функции или свойства антитела.
При создании настоящего изобретения установлено, что AAV294 и более предпочтительно антитела AAV293 и ABN912 дают перекрестную реакцию с рекомбинантным человеческим эотаксином-1. Поскольку эти антитела эффективно взаимодействуют с эотаксином-1, а также с МСР-1, их можно использовать для ингибирования связывания эотаксина-1 с его рецептором наряду с ингибированием связывания МСР-1 с его рецептором. Секреция эотаксина происходит при аллергических заболеваниях и нарушениях, включая аллергические и воспалительные заболевания дыхательных путей, такие как астма. Под объем настоящего изобретения подпадают антитела, прежде всего химерные антитела и антитела со встроенным путем трансплантации гипервариабельным участком, и предпочтительно человеческие антитела, обладающие способностью специфично связываться как с МСР-1, так и с эотаксином, например, с человеческим МСР-1 и человеческим эотаксином, а также применение таких антител для лечения заболеваний, опосредуемых МСР-1 или эотаксином.
Таким образом, еще одним объектом изобретения является антитело к МСР-1, которое дает перекрестную реакцию с эотаксином.
Предпочтительные согласно этому объекту изобретения антитела представляют собой антитела, которые обладают способностью ингибировать связывание МСР-1 с его рецептором и обладают способностью ингибировать связывание эотаксина с его рецептором.
И еще одним объектом изобретение является
I) применение антитела к МСР-1, дающего перекрестную реакцию с эотаксином-1, которое обладает способностью ингибировать связывание МСР-1 и эотаксина-1 с их рецепторам, и для лечения опосредуемых МСР-1 или эотаксином-1 болезни или нарушения;
II) способ лечения опосредуемых МСР-1 или эотаксином болезни или нарушения у пациента, который предусматривает введение пациенту эффективного количества антитела к МСР-1, которое дает перекрестную реакцию с эотаксином и обладает способностью ингибировать связывание МСР-1 и эотаксина с их рецепторами;
III) фармацевтическая композиция, содержащая антитело к МСР-1, которое дает перекрестную реакцию с эотаксином и обладает способностью ингибировать связывание МСР-1 и эотаксина с их рецепторами, в сочетании с фармацевтически приемлемыми эксципиентом, разбавителем или носителем; и
IV) применение антитела к МСР-1, которое дает перекрестную реакцию с эотаксином и обладает способностью ингибировать связывание МСР-1 и эотаксина с их рецепторами, для приготовления лекарственного средства, предназначенного для лечения опосредуемых МСР-1 или эотаксином болезни или нарушения.
В указанных дополнительных объектах антитело к МСР-1 предпочтительно дает перекрестную реакцию с эотаксином-1 и опосредуемые эотаксином болезни предпочтительно представляют собой болезни, опосредуемые эотаксином-1.
Для целей настоящего описания понятие «антитело, обладающее способностью ингибировать связывание МСР-1 и эотаксина с их рецепторами» подразумевает, что антитело обладает способностью ингибировать связывание МСР-1 и эотаксина с их рецепторами практически в такой же степени, что и антитела AAV294, AAV293 или ABN912, где понятие «в такой же степени» имеет указанное выше значение.
В настоящем описании понятие «опосредуемая МСР-1 болезнь» и «опосредуемая эотаксином болезнь» подразумевает все болезни и медицинские состояния, которые либо прямо, либо косвенно связаны с МСР-1 или эотаксином, прежде всего с эотаксином-1, включая этиологию, развитие, прогресс, персистентность или патологию болезни или состояния.
В настоящем описания понятия «лечение» или «лечить» относятся как к профилактическому или превентивному лечению, так и к исцеляющему или изменяющему течение болезни лечению, включая лечения пациента, который имеет риск заражения болезнью или для которого предусматривается возможность заражения болезнью, а также пациентов, которые уже больны или у которых диагностировано наличие болезни или медицинского состояния, и включает подавление клинического рецидива.
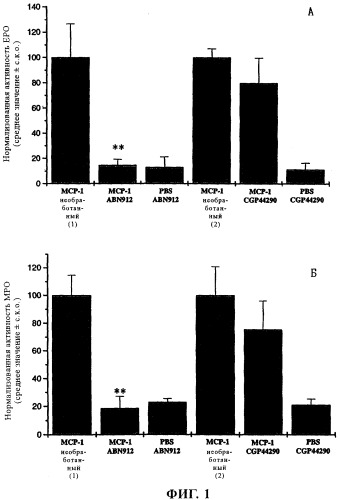
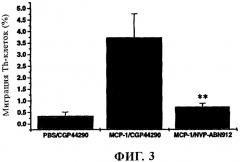
Аффинность связывания антител AAV293 и ABN912 с МСР-1 превосходит аффинности связывания ранее описанных антител к МСР-1, например, антител к человеческому МСР-1. Так, для ABN912 значение константы равновесия диссоциации kd, характеризующей связывание с МСР-1, составляет менее примерно 50 пМ, например, примерно 43 пМ. Указанная высокая аффинность связывания обусловливает очень высокую терапевтическую ценность ABN912.
Таким образом, еще одним объектом изобретения является антитело к МСР-1, для которого значение kd, характеризующее связывание с МСР-1, составляет примерно 50пМ или менее. Этот объект изобретения включает также применение таких высокоаффинных антител и содержащих их композиций, аналогичное применению, указанному выше для антител к МСР-1, которые дают перекрестную реакцию с эотаксином.
Кроме того, при создании изобретения было установлено, что антитело ABN912 связывается с антигенным эпитопом МСР-1, который включает остаток аргинина в положении 24 МСР-1. Отсюда ясно, что антитело ABN912 обладает способностью оказывать непосредственное воздействие на связывание МСР-1 с его рецептором (CCR2B); Arg24 является важным остатком МСР-1, который принимает участие в связывании МСР-1 с CCR2B. Помимо этого сайт связывания ABN912 включает остатки Argl8 и Lys49 МСР-1.
Таким образом, еще одним объектом изобретения является антитело к МСР-1, которое связывается с антигенным эпитопом МСР-1, который содержит остаток аргинина в положении 24 МСР-1. Предпочтительно антигенный эпитоп содержит также остаток аргинина в положении 18 и остаток лизина в положении 49 МСР-1. Этот объект изобретения включает также пути применения, способы и композиции, описанные выше для антител к МСР-1, которые дают перекрестную реакцию с эотаксином.
МСР-1-связывающие молекулы, как они определены выше, прежде всего МСР-1 -связывающие молекулы, описанные в первом и втором объектах изобретения; антитела к МСР-1, которые дают перекрестную реакцию с эотаксином, прежде всего антитела, которые обладают способностью ингибировать связывание МСР-1 и эотаксина с их рецепторами; антитела к МСР-1, для которых значение kd, характеризующее связывание МСР-1, составляет примерно 50 пМ или менее; и антитела к МСР-1, которые связываются с антигенным эпитопом МСР-1, который содержит остаток аргинина в положении 24 МСР-1, далее в контексте настоящего описания обозначены как «антитела по изобретению».
Предпочтительно антитела по изобретению представляют собой МСР-1-связывающие молекулы, описанные в первом и втором объектах изобретения. Предпочтительно антитела по изобретение представляют собой человеческие антитела, более предпочтительно антитело ABN912 или его непосредственный эквивалент.
Антитела по изобретению ингибируют воздействие МСР-1 на его клетки-мишени и вследствие этого их м