Антитела против интерферона-альфа
Иллюстрации
Показать всеИзобретение относится к биотехнологии и иммунологии. Описано моноклональное анти-IFNα антитело, которое связывается с подтипами IFNα: IFNα1, IFNα2, IFNα4, IFNα5, IFNα8, IFNα10, IFNα21 и содержит три CDR участка тяжелой цепи. Аминокислотная последовательность в описании. Раскрыта тяжелая цепь анти-IFNα антитела или ее фрагмент, которые также содержат указанные CDR участки. Описано анти-IFNα антитело, которое содержит, по-меньшей мере, одну легкую цепь и одну тяжелую. Раскрыты варианты нуклеиновых кислот, кодирующих указанные антитела, и варианты векторов для экспрессии нуклеиновых кислот, а также варианты трансформированных клеток-хозяина. Среди векторов экспрессии описаны также векторы, депонированные под №2881 и под №2882, несущие соответственно тяжелую и легкую цепь антитела. Описан способ получения антитела из указанных клеток. Раскрыта гибридомная линия клеток мыши, депонированная в АТСС под номером №РТА-2917, и антитело, продуцируемое указанной линией. Описаны также варианты фармацевтической композиции на основе антитела и способ диагностики аутоиммунного заболевания. Раскрыто также применение антител для лечения заболевания или состояния, ассоциированного у пациента с повышенными уровнями IFNα. Использование изобретения позволяет одновременно подавлять биологическую активность, по крайней мере, семи подтипов IFNα человека, а именно IFNα1, IFNα2, IFNα4, IFNα5, IFNα8, IFNα10, IFNα21, что может найти применение в диагностике и терапии различных заболеваний человека, опосредуемых IFNα, таких как инсулинозависимый сахарный диабет или системная красная волчанка. 24 н. и 29 з.п. ф-лы. 5 табл., 7 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится, главным образом, к созданию и характеристике нейтрализующих анти-IFN-α моноклональных антител с широкой реактивностью к различным подтипам IFN-α. Настоящее изобретение относится также к использованию таких анти-IFN-α антител в диагностике и лечении нарушений, связанных с повышенной экспрессией IFN-α, в частности аутоиммунных нарушений, таких как инсулинозависимый сахарный диабет (IDDM) и системная красная волчанка (SLE).
Описание близкого уровня техники
Интерферон-α (IFN-α)
Хотя интерфероны поначалу были открыты по их противовирусным активностям, при последующем изучении обнаружились многочисленные регуляторные активности, ассоциированные с этими сильнодействующими цитокинами. Интерфероны типа I образуют древнее семейство цитокинов, которое включает IFN-α, IFN-β, IFN-δ, IFN-ω и IFN-τ (Roberts et al., J. Interferon Cytokine Res. 18:805-816 [1998]). Они кодируются безынтронными генами и широко распространены среди позвоночных. Несмотря на то что IFN-β кодируется у приматов и грызунов единственным геном, у человека и мышей обнаруживается более 10-15 разных подтипов IFN-α. Другие интерфероны типа I менее распространены, например IFN-δ присутствует у свиней, IFN-τ - у крупного рогатого скота и овец, а IFN-ω - у крупного рогатого скота и людей. Таким образом, интерфероны типа I человека включают множество членов семейства IFN-α и по одному члену из семейств IFN-β и IFN-ω. Все IFN типа I связываются с единственным рецептором, который включает, по меньшей мере, два белка, пронизывающих мембрану. С другой стороны, интерфероны типа II представлены одним членом, IFN-γ, который связывается с отдельным рецептором.
Хотя все IFN типа I, в том числе и IFN-α, проявляют противовирусное и антипролиферативное действие и, тем самым, помогают бороться с вирусными инфекциями и злокачественными опухолями (Lefevre et al., Biochimie 80:779-788 [1998]; Horton et al., Cancer Res. 59:4064-4068 [1999]; Alexenko et al., J. Interferon Cytokine Res. 17:769-779 [1997]; Gresser, J. Leukoc. Biol. 61:567-574 [1997]), существует несколько аутоиммунных заболеваний, которые ассоциируются с повышенной экспрессией IFN-α, это прежде всего инсулинозависимый сахарный диабет (IDDM) и системная красная волчанка (SLE).
Диабет тип I, известный также как аутоиммунный диабет или инсулинозависимый сахарный диабет (IDDM), представляет собой аутоиммунное заболевание, характеризующееся избирательным разрушением панкреатических β-клеток аутореактивными Т-лимфоцитами (Bach, Endocr. Rev. 15:516-542 [1994]; Castano and Eisenbarth, Annu. Rev. Immunol. 8:647-679 [1990]; Shehadeh and Lafferty, Diabetes Rev. 1:141-151 [1993]). Патология IDDM является очень сложной, включающей взаимодействие между эпигенетическим событием (возможно, вирусная инфекция), панкреатическими β-клетками и иммунной системой у генетически чувствительного хозяина. Ряд цитокинов, в том числе IFN-α и IFN-γ, вовлечены у человека в патогенез IDDM и в животных моделях данного заболевания (Campbell et al., J. Clin. Invest 87:739-742 [1991]; Huang et al., Diabetes 44:658-664 [1995]; Rhodes and Taylor, Diabetologia 27:601-603 [1984]). Например, сообщается об экспрессии панкреатической мРНК Ifn-α и о наличии иммунореактивных IFN-α в β-клетках пациентов с IDDM (Foulis et al., Lancet 2:1423-1427 [1987]; Huang et al., [1995] выше; Somoza et al., J. Immunol. 153:1360-1377 [1994]). Экспрессия IFN-α ассоциируется в островках Лангерганса человека со сверхэкспрессией антигенов главного комплекса гистосовместимости (МНС) класса IA (Foulis et al., [1978] выше; Somoza et al., [1994] выше). В двух моделях аутоиммунного заболевания грызунов, подверженных диабету DP-BB-крыс и обработанных стрептозотоцином мышей, экспрессия мРНК Ifn-α в островках Лангерганса предшествует инсулиновой недостаточности и диабету (Huang et al., Immunity 1:469-478 [1994]). Кроме того, у трансгенных мышей, содержащих гибридную конструкцию человеческий инсулиновый промотор-Inf-α, развивается гипоинсулинемический диабет, сопровождаемый инсулиновой недостаточностью (Stewart et al., Science 260:1942-1946 [1993]).
Оказалось, что локальная экспрессия IFN-α клетками панкреатических островков в ответ на возможные диабетогенные стимулы, такие как вирусы, может запускать процесс развития инсулиновой недостаточности. Сообразно его роли в качестве инициирующего агента показано, что IFN-α индуцирует в эндотелиальных клетках островков Лангерганса человека фактор межклеточной адгезии-I (ICAM-1) и HLA класса IA, что может способствовать лейкоцитарной инфильтрации в период инсулиновой недостаточности (Chakrabarti et al., J. Immunol. 157:522-528 [1996]). Кроме того, IFN-α способствует Т-клеточной стимуляции в результате индукции ко-стимулирующих молекул ICAM-1 и В7.2 в антиген-презентирующих клетках островков Лангерганса (Chakrabarti et al., Diabetes 45:1336-1343 [1996]). Вместе эти исследования свидетельствуют о том, что ранняя экспрессия β--клетками IFN-α может являться ключевым событием в инициации аутоиммунного диабета. Несмотря на имеющийся ряд сообщений об участии IFN-γ в развитии IDDM в моделях грызунов корреляция между экспрессией данного цитокина и IDDM человека мала. Таким образом, клетки, экспрессирующие IFN-γ, можно обнаружить в островках Лангерганса в подгруппе пациентов-людей, подобранных по существенной лимфоцитарной инфильтрации в указанных островках. В группе пациентов, которых не подбирали по этому критерию, ассоциация между экспрессией IFN-γ и IDDM человека оказалась неочевидной.
Основываясь на повышенном уровне экспрессии IFN-α у пациентов с системной красной волчанкой (SLE), считается, что IFN-α также участвует в патогенезе SLE (Ytterberg and Schnitzer, Arthritis Rheum 25:401-406 [1982]; Shi et al., Br. J. Dermatol. 117:155-159 [1987]). Интересно отметить, что в настоящее время IFN-α используют для лечения рака, а также вирусной инфекции, такой как хронический гепатит, вызванный инфицированием вируса гепатита В и вирусом гепатита С. В соответствии с наблюдениями о повышенных уровнях IFN-α, запускающих аутоиммунность, сообщается о значительном повышении частоты возникновения аутоиммунных нарушений, таких как IDDM, SLE, тиреоидит, у пациентов, подвергающихся IFN-α-терапии. Например, было показано, что продолжительное использование IFN-α в качестве противовирусной терапии индуцирует IDDM (Waguri et al., Diabetes Res. Clin. Pract. 23:33-36 [1994]; Fabris et al., J. Hepatol. 28:514-517 [1998] или SLE (Garcia-Porrua et al., Clin. Exp. Rheumatol. 16:107-108 [1998]). Лечение инфекции, вызванной вирусом коксаки В (CBV), с помощью IFN-α-терапии также ассоциируется с индукцией IDDM (Chehadeh et al., J. Infect. Dis. 181:1929-1939 [2000]). Также сообщается о множестве случаев, свидетельствующих о развитии IDDM или SLE у пациентов с раком, которых лечили IFN-α (Ronnblom et al., J. Intern. Med. 227:207-210 [1990]).
Терапия антителами
Использование моноклональных антител в качестве терапевтических средств было признано для некоторых моноклональных антител (mAb), либо одобренных для использования на человеке, либо находящихся на последней стадии клинических испытаний. Первые mAb для лечения отторжения аллотрансплантата, одобренные в 1986 г. Управлением по контролю за продуктами и лекарствами (FDA), были антителами против CD3 (OKT3). С того времени достижения в области mAb значительно выросли, особенно с 1994 г., что привело к одобрению еще семи видов mAb для лечения человека. Они включают ReoPro® для терапии осложнений коронарной ангиопластики в 1994 г., Zenapax® (анти-CD25) для предотвращения отторжения аллотрансплантата в 1997 г., Rituxan® (анти-CD20) для лечения В-клеточной лимфомы не-Ходжкина в 1997 г., Infliximab® (анти-IFN-α) первоначально для лечения болезни Крона в 1998 г., а впоследствии для лечения ревматоидного артрита в 1998 г., Simulect® (анти-CD25) для предотвращения отторжения аллотрансплантата в 1998 г., Synagis® (антитела против F-белка респираторно-синцитиального вируса) для лечения респираторных инфекций в 1998 г., и Herceptin® (анти-HER2/neu) для лечения сверхэкспрессии HER2 метастазирующих злокачественных опухолей молочной железы в 1998 г. (Glennie and Johnson, Immunol. Today 21:403-410 [2000]).
Антитела против IFN-α
Болезненные состояния, которые поддаются воздействию mAb, включают все состояния, в которых наблюдается патологический уровень антигена-мишени. Например, антитело, которое нейтрализует IFN-α, присутствующий в сыворотке крови пациентов, больных SLE, и экспрессирующийся панкреатическими островками у больных IDDM, является потенциальным кандидатом для терапевтического воздействия на эти заболевания. Его можно было бы также использовать для терапевтического воздействия на другие аутоиммунные заболевания с подразумеваемым повышением причинно-обусловленной роли экспрессии IFN-α. Оказалось, что при заболевании человека IDDM (Foulis et al., Lancet 2:1423-1427 [1987]; Huang et al., Diabetes 44:658-664 [1995]; Somoza et al., J. Immunol. 153:1360-1377 [1994] и SLE (Hooks et al., Arthritis & Rheumatism 25:396-400 [1982]; Kim et al., Clin. Exp. Immunol. 70:562-569 [1987]; Lacki et al., J. Med. 28:99-107 [1997]; Robak et al., Archivum Immunologiae et Therapiae Experimentalis 46:375-380 [1998]; Shiozawa et al., Arthritis & Rheumatism 35:417-422 [1992]; von Wussow et al., Rheumatology International 8:225-230 [1988]), существует корреляция между заболеванием и IFN-α, но не IFN-β или IFN-γ. Таким образом, при антиинтерфероновом воздействии mAb при IDDM или SLE потребуется специфическая нейтрализация большинства, если не всех, подтипов IFN-α, без какой-либо существенной нейтрализации IFN-β или IFN-γ. Остаточная активность этих последних двух интактных интерферонов может также иметь преимущество, обеспечивая сохранение значительной противовирусной активности.
В то же время обнаружено, что несколько mAb, которые демонстрируют реактивность в отношении описанных подтипов рекомбинантного человеческого IFN-α, нейтрализуют лишь ограниченную проанализированную подгруппу подтипов рекомбинантного IFN-α или оказались неспособны нейтрализовать смесь подтипов IFN-α, полученную с помощью стимулированных лейкоцитов периферической крови (Tsukui et al., Microbiol. Immunol. 30:1129-1139 [1986]; Berg, J. Interferon Res. 4:481-491 [1984]; Meager and Berg, J. Interferon Res. 6:729-736 [1986]; Патент США №4902618; и EP публикация №0139676 В1).
Поэтому существует большая потребность в анти-IFN-α антителах, которые не только связываются с большинством подтипов IFN-α, предпочтительно всеми, но также нейтрализуют такие подтипы, которые не влияют на указанную биологическую функцию других интерферонов.
Краткое изложение существа изобретения
Настоящее изобретение основано на создании моноклональных антител, которые, что было экспериментально установлено, нейтрализуют все семь анализируемых разных подтипов рекомбинантного человеческого IFN-α и два независимых пула природных подтипов человеческого IFN-α.
Первой целью настоящего изобретения является создание анти-IFN-α моноклонального антитела человека, которое связывается и нейтрализует биологическую активность, по меньшей мере, IFN-α человека подтипов IFN-α1, IFN-α2, IFN-α4, IFN-α5, IFN-α8, IFN-α10, и IFN-α21. Еще одной целью настоящего изобретения является создание анти-IFN-α моноклонального антитела человека, которое связывается со всеми подтипами IFN-α человека и нейтрализует их биологическую активность. Антитело настоящего изобретения может в значительной мере уменьшить или подавить биологическую активность рассматриваемого IFN-α человека. В одном из вариантов осуществления настоящего изобретения антитело настоящего изобретения способно нейтрализовать, по меньшей мере, 60% или, по меньшей мере, 70%, предпочтительно, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 85% и еще более предпочтительно 90%, еще более предпочтительно, по меньшей мере, 95% и наиболее предпочтительно, по меньшей мере, 99% биологической активности IFN-α человеческого индивида. В другом варианте осуществления настоящего изобретения моноклональное антитело, нейтрализующее биологическую активность IFN-α человека, не нейтрализует соответствующую биологическую активность IFN-∃ человека.
Биологическая активность IFN-α человеческого индивида может представлять собой IFNAR2-связывающую активность. В конкретном варианте осуществления настоящего изобретения представлено моноклональное антитело против IFN-∀ человека, способное связывать и блокировать, по меньшей мере, 60% или, по меньшей мере, 70%, предпочтительно, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 85%, еще более предпочтительно, по меньшей мере, 90%, еще более предпочтительно, по меньшей мере, 95%, наиболее предпочтительно, по меньшей мере, 99% IFNAR2-связывающей активности всех или практически всех подтипов IFN-α человека. В другом варианте осуществления настоящего изобретения представлено моноклональное антитело против IFN-∀ человека, которое способно связывать и блокировать, по меньшей мере, 60% или, по меньшей мере, 70%, предпочтительно, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 85%, еще более предпочтительно, по меньшей мере, 90%, еще более предпочтительно, по меньшей мере, 95%, наиболее предпочтительно, по меньшей мере, 99% IFNAR2-связывающей активности каждого подтипа IFN-∀ человека - 1, 2, 4, 5, 8, 10 и 21. В другом варианте осуществления настоящего изобретения моноклональное антитело против IFN-∀ человека не обладает перекрестной реактивностью с IFN-∃ человека.
Биологическая активность IFN-α человеческого индивида может представлять собой противовирусную активность. В одном из вариантов осуществления настоящего изобретения моноклональное антитело против IFN-∀ человека способно связываться со всеми или практически со всеми подтипами IFN-α человека и нейтрализовать их противовирусную активность. В другом варианте осуществления настоящего изобретения моноклональное антитело против IFN-∀ человека способно связываться и нейтрализовать противовирусную активность каждого подтипа IFN-∀ человека - 1, 2, 4, 5, 8, 10 и 21. В конкретном варианте осуществления настоящего изобретения создано моноклональное антитело против IFN-∀ человека, которое способно связываться и нейтрализовать, по меньшей мере, 60% или, по меньшей мере, 70%, предпочтительно, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 85%, еще более предпочтительно, по меньшей мере, 90%, еще более предпочтительно, по меньшей мере, 95%, наиболее предпочтительно, по меньшей мере, 99% противовирусной активности всех или практически всех подтипов IFN-α человека. Еще в одном варианте осуществления настоящего изобретения создано моноклональное антитело против IFN-∀ человека, которое связывает и нейтрализует, по меньшей мере, 60% или, по меньшей мере, 70%, предпочтительно, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 85%, еще более предпочтительно, по меньшей мере, 90%, еще более предпочтительно, по меньшей мере, 95%, наиболее предпочтительно, по меньшей мере, 99% противовирусной активности каждого подтипа IFN-∀ человека - 1, 2, 4, 5, 8, 10 и 21. Еще в одном варианте осуществления настоящего изобретения моноклональное антитело, нейтрализующее противовирусную активность IFN-α человека, не нейтрализуют противовирусную активность IFN-∃ человека.
Антитело может быть мышиным, гуманизированным или антителом человека. Антитело может представлять собой мышиное моноклональное антитело 9F3 против IFN-α человека или его гуманизированный вариант, такой, например, как вариант 13 (V13), или его химерную форму. В рамки настоящего изобретение включено также антитело, которое существенно связывает тот же эпитоп IFN-α, что и эпитоп мышиного моноклонального антитела 9F3 против IFN-α человека, или эпитоп его гуманизированной или химерной формы. Например, стандартным антителом для этой цели является анти-IFN-α антитело, полученное с помощью мышиной гибридомной клеточной линии 9F3.18.5, депонированной в АТСС 18 января 2001 г. с инвентарным №РТА-2917. В другом варианте осуществления настоящего изобретения представлено мышиное или химерное, мышь/человек, моноклональное антитело против IFN-α человека, включающее аминокислотную последовательность вариабельного домена (вариабельной области) легкой цепи, представленной на Фиг.5А (SEQ ID NO:1), и/или аминокислотную последовательность вариабельного домена (вариабельной области) тяжелой цепи, представленной на Фиг.5В (SEQ ID NO:2). Еще в одном варианте осуществления настоящего изобретения представлено гуманизированное моноклональное антитело против IFN-α человека, включающее аминокислотную последовательность гуманизированной легкой цепи вариабельного домена, представленную на Фиг.5А (SEQ ID NO:3), и/или аминокислотную последовательность вариабельного домена гуманизированной тяжелой цепи, представленной на Фиг.5В (SEQ ID NO:5).
Кроме того, представлено моноклональное антитело против IFN-α человека, которое существенно связывает тот же эпитоп в подтипах 1, 2, 4, 5, 8, 10 и 21 IFN-α человека, который связывается мышиным моноклональным антителом 9F3 против IFN-α человека, либо гуманизированным или химерным его вариантом. Также представлено моноклональное антитело против IFN-α человека, которое конкурирует с мышиным моноклональным антителом 9F3 против IFN-α человека за связывание с каждым из подтипов 1, 2, 4, 5, 8, 10 и 21 IFN-α человека.
Кроме того, представлена выделенная молекула нуклеиновой кислоты, кодирующая любое из описанных здесь антител, вектор, включающий выделенную молекулу нуклеиновой кислоты, клетку-хозяина, трансформированную данной молекулой нуклеиновой кислоты, и способ получения антитела, включающий культивирование клетки-хозяина в условиях, в которых экспрессируется указанная молекула нуклеиновой кислоты с получением антитела, и необязательно выделение антитела из клетки-хозяина. Антитело может происходить из IgG-класса и представлять изотип, такой как IgG1, IgG2; IgG3 или IgG4. Рамки настоящего изобретения включают также фрагменты антител, такие как фрагменты Fv, scFv, Fab, F(ab′)2, и Fab′.
В соответствии с другой целью в настоящем изобретении представлена легкая цепь моноклонального антитела против IFN-α человека или ее фрагмент, включающая следующие гипервариабельные области (CDR) (как указано у Kabat, et al., Sequences of Proteins of Immune-logical Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD [1991]. vols 1-3): (a) LI формулы RASQSVSTSSYSYMH (SEQ ID NO:7); (b) L2 формулы YASNLES (SEQ ID NO:8); и (с) L3 формулы QHSWGIPRTF (SEQ ID NO:9). Рамки настоящего изобретения включают также вариабельный домен фрагмента легкой цепи моноклонального антитела против IFN-α человека. Кроме того, рамки настоящего изобретения включают полипептид легкой цепи моноклонального антитела против IFN-α человека, включающий аминокислотную последовательность вариабельного домена химерной легкой цепи мыши/человека, либо аминокислотную последовательность полипептида всей химерной легкой цепи, кодируемой вектором XAIFN-ChLpDR1, депонированным в АТСС 9 января 2001 г. с инвентарным №РТА-2880. Рамки настоящего изобретения включают также полипептид легкой цепи моноклонального антитела против IFN-α человека, включающий аминокислотную последовательность вариабельного домена гуманизированной легкой цепи, или аминокислотную последовательность полипептида всей гуманизированной легкой цепи, кодируемой вектором VLV30-IgG, депонированным в АТСС 9 января 2001 г. с инвентарным №РТА-2882.
Еще одной целью настоящего изобретения является создание тяжелой цепи моноклонального антитела против IFN-α человека, или ее фрагмента, включающей следующие CDR: (а) Н1 формулы GYTFTEYIIH (SEQ ID NO:10); (b) H2 формулы SINPDYDITNYNQRFKG (SEQ ID NO:11) и (с) Н3 формулы WISDFFDY (SEQ ID NO:12). Рамки настоящего изобретения включают также вариабельный домен такого фрагмента тяжелой цепи моноклонального антитела против IFN-α человека. Рамки настоящего изобретения дополнительно включают полипептид тяжелой цепи моноклонального антитела против IFN-α человека, включающий аминокислотную последовательность вариабельного домена химерной тяжелой цепи мыши/человека, или аминокислотную последовательность полипептида всей химерной тяжелой цепи, кодируемой вектором XAIFN-ChHpDR2, депонированным в АТСС 9 января 2001 г. с инвентарным №РТА-2883. Дополнительно включен полипептид тяжелой цепи моноклонального антитела против IFN-α человека, включающий аминокислотную последовательность вариабельного домена гуманизированной тяжелой цепи, или аминокислотную последовательность полипептида всей гуманизированной тяжелой цепи, кодируемой вектором VHV30-IgG2, депонированным в АТСС 9 января 2001 г. с инвентарным №РТА-2881.
В соответствии с дополнительной целью в настоящем изобретении представлено моноклональное антитело против IFN-α человека, включающее (А) по меньшей мере, одну легкую цепь или ее фрагмент, включающие следующие CDR: (а) L1 формулы RASQSVSTSSYSYMH (SEQ ID NO:7); (b) L2 формулы YASNLES (SEQ ID NO:8); и (с) L3 формулы QHSWGIPRTF (SEQ ID NO:9); и (В) по меньшей мере, одну тяжелую цепь, или ее фрагмент, включающую следующие CDR: (а) Н1 формулы GYTFTEYIIH (SEQ ID NO:10); (b) H2 формулы SINPDYDITNYNQRFKG (SEQ ID NO:11); и (с) Н3 формулы WISDFFDY (SEQ ID NO:12). Антитело может обладать гомотетрамерной структурой, состоящей из двух пар цепей, тяжелой и легкой, антитела, соединенных дисульфидной связью. Рамки настоящего изобретения включают, в частности, линейное антитело, мышиное антитело, химерное антитело, гуманизированное антитело или антитело человека. Дополнительно представлено химерное антитело, включающее (1) аминокислотную последовательность вариабельного домена химерной легкой цепи мыши/человека или аминокислотную последовательность полипептида всей химерной легкой цепи, кодируемой вектором XAIFN-ChLpDR1, депонированным в ATCC 9 января 2001 г. с инвентарным №РТА-2880; и (2) аминокислотную последовательность вариабельного домена химерной тяжелой цепи мыши/человека или аминокислотную последовательность полипептида всей химерной тяжелой цепи, кодируемой вектором XAIFN-ChHpDR2, депонированным в ATCC 9 января 2001 г. с инвентарным №РТА-2883. Дополнительно представлено гуманизированное антитело, включающее (1) аминокислотную последовательность вариабельного домена гуманизированной легкой цепи или аминокислотную последовательность полипептида всей гуманизированной легкой цепи, кодируемой вектором VLV30-IgG, депонированным в ATCC 9 января 2001 г. с инвентарным №РТА-2882; и (2) аминокислотную последовательность вариабельного домена гуманизированной тяжелой цепи или аминокислотную последовательность полипептида всей гуманизированной тяжелой цепи, кодируемой вектором VHV30-IgG2, депонированным в АТСС 9 января 2001 г. с инвентарным №РТА-2881.
Еще одной целью настоящего изобретения является представление фармацевтической композиции, включающей эффективное количество антитела настоящего изобретения в смеси с фармацевтически приемлемым носителем.
Другой целью настоящего изобретения является представление способа диагностики состояния, ассоциированного с экспрессией IFN-α в клетке, включающего контактирование клетки с анти-IFN-α антителом и детектирование присутствия IFN-α.
Еще одной целью настоящего изобретения является представление способа лечения заболевания или состояния, ассоциированного с экспрессией у пациента IFN-α, включающего введение пациенту эффективного количества анти-IFN-α антитела. Пациент является пациентом-млекопитающим, предпочтительно пациентом-человеком. Заболевание является аутоиммунным заболеванием, таким как инсулинозависимый сахарный диабет (IDDM); системная красная волчанка (SLE); или аутоиммунный тиреоидит.
Краткое описание чертежей
На Фиг.1 представлена принципиальная схема способа, используемого при создании моноклональных антител против IFN-α человека.
На Фиг.2 показано, каким образом мышиное mAb против IFN-α человека (9F3) способно нейтрализовать спектр подтипов рекомбинантного IFN-α, но не рекомбинантного IFN-β. Указанные IFN оценивают по ингибированию в клетках А549 роста вируса энцефаломиокардита (EMC) в присутствии увеличивающихся концентраций mAb 9F3. Данные, представленные в виде процентов ингибирования активности вирусного роста, получены для указанного IFN в отсутствие mAb 9F3.
На Фиг.3А-3В показана нейтрализация лейкоцитарного интерферона (Sigma) (Фиг.3А) и лимфобластоидного интерферона (NIH-стандарт Ga23-901-532) (Фиг.3В). На Фиг.3А, 20000 МЕ/мл (заштрихованные столбики) или 5000 МЕ/мл (незаштрихованные столбики) лейкоцитарного интерферона (Sigma Product No. I-2396) инкубируют с пустым контролем (только буфер) (обозначен в виде "-"), 10 г/мл IgG контрольной мыши (обозначен в виде "mIgG"), или 10 г/мл mAb 9F3 (обозначен в виде "9F3"). Использовали различные разведения и показана величина остаточной активности. Полученные результаты представляют собой средние значения повторных определений. На Фиг.3В лимфобластоидный интерферон (NIH-стандарт Ga23-901-532) анализируют при 10 (заштрихованные колонки) или 3 (незаштрихованные колонки) МЕ/мл в присутствии или в отсутствие указанных концентраций mAb 9F3. Наибольший цитопатический эффект является свидетельством уменьшения активности интерферона. Полученные результаты представлены в виде средних значений повторных определений.
На Фиг.4 изображены результаты анализа изменений электрофоретической подвижности (EMSA), показывающие индукцию ISGF3/ISRE-комплекса с помощью IFN-α и способность 9F3 mAb предотвращать образование данного комплекса. EMSA осуществляют в присутствии или в отсутствие либо IFN-α2 человека (обозначен в виде "α2"), либо IFN-∃ (обозначен в виде "∃") в концентрации 25 нг/мл для mAb 9F3 (обозначен в виде "9F3") или мышиного контрольного антитела IgG (обозначен в виде "IgG") в концентрации 10 г/мл.
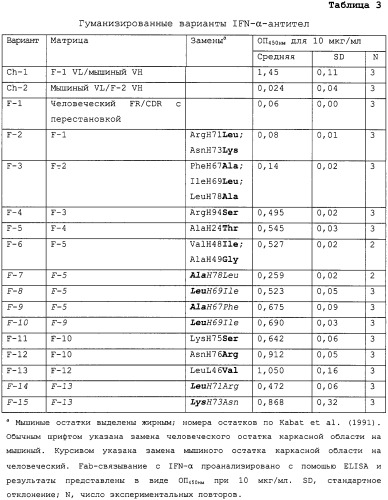
На Фиг.5A показано сопоставление аминокислотных последовательностей вариабельного домена легкой цепи мышиной 9F3 (мышиная, SEQ ID NO:1), варианта 13 гуманизированной 9F3 (V13, SEQ ID NO:3) и консенсусной вариабельной области легкой κ-цепи подгруппы I человека (huκI, SEQ ID NO:4). CDR (L1, SEQ ID NO:7; L2, SEQ ID NO:8; и L3, SEQ ID NO:9) выделены подчеркиванием. Нумерация аминокислотных остатков по Kabat et al., (1991) выше. Различия между мышиными последовательностями 9F3 и V13, а также различия между последовательностями 9F3 и huκI указаны звездочками.
На Фиг.5В показано сопоставление аминокислотных последовательностей вариабельной области тяжелой цепи мышиной 9F3 (мышиная, SEQ ID NO:2), варианта 13 гуманизированной 9F3 (V13, SEQ ID NO:5) и консенсусной вариабельной области подгруппы III тяжелой цепи человека (huIII, SEQ ID NO:6). CDR (H1, SEQ ID NO:10; H2, SEQ ID NO:11; и H3, SEQ ID NO:12) выделены подчеркиванием. Нумерация остатков по Kabat et al., (1991) выше. Различия между мышиными последовательностями 9F3 и V13, а также различия между последовательностями 9F3 и huIII указаны звездочками.
На Фиг.6 представлена картина нейтрализационной активности исходных mAb 9F3 (левая панель) и химерного белка СН8-2 (правая панель) по отношению к ингибированию проявляемого вирусного роста рекомбинантными подтипами IFN-α в клетках А549, зараженных вирусом энцефаломиокардита (EMC).
На Фиг.7 изображена модель гуманизированного варианта 13 9F3. Каркас областей VL и VH представлен в виде ленты. CDR показаны белым цветом и промаркированы (L1, L2, L3, H1, H2, H3). Структура боковых цепей, изменяемая от человека к мыши, представлена светлым изображением и промаркирована оцифрованным остатком.
Подробное описание предпочтительных вариантов осуществления настоящего изобретения
А. Определения
Если не оговорено иначе, используемые здесь технические и научные термины имеют то же значение, что и очевидное в большинстве случаев специалисту в данной области техники, к которой относится и настоящее изобретение. См., например, Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, NY 1994); Sambrook et al., Molecular Cloning, A Laboratory Manual Cold Springs Harbor Press (Cold Springs Harbor, NY 1989). Для целей настоящего изобретения ниже приводятся определения следующих терминов.
Используемый здесь термин "интерферон типа I" определяют в качестве термина, который включает все подтипы нативной последовательности интерферона типа I любого вида млекопитающих, в том числе интерферон-α, интерферон-β, интерферон-δ, интерферон-ω и интерферон-τ. Подобным образом термин "интерферон человека типа I" определяют в качестве термина, который включает все подтипы нативной последовательности интерферонов типа I человека, в том числе классы интерферона-α, интерферона-β и интерферона-ω, которые связываются с обычными клеточными рецепторами.
Если не предусмотрено специально, используемые здесь термины "интерферон-α", "IFN-α", и "интерферон-α человека", "IFN-α человека" и "IFN-∀" относятся ко всем видам нативной последовательности интерферона-альфа человека, в том числе ко всем подтипам нативной последовательности интерферона-α человека. Природный (нативная последовательность) интерферон-α человека включает 23 или более близкородственных белков, кодируемых отдельными генами с высокой степенью структурной гомологии (Weissmann and Weber, Prog. Nucl. Acid. Res. Mol. Biol., 33:251 [1986]; J. Interferon Res., 13:443-444 [1993]; Roberts et al., J. Interferon Cytokine Res. 18:805-816 [1998]). Локус IFN-α человека включает два подсемейства. Первое подсемейство состоит, по меньшей мере, из 14 функциональных, неаллельных генов, в том числе генов, кодирующих IFN-αА (IFN-α2), IFN-αВ (IFN-α8), IFN-αС (IFN-α10), IFN-αD (IFN-α1), IFN-αЕ (IFN-α22), IFN-αF (IFN-α21), IFN-αG (IFN-α5) и IFN-αН (IFN-α14), и псевдогенов, обладающих, по меньшей мере, 80% гомологией. Второе подсемейство, αII или Т, содержит, по меньшей мере, 5 псевдогенов и один функциональный ген (обозначаемый здесь в виде "IFN-αII1" или "IFN-Т"), который проявляет 70% гомологию с генами IFN-α (Weissmann and Weber [1986] выше).
Используемые здесь термины "первый рецептор интерферона-∀, (hIFN-∀) человека", "IFN-∀R", hIFNАR1", "IFNАR1", и "Uze-цепь" определены в виде белкового рецептора из 557 аминокислот, клонированного Uze et al., Cell, 60:225-234 (1990), включающего внеклеточный домен из 409 остатков, трансмембранный домен из 21 остатка и внутриклеточный домен из 100 остатков, как показано на Фиг.5 стр. 229 публикации Uze et al. Включены также вышеизложенные термины и фрагменты IFNAR1, которые содержат внеклеточный домен (ECD) (или фрагменты ECD) IFNAR1.
Используемые здесь термины "второй рецептор интерферона-∀ (hIFN-∀) человека", "IFN-∀∃R", hIFNAR2", "IFNAR2", и "Novick-цепь" определены в виде рецепторного белка из 515 аминокислот, клонированного Domanski et al., J. Biol. Chem., 37:21606-21611 (1995), включающего внеклеточный домен из 217 остатков, трансмембранный домен из 21 остатка и внутриклеточный домен из 250 остатков, как показано на Фиг.1 стр. 21608 публикации Domanski et al. Включены также вышеизложенные термины и фрагменты IFNAR2, которые содержат внеклеточный домен (ECD) (или фрагменты ECD) IFNAR2, и растворимые формы IFNAR2, такие как ECD IFNAR2, слитый с иммуноглобулиновой последовательностью, например, IFNAR2 ECD-Fc IgG, которая описана ниже.
Термин "нативная последовательность", в связи с интерфероном типа I, IFN-α или любым другим полипептидом, относится к полипептиду, который обладает той же аминокислотной последовательностью, что и соответствующий полипептид, полученный в природе, независимо от способа его получения. Такую нативную последовательность полипептида можно выделить из природного источника или можно изготовить рекомбинантным и/или синтетическим способами или любым их сочетанием. Термин "нативная последовательность" включает, в частности, естественно встречаемые усеченную или секретируемую формы (например, последовательность внеклеточного домена), естественно встречаемые вариантные формы (например, альтернативно сплайсированные формы) и естественно встречаемые аллельные варианты полноразмерных полипептидов.
"Полимеразная цепная реакция" или "ПЦР" относится к технологическому процессу или методу, в котором амплифицируют небольшие количества отдельного участка нуклеиновой кислоты, РНК и/или ДНК, как описано в Патенте США №4683195, выданном 28 июля 1987 г. Как правило, необходима информация о последовательности на концах области, представляющей интерес, или за ее пределами, так, чтобы сконструировать олигонуклеотидные праймеры; эти праймеры должны быть идентичны или подобны последовательности противоположных цепей матрицы, которая амплифицируется. 5'-Концевые нуклеотиды двух праймеров могут совмещаться с концами амплифицируемого материала. ПЦР можно использовать для амплификации специфичных РНК-последовательностей, специфичных ДНК-последовательностей из тотальной геномной ДНК и кДНК, транскрибируемой с тотальной клеточной РНК, бактериофаговых или плазмидных последовательностей, и т.д. и т.п. См. в основном Mullis et al., Cold Spring Harbor Symp. Quant. Biol. 51:263 (1987); Erlich, ed., PCR Technology (Stockton Press, NY, 1989). Используемая здесь ПЦР рассматривается в качестве одного, но не единственного примера способа полимеразной реакции нуклеиновой кислоты для амплификации тестируемого образца нуклеиновой кислоты, включающего использование известной нуклеиновой кислоты в качестве праймера и полимеразы нуклеиновой кислоты для амплификации или образования специфического участка нуклеиновой кислоты.
"Антитела" (Ab) и "иммуноглобулины" (Ig) являются гликопротеинами, обладающими одними и теми же структурными характеристиками. В то время как антитела проявляют специфичность связывания к специфичному антигену, иммуноглобулины включают в себя и антитела, и другие антитело-подобные молекулы, у которых отсутствует антигенная специфичность. Полипептиды последнего типа, например, продуцируются в малых количествах лимфатической системой и в повышенных количествах при миеломе.
"Нативные антитела и иммуноглобулины" представляют собой, как правило, гетеротетрамерные гликопротеины около 150000 дальтон, состоят из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь присоединена к тяжелой цепи одной ковалентной дисульфидной связью, причем число дисульфидных связей между тяжелыми цепями различных иммуноглобулиновых изотипов варьирует. Каждая тяжелая и легкая цепь обладает также расположенными с равными интервалами межцепочечными дисульфидными мостиками. Каждая тяжелая цепь содержит на одном конце вариабельную область (домен) (VH), после которой следует ряд константных доменов. Каждая легкая цепь обладает вариабельной областью на одном конце (VL) и константной областью на своем другом конце; константную область легкой цепи сопоставляют с первой константной областью тяжелой цепи, а вариабельную область легкой цепи сопоставляют с вариабельной областью тяжелой цепи. Предполагают, что отдельные аминокислотные остатки образуют стык (область контакта) между вариабельными областями легкой и тяжелой цепи (Chothia et al., J. Mol. Biol. 186:651 [1985]; Novotny and Haber, Proc. Natl. Acad. Sci. U.S.A. 82:4592 [1985]; Chothia et al., Nature 342: 877-883 [1989]).
Термин "вариабельный" относится к тому обстоятельству, что определенные части вариабельных доменов существенно отличаются у антител и используются для связывания и специфичности каждого отдельного антитела в отношении своего конкретного антигена. Однако вариабельность не распределена равномерно на всем протяжении вариабельных доменов антител. Она концентрируется в трех сегментах, именуемых определяющими комплементарность областями (CDR) или гипервариабельными областями в вариабельных доменах легкой и тяжелой цепи. Более высококонсервативные участки вариабельных доменов называют каркасными (FR). Вариабельные домены каждой нативной тяжелой и легкой цепи включают четыре FR-области, в большой степени принимающих β-складчатую конфигурацию, связанных с помощью трех CDR, которые образуют соединительные петли, и в некоторых случаях образующих отчасти структуру β-складки. В каждой цепи CDR удерживаются вместе в непосредственной близости от FR-областей и CDR другой цепи, способствуя образованию антиген-связывающего сайта антител (см. Kabat et al. (1991) выше). Константные домены прямо не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной токсичности.
Расщепление антител папаином приводит к образованию двух идентичных антиген-связывающих фрагментов, названных "Fab"-фрагментами, каждый с единственным антиген-связывающим сайтом, и остаточным "Fc"-фрагментом, наименование которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который обладает двумя антиген-связывающими сайтами и все еще способен перекрестно взаимодействовать с антигеном.
"Fv" является наименьшим фрагментом антитела, который содержит антиген-распознающий и -связывающий сайт. В двухцепочечных Fv-видах данная область состоит из димера одной тяжелой и одной легкой цепи вариабельного домена, находящихся в тесной нековалентной ассоциации. В одноцепочечных Fv-видах