Фармацевтические композиции, включающие аторвастатин, изготовленный без гранулирования
Иллюстрации
Показать всеТвердая стандартная дозированная форма включает аторвастатин или его фармацевтически приемлемую соль и наполнитель или комбинацию наполнителей, который включает более 50 мас.% разбавителей и менее 5 мас.% подщелачивающего агента в качестве добавки. Указанный разбавитель представляет собой моногидрат лактозы, безводную лактозу, микрокристаллическую целлюлозу или хлорид натрия. Твердая стандартная дозированная форма представляет собой таблетку или капсулу и изготавливается без стадии гранулирования. Изобретение позволяет предотвратить сегрегацию во время изготовления стандартной дозированной формы и обеспечить высокую точность дозирования аторвастатина. Исключение стадии гранулирования приводит к повышению эффективности производства стандартной дозированной лекарственной формы без снижения скорости производства. 3 н. и 2 з.п. ф-лы, 1 ил., 3 табл.
Реферат
Настоящая заявка претендует на приоритет над предварительной патентной заявкой США № 60/477918, поданной 12 июня 2003 г.
Настоящее изобретение относится к фармацевтическим композициям, включающим аторвастатин и его фармацевтически приемлемые соли, и к способу их изготовления, к наборам, содержащим указанные композиции, а также к способам применения указанных композиций для лечения субъектов, страдающих гиперхолестеринемией и/или гиперлипидемией, а также остеопорозом, доброкачественной гиперплазией предстательной железы (ДГПЖ - BPH) и болезнью Альцгеймера.
Превращение 3-гидрокси-3-метилглутарил-кофермента А (HMG-CoA) в мевалонат является ранней и ограничивающей скорость стадией пути биосинтеза холестерина. Данную стадию катализирует фермент HMG-CoA-редуктаза. Статины ингибируют HMG-CoA-редуктазу и препятствуют катализу указанного превращения. В качестве таковых все статины являются мощными агентами, понижающими уровень липидов.
Аторвастатин-кальций, описанный в патенте США № 5273995, который включен в настоящий документ в качестве ссылки, в настоящее время имеется в продаже как Lipitor®, имеющий химическое наименование тригидраткальциевой соли [R-(R*,R*)]-2-(4-фторфенил)-β,δ-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламин)карбонил]-1Н-пиррол-1-гептановой кислоты (2:1) и формулу
Аторвастатин и его фармацевтически приемлемые соли являются селективными конкурентными ингибиторами HMG-CoA-редуктазы. В качестве такового аторвастатин-кальций является мощным агентом, понижающим уровень липидов, и, таким образом, является пригодным в качестве гиполипидемического и/или гипохолестеринемического агента, а также для лечения остеопороза, доброкачественной гиперплазии предстательной железы (ДГПЖ) и болезни Альцгеймера.
Ряд патентов описывают аторвастатин, композиции аторвастатина, а также способы и ключевые промежуточные вещества для получения аторвастатина. Указанные патенты включают: патенты США №№ 4681893, 5273995, 5003080, 5097045, 5103024, 5124482, 5149837, 5155251, 5216174, 5245047, 5248793, 5280126, 5397792, 5342952, 5298627, 5446054, 5470981, 5489690, 5489691, 5510488, 5686104, 5998633, 6087511, 6126971, 6433213 и 6476235, которые включены в настоящий документ в качестве ссылок.
Аторвастатин может существовать в кристаллической, жидкокристаллической и некристаллической и аморфной формах.
Кристаллические формы аторвастатина-кальция описаны в патентах США №№ 5969156 и 6121461, которые включены в настоящий документ в качестве ссылок. Другие кристаллические формы аторвастатина описаны в патенте США № 6605729, который включен в настоящий документ в качестве ссылки.
Кроме того, ряд опубликованных международных патентных заявок описывают кристаллические формы аторвастатина, а также способы получения аморфного аторвастатина. Указанные заявки включают: WO 00/71116; WO 01/28999; WO 01/36384; WO 01/42209; WO 02/41834; WO 02/43667; WO 02/43732; WO 02/051804; WO 02/057228; WO 02/057229; WO 02/057274; WO 02/059087; WO 02/083637; WO 02/083638; WO 03/011826; WO 03/050085; WO 03/070702 и 04/022053.
Описано, что аморфные формы ряда лекарственных средств имеют разные характеристики растворения и в некоторых случаях разные свойства биодоступности по сравнению с кристаллическими формами (Konno, T., Chem. Pharm. Bull., 1990; 38:2003-2007). При некоторых терапевтических показаниях один профиль биодоступности может иметь преимущество перед другим.
Различия в скорости растворения могут сделать выгодным изготовление композиций аторвастатина как в кристаллической, так и аморфной форме. Например, для некоторых видов возможного применения аторвастатина (например, для неотложного лечения пациентов с инсультом, как описано в Takemoto, M.; Node, K.; Nakagami, H.; Liao, Y.; Grimm, M,; Takemoto, Y.; Kitakaze, M.; Liao, J.K., Journal of Clinical Investigation, 2001; 108(10): 1429-1437) быстрое начало активности может быть чрезвычайно благоприятным с точки зрения улучшения эффективности лекарственного средства.
Изготовление твердых композиций аторвастатина описано в патентах США №№ 5686104 и 6126971. В описанных процессах аторвастатин объединяют со стабилизирующей добавкой, такой как соль щелочноземельного металла, и наполнителями и подвергают влажному гранулированию. Одновременно зарегистрированная патентная заявка Соединенных Штатов, в обычной собственности, номер дела патентного поверенного РС25685, описывает фармацевтическую композицию аторвастатина, изготовленную влажным гранулированием, с содержанием приблизительно менее 5 мас.% добавки соли щелочноземельного металла. Несмотря на то что процессы влажного гранулирования широко используются в фармацевтической промышленности, обычно желательно по возможности избегать влажного гранулирования, поскольку это добавляет еще одну стадию к процессу, что снижает общую эффективность производства. Влажное гранулирование обычно выполняют, чтобы улучшить ряд свойств комбинации лекарственного средства и наполнителей. Кроме того, одновременно зарегистрированная патентная заявка Соединенных Штатов, в обычной собственности, номер дела патентного поверенного РС25686, описывает фармацевтическую композицию, включающую аторвастатин, изготовленную сухим гранулированием.
Поскольку аторвастатин является высокоэффективным лекарственным средством, композиции указанного лекарственного средства обычно являются достаточно разбавленными, что обеспечивает адекватный для производства и применения пациентом размер лекарственных форм. В случае когда лекарственное средство используется в разбавленной форме, существует опасность того, что сегрегация лекарственного средства и наполнителей во время процессов, которые выполняются до того, как лекарственное средство превращается в окончательную лекарственную форму, может привести к тому, что некоторые из стандартных дозированных форм будут иметь пониженную или повышенную активность. Контроль активности стандартных дозированных форм является существенным для предотвращения получения отдельными пациентами некорректных, субтерапевтических или вызывающих побочные эффекты доз лекарственного средства. Гранулирование является одним из способов предотвращения сегрегации. В настоящее время не существует способа a priori предсказать, какие наполнители, если они есть, будут обеспечивать достаточно малую сегрегацию в комбинации с данным лекарственным средством, для того чтобы сделать возможным использование наполнителя в процессе изготовления стандартных дозированных форм без стадии гранулирования. Таким образом, остается потребность в идентификации композиций аторвастатин плюс наполнитель, подходящих для изготовления стандартных дозированных форм, в процессе которого не будет стадии гранулирования, а сегрегация будет минимальной. В настоящем изобретении заявители неожиданно установили, что наполнители, подходящие для использования при изготовлении стандартных дозированных форм аторвастатина без стадии гранулирования, могут быть идентифицированы с использованием простой тест-процедуры.
В группе наполнителей, необходимых для изготовления выгодной композиции аторвастатина, масса наполнителя или комбинация наполнителей служит для разбавления лекарственного средства и, следовательно, обеспечения количества стандартной дозированной формы, удобного для производства и применения. Указанные материалы известны в области фармацевтики как разбавители. Разбавители описаны, например, в "Handbook of Pharmaceutical Excipients, 3-е издание" (A.H.Kibbe, издатель; Pharmaceutical Press, Лондон; 2000). Поскольку указанные материалы включают массу композиций аторвастатина, остается потребность в идентификации разбавителей, которые обеспечивают хорошую однородность доз для изготовления стандартных дозированных форм в условиях коммерческого производства.
Международные патентные заявки WO 00/35425 и WO 01/76566A1 описывают композиции для изготовления стандартных дозированных форм аторвастатина как часть более широкого обсуждения способов стабилизации содержащих статины лекарственных средств. Указанные описания, однако, не исследовали ни однородность доставляемых доз лекарственного средства, ни удобство указанных композиций для использования в коммерчески жизнеспособных процессах. Фактически описанные композиции включают наполнители, которые являются доступными в ряде размеров частиц, многие из которых не позволяют осуществлять надежный контроль веса и активности, необходимый для коммерческого производства.
Кроме того, для изготовления и хранения стандартных дозированных форм аторвастатина важно обеспечивать активное лекарственное средство в чистой форме. Более того, желательно достигать указанной высокой чистоты и стабильности при максимально простой композиции. Патенты Соединенных Штатов №№ 5686104 и 6126971 описывают способ стабилизации композиций аторвастатина с использованием добавок солей щелочноземельных металлов в процессе влажного гранулирования. Сохраняется потребность в простых композициях и способах изготовления стандартных дозированных форм аторвастатина, которые имеют низкие уровни примесей и обеспечивают адекватную стабильность, которые обеспечивают предельные сроки хранения лекарственной формы, являющиеся коммерчески жизнеспособными. Кроме того, соли щелочноземельных металлов и другие подщелачивающие добавки в композициях и лекарственных формах могут влиять на растворение лекарственного средства, что потенциально влияет на фармакокинетику лекарственного средства in vivo. Таким образом, остается желательным создание композиций аторвастатина, подходящих для изготовления стандартных дозированных форм, в которых адекватная чистота, стабильность и желательная скорость растворения, а также биодоступность лекарственного средства обеспечиваются при использовании минимальных уровней указанных материалов.
В целом целью настоящего изобретения является обеспечение приемлемой изменчивости активности между стандартными дозированными формами аторвастатина, изготовленными на высокоскоростном промышленном оборудовании, с использованием композиций и процессов, которые обеспечивают стабильные лекарственные формы аторвастатина. Еще одной целью настоящего изобретения является обеспечение устойчивости и стабильности с некристаллическими или аморфными формами аторвастатина.
Соответственно первым аспектом настоящего изобретения является стандартная дозированная форма, включающая аторвастатин или его фармацевтически приемлемую соль, изготовленная без стадии гранулирования, в которой измеренная активность аторвастатина в указанной стандартной дозированной форме демонстрирует относительное стандартное отклонение (RSD) для активности аторвастатина на стандартную дозированную форму не более чем приблизительно 7,8%, когда указанная стандартная дозированная форма изготовлена с производительностью более 10000 стандартных дозированных форм в час на один вид стандартной дозированной формы на одну машину.
Вторым аспектом настоящего изобретения является стандартная дозированная форма, включающая аторвастатин или его фармацевтически приемлемую соль, в комбинации с по меньшей мере одним активным лекарственным средством, изготовленная без стадии гранулирования, в которой измеренная активность аторвастатина в указанной стандартной дозированной форме демонстрирует относительное стандартное отклонение (RSD) для активности аторвастатина на стандартную дозированную форму не более чем приблизительно 7,8%, когда указанная стандартная дозированная форма изготовлена с производительностью более 10 000 стандартных дозированных форм в час на один вид стандартной дозированной формы на одну машину.
Третьим аспектом настоящего изобретения является способ изготовления таблеток или капсул аторвастатина или его фармацевтически приемлемой соли, включающий следующие стадии:
(а) изготовление композиции аторвастатина смешиванием аторвастатина или его фармацевтически приемлемой соли с одним или несколькими наполнителями, пригодных для использования без стадии гранулирования в мешалке; и
(b) наполнение таблетировочной пресс-формы или капсулы и прессование или герметизация таким образом, что измеренная активность аторвастатина демонстрирует относительное стандартное отклонение (RSD) для активности аторвастатина на таблетку или капсулу не более чем приблизительно 7,8%, когда указанные таблетки или капсулы изготовлены на таблетировочном прессе или на наполнительной машине для капсул таким образом, что более 10000 таблеток или капсул производится в час на одну машину.
Четвертым аспектом настоящего изобретения является способ изготовления таблеток или капсул аторвастатина или его фармацевтически приемлемой соли в комбинации с по меньшей мере одним лекарственным средством, включающий следующие стадии:
(а) изготовление композиции аторвастатина смешиванием аторвастатина или его фармацевтически приемлемой соли и по меньшей мере одного активного лекарственного средства с одним или несколькими наполнителями, пригодных для использования без стадии гранулирования в мешалке; и
(b) наполнение таблетировочной пресс-формы или капсулы и прессование или герметизация таким образом, что измеренная активность аторвастатина демонстрирует относительное стандартное отклонение (RSD) для активности аторвастатина на таблетку или капсулу не более чем приблизительно 7,8%, когда указанные таблетки или капсулы изготовлены на таблетировочном прессе или на наполнительной машине для капсул таким образом, что более 10000 таблеток или капсул производится в час на одну машину.
Пятым аспектом настоящего изобретения является терапевтическая упаковка или набор, подходящий для коммерческой продажи, включающий контейнер и терапевтически эффективное количество стандартных дозированных форм аторвастатина или его фармацевтически приемлемой соли, изготовленных без гранулирования.
Шестым аспектом настоящего изобретения является способ применения фармацевтических стандартных дозированных форм для лечения субъектов, страдающих гиперхолестеринемией и/или гиперлипидемией, остеопорозом, доброкачественной гиперплазией предстательной железы (ДГПЖ) и болезнью Альцгеймера.
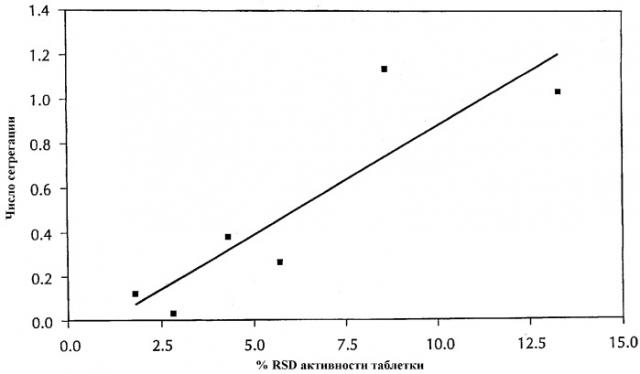
Настоящее изобретение далее описано следующими не ограничивающими примерами, которые относятся к прилагаемой фигуре 1, краткие подробности которой представлены ниже.
Чертеж показывает корреляцию между процентом относительного стандартного отклонения (% RSD) в активности для стандартных дозированных форм, изготовленных с использованием комбинации аторвастатина, стеарата магния и различных разбавителей, и числом сегрегации для указанных смесей.
Подробное описание изобретения
Аторвастатин можно легко получить, как описано в патентах Соединенных Штатов №№ 5273995 и 5969156, которые включены в настоящий документ в качестве ссылки. Гемикальциевая соль аторвастатина в настоящее время продается как Lipitor®.
Аторвастатин существует в ряде морфологических форм, варьирующих от высококристаллических форм до форм с различной степенью неупорядоченности. Некоторые из указанных неупорядоченных форм все же сохраняют некоторую структуру, как показывает порошковая рентгеновская дифракция. Для цели настоящего изобретения все формы аторвастатина выигрывают от изобретения и включаются в объем изобретения. Частично или полностью неупорядоченные формы аторвастатина особенно выигрывают от изобретения. Частично или полностью неупорядоченные формы аторвастатина, которые являются аморфными или преимущественно аморфными, более других выигрывают от настоящего изобретения. Указанные формы могут быть получены, например, из кристаллического аторвастатина с использованием процедур, описанных в патенте Соединенных Штатов № 6087511, который включен в настоящий документ в качестве ссылки. Альтернативно аморфный материал может быть получен согласно процессам, описанным в патентной заявке Соединенных Штатов, в обычной собственности, номер дела патентного поверенного РС25825. Для практического осуществления настоящего изобретения некристаллический и кристаллический аторвастатин можно получать любым способом, известным специалистам. Предпочтительные формы аторвастатина описаны в патентах Соединенных Штатов №№ 5969156, 6121461 и 6605729; и в международных патентных заявках WO 01/36384, WO 02/41834, WO 02/43732, WO 02/051804, WO 02/057229, WO 03/011826, WO 03/050085, WO 03/070702 и WO 04/022053, которые включены в настоящий документ в качестве ссылок.
Аторвастатин можно использовать в той форме, в которой он получен, или его можно подвергать обработке с использованием процесса, который изменяет физическую природу частиц. Например, материал можно размалывать с использованием любого процесса, известного специалистам. Неисключительные примеры указанных процессов включают механическое размалывание и струйное размалывание. Частицы, полученные как непосредственно в результате процесса формирования аморфного аторвастатина, так и с использованием размалывания, предпочтительно имеют средний диаметр частиц в пределах 1-100 мкм.
Фармацевтически приемлемые основно-аддитивные соли аторвастатина образуются с металлами или аминами, такими как щелочные и щелочноземельные металлы или органические амины. Примерами металлов, используемых в качестве катионов, являются натрий, калий, магний, кальций и т.п. Примерами подходящих аминов являются N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин и прокаин (см., например, Berge, S.M., et al., "Pharmaceutical Salts", J. Pharm. Sci., 1977; 66:1).
Основно-аддитивные соли аторвастатина получают контактированием свободной кислотной формы с достаточным количеством желаемого основания с получением соли обычным способом. Кроме того, аторвастатин может существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Объем настоящего изобретения охватывает указанные солевые и сольватированные формы аторвастатина.
Формы аторвастатина, которые являются по меньшей мере несколько неупорядоченными или которые представляют собой смесь кристаллической и неупорядоченной формы аторвастатина, более других выигрывают от настоящего изобретения. Под несколько неупорядоченными формами подразумевается, что ширина линии (ширина пика на половине высоты пика) любого из пиков, измеренных с использованием порошковой рентгеновской дифракции (PXRD), имеет 2 тета-величины, превышающих приблизительно 2°. Аморфные или преимущественно аморфные формы аторвастатина, которые особенно выигрывают от настоящего изобретения, характеризуются наличием очень широких, не имеющих характерных особенностей пиков. Следует заметить, что комбинации кристаллических и по меньшей мере несколько неупорядоченных форм аторвастатина демонстрируют как острые (т.е., менее 2° величины для 2 тета), так и широкие (т.е., более 2°) пики, и указанные комбинации форм выигрывают от настоящего изобретения.
Аторвастатин, как было установлено, представляет собой эффективное лекарственное средство даже в относительно низких дозах. Фактически, поддерживая для данного пациента низкую дозу, возможно минимизировать побочные эффекты, в то же время сохраняя эффективность лекарственного средства. Таким образом, желательно получение аторвастатина в форме, способной обеспечивать низкую дозу для пациента. Для целей настоящего изобретения доза, обеспечиваемая конечной лекарственной формой аторвастатина, предпочтительно составляет от 0,5 до 120 мгА (где мгА означает миллиграммы активного лекарственного средства на основе свободной кислоты); более предпочтительно от 5 до 80 мгА.
Для удобства и простоты соблюдения пациентом режима и схемы лечения большинство лекарственных средств доставляется в форме стандартных дозированных форм. Для твердых лекарственных веществ указанные стандартные дозированные формы обычно находятся в форме таблеток, капсул, саше, жевательных таблеток и быстрорастворимых лекарственных форм. В настоящем изобретении лекарственная форма предпочтительно имеет форму капсулы или таблетки; наиболее предпочтительно имеет форму таблетки. Изготовление указанных форм включает необходимую стадию наполнения порошком, или по объему или по весу. Например, при изготовлении таблеток и капсул порошком по объему наполняют пресс-форму или капсулу соответственно. Для того чтобы стандартные дозированные формы имели одинаковую активность (т.е. количество лекарственного средства на стандартную дозированную форму) в допустимых пределах (относительное стандартное отклонение, RSD, менее 6% для удовлетворения требований стадии I и менее 7,8% для удовлетворения требований стадии II Фармакопеи Соединенных Штатов, USP, руководство), не должна иметь место сколько-нибудь значительная сегрегация активного лекарственного средства и наполнителей. Это особенно важно в случае сильно разбавленных форм. Настоящее изобретение описывает композиции, которые обеспечивают воспроизводимую активность для фиксированного веса активного аторвастатина плюс наполнители без необходимости гранулирования. Более того, указанный контроль активности производится в течение всего процесса изготовления продукта. Указанные композиции обеспечивают аторвастатин с изменчивостью активности (мгА на грамм смеси) менее чем RSD 7,8%; более предпочтительно менее 6,0%. Помимо этого, настоящие композиции обеспечивают хорошую текучесть порошка, таким образом, что контроль веса продолжается между стандартными дозированными формами при использовании указанных композиций. Предпочтительно указанные композиции обеспечивают стандартные дозированные формы с контролем веса в пределах RSD 6%; более предпочтительно в пределах 5%; наиболее предпочтительно в пределах 4%. Объединение контроля веса и контроля активности позволяет настоящим композициям обеспечивать стандартные дозированные формы с истинной активностью аторвастатина на стандартную дозированную форму, имеющие RSD предпочтительно менее 7,8%; более предпочтительно менее 6,0%. То, что указанные стандарты удовлетворяются без гранулирования, обеспечивает более эффективный процесс производства путем уменьшения количества отдельных операций по сравнению с процессами, включающими в себя гранулирование. При изготовлении стандартных дозированных форм аторвастатина без стадии гранулирования возможным является производство указанных стандартных дозированных форм без использования для указанных композиций процессов, неудобных для коммерческого производства. Например, отдельные ингредиенты можно было бы взвешивать непосредственно в капсулу. Настоящее изобретение, таким образом, предпочтительно используется в сочетании с высокоскоростным производственным оборудованием. Более конкретно предпочтительные композиции позволяют осуществлять контроль активности стандартных дозированных форм до менее чем 7,8% RSD (более предпочтительно менее 6,0% RSD) при использовании производственного оборудования для изготовления отдельной стандартной дозированной формы с производительностью более 10000 стандартных дозированных форм в час; более предпочтительно более 25000 стандартных дозированных форм в час; еще более предпочтительно более 50000 стандартных дозированных форм в час. Предпочтительным оборудованием или машинами для изготовления стандартных дозированных форм являются ротационные таблетировочные прессы и коммерческое оборудование для наполнения капсул. Неисключительные примеры коммерческих ротационных таблетировочных прессов включают прессы, произведенные компаниями Niro Pharma Systems (Columbia, MD), Kilian and Company (Horsham, PA), Korsch (Берлин, Германия) и Elizabet-Hata International (North Huntingdon, PA). Неисключительные примеры коммерческого оборудования для наполнения капсул включают оборудование, произведенное компаниями Capsugel (Morris Plains, NJ) и CapPlus Technologies (Phoenix, AZ).
Измерение активности стандартных дозированных форм аторвастатина является необходимым для определения изменчивости активности между стандартными дозированными формами. Процесс экстракции по сравнению со стандартом с независимо известными уровнями лекарственного средства наилучшим образом определяет указанную активность. Анализ активности лучше проводить с использованием высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ), известной специалистам, при сравнении со стандартами. Измерения RSD для целей настоящего изобретения лучше выполнять с использованием отбора образцов во время процесса изготовления стандартной дозированной формы. Более конкретно образцы стандартных дозированных форм можно отбирать во время процесса изготовления в различные периоды времени (в начале, в середине и в конце производственного цикла). При определении величины RSD по меньшей мере три стандартные дозированные формы отбирают для измерений из каждой секции. Альтернативная аналитическая методика для определения активности образца лекарственного средства включает использование спектроскопии с поглощением света ультрафиолетового и видимого спектров. В данной методике поглощение, соответствующее аторвастатину, используют для количественного определения концентрации аторвастатина в образце (принимая меры для того, чтобы наполнитель не создавал помехи поглощения), как это известно специалистам.
Настоящее изобретение относится к способам и композициям, которые обеспечивают аторвастатин в чистой и стабильной форме. Термин «примеси» описывает материалы в веществе лекарственного средства, присутствующие как результат процесса синтеза и очистки, и любые материалы на основе лекарственного средства, образованные при изготовлении стандартной дозированной формы. Термин «продукты разложения» относится к любым материалам на основе лекарственного средства, образованным после изготовления стандартной дозированной формы. Анализ примесей и продуктов разложения производят с использованием методики ВЭЖХ с обращенной фазой в экстрагированных образцах, как это известно специалистам. Расчеты количества примесей и продуктов разложения выражают как процент объединенной площади пика (пиков) продукта разложения или примеси, деленный на процент объединенной площади всех пиков, связанных с лекарственным средством.
В композиции аторвастатина без гранулирования используют комбинации разбавителей, связующих агентов, разрыхлителей, корригентов и смазывающих агентов для обеспечения свойств, необходимых для стандартной дозированной формы, как это известно специалистам. Например, для изготовления таблеток комбинация обеспечивает адекватную твердость таблеток после прессования, в то же время обеспечивая быстрый распад in vivo. Несмотря на то что существует высокая степень свободы при создании композиций аторвастатина, которые отвечают указанным требованиям, обычно указанные композиции содержат приблизительно 1-40 мас.%:мас.% (м:м) лекарственного средства, приблизительно 5-10% разрыхлителя, приблизительно 0-10% связующего агента и приблизительно 0,5-2% смазывающего агента, а оставшаяся процентная доля включает разбавители по настоящему изобретению. Предпочтительные разрыхлители включают карбоксиметилцеллюлозу, гидроксипропилцеллюлозу (малозамещенную), микрокристаллическую целлюлозу, порошкообразную целлюлозу, коллоидный диоксид кремния, натрий-кроскармеллозу, кросповидон, силикат магния-алюминия, метилцеллюлозу, полакрилин-калий, повидон, альгинат натрия, гликолят натрий-крахмала и крахмалы. Предпочтительные связующие агенты включают аравийскую камедь, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, декстрин, желатин, гуаровую камедь, гидроксипропилметилцеллюлозу, силикат магния-алюминия, мальтодекстрин, метилцеллюлозу, полиэтиленоксид, полиметакрилаты, повидон, альгинат натрия, крахмалы и зеин. Предпочтительные смазывающие агенты включают стеарат кальция, глицерилпальмитостеарат, оксид магния, полоксамер, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, лаурилсульфат натрия, стеарилфумарат натрия, стеариновую кислоту, тальк, стеарат цинка и стеарат магния.
При изготовлении композиций аторвастатина в формах, подходящих для изготовления стандартных дозированных единиц без гранулирования, лекарственное средство и наполнители обычно смешивают в виде порошков. Указанное смешивание можно осуществлять с использованием любых методик смешивания, известных специалистам. Смешивание предпочтительно осуществляют с использованием высокоскоростной мешалки, V-блендера (или другого блендера с двойным кожухом), блендера с бункером или мешалки - встряхивающего устройства TurbulaTM. Смешивание обычно осуществляют сначала без добавления смазывающего агента в течение времени, достаточного для осуществления полного смешивания. В указанный момент обычно добавляют смазывающий агент с последующим коротким (около 1-10 минут) дополнительным периодом перемешивания. После получения смеси изготавливают стандартные дозированные формы с использованием процедур, известных специалистам. Предпочтительно стандартные дозированные формы изготавливают на ротационных таблетировочных прессах или машинах для наполнения капсул. Изготовленные таким способом лекарственные формы затем необязательно покрывают пленкой, обеспечивающей легкое проглатывание, патентованный или идентификационный внешний вид и/или защиту лекарственной формы. Конечную лекарственную форму затем упаковывают с использованием процедур, известных специалистам. Для настоящего изобретения пакование предпочтительно осуществляют в форме блистерных упаковок из фольги, получаемых холодным формованием, пластиковых блистерных упаковок или запечатанных бутылочек, содержащих десиканты. Необязательно, упаковка может содержать материалы, поглощающие активный кислород, такие, которые описаны в ЕР 1243524 А2 и ЕР 1241110 А1, которые включены в настоящий документе в качестве ссылок.
Стандартные дозированные формы аторвастатина, которые изготовлены без стадии гранулирования с предпочтительными наполнителями, демонстрируют низкие уровни связанных с лекарственным средством примесей и продуктов разложения. Неожиданно было установлено, что указанный низкий уровень примесей и продуктов разложения имеет место даже в отсутствие добавленных подщелачивающих агентов или солей щелочноземельных металлов. Еще более удивительно, что указанный низкий уровень примесей и продуктов разложения сохранялся, даже когда использовавшийся аторвастатин представлял собой по меньшей мере несколько неупорядоченную форму лекарственного средства. В частности, было установлено, что в то время как изготовленные с использованием влажного гранулирования контрольные стандартные дозированные формы аторвастатина демонстрируют высокие уровни разложения лекарственного средства, стандартные дозированные формы, изготовленные без гранулирования, имеют более высокую стабильность. Предпочтительными являются такие стандартные дозированные формы аторвастатина, изготовленные без гранулирования, которые содержат более приблизительно 2% всех связанных с лекарственным средством примесей и/или продуктов разложения на основе процента площади примесей/продуктов разложения по сравнению с объединенной площадью всех пиков, связанных с лекарственным средством, по результатам ВЭЖХ; более предпочтительно они содержат менее 1%, еще более предпочтительно менее 0,7%. Помимо этого предпочтительными являются такие стандартные дозированные формы аторвастатина, изготовленные без гранулирования, которые обеспечивают стабильность при хранении при 40°С и 75% относительной влажности (RH) в течение четырех недель, стандартные дозированные формы содержат не более приблизительно 2% всех связанных с лекарственным средством примесей и/или продуктов разложения на основе процента площади примесей/продуктов разложения по сравнению с объединенной площадью всех пиков, связанных с лекарственным средством, по результатам ВЭЖХ; более предпочтительно они содержат менее 1%, еще более предпочтительно менее 0,7%.
Разложение аторвастатина происходит двумя главными путями: лактонизацией и окислением. Лактон образуется путем внутренней конденсации (потери воды) спирта и карбоновой кислоты с образованием шестичленного кольца. Оно представляет собой главный продукт разложения аморфного аторвастатина, который обнаруживают после влажного гранулирования и изготовления таблеток, как описано в патентах Соединенных Штатов №№5686104 и 6126971, особенно в отсутствие добавок в виде солей щелочноземельных металлов. Заявители неожиданно установили, что уровень лактона в стандартных дозированных формах, как исходно, так и после хранения в ускоряющих старение условиях повышенной температуры и влажности, может быть значительно уменьшен комбинированием настоящих наполнителей и изготовления стандартных дозированных форм без процесса гранулирования. В качестве таковых предпочтительными являются такие стандартные дозированные формы аторвастатина, изготовленные без стадии гранулирования, у которых уровень лактона аторвастатина составляет менее 2% (на основе соотношения объединения пиков лактона и объединенных площадей общих связанных с лекарственным средством пиков, по результатам ВЭЖХ), после изготовления указанных стандартных дозированных форм и их хранения при 40°/75% RH (где RH представляет собой относительную влажность) в течение четырех недель; более предпочтительно менее 1%.
Для минимизации проблем биодоступности и потенциальных взаимодействий с другими лекарственными средствами в комбинированных лекарственных формах в практике настоящего изобретения уровень солей щелочноземельных металлов в композиции предпочтительно составляет приблизительно 0-5% (м:м); более предпочтительно приблизительно 0-2%; наиболее предпочтительно приблизительно 0-1%. Также предпочтительно, чтобы уровень других подщелачивающих агентов в композиции составлял приблизительно 0-5% (м:м); более предпочтительно приблизительно 0-3%; наиболее предпочтительно приблизительно 0-2%. Также предпочтительно, чтобы уровни полимерных амидов или полимерных аминов составляли менее приблизительно 0-5% (м:м); более предпочтительно приблизительно 0-3%; наиболее предпочтительно приблизительно 0-2% композиции. Примеры указанных полимеров описаны в международной патентной заявке WO 01/76566 А1.
Подщелачивающие агенты представляют собой добавки или наполнители, которые обладают свойством повышать рН композиции, когда указанные композиции добавляют к воде. Примеры подщелачивающих агентов включают неорганические и органические основания (буферы). Примеры неорганических подщелачивающих агентов включают цитрат, карбонат, бикарбонат, фосфат, сульфат, бензоат и аскорбат натрия или калия, и карбонат кальция и карбонат магния. Два последних агента также представляют собой примеры солей щелочноземельных металлов. Примеры органических подщелачивающих агентов включают амины. Конкретные примеры аминов включают N-метилглюкамин, гуанин и аргинин.
Один из распространенных механизмов сегрегации частиц представляет собой процесс «просеивания». Просеивание представляет собой процесс, посредством которого малые частицы продвигаются через матрикс более крупных частиц или наоборот. Указанная форма сегрегации будет происходить, если разница в размерах частиц является достаточной (всего 30% разница в размерах может быть связана с просеиванием), материалы не связаны друг с другом, и это является механизмом межчастичного движения. При изготовлении лекарственных форм межчастичное движение может наблюдаться во время смешивания или течения порошка. Использование аторвастатина и наполнителей, имеющих сходные размеры частиц, будет потенциально предотвращать сегрегацию между материалами во время изготовления стандартных дозированных форм, однако это может быть проблематичным по ряду причин. Как обсуждается ниже, для того чтобы обеспечить адекватную текучесть порошка, средние размеры частиц наполнителей предпочтительно составляют приблизительно 80-360 мкм в диаметре. Напротив, средний размер частиц аторвастатина предпочтительно составляет приблизительно 1-100 мкм в диаметре. Указанный размер является предпочтительным в силу простоты изготовления, воспроизводимости растворения лекарственного средства (биодоступности) и для улучшения изменчивости активности лекарственной