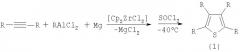Способ получения 2,3,4,5-тетраалкилтиофенов
Иллюстрации
Показать всеИзобретение относится к органической химии, в частности к способу получения 2,3,4,5-тетраалкилтиофенов, которые могут найти применение в пищевой промышленности в качестве биологически активных соединений, красителей, присадок к маслам и гидравлическим жидкостям. Сущность способа заключается во взаимодействии дизамещенных ацетиленов с R'AlCl2 и SOCl2 в присутствии металлического Mg и катализатора цирконацендихлорида в атмосфере аргона в тетрагидрофуране в течение 11-15 часов. Предложенный способ по упрощенной технологии с использованием легкодоступного и нетоксичного сырья позволяет получить целевой продукт с выходом порядка 47-54%. 1 табл.
Реферат
Предлагаемое изобретение относится к органической химии, конкретно к усовершенствованному способу получения 2,3,4,5-тетраалкилтиофенов общей формулы (1):
где R=С2Н3, н-С3Н7, н-С4Н9
Замещенные тиофены могут найти применение в пищевой промышленности в качестве компонентов усилителей аромата пищи, биологически активных соединений, красителей, присадок к маслам и гидравлическим жидкостям.
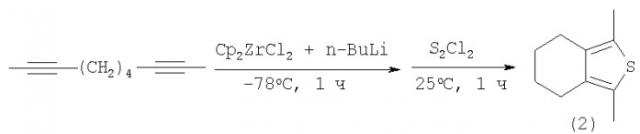
Известен способ ([1], R.J.Fagan, W.A.Nugent, J.C.Calabrese. Metallacycle transfer from zirconium to main group elements: A versatile synthesis of heterocycles // JACS, V.116, 5, (1994), 1880-1890) получения тетразамещенных тиофенов (2) с выходом ˜55% взаимодействием α,ω-диацетиленов с бис-циклопентадиенилцирконийдихлоридом и бутиллитием (n-BuLi), с последующей обработкой реакционной массы полухлористой серой (S2Cl2) за 1 ч по схеме:
Известным способом не могут быть получены 2,3,4,5-тетраалкилтиофены (1).
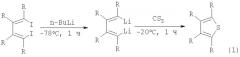
Известен способ ([2], J.Chen, Q.Song, Z.Xi. Novel reaction patterns of carbon disulfide with organolithium compounds via cleavage of C=S bonds or via cycloaddition reactions // Tetrahedron Lett., 43 (2002), 3533-3535) получения тетраалкилтиофенов взаимодействием 1,4-дилитио-1,3-диенов, приготовленных обработкой 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов бутиллитием (n-BuLi) при температуре -78°С в течение 1 ч, с сероуглеродом при -20°С за 1 ч с выходом 52-68% по схеме:
Известный способ синтеза 2,3,4,5-тетраалкилтиофенов (1) предполагает использование труднодоступных 1,4-дииодо-1,3-бутадиенов, пирофорного n-BuLi и сероуглерода (CS2), представляющего из себя легковоспламеняющуюся, легколетучую и высокотоксичную жидкость, кроме того в ходе реакции необходимо поддерживать низкую температуру -78°С.
Предлагается усовершенствованный способ синтеза 2,3,4,5-тетраалкилтиофенов (1).
Сущность способа заключается во взаимодействии дизамещенных ацетиленов формулы R-≡-R, где R=С2Н5, н-С3Н7, н-С4Н9, с R'AlCl2 (R'=С2Н5, Cl) и металлического Mg в присутствии катализатора цирконацендихлорида Cp2ZrCl2, взятыми в мольном соотношении R-≡-R:R'AlCl2:Mg:Cp2ZrCl2=10:(6-10):(6-10):(1.0-1.4), предпочтительно 10:8:8:1.2, в течение 8 ч, с последующим добавлением при -40°С тионилхлорида (SOCl2) в эквимольном количестве по отношению к R'AlCl2 и перемешиванием реакционной массы в течение 1 ч. Далее температуру доводят до комнатной и перемешивают еще 2-6 ч. Реакцию проводят в атмосфере аргона и атмосферном давлении. Общее время реакции 11-15 ч, выход целевых продуктов 39-54%. В качестве растворителя необходимо использовать тетрагидрофуран, в других эфирных растворителях (эфир, диоксан) выход целевых продуктов (1) значительно снижается.
Реакция протекает по схеме:
R=C2H5, н-C3H7, н-C4H9; R'=С2Н5, Cl
Целевые продукты (1) образуются только лишь с участием дизамещенного ацетилена, R'AlCl2, тионилхлорида (SOCl2) и катализатора Cp2ZrCl2. В присутствии других катализаторов на основе комплексов переходных металлов (например, Zr(acac)4, Cp2TiCl2, Pd(acac)2, Ni(acac)2, Fe(асас)3) целевые продукты (1) не образуются.
Проведение реакции в присутствии катализатора Cp2ZrCl2, взятого в количестве больше 14 мол. % по отношению к ацетилену, не приводит к существенному увеличению выхода целевых продуктов (1). Использование в реакции катализатора Cp2ZrCl2 в количестве менее 10 мол.% снижает выход (1), что связано со снижением каталитически активных центров в реакционной массе.
Изменение соотношения исходных реагентов в сторону увеличения содержания R'AlCl2 по отношению к ацетилену не приводит к значительному повышению выхода целевых продуктов (1). Снижение количества R'AlCl2 по отношению к ацетилену уменьшает выход (1).
Существенные отличия предлагаемого способа:
1. В предлагаемом способе используются в качестве исходных соединений дизамещенный ацетилен, R'AlCl2, SOCl2 и катализатор Cp2ZrCl2. В известном способе тетраалкилтиофены (1) получают из 1,4-дииодобутадиенов, бутиллития и сероуглерода.
Предлагаемый способ обладает следующими преимуществами:
1. Способ позволяет получать с высокой селективностью 2,3,4,5-тетраалкилтиофены (1) без использования труднодоступных 1,4-дииодобутадиенов, пирофорного н-BuLi и высокотоксичного сероуглерода CS2.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 10 мл ТГФ, 1,2 ммоль Cp2ZrCl2, 10 ммоль гекс-3-ина, 8 мг-ат. металлического Mg и при температуре ˜0°С 8 ммоль R'AlCl2. Температуру доводят до комнатной и перемешивают 8 ч. Далее реакционную массу охлаждают до -40°С, добавляют 8 ммоль тионилхлорида SOCl2 и перемешивают 1 ч. Затем температуру доводят до комнатной, перемешивают еще 4 ч. Получают индивидуальный 2,3,4,5-тетраэтилтиофен (1) с выходом 48%. Спектральные характеристики 2,3,4,5-тетрапропилтиофена (1).
| Спектр ЯМР 13С(δ, м.д.): 13.56 (С11,13), 14.24 (С7,9), 29.36 (С6,8), 30.18 (С10,12), 135.23 (С2,5), 136.75 (С3,4). |
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | |||||
| №№ п/п | R-≡-R | R'AlCl2 | Мольное соотношение RC≡CR:R'AlCl2:Mg:SOCl2:Cp2ZrCl2, ммоль | Общее время реакции, час | Выход (1), % |
| 1 | гекс-3-ин | R'=Cl | 10:8:8:8:1.2 | 13 | 48 |
| 2 | " | " | 10:10:10:10:1.2 | 13 | 52 |
| 3 | " | " | 10:6:6:6:1.2 | 13 | 45 |
| 4 | " | " | 10:8:8:8:1.4 | 13 | 54 |
| 5 | " | " | 10:8:8:8:1.0 | 13 | 39 |
| 6 | " | " | 10:8:8:8:1.2 | 15 | 51 |
| 7 | " | " | 10:8:8:8:1.2 | 11 | 43 |
| 8 | окт-4-ин | " | 10:8:8:8:1.2 | 13 | 44 |
| 9 | дец-5-ин | " | 10:8:8:8:1.2 | 13 | 42 |
| 10 | гекс-3-ин | R'=C2H5 | 10:8:8:8:1.2 | 13 | 47 |
Все опыты проводили в тетрагидрофуране.
Способ получения 2,3,4,5-тетраалкилтиофенов общей формулы (1)
,
где R=C2H5, н-С3Н7, н-С4Н9,
отличающийся тем, что дизамещенный ацетилен общей формулы R-≡-R, где R=С2Н5, н-С3Н7, н-С4Н9, подвергают взаимодействию с R'AlCl2, где R'=C2H5, Cl, в присутствии металлического Mg и катализатора цирконацендихлорида Cp2ZrCl2 в мольном соотношении R-≡-R : R'AlCl2 : Mg : Cp2ZrCl2=10 : 6-10 : 6 : 10 : 1,0-1,4 в тетрагидрофуране в атмосфере аргона при нормальном давлении и комнатной температуре в течение 8 ч с последующим добавлением при -40°С тионилхлорида SOCl2, взятого в эквимольном количестве по отношению к R'AlCl2 и перемешиванием в течение 1 ч, дальнейшим доведением температуры до комнатной и последующим перемешиванием еще в течение 2-6 ч.