Киназа pim-3 в качестве мишени для сахарного диабета типа 2
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в фармацевтической промышленности. Предусматривается применение PIM-3 в качестве агента для идентификации лекарственных средств против сахарного диабета типа 2. Использование изобретения обеспечивает лекарственные средства против диабета типа 2, влияющие на уровень экспрессии PIM-3. 2 з.п. ф-лы, 11 табл.
Реферат
Настоящее изобретение относится к новому применению киназы PIM-3, к новым подтипам киназы PIM-3 и их применению.
Известно, что крысиная PIM-3 (первоначально обозначенная как KID-1, KID "индуцируемая деполяризацией киназа"), PIM-1 лягушки и человеческая и мышиная PIM-1 все обладают серин/треонин протеинкиназной активностью при анализах фосфорилирования in vitro. Высокое сходство полипептидных последовательностей человеческой, мышиной и крысиной PIM-3, PIM-1 лягушки и человеческой и мышиной PIM-1 демонстрирует то, что человеческая и мышиная PIM-3 представляют собой серин/треониновые протеинкиназы.
Крысиная PIM-3 описана у Feldman, J. D. et al. (J. Biol. Chem. (1998) 273, 16535-16543). Крысиная PIM-3 индуцируется в особых областях гиппокампа и коры в ответ на каиновую кислоту и электросудорожный шок, что означает, что PIM-3 вовлечена в деятельность нейронов, синаптическую пластичность, обучение и память, а также в судороги, вызванные каиновой кислотой, и некоторые заболевания, связанные с нервной системой, такие как припадки и эпилепсия.
Также к киназе PIM-3 относится US 6143540, Konietzko, U. et al. (EMBO (1999) 18, 3359-3369) и Eichmann, A. (Oncogene (2000) 19, 1215-1224).
Настоящее изобретение относится к новым кодирующим PIM-3 последовательностям и к новым применениям PIM-3.
Настоящее изобретение относится к новой последовательности человеческой и мышиной PIM-3. SEQ ID NO: 1 представляет собой последовательность ДНК, а SEQ ID NO: 2 - предсказанную аминокислотную последовательность человеческой PIM-3. Открытая рамка считывания SEQ ID NO: 1 расположена от нуклеотида 17 до нуклеотида 995 (SEQ ID NO: 3).
SEQ ID NO: 5 представляет собой последовательность ДНК, а SEQ ID NO: 6 - предсказанную аминокислотную последовательность мышиной PIM-3. Открытая рамка считывания SEQ ID NO: 5 расположена от нуклеотида 199 до нуклеотида 1177 (SEQ ID NO: 7).
Настоящее изобретение в двух независимых моделях резистентности к инсулину демонстрирует то, что экспрессия гена PIM-3 в жировых клетках уменьшается. Лечение активатором инсулина вызывает увеличение экспрессии гена PIM-3 в мышиных клетках 3T3-L1. Так как человеческая и мышиная PIM-3 представляют собой видовые ортологи крысиной PIM-3, человеческая и мышиная PIM-3 вовлечены в некоторые или все из процессов и заболеваний, в которые вовлечена крысиная PIM-3. PIM-3, в частности человеческая и мышиная PIM-3, вовлечены в развитие резистентности к инсулину. Кроме того, PIM-3, в частности человеческая и мышиная PIM-3, вовлечены в развитие сахарного диабета типа 2. Кроме того, паралоги человеческой и мышиной PIM-3, белки PIM-1 представляют собой протоонкогены. Следовательно, PIM-3, в частности человеческая и мышиная PIM-3, вовлечены в регуляцию клеточного роста, канцерогенез и связанные пути и заболевания.
Настоящее изобретение относится к применению кодирующих PIM-3 молекул нуклеиновых кислот, белков PIM-3 и гомологичных белков в a) скринирующих анализах для идентификации соединений, модулирующих резистентность к инсулину или сахарный диабет типа 2; b) диагностических анализах для выявления резистентности к инсулину или сахарного диабета типа 2 (например, хромосомное картирование, типирование тканей, судебная медицина); c) прогностической терапии (прогнозирование резистентности к инсулину или сахарного диабета типа 2, например, посредством диагностических анализов, прогностических анализов, мониторинга клинических испытаний и фармакогеномики).
В частности, настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность SEQ ID NO: 1. Кроме того, настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность SEQ ID NO: 3.
Настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, выбранную из:
a) SEQ ID NO: 5;
b) SEQ ID NO: 7;
c) последовательности ДНК, гибридизующейся с SEQ ID NO: 5 или SEQ ID NO: 7; и
d) последовательностей ДНК, которые являются вырожденными вследствие вырожденности генетического кода относительно последовательностей, определенных в a), b) и c) и которые кодируют полипептид типа PIM-3.
Настоящее изобретение дополнительно относится к векторам и клеткам-хозяевам, содержащим соответствующие последовательности ДНК или их части.
Настоящее изобретение относится к полипептидам, обладающим активностью PIM-3, при этом указанные полипептиды выбраны из:
a) полипептида с аминокислотной последовательностью SEQ ID NO: 6,
b) полипептида, который относительно a), не содержит одной или более аминокислот,
c) полипептида, у которого относительно a), одна или более аминокислот замещены другими аминокислотами,
d) полипептида, у которого относительно a), к последовательности добавлены одна или более аминокислот,
e) гибридного полипептида, включающего аминокислотную последовательность, содержащую все или часть аминокислот последовательности SEQ ID NO: 6. Предпочтительно, согласно c), замещены не более чем 10 аминокислот.
Настоящее изобретение относится к применению PIM-3 в качестве средства для скрининга для определения лекарственных средств против сахарного диабета, например применению кодирующей PIM-3 ДНК или полипептида с активностью PIM-3 для такой цели.
Настоящее изобретение дополнительно относится к применению PIM-3 для получения лекарственного средства для лечения резистентности к инсулину или сахарного диабета типа 2 и к применению PIM-3 для прогнозирования резистентности к инсулину или сахарного диабета типа 2.
Белок PIM-3, взаимодействующий с другими клеточными белками можно, таким образом, применять как мишень для разработки терапевтических молекул для регуляции белка PIM-3 в клетках, экспрессирующих белок PIM-3 или клетках, вовлеченных в пути передачи сигнала PIM-3, например жировых клетках. Молекулы нуклеиновых кислот по изобретению можно применять для экспрессии белка PIM-3 (например, посредством рекомбинантного экспрессионного вектора в клетке-хозяине в генотерапевтических применениях), для выявления мРНК PIM-3 (например, в биологическом образце) или генетического повреждения в гене PIM-3 и для регуляции активности PIM-3.
Белки PIM-3 можно применять для скрининга лекарственных средств или соединений, регулирующих активность или экспрессию PIM-3, а также для лечения заболеваний, характеризующихся недостаточностью или избыточной продукцией белка PIM-3 или продукцией форм белка PIM-3, обладающих сниженной или ненормальной по сравнению с белком PIM-3 дикого типа активностью.
Изобретение относится к способам (также обозначаемым здесь как "скринирующий анализ") для идентификации регуляторов, например соединений-кандидатов или тестируемых соединений или средств (например, пептидов, пептидомиметиков, низкомолекулярных соединений или других лекарственных средств), связывающих белки PIM-3 или обладающих стимулирующим или ингибирующим действием, например, на экспрессию PIM-3 или активность PIM-3.
В одном осуществлении данное изобретение относится к анализам скрининга соединений-кандидатов или тестируемых соединений, которые связывают белок PIM-3 или полипептид или его биологически активную часть или регулируют его активность. Тестируемые соединения по настоящему изобретению можно получить с применением любых из многочисленных подходов к способам комбинаторных библиотек, известных в данной области, включающих: биологические библиотеки, пространственно адресуемые параллельные библиотеки в твердой и жидкой фазах, способы синтетических библиотек, в которых требуется обратное преобразование, способ библиотек "одна гранула - одно соединение" и способы синтетических библиотек с применением отбора при помощи аффинной хроматографии.
В одном осуществлении анализ по настоящему изобретению представляет собой анализ в бесклеточной системе, включающий контактирование белка PIM-3 или его биологически активной части с тестируемым соединением и определение способности тестируемого соединения связываться с белком PIM-3 или с его биологически активной частью. Связывание тестируемого соединения с белком PIM-3 можно определить или прямым способом или косвенным.
В другом осуществлении анализ включает контактирование белка PIM-3 или его биологически активной части с известным соединением, которое связывает PIM-3 с формированием смеси для анализа, контактирование смеси для анализа с тестируемым соединением и определение способности тестируемого соединения взаимодействовать с белком PIM-3, при этом определение способности тестируемого соединения взаимодействовать с белком PIM-3 включает определение способности тестируемого соединения к предпочтительному связыванию с PIM-3 или его биологически активной частью в сравнении с известным соединением.
В другом осуществлении анализ представляет собой бесклеточный анализ, включающий контактирование белка PIM-3 или его биологически активной части с тестируемым соединением и определение способности тестируемого соединения регулировать (например, стимулировать или ингибировать) активность белка PIM-3 или его биологически активной части. Определение способности тестируемого соединения регулировать активность PIM-3 можно проводить, например, посредством определения способности белка PIM-3 связываться с молекулой-мишенью PIM-3, что означает определение прямого связывания. В альтернативном осуществлении определение способности тестируемого соединения регулировать активность PIM-3 можно проводить посредством определения способности белка PIM-3 дополнительно регулировать молекулу-мишень для PIM-3. Например, можно определить каталитическую/ферментативную активность молекулы-мишени на соответствующем субстрате.
В другом осуществлении бесклеточный анализ включает контактирование белка PIM-3 или его биологически активной части с известным соединением, которое связывается с PIM-3 с формированием смеси для анализа, контактирования смеси для анализа с тестируемым соединением и определение способности тестируемого соединения взаимодействовать с белком PIM-3, при этом определение способности тестируемого соединения взаимодействовать с белком PIM-3 включает определение способности белка PIM-3 к предпочтительному связыванию с молекулой-мишенью PIM-3 или к регуляции ее активности.
Также можно провести анализ фосфорилированного субстрата с фосфоаминокислотами для определения того, какие остатки на субстрате PIM-3 являются фосфорилированными. Коротко, полосу белка, фосфорилированного радиоактивным фосфором, можно вырезать из геля с SDS и подвергнуть частичному кислотному гидролизу. Затем продукты можно разделить одномерным электрофорезом и анализировать, например, на фосфоимейджере и сравнить с окрашенными нингидрином стандартами фосфоаминокислот.
В другом осуществлении изобретения бесклеточный анализ определяет способность белка PIM-3 фосфорилировать молекулу-мишень для PIM-3, например, посредством киназного анализа in vitro. Коротко, молекулу-мишень для PIM-3, например, иммунопреципитированную молекулу-мишень для PIM-3 из клеточной линии, экспрессирующей такую молекулу, можно инкубировать с белком PIM-3 и радиоактивным АТФ.
В другом осуществлении анализ представляет собой анализ, основанный на системе с клетками в котором клетки, экспрессирующие растворимую форму белка PIM-3 или его биологически активную часть, контактируют с тестируемым соединением и определяют способность тестируемого соединения связываться с белком PIM-3. Например, клетка может представлять собой клетку дрожжей или клетку, происходящую от млекопитающих. Определение способности тестируемого соединения связываться с белком PIM-3 можно проводить, например, посредством присоединения к тестовому соединению радиоизотопа или ферментной метки, так что связывание тестируемого соединения с белком PIM-3 или его биологически активной частью можно определить посредством детекции меченого соединения в комплексе, например, с 125I, 35S, 14C или 3H или ферментативно, например, с пероксидазой хрена, щелочной фосфатазой или люциферазой.
В другом осуществлении анализ представляет собой анализ, основанный на системе с клетками, включающий контактирование клеток, экспрессирующих растворимую форму белка PIM-3 или его биологически активную часть с тестируемым соединением и определение способности тестируемого соединения регулировать (например, стимулировать или ингибировать) активность белка PIM-3 или его биологически активной части. Определение способности тестируемого соединения регулировать активность PIM-3 или его биологически активной части можно проводить, например, посредством определения способности белка PIM-3 связываться или взаимодействовать с молекулой-мишенью PIM-3.
Как используют здесь, "молекула-мишень" представляет собой молекулу, с которой PIM-3 связывается или взаимодействует в природных условиях, например, молекулу субстрата, фосфорилируемого белком PIM-3 во внутреннем пространстве клетки, экспрессирующей белок PIM-3, внутриклеточные домены трансмембранных рецепторов, молекулу, связанную с внутренней поверхностью клеточной мембраны или цитоплазматическую молекулу. Молекула-мишень PIM-3 может представлять собой молекулу, не являющуюся PIM-3 или белком или полипептидом PIM-3 по настоящему изобретению. В одном осуществлении молекула-мишень PIM-3 представляет собой компонент пути передачи сигнала, опосредующего передачу сигнала.
В одном осуществлении определение способности белка PIM-3 связываться или взаимодействовать с молекулой-мишенью PIM-3 можно проводить посредством определения активности молекулы-мишени. Например, активность молекулы-мишени можно определять посредством определения индукции клеточных вторичных посредников мишени (например, внутриклеточный Ca2+, диацилглицерол, IP3 и т.д.), посредством определения каталитической/ферментативной активности мишени на соответствующем субстрате, посредством определения индукции репортерного гена (например, отвечающий на PIM-3 регуляторный элемент, функционально связанный с нуклеиновой кислотой, кодирующей детектируемый маркер, например, люциферазу) или посредством детекции клеточного ответа, например, клеточной дифференцировки или клеточной пролиферации.
В различных форматах способов анализа по настоящему изобретению может являться желательным иммобилизовать PIM-3 или ее молекулу-мишень для облегчения разделения форм одного или обоих белков в комплексе от форм вне комплекса, а также для обеспечения автоматизации анализа. Связывание тестируемого соединения с PIM-3 или взаимодействие PIM-3 с молекулой-мишенью в присутствии или отсутствии соединения-кандидата можно проводить в резервуаре, подходящем для содержания реагентов. Примеры таких резервуаров включают планшеты для микротитрования, пробирки для тестов и пробирки для микроцентрифугирования. В одном осуществлении можно получить гибридный белок, в котором добавлен домен, позволяющий одному или обоим белкам связываться с матриксом. Например, гибридные белки глутатион-S-трансфераза/PIM-3 или гибридные белки глутатион-S-трансфераза/мишень могут адсорбироваться на гранулы глутатион-сефарозы или дериватизированные глутатионом планшеты для микротитрования, которые затем совмещают с тестируемым соединением или тестируемым соединением и неадсорбированными молекулами белка-мишени или белка PIM-3, и смесь инкубируют в условиях, подходящих для образования комплекса (например, при физиологических условиях солевого состава и pH). После инкубации гранулы и лунки планшетов для микротитрования отмывают для удаления несвязавшихся компонентов, и образование комплекса измеряют или прямым или непрямым способом. Альтернативно, комплексы можно отделить от матрикса, и с применением стандартных способов определить уровень связывания или активности PIM-3.
В скринирующих анализах по изобретению для иммобилизации белков на матриксах также можно использовать другие способы. Например, PIM-3 или ее молекулу-мишень можно иммобилизовать с применением конъюгации биотина и стрептавидина. Биотинилированную PIM-3 или молекулы-мишени можно получить из биотин-NHS (N-гидроксисукцинимид) с применением хорошо известных в данной области способов. Альтернативно, лунки планшета можно дериватизировать антителами, взаимодействующими с PIM-3 или молекулами-мишенями, но не препятствующими связыванию белка PIM-3 с его молекулой-мишенью, а несвязанную мишень или PIM-3 удерживали в лунках конъюгацией с антителом. Способы детекции таких комплексов в добавление к описанным выше способам для иммобилизованных с применением GST комплексов включают иммунодетекцию комплексов с применением антител, взаимодействующих с PIM-3 или молекулой-мишенью, а также ферментативные анализы, основанные на детекции ферментативной активности, ассоциированной с PIM-3 или молекулой-мишенью.
В другом осуществлении идентифицируют регуляторы экспрессии PIM-3 способом, в котором клетка контактирует с соединением-кандидатом, и в котором определяют экспрессию мРНК или белка PIM-3 в клетке. Уровень экспрессии мРНК или белка PIM-3 в присутствии соединения-кандидата сравнивают с уровнем экспрессии мРНК или белка PIM-3 в отсутствие соединения-кандидата. Затем, основываясь на данном сравнении, соединение-кандидат можно идентифицировать как регулятор экспрессии PIM-3. Например, когда экспрессия мРНК или белка PIM-3 больше (статистически значимо больше) в присутствии соединения-кандидата, чем в его отсутствие, соединение-кандидат идентифицируют как стимулятор экспрессии мРНК или белка PIM-3. Альтернативно, когда экспрессия мРНК или белка PIM-3 меньше (статистически значимо меньше) в присутствии соединения-кандидата, чем в его отсутствие, соединение-кандидат идентифицируют как ингибитор экспрессии мРНК или белка PIM-3. Уровень экспрессии мРНК или белка PIM-3 в клетках можно определить способами, описанными здесь для детекции мРНК или белка PIM-3.
В другом аспекте изобретения белки PIM-3 или их полипептиды можно применять как "белки-наживки" в двухгибридном анализе или трехгибридном анализе для идентификации других белков, связывающихся или взаимодействующих с PIM-3 ("белки, связывающиеся с PIM-3" или "PIM-3-bp") и регулирующих активность PIM-3. Вероятно, что такие связывающиеся с PIM-3 белки вовлечены в распространение сигналов белками PIM-3, например, в качестве вышерасположенных или нижерасположенных элементов пути передачи сигнала PIM-3. Изобретение также относится к применению белков, взаимодействующих с PIM-3, например молекул, взаимодействующих с PIM-3 в двухгибридной системе в качестве наживки при двухгибридных скринингах, и к идентификации белков, взаимодействующих с взаимодействующими с PIM-3 белками. Вероятно, что белки, взаимодействующие с взаимодействующими с PIM-3 белками, вовлечены в путь передачи сигнала PIM-3.
Настоящее изобретение также относится к области прогностической терапии, где диагностические анализы, прогностические анализы, фармакогеномика и мониторинг клинических испытаний применяют в целях прогноза (предсказания), т.е. для профилактического лечения индивидуума. Следовательно, один аспект настоящего изобретения относится к диагностическим анализам для определения экспрессии белка и/или нуклеиновой кислоты PIM-3, а также активности PIM-3 в контексте биологического образца (например, кровь, сыворотка, клетки, ткань индивидуума, предпочтительно человека) для определения таким образом, того, страдает ли индивидуум заболеванием или нарушением или существует ли риск развития нарушения, ассоциированного с ненормальной экспрессией или активностью PIM-3. Изобретение также относится к прогностическим (или предсказательным) анализам для определения того, существует ли у индивидуума риск развития нарушения, ассоциированного с белком, экспрессией нуклеиновой кислоты или активностью PIM-3. Например, в биологическом образце можно анализировать мутации в гене PIM-3. Такие анализы можно применять для целей прогноза или предсказания, т.е. для профилактического лечения индивидуума до начала развития нарушения, характеризующегося или ассоциированного с белком, экспрессией нуклеиновой кислоты или активностью PIM-3.
В другом аспекте изобретение относится к способам определения белка PIM-3, экспрессии нуклеиновой кислоты или активности PIM-3 в биологических образцах индивидуумов для выбора, таким образом, соответствующих терапевтических или профилактических средств для данного индивидуума (обозначаемом здесь как "фармакогеномика"). Фармакогеномика обеспечивает выбор средств (например, лекарственных средств) для терапевтического или профилактического лечения индивидуума, основываясь на генотипе индивидуума (например, исследуют генотип индивидуума для определения способности индивидуума отвечать на воздействие конкретным средством).
В другом аспекте изобретение относится к мониторингу влияния средств (например, лекарственных средств или других соединений) на экспрессию или активность PIM-3 при клинических испытаниях.
Характерный способ для определения присутствия или отсутствия PIM-3 в биологическом образце включает получение биологического образца у тестируемого субъекта и контактирование биологического образца с соединением или средством, способным к определению белка PIM-3 или нуклеиновой кислоты, кодирующей белок PIM-3 (например, мРНК, геномная ДНК) так, что в биологическом образце определяют присутствие PIM-3. Средство для определения мРНК или геномной ДНК PIM-3 может представлять собой меченый зонд нуклеиновой кислоты, способный к гибридизации с мРНК или геномной ДНК PIM-3.
Средство для определения белка PIM-3 может представлять собой антитело, способное к связыванию с белком PIM-3, предпочтительно антитело с детектируемой меткой. Антитела могут являться поликлональными или, более предпочтительно, моноклональными. Можно применять целое антитело или его фрагмент (например, Fab или F(ab')2).
Термин "биологический образец" предназначен для включения в него тканей клеток и биологических жидкостей, полученных у индивидуума, а также тканей, клеток и жидкостей, представленных у индивидуума. То есть, способ определения по изобретению можно применять для детекции мРНК, белка или геномной ДНК PIM-3 в биологическом образце, например, in vitro или in vivo. В одном осуществлении биологический образец содержит молекулы белка тестируемого субъекта. Альтернативно, биологический образец может содержать молекулы мРНК тестируемого субъекта или молекулы ДНК тестируемого субъекта. Биологический образец представляет собой, например, материал биопсии из жировой ткани, полученный от субъекта традиционными способами.
В другом осуществлении способы дополнительно включают получение от субъекта контрольного биологического образца, контактирование контрольного образца с соединением или средством, способным к детекции белка, мРНК или геномной ДНК PIM-3, так что в биологическом образце выявляется присутствие белка, мРНК или геномной ДНК PIM-3, и сравнение наличия белка, мРНК или геномной ДНК PIM-3 в контрольном образце с наличием белка, мРНК или геномной ДНК PIM-3 в тестируемом образце.
Изобретение также относится к наборам для определения наличия PIM-3 в биологическом образце (тестируемый образец). Такие наборы можно применять для определения того, поражен ли индивидуум заболеванием, ассоциированным с резистентностью к инсулину, или диабетом типа 2 или у него повышен риск развития данного заболевания. Например, набор может содержать меченое соединение или средство, обеспечивающее определение белка или мРНК PIM-3 в биологическом образце и средства для определения количества PIM-3 в образце (например, антитела к PIM-3 или нуклеотидный зонд, связывающийся с ДНК, кодирующей PIM-3, например, SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 или SEQ ID NO: 7).
Описанные здесь способы, кроме того, можно применять в качестве диагностических или прогностических анализов для выявления субъектов с заболеванием или нарушением, ассоциированным с ненормальной экспрессией или активностью PIM-3 или с риском их развития. Например, описанные здесь анализы, такие как указанные выше диагностические анализы или следующие далее анализы, можно применять для выявления субъекта с резистентностью к инсулину или диабетом типа 2 или с риском их развития. Таким образом, настоящее изобретение относится к способу, в котором в тестируемом образце от индивидуума определяют наличие белка или нуклеиновой кислоты (например, мРНК, геномной ДНК) PIM-3, где наличие белка или нуклеиновой кислоты PIM-3 является диагностическим для индивидуума в плане наличия заболевания или нарушения, ассоциированного с ненормальной экспрессией или активностью PIM-3 или риска их развития. Как применяют здесь "тестируемый образец" относится к биологическому образцу, полученному от интересующего субъекта. Например, тестируемый образец может представлять собой биологическую жидкость (например, сыворотку), клеточный образец или ткань.
Кроме того, прогностические анализы можно применять для определения того, можно ли субъекту вводить средство (например, агонист, антагонист, пептидомиметик, белок, пептид, нуклеиновую кислоту, низкомолекулярное соединение или другие кандидаты в лекарственные средства) для лечения резистентности к инсулину или диабета типа 2. Например, такие способы можно применять для определения того, можно ли эффективно лечить субъекта конкретным средством или классом средств (например, типом средств, уменьшающих активность PIM-3).
Средства или регуляторы со стимулирующим или ингибирующим действием на активность PIM-3 (например, на экспрессию гена PIM-3), выявленные посредством скринирующего анализа, можно применять для получения фармацевтического препарата, пригодного для лечения (профилактического или терапевтического) заболеваний (например, заболеваний относящихся к клеткам или тканям, в которых экспрессируется PIM-3, таким как жировые клетки), ассоциированных с ненормальной активностью PIM-3. В связи с таким лечением, можно рассматривать фармакогеномику индивидуума (т.е. исследования связи между генотипом индивидуума и ответа данного индивидуума на чужеродное соединение или лекарственное средство). Различия в метаболизме терапевтических средств могут вести к сильной токсичности или терапевтически неблагоприятному исходу из-за изменения связи между дозой фармакологически активного лекарства и его концентрацией в крови. Таким образом, фармакогеномика индивидуума позволяет выбирать эффективные средства (например, лекарственные средства) для профилактических или терапевтических способов лечения, основанных на рассмотрении генотипа индивидуума. Кроме того, такую фармакогеномику можно применять для определения соответствующих доз и терапевтических режимов. Таким образом, можно определить активность белка PIM-3, экспрессию нуклеиновой кислоты PIM-3 или наличие мутаций генов PIM-3 у индивидуума, для выбора таким образом соответствующего средства для терапевтического или профилактического лечения индивидуума.
Мониторинг влияния средств (например, лекарственных средств, соединений) на экспрессию или активность PIM-3 (например, способность модулировать ненормальную клеточную пролиферацию и/или дифференцировку) можно применять не только для начального скрининга лекарственных средств, но также и при клинических испытаниях.
Средство против диабета типа 2, регулирующее активность белка PIM-3, может представлять собой средство, такое как низкомолекулярное соединение, например, низкомолекулярное соединение, регулирующее активность протеинкиназы PIM-3, нуклеиновая кислота или белок, природный родственный лиганд белка PIM-3, пептид или пептидомиметик PIM-3. В одном осуществлении средство стимулирует один или более видов биологической активности белка PIM-3. Примеры таких стимулирующих средств включают низкомолекулярные соединения, стимулирующие один или более видов биологической активности PIM-3, например, протеинкиназную активность PIM-3, активный белок PIM-3 и кодирующую PIM-3 нуклеиновую кислоту, введенную в клетку. В другом осуществлении средство ингибирует один или более видов биологической активности белка PIM-3. Примеры таких стимулирующих средств включают низкомолекулярные соединения, стимулирующие один или более видов биологической активности PIM-3, например, протеинкиназную активность PIM-3, антисмысловые последовательности молекул нуклеиновых кислот PIM-3 и антитела против PIM-3.
Изобретение далее иллюстрируют посредством следующих примеров, которые не следует истолковывать как ограничение. Содержание всех ссылок, патентов и опубликованных патентных заявок, цитируемых в данной заявке, включены сюда в качестве ссылки.
Примеры
Пример 1
Определение нуклеотидной последовательности человеческой и мышиной PIM-3
Нуклеотидную последовательность крысиной PIM-3 (AF057026, NM0_22602, SEQUENCE ID NO: 9) применяли для запроса к принадлежащей авторам настоящего изобретения базе данных с применением программы BLASTN с матрицей BLOSUM62. Данная принадлежащая авторам настоящего изобретения база данных основана на принадлежащей авторам настоящего изобретения библиотеке кДНК, созданной в стандартных клонирующих векторах. У наиболее близкородственных клонов кДНК, идентифицируемых посредством данной BLASTN, определяли последовательность. Последовательности кДНК объединяли в контиг. Из консенсусной последовательности данного контига определяли последовательность человеческой PIM-3, дополнительный анализ данного контига позволил выявить последовательность кДНК длиной 1977 п.н. Данная кДНК человеческой PIM-3 содержит открытую рамку считывания из 978 пар оснований, для которой вычислили, что она кодирует новый белок из 326 аминокислот.
Нуклеотидную последовательность крысиной PIM-3 также применяли для запроса к открытой базе данных UNIGENE Mouse с применением программы BLASTN с матрицей BLOSUM62. Посредством данной BLASTN обнаружили несколько близкородственных последовательностей EST. Информацию о последовательности данных EST применяли для скрининга библиотеки кДНК мышиного эмбриона с применением технологии Gene Trapper II (Life Technologies, Karlsruhe, Germany). Определяли последовательность клона кДНК, а последовательности кДНК объединяли в контиг. Исходя из консенсусной последовательности данного контига, определяли последовательность мышиной PIM-3, дополнительный анализ данного контига и исключение интронной последовательности выявили последовательность кДНК длиной 2236 п.н. Данная мышиная кДНК содержит открытую рамку считывания длиной 978 пар оснований, для которой вычислили, что она кодирует новый белок из 326 аминокислот.
Пример 2
Характеристика человеческого и мышиного белков PIM-3
В данном примере предсказанную аминокислотную последовательность человеческой PIM-3 и мышиной PIM-3 сравнивали с аминокислотными последовательностями известных мотивов и/или доменов, представленных в белках и с полипептидными последовательностями известных белков. Полипептидные домены и/или мотивы, существующие в человеческой PIM-3 и мышиной PIM-3, определили как белки со значительным аминокислотным сходством в отношении человеческой PIM-3 и мышиной PIM-3. Кроме того, предсказали молекулярную массу белка человеческой PIM-3 и мышиной PIM-3.
Нуклеотидные последовательности человека и мыши (SEQ ID NO: 1; SEQ ID NO: 5), определенные как описано выше, кодируют белок из 326 аминокислот (SEQ ID NO: 2 и SEQ ID NO: 6). Человеческая и мышиная PIM-3 обладают предсказанными MW приблизительно 35,9 кДа соответственно, не включая посттрансляционных модификаций. Для проверки наличия предполагаемой киназной активности и возможных участков посттрансляционной модификации человеческую и мышиную полипептидные последовательности SEQ ID NO: 2 и SEQ ID NO: 6 соответственно анализировали с применением базы данных белковых профилей PROSITE, а также с применением IMPALA и PFAM.
Поиск в базе данных PROSITE выявил наличие одного участка фосфорилирования цАМФ- и цГТФ-зависимой протеинкиназой, состоящего из аминокислот 260-263 SEQ ID NO: 2 и SEQ ID NO: 6; трех участков фосфорилирования казеинкиназой II, состоящих из аминокислот 202-205, 211-214 и 321-324 SEQ ID NO: 2 и четырех участков фосфорилирования казеинкиназой II, состоящих из аминокислот 202-205, 211-214, 299-302 и 321-324 SEQ ID NO: 6; десяти участков N-миристилирования, состоящих из аминокислот 43-48, 49-54, 52-57, 57-62, 63-68, 80-85, 98-103, 101-106, 295-300 и 316-321 SEQ ID NO: 2 и SEQ ID NO: 6; трех участков фосфорилирования протеинкиназой C, состоящих из аминокислот 137-139, 275- 277 и 279-281 SEQ ID NO: 2 и SEQ ID NO: 6; один участок фосфорилирования тирозинкиназой, состоящий из аминокислот 33-40 SEQ ID NO: 2 и SEQ ID NO: 6; одну сигнатуру и профиль протеинкиназ (участок связывания АТФ), состоящие из аминокислот 46-69 SEQ ID NO: 2 и SEQ ID NO: 6; одну сигнатуру активного участка серин/треониновой протеинкиназы, состоящую из аминокислот 166-178 SEQ ID NO: 2 и SEQ ID NO: 6. Поиск с применением IMPALA выявил наличие одного эукариотического протеинкиназного домена, состоящего из аминокислот 40-293 (SEQ ID NO: 4 и SEQ ID NO: 8 соответственно) SEQ ID NO: 2 и SEQ ID NO: 6; со счетом 186 бит и математическим ожиданием 8e-49 и со счетом 184 бит и математическим ожиданием 4e-48 соответственно. Поиск с применением PFAM также выявил наличие одного эукариотического протеинкиназного домена, состоящего из аминокислот 40-293 SEQ ID NO: 2 и SEQ ID NO: 6; со счетом 262,5 и математическим ожиданием 5,7e-75 и со счетом 261,1 бит и математическим ожиданием 1,5e-74 соответственно.
Полипептидные последовательности человеческой, мышиной и крысиной PIM-3 (SEQ ID NO: 2, SEQ ID NO: 6 и SEQ ID NO:10) сопоставляли посредством парного анализа сопоставления Clustal W с применением матрицы белковых весов blosum. Таким образом, обнаружено, что человеческая PIM-3 обладает 95% идентичности с мышиной и крысиной PIM-3 (AF057026, NM_022602, SEQ ID NO: 10) со счетом 2011, мышиная PIM-3 обладает 99% идентичности с крысиной PIM-3 (AF057026, NM_022602, SEQ ID NO: 10) со счетом 2074.
Полипептидные последовательности SEQ ID NO: 2 и SEQ ID NO: 6 человеческой и мышиной PIM-3 также применяли для запроса к базе данных белковых последовательностей Swissprot с применением программы BLASTP с матрицей BLOSUM62. Перечислены четыре максимально родственных с человеческой и мышиной PIM-3 белка, идентифицированных посредством данного анализа BLASTP: обнаружено, что человеческая и мышиная PIM-3 на 76% идентичны с PIM-1 Xenopus laevis (лягушки) (Q91822; SEQ ID NO: 11) со счетом 518, на 72% идентичны крысиной PIM-1 (P26794; SEQ ID NO: 12) со счетом 442, на 71% идентичны человеческой PIM-1 (P11309; SEQ ID NO: 13) со счетом 441 и на 71% идентичны с мышиной PIM-1 (P06803; SEQ ID NO: 14) со счетом 436 и 438 соответственно.
Пример 3:
Экспрессия гена PIM-3 в модели резистентности к инсулину и сахарного диабета типа 2 in vivo
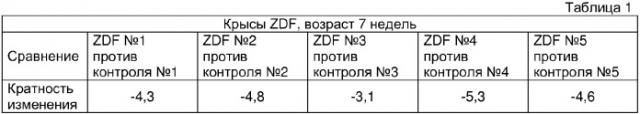
Крысы с сахарным диабетом с ожирением (ZDF) представляют собой хорошо известную животную модель, несущую гомозиготный дефект в гене рецептора лептина fa. В данной линии крыс развивается зависимое от возраста состояние резистентности к инсулину/гиперинсулинемии, которое затем развивается в явное состояние сахарного диабета типа 2/гипергликемии. Для идентификации генов, экспрессия которых или индуцирована или репрессирована и, таким образом, может вносить вклад или маркировать развитие резистентности к инсулину или сахарного диабета типа 2, с применением способа профилирования, основанного на олигонуклеотидном массиве, получали профили экспрессии генов крыс ZDF и их гетерозиготных контрольных пар из того же помета без ожирения.
Материалы и методы:
Самцов крыс с сахарным диабетом с ожирением (ZDF/Gmi™-fa/fa), а также их противоположности, представляющие собой самцов fa+/fa- без ожирения, применяемых как здоровые контроли, в возрасте 6, 8 и 13 недель получали из Genetic Models Inc. (Indianapolis, IND., US).
Перед включением животных в исследование их одну неделю содержали в стандартных условиях содержания животных. Для сбора жировой ткани придатка яичка и образцов крови животных умерщвляли посредством цервикального смещения. 6 крыс ZDF и 6 крыс fa+/fa- из того же помета без ожирения на возрастную группу использовали для анализа экспрессии генов, как описано ниже.
Сбор ткани и выделение РНК:
После цервикального смещения жировые прослойки придатка яичка хирургически удаляли, разделяли на части и быстро переносили в подходящие пробирки, позже содержащие достаточные объемы РНК (Ambion, TX, US). Образцы от каждого животного хранились отдельно. Длительное хранение образцов проводили при -80°C.
Из жировой ткани выделяли тотальную клеточную РНК с применением набора Rneasy Mini kit (Qiagen, Hilden, Germany) согласно рекомендациям производителя для выделения РНК из жировой ткани. РНК дважды элюировали в 50 мкл воды без РНКазы, концентрацию РНК определяли спектроскопически (A260).
Для дальнейшей очистки рас