Пептиды, способные продуцировать ароматы
Иллюстрации
Показать всеИзобретение относится к пищевой промышленности. Конкретные дипептиды, получаемые из какао-бобов, при вовлечении их в реакцию Майяра с редуцирующими сахарами способны продуцировать совершенно особые ароматы. В частности, указанные специфические пептиды могут быть использованы для получения шоколадного аромата, аромата какао, карамельного аромата, хлебного аромата и мясного аромата. 11 н. и 9 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Настоящее изобретение относится к пищевой промышленности, в частности к специфическим пептидам, которые получают из какао-бобов и которые, вступая в реакцию Майяра с редуцирующими сахарами, способны продуцировать совершенно особые ароматы. В частности, настоящее изобретение касается использования указанных специфических пептидов для получения шоколадного аромата, а именно аромата какао и карамельного аромата, цветочного аромата или аромата карамельных изделий, хлебного аромата, аромата жареного продукта и мясного аромата.
Типичный аромат какао образуется в процессе обработки какао-бобов, которая включает их ферментацию, сушку и обжаривание.
При ферментации белки какао-бобов подвергаются распаду под действием протекающих микробиологических и ферментативных процессов с образованием преимущественно гидрофильных пептидов и гидрофобных аминокислот, которые служат предшественниками уникального шоколадного аромата. Участвующая в этом процессе протеолитическая система какао-бобов является высокоактивной. Эндогенная протеолитическая активность в какао-бобах представлена эндопротеазами, аминопептидазами и карбоксипептидазами, которые во взаимодействии друг с другом обладают способностью к гидролизу целого белка на отдельные аминокислоты и олигопептиды различной длины.
В процессе обжаривания происходят различные химические реакции, в частности реакции типа реакции Майяра и реакции теплового распада (декарбоксилирование, дезаминирование, окисление и др.). Реакция Майяра с участием пептидов, аминокислот и редуцирующих сахаров генерирует соединения, которые, как предполагается, в конечном итоге вносят свой вклад в формирование аромата какао/шоколадного аромата.
В последнее время было получено еще больше доказательств тому, что размер пептидов и их аминокислотный состав/последовательность играют важную роль в формировании аромата. Изучен аминокислотный пул необжаренных и обжаренных ферментированных какао-бобов; установлено, что в формировании аромата какао участвуют определенные гидрофобные аминокислоты (Seiki, Rev. Int. Choc. 28 (1973) 38-42).
Однако идентификация содержащихся в какао-бобах нативных пептидов крайне затруднена, в частности, из-за присутствия в них свободных аминокислот и полифенолов. Именно поэтому очень мало известно о природе короткоцепочечных пептидов, входящих в пептидный пул какао-бобов.
Был предпринят ряд попыток для получения аромата какао искусственным путем. Одна такая попытка предусматривала автолиз высушенного ацетоном порошка, полученного из неферментированных зрелых какао-бобов, при рН 5,2 с последующим обжариванием в присутствии редуцирующих сахаров (Voigt et al., Food Chem. 49 (1994), 173-180). Mohr et al. сообщает в Fette, Seifen, Anstriche 73 (1971), 515-521 о выделении пептидной фракции, обладающей потенциалом к образованию шоколадного аромата. Более того, Voigt et al. в нескольких статьях в Food Chem. 51 (1994), 7-14; 177-184; 197-205 сообщает о получении обогащенного пептидами пула предшественников аромата при использовании очищенных запасных белков и эндогенной протеолитической системы какао-бобов: в ходе термической реакции указанных предшественников с редуцирующими сахарами отмечалось образование аромата, аналогичного шоколадному.
Установлено также, что термические реакции смеси из фруктозы и глюкозы с гидрофобными аминокислотами в среде с низкой активностью воды, например глицерине или пропиленгликоле и др., приводят к образованию аромата, аналогичного шоколадному. Используя образующийся в ходе указанного типа реакции аромат в качестве основы и комбинируя его с некоторыми легкими оттенками аромата, среди которых наиболее известен аромат ванили, можно было бы получать концентраты аромата, идентичного шоколадному. Однако из-за сложной природы этих реакций крайне трудно получить чистый и хорошо сбалансированный концентрат шоколадного аромата, что создает еще дополнительную проблему обеспечения его постоянного качества.
Касаясь вопроса создания ароматов для шоколада на основе реакций, происходящих при его производстве, Schnermann et al. сообщает в «Оценке основных одорантов молочного шоколада и какао тертого методом разбавления ароматических экстрактов» (Evaluation of key odorants in milk chocolate and cocoa mass by aroma extract dilution analyses - J. Agric. Food Chem. 45, (1997), 867-872 об идентификации и характеристике летучих соединений из какао- или шоколадных продуктов. Общая цель исследований по изучению профиля летучих соединений заключалась в «составлении» интенсивного искусственного шоколадного аромата с достаточной степенью гибкости, с помощью которого можно было бы регулировать ароматический профиль шоколада или шоколадных изделий в зависимости от требований потребителя. Однако до сих пор попытки имитировать аромат шоколада не увенчались успехом. Хотя полученные синтетические смеси в какой-то степени напоминают аромат шоколада, они не обладают ни плотностью, ни интенсивностью типичного шоколадного аромата.
Выпускаемые в настоящее время искусственные шоколадные ароматы не обладают требуемой интенсивностью шоколадного аромата и соответствующей плотностью.
Таким образом, целью настоящего изобретения является обеспечение средства, позволяющего искусственным путем получить шоколадный аромат, который в предпочтительном варианте должен включать все компоненты типичного шоколадного аромата и обладать соответствующей плотностью.
В ходе крупномасштабных исследований, результатом которых явилось настоящее изобретение, было установлено, что какао-бобы содержат множество различных пептидов, способных продуцировать неожиданный для какао-бобов аромат. Согласно первому аспекту настоящее изобретение относится к способным продуцировать аромат соединениям, источником происхождения которых являются какао-бобы и которые получают путем вовлечения пептидов, выбираемых из группы, включающей Arg-Phe, Ala-Glu, Glu-Ala, Val-Ala, Phe-Glu, Thr-Leu, Tyr-Val, Val-Tyr, Pro-Val, Asp-Ala, Ala-Asp, Trp-Ala, Ala-Asp, Trp-Ala, Phe-Ala, Ala-Phe, Tyr-Ala, Ala-Tyr, Lys-Glu, Lys-Phe, Val-Lys, Val-Phe, Leu-Leu, Met-Tyr, в реакцию Майяра с редуцирующими сахарами.
Согласно предпочтительному варианту предметом настоящего изобретения являются соединения, получаемые путем вовлечения пептидов, выбираемых из группы, включающей Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe, Ala-Asp, Val-Phe, Val-Lys, Leu-Leu или Val-Tyr, в реакцию Майяра с редуцирующими сахарами, причем эти соединения продуцируют шоколадный аромат, состоящий из аромата какао и/или карамели.
Согласно альтернативному варианту изобретения пептиды выбираются из группы пептидов, включающей Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe или Ala-Asp, которые, как было установлено, способны продуцировать отличный аромат с соответствующей плотностью. Согласно предпочтительному варианту изобретения пептидами являются Val-Tyr, Tyr-Val или Leu-Leu, которые продуцируют лучший аромат какао.
Согласно альтернативному варианту изобретения пептиды выбираются из группы пептидов, включающей Val-Phe или Val-Lys, которые дают карамельный аромат.
Согласно еще одному варианту изобретения среди пептидов, вовлекаемых в реакцию Майяра, только Met-Thr способен, как было установлено, продуцировать отличный и интенсивный мясной аромат.
В качестве редуцирующих сахаров, реагирующих с перечисленными выше пептидами, могут использоваться, например, фруктоза, глюкоза, ксилоза, мальтоза, лактоза, фукоза, арабиноза, галактоза и рамноза. Реакция сахаров с пептидами предпочтительно должна протекать в безводном растворителе, таком как глицерин, пропиленгликоль, водные системы с низкой активностью воды, этанол, жиры, при повышенных температурах и в условиях, которые благоприятствуют связыванию сахаров с пептидами.
Согласно другому варианту изобретения предложен способ получения требуемого аромата, в частности шоколадного аромата, аромата какао, карамельного или бисквитного аромата либо мясного аромата, который предусматривает вовлечение одного или более пептидов, выбираемых из группы, включающей Arg-Phe, Ala-Glu, Glu-Ala, Val-Ala, Phe-Glu, Thr-Leu, Tyr-Val, Val-Tyr, Pro-Val, Asp-Ala, Ala-Asp, Trp-Ala, Ala-Asp, Trp-Ala, Phe-Ala, Ala-Phe, Tyr-Ala, Ala-Tyr, Lys-Glu, Lys-Phe, Val-Lys, Val-Phe, Leu-Leu, Met-Tyr, в реакцию Майяра с редуцирующими сахарами.
Соединения, полученные в результате реакции Майяра, или специфические вышеперечисленные пептиды могут использоваться в производстве любых продуктов, в которых требуется наличие аромата, сформированного из конкретных для каждого вида продукта соединений, таких как пищевые продукты, косметические изделия или фармацевтические продукты. Примерами пищевых продуктов могут служить молочные продукты, любой вид молочных продуктов, например молоко, йогурт, пудинги, мороженое, либо кондитерские изделия, такие как шоколад. Подобно этому с использованием соединений согласно настоящему изобретению можно ароматизировать продукты детского питания или даже корма для домашних животных. В частности, вкусовые качества любого корма для домашних животных можно улучшить за счет усиления в нем мясного вкуса путем добавления к корму соединения согласно настоящему изобретению.
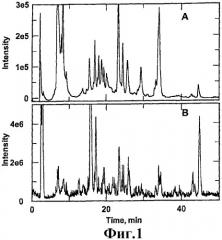
Фиг.1 показывает хроматографический профиль в ультрафиолетовом свете (UV) и в общем потоке ионов экстракта какао-порошка из ядер (CNP) ферментированных в течение 5 дней какао-бобов, полученный комбинированным методом обращенно-фазной жидкостной хроматографии высокого разрешения/масс-спектрометрии с ионизацией электрораспылением (RP-HPLC/ESI-MS).
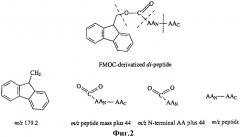
Фиг.2 показывает образец фрагментации FMOC-дериватизированных пептидов, полученный методом масс-спектрометрии/масс-спектрометрии (MS/MS).
Фиг.3 показывает количественный анализ дипептидов на различных стадиях ферментации.
В ходе исследований, результатом которых явилось настоящее изобретение, разработан новый способ выделения и детектирования пептидов из нативного пептидного пула какао-бобов, раскрытие которого в достаточной мере в контексте данного описания не представляется возможным.
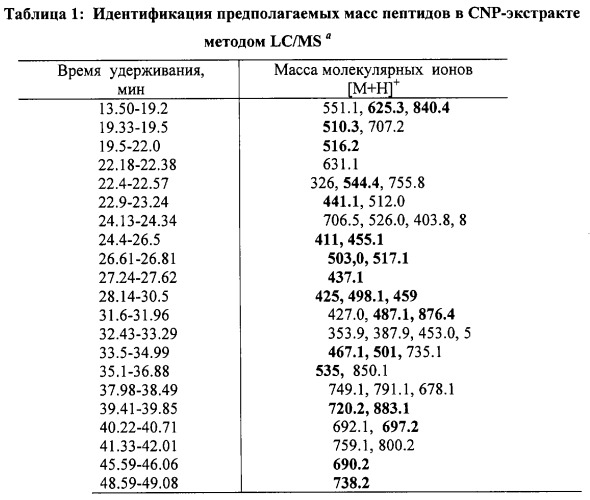
Анализ экстракта какао-порошка из ядер какао-бобов (CNP) масс-спектрометрией с ионизацией электрораспылением (ESI) в комбинации с обращенно-фазной жидкостной хроматографией высокого разрешения (RP-HPLC) в режиме хроматографии с использованием системы растворителей трифторуксусной кислоты/ацетонитрила (TFA/ACN) позволил обнаружить только небольшое количество масс из-за относительно малого избытка большинства ионов (1-6×104). Это, по-видимому, можно объяснить слабой ионизацией «голых» свободных аминокислот и короткоцепочечных пептидов. Предколоночная дериватизация с FMOC с последующим LC/MS анализом CNP-экстракта позволила обнаружить большое количество пиков (фиг.1). Были составлены подробный перечень присутствующих общих моноизотопных ионов, а на основе известных значений времени удерживания и массы молекулярных ионов аминокислот - перечень масс потенциальных пептидов (таблица 1). Все неизвестные массы за исключением массы 222 (доля FMOC) показали положительное парное соответствие до 5 остатков синтетическим пептидам из базы данных.
а из фиг.1. Массы, выделенные жирным шрифтом, по результатам MS/MS анализа показали присутствие типичного молекулярного иона m/z 179 из FMOC-пептидов.
| Таблица 2Идентификация и характеристика пептидов методом тандемной MS/MS | |||
| Время удерживания, мин | Молекулярные ионы [М+1]+ | Масса пептидов | Пептидная последовательность |
| 14 | 840.4 | 617.4 | RGTVVS |
| 19 | 625.3 | 402.3 | IRD |
| 19.6 | 510.3 | 287.3 | IR |
| 20.49 | 516.2 | 293.2 | KF |
| 22.5 | 544.4 | 321.4 | RF или FR |
| 22.8 | 441.1 | 218.1 | EA |
| 25.3 | 411 | 188 | AV |
| 25.25 | 517.1 | 294.1 | EF или FE |
| 24.7 | 455.1, 437.0b | 232.1 | IT или LT |
| 25.3 | 503.1 | 280.1 | YV или VY |
| 26.1 | 437.1 | 214.1 | VP |
| 27.1 | 425 | 202 | AD |
| 28.49 | 498.1 | 275.1 | WA или AW |
| 29.7 | 459 | 236 | AF |
| 31.7 | 876.4 | 653.4 | EEETF |
| 32 | 487.1 | 264.1 | VF или FV |
| 33.5 | 467.1 | 244.1 | LL, LY или YL |
| 35 | 501 | 278 | FL |
| 36 | 535 | 312 | MY |
| 40 | 697.2 | 253.2 | AY |
| 40 | 720.2 | 497.2 | EK |
| 43 | 690.2 | 467.2 | KV |
| 46 | 738.2 | 515.2 | FK |
| b - молекулярный ион минус молекула воды. |
С целью определения аминокислотной последовательности пептидов были получены индуцируемые столкновением фрагменты дериватизированных пептидов. Фрагментарный образец каждого пептида анализировали вручную. Как указывалось выше, дериватизация аминокислот и пептидов с использованием реагента FMOC вводит дополнительную массу 222. Путем наблюдений при MS/MS была выявлена следующая основная фрагментация дериватизированного пептида: моноизотопный ион m/z 179.2±0.1, соответствующий потере ароматической части FMOC (см. фиг.3). Потеря m/z 179 продуцировала ион пептидной массы плюс 44, соответствующий O-С=O части FMOC (фиг.3). При изучении последующей фрагментации была отмечена потеря С-концевой аминокислоты, продуцирующая молекулярный ион, соответствующий N-концевой аминокислоте плюс 44 масс-единицы, что свидетельствует об идентичности пептидной последовательности. В дополнение к этому одновременная потеря 44 масс-единиц продуцировала молекулярный ион пептида. Аналогичное наблюдение образца фрагментации проводилось и в случаях пептидов, несущих дополнительную часть FMOC вследствие присутствия остатков Lys или Tyr.
Используя вышеописанный подход по отношению как к N-концевой, так и к С-концевой аминокислотам в короткоцепочечных пептидах, удалось идентифицировать 23 пептида, из них 20 дипептидов, 1 трипептид, 1 пентапептид и 1 гексапептид. Однако в случае дипептидов, состоящих из изотопических аминокислот, например, в Gln и Lys или в Ile и Leu, не удалось провести четкой идентификации N- или С-концевой аминокислот.
Судьба каждого из идентифицированных пептидов была представлена графически в течение всего периода ферментации. Данные представлены на фиг.3. Как и ожидалось, в неферментированных какао-бобах присутствия пептидов не обнаружено. Количественный анализ пептидов в ферментированных какао-бобах (1-7 дней) показывает, что в случае набора пептидов (группа А) их концентрация достигала стабильности в период от 3 до 5 дней ферментации, после чего отмечалось хотя и небольшое, но заметное снижение концентрации. Другая группа пептидов (группа В) по достижении максимальной концентрации в период от 3 до 5 дней ферментации в дальнейшем не показала изменения концентрации. Пептиды группы С достигали своей максимальной концентрации в промежутке 1-2 дней ферментации, при последующей ферментации их концентрация не изменялась. Эти данные показывают, что идентифицированные пептиды возникают уникальным образом в ходе ферментации какао-бобов.
Компьютерный поиск аминокислотной последовательности идентифицированных пептидов в базе данных последовательностей запасных белков (2S и 21-кДа альбумин, 10-, 14-, 37-, 41-кДа полипептиды вициллина) показал 100% парное соответствие каждого из пептидов. Эти данные ясно показывают, что источником происхождения всех идентифицированных пептидов являются какао-бобы и что все они образуются при распаде запасных белков.
С целью оценки потенциальной способности идентифицированных дипептидов какао-бобов к продуцированию шоколадного аромата были идентифицированы (см. выше) синтетические аналоги соединений. Был изучен набор из 36 дипептидов (таблица 3). Для лучшего понимания реакции Майяра с участием пептидов N-концевую аминокислоту каждого пептида меняли местами с С-концевой аминокислотой. В ходе реакции были протестированы все пептиды.
Сначала все образцы оценивали путем многократной оценки их запаха с помощью органов обоняния. Результаты представлены в таблице 3. Для крупномасштабной ольфактометрической оценки отобрали набор из 11 образцов пептидов. По данным ольфактометрии, дипептиды Val-Tyr и Tyr-Val четко показали сбалансированный шоколадный аромат, причем, как ни удивительно, шоколадный аромат, продуцируемый Tyr-Val, был более интенсивным по сравнению с Val-Tyr.
| Таблица 3 | |||
| Оценка ароматического профиля ароматов реакций с участием пептидов | |||
| Пептид | Характеристика аромата | Пептид | Характеристика аромата |
| IR | Пряный, посторонние | AF | Карамельный, фруктовый |
| тона | |||
| RI | Пряный, посторонние | YA | Карамельный, |
| тона | посторонние тона | ||
| KF | Посторонние тона | AY | Шоколадный |
| FR | Посторонние тона | КЕ | Хлебный, ореховый, |
| жареного продукта, | |||
| шоколадный | |||
| RF | Карамельный, хлебный | ЕК | Посторонние тона |
| АЕ | Умеренно выраженный | KF | Сильно выраженный |
| карамельный | карамельный | ||
| ЕА | Умеренно выраженный | VK | Карамельный |
| карамельный | |||
| AV | Посторонние тона | KV | Посторонние тона |
| VA | Карамельный, | FV | Посторонние тона |
| посторонние тона | |||
| FE | Карамельный, | VF | Карамельный |
| посторонние тона | |||
| TL | Посторонние тона, | LL | Фруктовый, аромат какао, |
| мясной | цветочный | ||
| YV | Сбалансированный | LY | Посторонние тона |
| шоколадный | |||
| VY | Шоколадный,слабовыраженные | YL | Посторонние тона |
| посторонние | |||
| тона | |||
| PV | Аромат жареного | LF | Посторонние тона |
| продукта, хлебный | |||
| VP | Посторонние тона | FL | Посторонние тона |
| DA | Посторонние тона, | MY | Сильно выраженный |
| карамельный | мясной тон | ||
| AD | Бисквитный, карамельный | YM | NCA |
| WA | Карамельный, пряный, | FK | NCA |
| посторонние тона | |||
| AD | Бисквитный, карамельный | EF | NCA |
| WA | Карамельный, пряный, | LT | NCA |
| посторонние тона | |||
| AW | Посторонние тона | IT | NCA |
| FA | Карамельный, | TI | NCA |
| посторонние тона |
Наиболее перспективные пептиды по характеристикам аромата в ходе их реакций обозначены серым цветом.
В нижеследующих примерах раскрывается сущность изобретения, но она не ограничивается только приведенными примерами.
Пример 1
Западно-африканские какао-бобы Амелонадо (Amelonado) хорошего качества ферментировали в ферментационных кучах по 80 кг, покрытых сверху листьями бананов, на ферме Abengoorou Idefor в Республике Кот-д'Ивуар. Образцы отбирали с интервалом в 1 день в течение 7-дневного периода ферментации, высушивали на солнце, очищали вручную и отгружали в NRC/Лозанна. Какао-бобы хранили при -20°С.
Синтетические пептиды получали от фирмы Bachem. Ацетонитрил, метанол и воду для HPLC - от фирмы Merck. Трифторуксусную кислоту, триэтиламин и фтороскамин -от фирмы Fluka.
Приготовление растворимого экстракта пептидов
Высушенные какао-бобы пропускали через дробилку для какао-бобов (Brook Crampon), а затем просеивали для удаления какаовеллы. Ядра хранили в коричневой бутылке при -20°С. Ядра какао-бобов (20-30 г) измельчали в течение нескольких секунд в универсальной мельнице (IKA, М-20). Порошок из ядер какао-бобов пропускали через сито с диаметром отверстий 0,8 мм и хранили при 4°С (ссылки NRC с 14С181-щ по 14С18-7).
Порошок из ядер какао-бобов (1 г) суспендировали в 10 мл экстракционного растворителя (30% (об./об.) метанол/0,1% (об./об.) TFA). Суспензию подвергали обработке гомогенизацией в течение 1 мин при максимальной скорости (Polytron, Kinematica AG) и центрифугировали при 15000 об./мин при 4°С в течение 15 минут. Чистый супернатант аккуратно сливали, пропускали через фильтровальный диск 0,22 мкм и хранили в аликвотных количествах при -20°С.
Дериватизация с использованием FMOC
Растворимый экстракт пептидов (50-100 мкл) или раствор синтетических пептидов и аминокислот (10-40 нмоль/100 мкл) смешивали с 400 мкл боратного буфера (0,1 М, рН 10,4). Раствор интенсивно смешивали с реагентом FMOC (500 мкл, 5,8 мМ в ацетоне) (Einarson et al., J. Chromatogr. 66 (1983), 3688-3695). Смесь дважды экстрагировали 2 мл пентан-этилацетата (80:20). Водную фазу, содержащую FMOC-производные, анализировали комбинированным методом RP-HPLC и ESI-масс-спектрометрии.
LC-MS-анализ
Измерения массы и фрагментацию пептидов проводили с использованием LCQ масс-спектрометра с ионной ловушкой фирмы FinniganMat, соединенного с HPLC-системой Spectra (FinniganMat). Система состояла из четырехкомпонентного насоса (TSP Р4000), автоинжектора (TSP AS3000) и детектора в ультрафиолетовой/видимой частях спектра (модель UVIS 205 от фирмы Linear Instruments), оборудованного изготовленной из нержавеющей стали ячейкой потока высокого давления (объем 1,6 мкл, длина прохода 2 мм). LC-поток поступал непосредственно в LCQ масс-спектрометр без использования разделителя потока. Обычно применяли следующие режимы: температура капилляров 200°С, ограниченный газовый поток 70, вспомогательный газовый поток 10, источник напряжения 5 кВ. Другие параметры регулировались автоматически в процессе калибровки/настройки согласно инструкции изготовителя. При MS/MS-анализе самых интенсивных ионов индуцируемая столкновением энергия диссоциации была отрегулирована на уровне 35%. В случае самых интенсивных ионов выборка массы и отсекающие отверстия составляли 1 масс-единицу.
Анализ недериватизированных образцов проводили на RP C18 колонке (Nucleosil 100-3 С18 HD; 3 мкм, 2×150 мм, Macherey-Nagel) с увеличением линейного градиента растворителя В (0,05% TFA/80% ACN (об./об.) в воде) в растворителе А (0,045% TFA (об./об.) в воде) в следующем режиме: 10 мин изократического элюирования при 0% В, 0-25% В за 25 мин, 25-50% В за 10 мин, 50-100% В за 5 мин с последующим изократическим элюированием при 100% В в течение 5 мин. Скорость потока составляла 0,2 мл/мин, детектирование проводили на волне 215 нм. FMOC-производные разделяли на той же колонке с применением следующего линейного градиента: 0-35% В за 5 мин, 35-100% В за 65 мин и изократическое элюирование при 100% В в течение 5 мин. Скорость потока составляла 0,2 мл/мин, детектирование вели на волне 260 нм.
Модельная реакция пептидов
Предварительно составленную смесь из дипептидов (305 г) и D-фруктозы (75 мг) добавляли к предварительно нагретому (120°С) пропиленгликолю в склянке Шотта на 50 мл с укупорочным колпачком. рН реакции устанавливали с помощью 0,01 N NaOH (75 мкл) на уровне рН 7,5-8,5. Реакционную смесь перемешивали на магнитной мешалке. Реакционную смесь нагревали в течение времени до 60 мин, охлаждали до комнатной температуры и хранили при 4°С.
Сенсорная оценка профильным методом
При предварительном скрининге комиссия экспертов оценивала и описывала ароматический профиль протекающих реакций. В каждый заданный промежуток времени с помощью органов обоняния оценивали максимум 6 образцов. Процесс повторяли трижды с выборочным набором образцов с целью достижения более высокой степени надежности сенсорной оценки. В случае наиболее перспективных соединений комиссия из специально обученных экспертов проводила дополнительную оценку ароматического профиля. Всего в тестах по оценке аромата с помощью органов обоняния участвовали 17 экспертов, специально обученных выявлению аромата шоколадной крошки и/или шоколада. Тесты были индивидуальными (1 эксперт одновременно); спустя несколько дней оценку проводили повторно. Экспертов не ставили в известность, что одни и те же ароматы они оценивали дважды. Склянки с ароматом реакции с участием пептидов готовили за 1 день до проведения теста: бумажную полоску опускали в склянку таким образом, чтобы примерно 1 см ее стал влажным. Затем аккуратно стряхивали, отрезали кусок длиной примерно 5 см и помещали в банку с крышкой на 20 мл. Банки кодировали 3-цифровыми кодами и в произвольном порядке размещали на подносе. До начала проведения оценки экспертам давали понюхать контрольные промышленные образцы аромата карамели, темного шоколада, какао и бисквита. Аромат какао тертого и шоколада оценивали по 9-балльной шкале от 1 до 9. Коды образцов меняли трижды и трижды повторяли оценку аромата. Из всех протестированных пептидов высокую оценку продуцируемого ими шоколадного аромата получили следующие: Tyr-Val, Val-Tyr, Leu-Leu, Pro-Val, Val-Phe и Lys-Glu.
1. Соединение, способное продуцировать аромат, получаемое путем вовлечения пептидов, выбираемых из группы, включающей Arg-Phe, Ala-Glu, Glu-Ala, Val-Ala, Phe-Glu, Thr-Leu, Tyr-Val, Val-Tyr, Pro-Val, Asp-Ala, Ala-Asp, Trp-Ala, Phe-Ala, Ala-Phe, Tyr-Ala, Ala-Tyr, Lys-Glu, Lys-Phe, Val-Lys, Val-Phe, Leu-Leu, Met-Tyr, Phe-Val, Met-Thr, в реакцию Майяра с редуцирующими сахарами.
2. Соединение по п.1, являющееся дипептидом Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe или Ala-Asp.
3. Соединение по п.1, являющееся дипептидом Val-Phe или Val-Lys.
4. Соединение по п.1, являющееся дипептидом Met-Tyr или Pro-Val.
5. Соединение по любому из пп.1-4, согласно которому редуцирующими сахарами являются фруктоза, глюкоза, ксилоза, мальтоза, лактоза, фукоза, арабиноза, галактоза и рамноза.
6. Соединение, способное продуцировать шоколадный аромат, полученное путем вовлечения пептидов, которые выбирают из группы, включающей Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe, Ala-Asp, Val-Phe, Val-Lys, в реакцию Майяра с редуцирующими сахарами.
7. Соединение, способное продуцировать какао аромат, полученное путем вовлечения пептидов, которые выбирают из группы, включающей Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe или Ala-Asp, в реакцию Майяра с редуцирующими сахарами.
8. Соединение, способное продуцировать карамельный аромат, полученное путем вовлечения пептидов, которые выбирают из группы, включающей Val-Phe или Val-Lys, в реакцию Майяра с редуцирующими сахарами.
9. Соединение, способное продуцировать хлебный аромат, полученное путем вовлечения пептидов, которые выбирают из группы, включающей Phe-Val или Lys-Glu, в реакцию Майяра с редуцирующими сахарами.
10. Соединение, способное продуцировать мясной аромат, полученное путем вовлечения пептидов, которые выбирают из группы, состоящей из Met-Thr, в реакцию Майяра с редуцирующими сахарами.
11. Способ получения шоколадного аромата, который включает вовлечение пептидов, выбираемых из группы, включающей Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe, Ala-Asp, Val-Phe или Val-Lys, в реакцию Майяра с редуцирующими сахарами.
12. Способ по п.11, согласно которому редуцирующие сахара включают фруктозу, глюкозу, ксилозу, мальтозу, лактозу, фукозу, арабинозу, галактозу и рамнозу.
13. Способ получения аромата какао, который включает вовлечение пептидов, выбираемых из группы, включающей Leu-Leu, Val-Tyr, Tyr-Val, Ala-Phe или Ala-Asp, в реакцию Майяра с редуцирующими сахарами.
14. Способ по п.13, согласно которому редуцирующие сахара включают фруктозу, глюкозу, ксилозу, мальтозу, лактозу, фукозу, арабинозу, галактозу и рамнозу.
15. Способ получения карамельного аромата, который включает вовлечение пептидов, выбираемых из группы, включающей Val-Phe или Val-Lys, в реакцию Майяра с редуцирующими сахарами.
16. Способ по п.15, согласно которому редуцирующие сахара включают фруктозу, глюкозу, ксилозу, мальтозу, лактозу, фукозу, арабинозу, галактозу и рамнозу.
17. Способ получения мясного аромата, который включает вовлечение Met-Tyr в реакцию Майяра с редуцирующими сахарами.
18. Способ по п.17, согласно которому редуцирующие сахара включают фруктозу, глюкозу, ксилозу, мальтозу, лактозу, фукозу, арабинозу, галактозу и рамнозу.
19. Применение соединения по любому из пп.1-10 в производстве пищевых продуктов, косметических изделий или фармацевтических продуктов.
20. Применение по п.19, согласно которому пищевым продуктом является шоколад, молоко, йогурт, пудинг, мороженое, напитки, продукты детского питания, пищевые продукты, подвергнутые кулинарной обработке, отдушки или корм для домашних животных.