Способ идентификации противоопухолевых целевых ферментов
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Идентифицируют фермент, используемый при получении препарата для доставки противораковых соединений, которые избирательно превращаются в активные вещества в опухолевой ткани или клетках. Для этого сравнивают уровни экспрессии генов в здоровой человеческой ткани или нормальных клетках с уровнями экспрессии генов в человеческой опухолевой ткани или клетках опухолевого происхождения. Затем выбирают фермент, имеющий в тканях или клетках опухолевого происхождения уровень экспрессии, более чем вдвое превышающий уровень экспрессии в нормальных клетках или в здоровой ткани. Изготавливают препарат для доставки противораковых соединений. Для этого культивируют клетки в присутствии или в отсутствие тестируемого соединения, где в указанные клетки включена кДНК идентифицированного фермента. Далее определяют, представляет ли собой тестируемое соединение противораковое соединение, которое способно избирательно превращаться в активные вещества в опухолях. Применяют фермент для доставки противораковых соединений. Настоящее изобретение позволяет исключать побочные эффекты при лечении онкологических заболеваний. 3 н. и 11 з.п. ф-лы.
Реферат
Настоящее изобретение относится к способу идентификации ферментов, которые преимущественно экспрессируются в некоторых опухолевых тканях по сравнению с быстро растущими нормальными клетками или тканями, применению указанных ферментов для разработки соединения, предназначенного для избирательного образования активного противоракового вещества в опухолевой ткани, соединениям, созданным на основе указанных ферментов, их фармацевтически приемлемым солям, а также фармацевтическим композициям на их основе.
Одной из наиболее серьезных и наиболее важных проблем в области лекарственной медицины являются побочные эффекты. Побочные эффекты лекарственных средств главным образом вызваны их неспецифическим действием; лекарства взаимодействуют и влияют не только на молекулы-мишени, но и на другие молекулы, играющие важную роль в поддерживании нормальных физиологических процессов. Другая важная причина побочных эффектов состоит в неспецифическом распределении лекарственных средств во многих тканях; лекарства внедряются не только в поврежденные ткани, но также и в другую ткань, которая не должна затрагиваться для сохранения нормальных физиологических функций. Молекулы-мишени большинства противораковых лекарственных средств повсеместно экспрессированы во многих тканях и не являются специфичными для определенной ткани. С другой стороны, заболевание обычно вызывается нарушением регуляции определенных молекул в определенных тканях. Таким образом, для исключения побочных эффектов необходимо установить способы, с помощью которых лекарства оказывают влияние на определенные молекулы только в конкретной ткани, ответственной за заболевание, и обеспечить лекарства, разработанные с помощью упомянутых способов.
Среди многих заболеваний при лечении онкологических больных побочные эффекты лекарственных средств имеют особенное значение. Цитотоксические лекарства широко используются для лечения рака, и их регулярное применение для химиотерапевтического лечения рака будет продолжаться, по меньшей мере, в течение следующего десятилетия. Однако применение цитотоксических лекарственных средств ограничивается их недостаточной эффективностью и тяжелыми побочными эффектами. В опухолевых тканях многие цитотоксические лекарства, например 5-FU, 2'-дезоксицитидины, метотрексат, камптотецины и таксаны, воздействуют на опухолевые клетки, находящиеся в S или М фазе клеточного цикла, т.е. во время синтеза ДНК или митоза. Однако растущие опухолевые клетки опухолевой ткани находятся в различных стадиях клеточного цикла, и лишь небольшая часть опухолевых клеток находится в S или М фазах. Поэтому время действия идеального лекарственного средства должно быть, по меньшей мере, большим, чем время, которое требуется для завершения одного клеточного цикла (длящегося 20-40 часов), а идеальным режимом дозирования цитотоксических лекарств является последовательное ежедневное или непрерывное лечение, направленное на воздействие на все раковые клетки, присутствие в опухолевой ткани. Однако лечение цитотоксическими лекарствами в таких режимах дозирования оказывает тяжелое токсическое действие на быстро растущие здоровые клетки, в особенности на кроветворные клетки-предшественницы и кишечные клетки крипта. Миелосупрессия, являющаяся следствием токсического воздействия на кроветворные клетки-предшественницы, является наиболее распространенным побочным эффектом действия цитотоксических лекарств и часто приводит к ухудшению иммунной реакции хозяина и эмбриональному инфицированию. При проявлении симптомов миелосупрессии обычно требуется 2-3 недели для восстановления после миелотоксичности, и этот факт служит основной причиной применения цитотоксических лекарств один раз каждые 3-4 недели. Однако такой режим прерывистой дозировки ответственен за недостаточную эффективность большинства существующих цитотоксических лекарств.
В настоящее время разрабатываются некоторые новые противоопухолевые агенты с новым типом действия. Однако им также присущи проблемы, связанные с безопасностью действия за счет недостаточной противоопухолевой селективности. По-видимому, основными факторами токсичности ингибиторов фарнезилтрансферазы и тирозинкиназных ингибиторов рецептора эпидермального фактора роста (EGF) являются миелотоксичность и кожные язвы соответственно. По-видимому, это связано с тем фактом, что целевой фермент или белок гиперэкспрессруются не только в опухолевой ткани, но также и в других здоровых тканях, например в костном мозге и коже.
С другой стороны, капецитабин (пероральный фторпиримидин) является цитотоксичным лекарством, которое последовательно превращается в активное лекарство 5-FU под действием ферментов, интенсивно экспрессирующихся в печени и опухолях, но не в растущих клетках костного мозга [Miva. M. et al. Design of oral fluoropyrimidine carbamate, capecitabine, which generates 5-furuoloyracil selectiviely in tumors by enzymes concentrated in human liver and cancer tissue. Eur. J. Cancer 34, 1274-1281 (1998)]. В результате рассматриваемый лекарственный препарат обеспечивает высокие концентрации 5-FU непосредственно в опухолевой ткани и демонстрирует улучшенные профили эффективности по сравнению с профилями 5-FU. Кроме этого, рассматриваемый препарат обладает низкой миелотоксичностью. Такие характеристики позволяют использовать такой препарат в ежедневном лечении с высокими дозировками даже в течение длительного времени. В настоящее время этот препарат назначают для лечения рака груди, колоректального рака и других видов онкологических заболеваний. Несмотря на это, все еще трудно идентифицировать противораковые лекарственные средства повышенной эффективности и пределами безопасного применения, подобные капецитабину, поскольку не разработан подход к точному определению ферментов и/или белков, среди тех, что экспрессируются в различных тканях.
Настоящее изобретение относится к способам обнаружения ферментов для конструирования соединений, способных избирательно превращаться в активные вещества в опухолях, но не в растущих здоровых клетках (далее в тексте противоопухолевые целевые цитотоксиканты, (ТТС)), в особенности гранулоцитных предшественников, которые преимущественно присутствуют в костном мозге. Противоопухолевые цитотоксиканты должны избирательно воздействовать на опухоль лишь с незначительной миелотоксичностью. Такие соединения должны без опасений назначаться в высоких дозах в течение длительного времени, обеспечивая более высокую безопасность и эффективность, чем существующие цитотоксиканты. Рассматриваемые соединения могут уменьшить госпитализацию, связанную с проявлением побочных эффектов, и могут безопасно назначаться амбулаторным больным. Другие преимущества противоопухолевых целевых цитотоксикантов состоят в том, что они позволяют проводить индивидуальные оздоровительные процедуры (адаптационная терапия) в результате измерения уровней экспрессии их активационных ферментов (ТТС-активационные ферменты). Индивидуальные опухоли, экспрессирующие высокие уровни ТТС-активационных ферментов, могут эффективно генерировать активные лекарства из противоопухолевых цитотоксикантов, и поэтому они могут обладать высокой чувствительностью к противоопухолевым цитотоксикантам.
Цель настоящего изобретения заключается в разработке способов обнаружения ферментов для получения противораковых соединений, способных избирательно превращаться в активные вещества в опухолях, причем такие способы предусматривают измерение уровней экспрессии генов и/или белков в человеческой ткани и/или клетках нормального или опухолевого происхождения, сравненение измеренных уровней экспрессии и выбор ферментов, в которых уровни содержания мРНК и/или белков в опухолевой ткани более чем в два раза выше, чем в нормальных растущих кроветворных предшественниках, кишечнике и/или коже.
Другая цель настоящего изобретения заключается в разработке способов идентификации противораковых соединений, способных избирательно превращаться в активные вещества в опухолях, включающих стадии генерации клеток, экспрессирующих фермент с более чем вдвое большим содержанием белка в опухолевой ткани, по сравнению со здоровыми клетками и тканями, и определения активностей факторов роста указанных противораковых соединений.
Еще одна цель настоящего изобретения заключается в разработке противораковых соединений формулы (I)
X-Y-Q (I),
в которой
Х представляет собой профрагмент, предназначенный для генерации активного противоракового вещества (Q-Y-H) непосредственно в опухолях под воздействием ферментов настоящего изобретения;
Q-Y- представляет собой радикал, производный активного противоракового вещества (Q-Y-H), в котором Y представляет собой
-О-, -S- или -N-,
и их фармацевтически применимых солей.
Другая цель настоящего изобретения заключается в разработке противораковых соединений, представленных формулой (II),
в которой
Q и Y имеют указанные выше значения,
R0 представляет собой боковую цепь природной или синтетической аминокислоты,
Z представляет собой (С1-С3)алкилен или группу -О-СН(R3)-, в которой R3 представляет собой водород или неразветвленный (С1-С4)алкил,
R1 представляет собой водород или метил, и
R2 представляет собой водород, разветвленный (С3-С10)алкил или (С3-С8)циклоалкил,
или их фармацевтически применимых солей.
Еще одна цель настоящего изобретения заключается в разработке противораковых соединений, представленных формулой (III),
в которой
R0 имеет указанные выше значения,
R4 представляет собой бензоил или трет-бутоксикарбонил,
R5 представляет собой водород или ацетил,
или их фармацевтически применимых солей.
Другая цель настоящего изобретения заключается в разработке противораковых соединений, представленных формулой (IV),
в которой
R0, R1, R2 и R3 имеют указанные выше значения,
R6 представляет собой водород, фтор, гидроксил или циано,
R7 представляет собой водород, фтор или гидрокси,
или R6 и R7 совместно образуют метилиден или фторметилиден,
R8 представляет собой водород или этинил,
R9 представляет собой водород, фтор, винил или этинил, и
R10 представляет собой водород или гидрокси
или их фармацевтически применимых солей.
Еще одна цель настоящего изобретения заключается в обеспечении противораковых соединений, представленных формулой (V),
в которой m представляет собой цело число, равное 2 или 3,
R0, R2, R6, R7, R8, R9 и R10 имеют указанные выше значения,
и их фармацевтически применимых солей.
Другая цель настоящего изобретения предусматривает противораковые соединения, представленные формулой (VI),
в которой
m представляет собой целое число в интервале 1-3,
n представляет собой целое число, равное 0 или 1,
R0 имеет указанные выше значения,
R11 представляет собой водород или фтор,
R12 представляет собой водород, фтор, метил или гидрокси,
R13 представляет собой водород, амино, нитро или (диметиламино)метил,
R14 представляет собой водород, (С1-С4)алкил, 4-метилпиперазинилметил, трет-бутоксииминометил, или R13 и R14, либо R11 и R12, взятые вместе, могут образовывать пяти- или шестичленное кольцо, которое может содержать один или два гетероатома и может быть необязательно замещено (С1-С8)алкилом, амино, (С1-С8)алкиламино и ди-(С1-С4)алкиламино,
или их фармацевтически применимые соли.
Используемый в тексте настоящего описания термин «(С1-С3)алкилен» относится к бирадикальной разветвленной или неразветвленной углеводородной цепочке, содержащей 1-3 углеродных атома, например к метилену, этилену, пропилену и триметилену, наиболее предпочтительно к этилену.
В тексте настоящего изобретения термин "-О-СН(R3)-" относится к группам -О-СН2-, -О-СН(СН3)-, -О-СН(СН2СН3)-, -О-СН(СН2СН2СН3)-, -О-СН(СН2СН2СН2СН3)-; предпочтительно -О-СН2-, -О-СН(СН3)- и наиболее предпочтительно к -О-СН(СН3)-.
Термин «ацетил» относится к группе СН3СО-.
Термин «циклоалкил» обозначает насыщенную, циклическую углеводородную группу, содержащую 3-7 углеродных атомов, предпочтительно 4-7 углеродных атомов, более предпочтительно 4-6 углеродных атомов, например циклопропил, циклобутил, циклопентил и циклогексил и т.п.
Термин «гетероатом» относится к атомам кислорода, азота и серы.
Термин «моно- и диалкиламино» относится к указанным ниже аминогруппам, замещенным алкилом или диалкилом, например к алкил-NH- и диалкил-N-.
Термин «(С1-С8)алкиламино» относится к метиламино, этиламино, пропиламино, изопропиламино, бутиламино, третбутиламино, пентиламино, гексиламино, гептиламино и октиламино; предпочтительно к бутиламино и пентиламино группам.
Термин «ди-(С1-С4)алкиламино» относится к диметиламино, диэтиламино, дипропиламино, дибутиламино; предпочтительно к диметиламино и диэтиламино группам.
В определение R0 формулы (II) термин «боковая цепь природной аминокислоты» предпочтительно обозначает такую боковую цепь природных аминокислот, как метил, изопропил, 2-метилпропил, 1-метилпропил, бензил, индол-3-илметил, 2-(метилтио)этил и 4-аминобутил, 3-аминопропил; предпочтительно обозначает боковую цепь природной липофильной аминокислоты, например метил, 2-метилпропил, бензил и индол-3-метил.
Термин «боковая цепь синтетической аминокислоты» предпочтительно обозначает (С5-С12)алкил, циклоалкилметил, замещенный или незамещенный арилметил, (циклоалкилтио)метил, алкилтио-(СН2)r-, где r представляет собой целое число, равное 1 или 2, и т.д.
В приведенном выше тексте термин «(С5-С12)алкил» обозначает неразветвленную или разветвленную алкильную цепь, содержащую 5-12 углеродных атомов; более предпочтительно неразветвленную (С8-С12)алкильную цепь, например н-октил, нонил, децил, ундецил и додецил.
Термин "алкилтио-(СН2)r-" обозначает алкилтиометил или алкилтиоэтил, содержащий нормальную или разветвленную алкильную цепь, включающую 2-10 углеродных атомов, например этилтиометил, этилтиоэтил, н-пропилтиометил, н-бутилтиометил, н-пентилтиометил, н-октилтиометил, н-нонилтиометил, н-децилтиометил, третбутилтиометил и т.п.; более предпочтительно этилтиоэтил, н-пропилтиометил и н-бутилтиометил.
Термин «замещенный или незамещенный арилметил» предпочтительно обозначает 4-фенилбензил, нафт-2-илметил, [4-(4-гидроксифенокси)фенил]метил и (4-низший алкоксифенил)метил, причем в рассматриваемом термине сочетание «низшая алкокси» обозначает алкильную цепь нормального или изостроения, содержащую 1-6 углеродных атомов; предпочтительно метокси, этокси, пропокси, бутокси и изопропокси. Наиболее предпочтительными значениями термина «замещенный или незамещенный арилметил» является 4-фенилбензил, нафт-2-илметил, (4-метоксифенил)метил и [4-(4-гидроксифенокси)фенил]метил.
Используемый в определении R2 формулы (II) термин «разветвленный (С3-С10)алкил» обозначает разветвленную алкильную цепь, содержащую 3-6 углеродных атомов, предпочтительно изопроприл, 2-бутил, 3-пентил, неопентил и т.п.; более предпочтительно изопропил и 3-пентил. Термин «(С3-С8)циклоалкил» обозначает углеродное кольцо, состоящее из 3-8 углеродных атомов, например циклопропил, циклобутил, циклопентил, циклогексил и т.п.; более предпочтительно циклопентил и циклогексил.
В определении R3 формулы (II) термин «разветвленный (С1-С4)алкил» обозначает разветвленную алкильную группу, содержащую 1-4 углеродных атомов, предпочтительно метил, этил и н-пропил.
Термин «фармацевтичски применимая соль» относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований и свободных кислот, которые приемлемы в биологическом или ином отношении. Рассматриваемые соли получают путем взаимодействия с такими неорганическими кислотами, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и т.п., и такими органическими кислотами, как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и т.д. Кроме этого, рассматриваемые соли могут быть получены присоединением неорганического или органического основания к свободной кислоте. Соли, являющие производными неорганического основания, без конкретных ограничений, включают соли натрия, калия, лития, аммония, кальция, магния и т.д. Соли, являющие производными органического основания, без конкретных ограничений, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, например изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полииминовые смолы и т.п. Предпочтительные соли представляют собой гидрохлориды. Соединения, не содержащие солей, могут быть получены способами, известными в данной области техники.
В контексте настоящего изобретения фраза «про-фрагмент (Х)» обозначает уходящую группу, которая отщепляется в опухолях под действием упомянутого выше фермента после применения соединения формулы (I) или (II), например Х представляет собой группу формулы:
Используемый в тексте изобретения термин «таксаны» обозначает таксол [Front. Biotechnol. Pharm. (2000), 1, 336-348], таксорет [J.Med. Aromat. Sci. (2001), 22/4А-23/1А 4-5], IDN 5109 [Chirality, (2000), 12 (5/6), 431-441], BMS 188797 [Clinical Cancer Research. 5 (suppl.), 3859, Nov 1999], BMS184476 [L. Clinical Oncology 19: 2493-2503, 1 May 2001].
Термин «камптотецины» [(a) Cancer Chemotherapy and Biotherapy: Principle and Practice, 2nd Ed., Lippincott-Ravenmeans, page 463-484, (b) Biochim. Biophys. Acta (1998), 1400 (1-3), 107-119] обозначает любые соединения со структурой камптотецина, например камптотецин, топотекан, SN-38, 9-аминокамптотецин, 9-нитрокамптотецин, луртотекан [Br. J. Cancer (1998), 78 (10), 1329-1336], DX-8951f [Ann. N.Y. Acad. Sci. (2000), 922 (Camptotecins), 260-273], BN-80915 [Anti-cancer Drugs (2001), 12(1), 9-19] и т.д.
Термин «противораковые нуклеозиды» обозначает производное цитидина [Cancer Chemotherapy and Biotherapy: 2nd Ed., Lippincott-Ravenmeans, page 213-233], например, DFDC (гемцитабин), DMDC [Clin. Cancer Res. (2000), 6(6), 2288-2294], FMDC [Curr.Opin. Invest. Drugs (PharmaPress Ltd.) (2000), 1(1), 135-140], Ara-C, децитабин [IDrugs (2000), 3(12), 1525-1533] троксацитабин [Clin.Cancer Res. (2000), 6(4), 1574-1588], 2'-циано-2'-дезоксицитидин (CNDAC), 3'-этинилцитидин (TAS106) [Jpn.J. Cancer Res. (2001), 92 (3), 343-351], 5-фтор-5'-дезоксицитидин [Bioorg. Med. Che. Lett., (2000), 8, 1697-1706], 5-винил-5'-дезоксицитидин или производное аденозина [Cancer Chemotherapy and Biotherapy: Principle and Prectice, 2nd Ed., Lippincott-Ravenmeans, page 235-252], например флударабин, кладрибин и т.п.
Термин «доластатины» обозначает доластатин 10 [Curr. Pharm. Des. (1999), 5(3), 139-162], доластатин 14, TZT1027 [Drugs Future (1999), 24(4), 404-409], цемадотин и т.п.
Термин «антрациклины» [Cancer Chemotherapy and Biotherapy: Principle and Prectice, 2nd Ed., Lippincott-Ravenmeans, page 409-434] обозначает адриамицин, дауномицин, идарубицин и т.п.
Термин «ингибиторы фарнезилтрансферазы» обозначает R115777 [Cancer Res. (2001), 61(1), 131-137] и т.д.
Термин «тирозинкиназные ингибиторы рецептора EGF» обозначает ZD 1839 [Drugs (2000), 60 (Suppl.1), 33-40], CP 358774 (OSI-774) [J. Pharmacol. Exp. Thr. (1999), 291 (2), 739-748], PD 158780 [J. Mad, Chem. (2001), 44(3), 429-440], GW2016 и т.д.
Приведенные ниже символы и сокращения, используемые в тексте описания, относятся к следующим соединениям:
а) таксол означает
6,12b-бис(ацетилокси)-12-(бензоилокси)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-4,11-дигидрокси-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодекса[3,4]бенз[1,2-b]оксет-9-иловый эфир [2aR-[2aα,4β,4αβ,6β,9α(αR*,βS*),11α,12α,12aα,12bα]-β-(бензоиламино)-α-гидроксибензолпропановой кислоты,
b) таксотер означает
12b-(ацетилокси)-12-(бензоилокси)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-4,6,11-тригидрокси-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклододека[3,4]бенз[1,2-b]оксет-9-иловый эфир [2aR-[2aα,4β,4aα,6β,9α(αR*,βS*,11α,12α,12aα,12bα)]-β-[[(1,1-диметилэтокси)карбонил]амино)-α-гидроксибензолпропановой кислоты,
с) IDN 5109 означает
(3aS,4R,7R,8aS,9S,10aR,12aS,12bR,13S,13aS)-7,12a-бис(ацетилокси)-13-бензилокси)-3а,4,7,8,8а,9,10,10а,12,12а,12b,13-додекагидро-9-гидрокси-5,8а,14,14-тетраметил-2,8-диоксо-6,13а-метано-13аН-оксето[2",3":5',6']бензо[1',2':4,5]циклодека[1,2-d]-1,3-диоксол-4-иловый эфир (2R,3S)-3-[[(1,1-диметилэтокси)карбонил]амино]-2-гидрокси-5-метил-4-гексеновой кислоты,
d) BMS 188797 означает
(2aR,4S,4aS,6R,9s,11S,12S,12aR,12bS)-6-(ацетилокси)-12-(бензоилокси)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-4,11-дигидрокси-12b-[(метоксикарбонил)окси]-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека[3,4]бенз[1,2-b]оксет-9-иловый эфир (2R,3S)-β-(бензоиламино)-α-гидроксибензолпропановой кислоты, и
е) BMS 184476
(2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-бис(ацетилокси)-12-(бензоилокси)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-11-гидрокси-4a,8,13,13-тетраметил-4-[(метилтио)метокси]-5-оксо-7,11-метано-1Н-циклодека[3,4]бенз[1,2-b]оксет-9-иловый эфир (2R,3S)-β-(бензоиламино)-α-гидроксибензолпропановой кислоты,
f) камптотецин означает
4(S)-этил-4-гидрокси-1Н-пирано[3',4':6,7]индолизино[1,2b]хинолин-3,14(4Н,12Н)-дион,
g) топотекан означает
моногидрохлорид (4S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1Н-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14(4Н,12Н)-диона,
h) DX-8951f означает
(1S,9S)-1-амино-9-этил-5-фтор-9-гидрокси-4-метил-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13-дион,
i) BN-80915 означает
5(R)-этил-9,10-дифтор-1,4,5,13-тетрагидро-5-гидрокси-3Н,15Н-оксепино[3',4':6,7]индолизино [1,2-b]хинолин-3,15-дион,
j) 9-аминокамптотецин означает
(S)-10-амино-4-этил-4-гидрокси-1Н-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14(4Н,12Н)-дион,
к) 9-нитрокамптотецин означает
4(S)-этил-4-гидрокси-10-нитро-1Н-пирано[3',4':6,7]-индолизино[1,2-b]хинолин-3,14(4Н,12Н)-дион,
l) DFDC означает
2'-дезокси-2',2'-дифторцитидин,
m) DMDC означает
2'-дезокси-2'-метилиденцитидин,
n) FMDC означает
(Е)-2'-дезокси-2'-(фторметилен)цитидин,
о) Ara-C означает
1-(β-D-арабинофуранозил)цитозин,
p) децитабин означает
4-амино-1-(2-дезокси-β-D-эритропентофуранозил)-1,3,5-триазин-2(1Н)-он,
q) троксацитабин означает
4-амино-1-[(2S,4S)-2-(гидроксиметил)-1,3-диоксолан-4-ил]-2(1H)-пиримидинон,
r) флударабин означает
2-фтор-9-(5-О-фосфоно-β-D-арабинофуранозил)-9Н-пурин-6-амин,
s) кладрибин означает
2-хлор-2'-дезоксиаденозин,
t) доластатин 10 означает
N,N-диметил-L-валил-N-[(1S,2R)-2-метокси-4-[(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[[(1S)-2-фенил-1-(2-тиазолил)этил]амино]пропил]-1-пирролидинил]-1-[(1S)-1-метилпропил]-4-оксобутил]-N-метил-L-валинамид,
u) доластатин 14 означает
цикло[N-метилаланил-(2Е,4Е,10Е)-15-гидрокси-7-метокси-2-метил-2,4,10-гексадекатриеноил-L-валил-N-метил-L-фенилаланил-N-метил-L-валил-N-метил-L-валил-L-пролил-N2-метиласпарагинил],
v) доластатин 15 означает
(1S)-1-[[(2S)-2,5-дигидро-3-метокси-5-оксо-2-(фенилметил)-1Н-пиррол-1-ил]карбонил]-2-метилпропиловый эфир N,N-диметил-L-валил-L-валил-N-метил-L-валил-L-пролил-L-пролина,
w) TZT 1027 означает
N,N-диметил-L-валил-N-[(1S,2R)-2-метокси-4-[(2S)-2-[1R,2R)-1-метокси-2-метил-3-оксо-3-[(2-фенилэтил)амино]пропил]-1-пирролидинил]-1-[(1S)-1-метилпропил]-4-оксобутил]-N-метил-L-валинамид,
х) цемадотин означает
N,N-диметил-L-валил-L-валил-N-метил-L-валил-L-пролил-N-(фенилметил)-L-пролинамид,
y) адриамицин означает
гидрохлорид (8S,10S)-10-[(3-амино-2,3,6-тридезокси-L-ликсогексопиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метоксинафтацен-5,12-диона,
z) дауномицин означает
гидрохлорид 8-ацетил-10-[(3-амино-2,3,6-тридезокси-L-ликсогексопиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метоксинафтацен-5,12-диона,
аа) идарубицин означает
(7S,9S)-9-ацетил-7-[(3-амино-2,3,6-тридезокси-L-ликсогексопиранозил)окси]-7,8,9,10-тетрагидро-6,9,11-тригидроксинафтацен-5,12-дион
bb) ZD 1839 означает
N-(3-хлор-4-фторфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамин,
сс) CP 358774 означает
N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин,
dd) PD 158780 означает
N4-(3-бромфенил)-N6-метилпиридо[3,4-d]пиримидин-4,6-диамин,
ее) GW 2016 означает
N-(3-хлор-4-((3-фторбензил)окси)фенил)-6-(5-(((2-метилсульфонил)этил)амино)метил)-2-фурил)-4-хиназолинамин,
ff) R 115777 означает
6-[1-амино-1-(4-хлорфенил)-1-(1-метилимидазол-5-ил)метил]-4-(3-хлорфенил)-1-метилхинолин-2(1H)-он.
Согласно настоящему изобретению ферменты, которые предпочтительно экспрессируются в опухолевой ткани, избирательно активируя соединения, идентифицируют путем анализа уровней мРНК и/или белков в человеческой ткани. Затем из известных и/или новых цитотоксических лекарств конструируют соединения путем добавления фрагментов, которые маскируют биологические активности цитотоксических лекарств, но распознаются и избирательно удаляются указанными ферментами в опухолевых тканях-мишенях.
Нормальные и опухолевые человеческие ткани, используемые для анализа, включают ткань мозга, пищевода, сердца, легких, молочной железы, желудка, печени, поджелудочной железы, желчного пузыря, кишечника, толстой кишки, прямой кишки, почек, яичника, матки, яичка, предстательной железы, кожи, кости, костного мозга и крови. Предпочтительно предшественники гранулоцитов в качестве нормальных клеток используют для сравнения уровней экспрессии генов и/или белков в опухолевой и нормальной ткани, выбора генов и/или белков, которые предпочтительно экспрессируются в опухолевой ткани. После резекции человеческой ткани в ходе хирургической операции ее немедленно замораживают в жидком азоте или ацетоне, содержащим сухой лед, с добавлением или без добавления соединения О.С.Т. (Sakura-Seiki, Tokyo, Japan, Catalog № 4583) и хранят при температуре ниже -70°С или -80°С до последующего использования.
Если опухолевая ткань содержит значительное количество нормальных клеток, опухолевые клетки выделяют из ткани, залитой в ОСТ пролекарство, с помощью возбуждаемой лазером микродессекции (Ohyama H. et al. Laser capture microdessection - generated target sample for high-density oligonucleotide array hybridization. Biotechniques 29, 530-536 (2000), Leethanakul C. et al., Gene expression profiles in squamous cell carcinomas of the oral cavity: use of laser capture microdissection for the construction and analysis of stage-specific cDNA libraries. Oral Oncol 36, 474-83 (2000)). Для проведения микродессекции замороженные срезы толщиной 6 и 10 микрометров фиксируют 70% раствором этанола, окрашенного гематоксилином Майера, и заем дегидратируют в присутствии градиента этанола и ксилола. Микродессекцию опухолевых клеток проводят с помощью устройства для микродессекции с лазерным захватом (Olympus, Tokyo, Japan, Model LM200) и РНК в опухолевых клетках экстрагируют с использованием выпускаемого промышленностью набора (Micro RNA Isolation Kit, Stratagene, La Jolla, CA, USA).
Предшественников человеческих гранулоцитов, которые обладают наибольшей восприимчивостью к цитотоксическим лекарствам, готовили размножением CD34-положительных моноядерных клеток на мышиных стромальных клетках в присутствии некоторых цитокинов, включающих Flt3-лиганд, фактор стволовых клеток (SCF) и тромбопоэтин (TPO). CD34-положительные моноядерные клетки в крови человеческой пуповины или в костном мозге инкубировали и связывали с анти-CD34 антителом, коньюгированным с магнитными шариками, и подвергали очистке путем классификации клеток в магнитном поле (MACS) (Miltanyi, et al. In: Hematopoietic stem cells: The mulhouse manual, 201-213, AlphaMed press, Dayton (1994)). Очищенные CD34-моноядерные клетки, сохраняющие способность к дифференцировке в различные типы кроветворных клеток, размножали на чашах для культивирования и процентное количество предшественников гранулоцитов в культуре подтверждали изучением экспрессии CD34 после окрашивания клеток флуоресцентно-конъюгированным антителом против CD34. Обычно более 90% клеток в культуре становились предшественниками CD34-положительных гранулоцитов после размножения. Способность таких предшественников гранулоцитов к дифференцировке в миелобласты и затем в миелоциты и гранулоциты тестировали путем их обработки фактором стимуляции гранулоцитных колоний (G-CSF) или интерлейкином 3 (IL3) в комбинации с фактором стимуляции гранулоцит-макрофаговой колонии (GM-CSF) и G-CSF. Линию и стадии дифференцировки клеток изучали мониторингом таких антигенов поверхности клеток, как CD11, CD13 и CD15, методом флуоресцентной классификации клеток (FACS) с помощью FACSCalibur (Becton Dickinson, Franklin Lakes, New Jersey, USA) и/или методом микроскопии после окрашивания клеток красителем по Гимза (Diff-Quick) (Midori-Juji, Co. Osaka, Japan, Catalog № 16920) или красителем Leishman (Merck, Darmstadt, Germany, Catalog № 105387 0500). Данные FACS анализировали с помощью программного обеспечения FACSCalibur CELLQuest, в соответствии с руководством FACSCalibur, FACSStation ver.1.1. (Becton-Dickinson, Franklin Lakes, New Jersey, USA).
Ферменты и белки, экспрессирующиеся в некоторых опухолевых тканях, определяли измерением содержания их мРНК и/или белков в тканях и клетках человека. Уровни экспрессии мРНК определяли такими известными способами, как анализ ДНК на микроматрицах (Schena, M. Et al. Quantitative minitoring of gene expression patterns with complementary DNA microarray, Science 270, 467-470 (1995), and Lipshutz, R.J. et al. High density synthetic oligonucleotide arrays. Nature Genetics 21, 20-24 (1999)), полимеразная реакция с обратной транскрипцией (далее RT-PCR) (Weis, J.H. et al. Detection of rare mRNAs via quantitative RT-PCR, Trend Genetics 8, 263-264 (1992), Bustin, S.A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain traction assays, J. Mol. Endocrinol. 25, 169-193 (2000)), нозерн-блоттинг и гибридизация in situ (Parker, R.M., Barnes N.M. mRNA: detection in situ and northern hybridization, Methods Mol. Biol. 106, 247-283 (1999), анализ на защиту РНК (Hod, Y.A. Samplified ribonuclease protection assay, Biotechniques 13, 8520854 (1992), Saccomanno, C.F. et al. A faster ribonuclease protection assay, Biotechniques 13, 846-850 (1992)), вестерн-блоттинг (Towbin, H. et al. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets, Proc. Natl. Acad. Sci. US A 764350-4354 (1979), Burnette, W,N, Western blotting: Electrophoretic transfer of proteins form sodium dodecyl sulfate-polyacrylamide gels to unmodified nitrocellulose and radioiodinated protein A, Anal. Biochem. 112, 195-2-3 (1981)), анализ ELISA (Engvall E, Perlman, P. Enzyme-linked immunosorbent assay (ELISA): Quantitative assay of immunoglobulin G, Immunochemistry 8: 871-879 (1971) и анализ белков на матрицах (Merchant, M, Weinberger, S.R. Review: Recent advancements in surface-enhanced laser desorption|ionization-time of light-mass spectrometry, Electrophoresis 21, 1164-1177 (2000), Paweletz, C.P. et al. Rapid protein display profiling of cancer progression directly from human tissue using a protein biochip, Drug Development Research 49, 34-42 (2000)). Для высокопроизводительного и количественного анализа экспрессии мРНК предпочтительно использовать такие методы, как анализ ДНК на микроматрицах и RT-PCR соответственно.
Для анализа ДНК на микроматрицах РНК вырезают из мелких кусков ткани и/или клеток, которые были заморожены в жидком азоте или системе ацетон-сухой лед, и хранились при температуре -70 или -80°С. Ткани или клетки гомогенизируют и РНК в ткани и клеточные гомогенаты экстрагируют хлороформом и осаждают изопропиловым спиртом. Препарат РНК, загрязненный ДНК, переваривают с DNase I и РНК дополнительно очищают гель-фильтрационной колонной хроматографией. Вывод о качестве РНК делают из соотношения между 28S и 18S рибосомальной РНК после электрофореза на агарозном геле и окрашивания РНК бромистым этидием.
Используя в качестве шаблона полную РНК, проводят синтез кДНК в присутствии олиго-dT праймера (Sawady Technology, Tokyo, Japan), который содержит последовательности Т7 промотора и обратной транскриптазы. Полученную кДНК экстрагируют смесью фенола и хлорформа и отделяют от коротких олигонулкеотидов методом гель-фильтрационной колонной хроматографии.
Используя в качестве матрицы кДНК, кРНК синтезируют с использованием Т7 полимеразы, аденозин трифосфата (АТР), трифосфата гуанозина (GTP), трифосфата цитидина (СТР), трифосфата уридина (UTP), Bio-11CTP и Bio-16 UTP (ENZO Diagnostics, Farmingdale, USA, Catalog № 42818 and 42814 соответственно) при 37°С в течение 6 часов. Полученную в результате кРНК отделяют от нуклеотидов методом гель-фильтрационной колонной хроматографии. Вывод о качестве кРНК делают из длины кРНК после электрофореза на агарозном геле и окрашивания кРНК бромистым этидием.
Анализ ДНК на микроматрицах проводят в присутствии олигонуклеотидных чипов высокой плотности (матрица HuGeneFL, Affymetrix, Santa Clara, USA, Catalog № 510137) (Lipshutz, R.L. et al. Nature Genet. 21, 20-24 (1999)) в соответствии с инструкциями производителя. Фрагментацию кРНК при 95°С, гибридизацию и промывку осуществляют в соответствии с инструкциями производителя. Каждый пиксель регистрируют с помощью лазерного сканера (Affymetrix, Santa Clara, USA) и уровни экспрессии каждой кДНК и достоверность определения (запрос на присутствие/отсутствие) рассчитывают с помощью программного обеспечения Affymetrix GeneChip ver.3. и Affymetrix Microarray Suite ver. 4.0.
Помимо анализа ДНК на микроматрицах, другие методы, включающие RT-PCR (Weis,J.H. et al. Detection of rare mRNAs via quantitative RT-PCR, Trend Genetics 8, 263-264 (1992), and Bustin, S.A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain traction assays, J. Mol. Endocrinol. 25, 169-193 (2000)), нозерн-блоттинг и гибридизацию in situ (Parker, R.M., Barnes N.M. mRNA: detection in situ and northern hybridization, Methods Mol. Biol. 106, 247-283 (1999)), дифференциальное отображение (Zhu, W, and Liang, P. Detection and isolation of differentially expressed genes by differential display, Methods Mol. Biol. 68, 211-20 (1997), Liang, P., Pardee A.D. Differential display of euceriotic messenger RNA by means of the polymerase chain reaction. Science, 257, 967-971 (1992)), анализ с защитой РНК (Hod, Y.A. Samplified ribonuclease protection assay, Biotechniques 13, 8520854 (1992), Saccomanno, C.F. et al. A faster ribonuclease protection assay, Biotechniques 13, 846-850 (1992)), анализ белков на матрице ((Merchant, M, Weinberger, S.R. Review: Recent advancements in surface-enhanced laser desorption/ionization-time of light-mass spectrometry, Electrophoresis 21, 1164-1177 (2000), Paweletz, C.P. et al. Rapid protein display profiling of cancer progression directly from human tissue using a protein biochip, Drug Development Research 49, 34-42 (2000)), вестерн-блоттинг (Towbin, H. et al. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets, Proc. Natl. Acad. Sci. US A 764350-4354 (1979), Burnette, W,N, Western blotting: Electrophoretic transfer of proteins form sodium dodecyl sulfate-polyacrylamide gels to unmodified nitrocellulose and radioiodinated protein A, Anal. Biochem. 112, 195-2-3 (1981)), двухмерный гель-электрофорез (O'farrell, P.H. High-resolution two-dimensional electrophoresis of protein. L. Biol. Chem. 250: 4007-4021 (1975)), анализ ELISA (Engwall, E., Perlman, P. Enzyme-linked immunosorbent assay (ELISA): Quantitative assay of immunoglobulin G. Immunochemistry 8: 871-879 (1971)), также могут использоваться для определения уровней содержания мРНК и/или белков.
Ферменты и/или белки, которые преимущественно экспрессируются в некоторых опухолях, но не в предшественниках гранулоцитов и других нормальных тканях, идентфицируют путем сравнения уровней содержания мРНК и белков в опухолевой ткани с соответствующими значениями в нормальной ткани. Гены и/или белки, уровни экспрессии которых в некоторых опухолях и предшественниках гранулоцитов отличаются более чем вдвое, выбирают в качестве генов-кандидатов для ферментов и/или белков, подходящих для активации ТТС. Более предпочтительны те гены и/или белки, которые демонстрируют наибольшие различия в уровнях экспрессии между экспрессией в некоторых опухолях и предшественниках гранулоцитов. После этого уровни мРНК, продемонстрировавшие высокую экспрессию в некоторых опухолевых тканях, но не в предшественниках гранулоцитов, сравнивают с соответствующими значениями в других нормальных тканях, в особенности с нормальной печенью, поскольку печень является главным органом, ответственным за метаболизм большинства лекарственных средств. Выбирают те мРНК, уровни которых в некоторых опухолевых тканях выше соответствующих значений в предшественниках гранулоцитов и других нормальных тканях, особенно в печени.
Дополнительную селекцию проводят среди ферментов и/или белков, выбранных в соответствии с различием в уровнях экспрессии между некоторыми опухолевыми тканями и предшественниками гранулоцитов и другими нормальными тканями, например печенью, обладающих относительно широким спектром специфичности в отношении субстрата и механизмом ферментной реакции, подходящим для конструирования соединения.
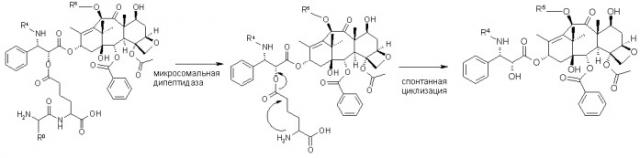
Такие ферменты включают фосфолипазу С, микросомальную дипептидазу, арилсульфатазу А, DT-диафоразу, пирролин 5'-карбоксиредуктазу, дегидродиолдегидрогеназу, карбонилредуктазу, лизилгидроксилазу, пролидазу, дигидропиримидиназу, глутамин:фруктоза-6-фосфат амидотрансферазу, UDP-галактозакерамидгалактозилтрансферазу, лизилоксидазу, энолазу, глюкоза-6-фосфатдегидрогеназу, стеароил-кофермент А десатуразу, эпоксидгидролазу и альдолазу С.
Более предпочтительные ферменты для конструирования ТТС представляют собой микросомальные дипептидазы, фосфолипазу С, DT-диафоразу, дигидродиолдегидрогеназу, пирролин 5'-карбоксиредуктазу, карбонилредуктазу, лизилгидролазу или матричные металлопротеиназы.
Рассматриваемые ферменты могут использоваться для создания противораковых соединений формулы (I)
X-Y-Q (I),
в которой
Х представляет собой про-фрагмент, предназначенный для избирательной генерации активного противоракового вещества (Q