Аналоги гимбацина, их применение и фармацевтическая композиция на их основе, обладающая свойствами антагониста рецептора тромбина
Иллюстрации
Показать всеДанное изобретение относится к замещенным по гетероциклу трициклическим соединениям нижеприведенной формулы или их фармацевтически приемлемой соли, где R означает водород; R1 и R2 независимо выбраны из группы, включающей водород или алкил с 1-6 атомами углерода, R3 означает водород, n1 и n2 независимо равны 0-3, при условии, что оба не равны 0; Het означает пиридил, при этом Het присоединен к В через циклический атом углерода и содержит от 1 до 4 заместителей, W, независимо выбранных из группы, включающей -NR4R5; -NHCOR26; -NHSO2R16; R21-арил; и R21-гетероарил, при этом гетероарил представляет собой фурил, тиенил, пиридил, тиазолил, пирролидинил, азетидинил; R4 и R5 означают водород или алкил с 1-6 атомами углерода, или R4 и R5 совместно означают -(СН2)3-, -(СН2)4-, -(СН2)5- или -(CH2)2NR7-(CH2)2-; R7 означает водород или алкил с 1-6 атомами углерода; R8, R9, R10 и R11 означают водород; B означает (CH2)n4CR12=CR12a(СН2)n5, где n4 и n5 независимо равны 0-2, и R12 и R12a независимо выбраны из группы, включающей водород или алкил с 1-6 атомами углерода; R21 означает от 1 до 3 заместителей, независимо выбранных из группы, включающей водород, трифторметил, трифторметокси, галоген, циано, алкил с 1-6 атомами углерода, алкокси с 1-6 атомами углерода, или -CR29(=NOR28); R22 означает -COR23, -S(O)R31, -S(O)2R31 или -COOR27; R23 означает циклоалкил с 3-7 атомами углерода; (С3-С7)циклоалкил(С1-С6)алкил; циклоалкил с 3-7 атомами углерода, содержащий от 1 до 3 заместителей, выбранных из группы, включающей галоген, (C1-С3)алкокси(С1-С3)алкил, гидрокси и алкокси с 1-6 атомами углерода; арил; арил(С2-С6)алкил; R27 означает алкил с 1-6 атомами углерода, фенил или бензил; R28 и R29 независимо выбраны из группы, включающей водород или алкил с 1-6 атомами углерода; R31 означает алкил с 1-6 атомами углерода; галогеналкил с 1-6 атомами углерода; арил; арил(С1-С6)алкил, а также содержащие их фармацевтические композиции и их применение для получения лекарственного средства для лечения тромбоза, атеросклероза, рестенозы, гипертензии, стенокардии, аритмии, порока сердца и рака.
5 н. и 5 з.п. ф-лы, 10 табл.
Реферат
Изобретение относится к новым пиперидиновым алкалоидам, более конкретно к новым аналогам гимбацина, их применению и фармацевтической композиции на их основе, обладающей свойствами антагониста рецептора тромбина.
Известно, что тромбин обладает различной активностью в разных типах клеток, и известно, что рецепторы тромбина находятся в таких типах клеток, как тромбоциты, различные гладкомышечные клетки, эндотелиальные клетки и фибробласты человека. Поэтому предполагается, что антагонисты рецептора тромбина будут полезны при лечении тромбоцитарных, воспалительных, атеросклеротических и фибропролиферативных заболеваний, а также других заболеваний, в патологии которых играют роль тромбин и его рецепторы.
Пептидные антагонисты рецептора тромбина выявлены с помощью исследований зависимостей структура - активность, включавших замещение аминокислот рецепторов тромбина. В работе Bernatowicz et al., J. Med. Chem., 39 (1996), p.4879-4887, описаны тетра- и пентапептиды как активные антагонисты рецептора тромбина, например N-транс-циннамоил-п-фтор-Phe-п-гуанидино-Phe-Leu-Arg-NH2 и N-транс-циннамоил-п-фтор-Phe-п-гуанодино-Phe-Leu-Arg-Arg-NH2. Пептидные антагонисты рецептора тромбина также раскрыты в международной заявке WO 94/03479, опубликованной 17 февраля 1994 г.
Каннабиноидные рецепторы относятся к надсемейству рецепторов, связывающих G-белок. Они подразделяются на преимущественно нейронные рецепторы CB1 и преимущественно периферические рецепторы СВ2. Эти рецепторы проявляют свою биологическую активность путем модуляции аденилатциклазы и потоков Са+2 и K+. В то время как воздействие рецепторов CB1 в основном связано с центральной нервной системой, полагают, что рецепторы СВ2 в основном проявляют периферические воздействия, связанные с сужением бронхов, иммуномодуляцией и воспалением. Как таковой реагент, селективно связывающий рецептор СВ2, предположительно может найти применение в терапии при лечении заболеваний, сопутствующих ревматоидному артриту, системной красной волчанке, рассеянному склерозу, диабету, остеопорозу, ишемии почек, апоплексическому удару, ишемии головного мозга, нефриту, воспалительным заболеваниям легких и желудочно-кишечного тракта и заболеваниям дыхательных путей, таким как обратимая обструкция дыхательных путей, хроническая астма и бронхит (R.G.Pertwee, Curr. Med. Chem. 6(8), (1999), 635).
Гимбацин, пиперидиновый алкалоид формулы
был идентифицирован как антагонист мускаринового рецептора. Полный синтез (+)-гимбацина раскрыт в CHackalamannil et al., J. Am. Chem Soc., 118 (1996), p.9812-9813.
Настоящее изобретение относится к аналогам гимбацина формулы (I)
или их фармацевтически приемлемой соли, где:
R означает водород;
R1 и R2 независимо выбраны из группы, включающей водород или алкил с 1-6 атомами углерода,
R3 означает водород,
n1 и n2 независимо равны 0-3, при условии, что оба не равны 0;
Het означает пиридил, при этом Het присоединен к В через циклический атом углерода и содержит от 1 до 4 заместителей, W, независимо выбранных из группы, включающей -NR4R5; -NHCOR26; -NHSO2R16;
R21-арил; и R21-гетероарил, при этом гетероарил представляет собой фенил, тиенил, пиридил, тиазолил, пирролидинил, азетидинил;
R4 и R5 означают водород или алкил с 1-6 атомами углерода, или R4 и R5 совместно означают -(СН2)3-, -(СН2)4-, -(СН2)5- или -(CH2)2NR7-(CH2)2-;
R7 означает водород или алкил с 1-6 атомами углерода;
R8, R9, R10 и R11 означают водород;
В означает -(CH2)n4CR12=CR12a(CH2)n5, где n4 и n5 независимо равны 0-2,
и R12 и R12a независимо выбраны из группы, включающей водород или алкил с 1-6 атомами углерода;
R21 означает от 1 до 3 заместителей, независимо выбранных из группы, включающей водород, трифторметил, трифторметокси, галоген, циано, алкил с 1-6 атомами углерода, алкокси с 1-6 атомами углерода, или -CR29(=NOR28);
R22 означает -COR23, -S(O)R31, -S(O)2R31 или -COOR27;
R23 означает циклоалкил с 3-7 атомами углерода; (С3-С7)циклоалкил-(С1-С6)алкил; циклоалкил с 3-7 атомами углерода, содержащий от 1 до 3 заместителей, выбранных из группы, включающей галоген, (С1-С3)алкокси(С1-С3)алкил, гидрокси и алкокси с 1-6 атомами углерода; арил; арил(С2-С6)алкил;
R27 означает алкил с 1-6 атомами углерода, фенил или бензил;
R28 и R29 независимо выбраны из группы, включающей водород или алкил с 1-6 атомами углерода;
R31 означает алкил с 1-6 атомами углерода; галогеналкил с 1-6 атомами углерода; арил; арил(С1-С6)алкил.
Настоящее изобретение также относится к применению соединения формулы (I) для получения лекарственного средства для лечения тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, порока сердца, инфаркта миокарда, громерулонефрита, тромботического удара, тромбоэмболического удара, заболеваний периферических сосудов, ишемии головного мозга или рака.
Дальнейшим объектом изобретения является фармацевтическая композиция, обладающая свойствами антагониста рецептора тромбина, включающая эффективное количество, по меньшей мере, одного соединения формулы (I) и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к аналогам гимбацина формулы (II)
где W и Z являются такими, как указано в приведенной ниже Таблице:
| W | Z |
| -S- | |
| -S(O)- | |
| -O- | |
| -O- | |
| -O- | |
| -O- | |
| -O- | |
| -O- | |
| -NH- | |
| -N(CH3)- |
Соединения формулы (II) также представляют собой антагонисты рецептора тромбина, которые также известны как антагонисты рецептора, активируемого протеазой (РАП).
Соединения по настоящему изобретению также связывают каннабиноидные рецепторы (СВ2) и применимы при лечении воспалительных заболеваний или респираторных заболеваний, таких как одно или большее количество заболеваний, выбранных из группы, включающей ревматоидный артрит, системную красную волчанку, рассеянный склероз, диабет, остеопороз, ишемия почек, апоплексический удар, ишемию головного мозга, нефрит, воспалительные заболевания легких и желудочно-кишечного тракта и заболевания дыхательных путей, такие как обратимая обструкция дыхательных путей, хроническая астма и бронхит.
Предпочтительные значения переменных в структурной формуле (I) являются следующими.
В первую группу предпочтительных соединений формулы (I) входят соединения, у которых сумма n1 и n2 равна 3.
Во вторую группу предпочтительных соединений формулы (I) входят соединения, у которых R1, R2, R3, R8, R9, R10 и R11 означают водород.
В третью группу предпочтительных соединений формулы (I) входят соединения, у которых В означает -СН=СН-; Het означает пиридил, W-замещенный пиридил; W означает -NR4R5, -NHCOR26, -NHSO2R16, R21-арил или R21-гетероарил, при этом R21 означает от 1 до 3 заместителей, независимо выбранных из группы, включающей водород, трифторметил, трифторметокси, галоген, циано, алкил с 1-6 атомами углерода, алкокси с 1-6 атомами углерода и -CR29(=NOR28).
В четвертую группу предпочтительных соединений формулы (I) входят соединения, у которых R22 означает -COR23, -S(O)2R31 или -COOR27; R23 означает циклоалкил с 3-7 атомами углерода; циклоалкил с 3-7 атомами углерода, содержащий от 1 до 3 заместителей, выбранных из группы, включающей галоген, (С1-С3)алкокси(С1-С3)алкил, гидрокси и алкокси с 1-6 атомами углерода; (С3-С7)циклоалкил(С1-С6)алкил; арил; или арил(С2-С6)алкил; R31 означает алкил с 1-6 атомами углерода, арил или арил(С1-С6)алкил, и R27 означает алкил с 1-6 атомами углерода, фенил или бензил.
В пятую группу предпочтительных соединений формулы (I) входят соединения, выбранные из группы, включающей соединения формулы:
где W и R22 являются такими, как указано в Таблице:
| W | R22 |
| -CO2Et | |
| -CO2Et | |
| -CO2Et | |
| -CO2Et | |
и аналоги гимбацина формулы:
где W является таким, как указано в приведенной ниже Таблице:
| W | |
В шестую группу предпочтительных соединений формулы (I) входят соединения, выбранные из группы, включающей соединения формулы (II)
где W и Z являются такими, как указано в приведенной ниже Таблице:
| W | Z |
| -S- | |
| -S(O)- | |
| -O- | |
| -O- | |
| -O- | |
| -O- | |
| -O- | |
| -O- | |
| -NH- | |
| -N(CH3)- |
Если не указано иного, то термин "алкил" означает линейные или разветвленные алкильные цепи, содержащие от 1 до 6 атомов углерода. То же самое является действительным для термина «алкокси».
"Галоген" означает радикалы фтора, хлора, брома или йода.
"Арил" означает фенил, нафтил, инденил, тетрагидронафтил или инданил.
Соединения по настоящему изобретению могут содержать, по меньшей мере, один асимметрический атом углерода и поэтому все изомеры, включая диастереоизомеры и поворотные изомеры, считаются частью настоящего изобретения. Настоящее изобретение включает (+)- и (-)-изомеры в чистом виде и в смеси, включая рацемические смеси. Изомеры можно получить с помощью обычных методик или по реакции оптически чистых или обогащенных определенными оптическими изомерами исходных веществ, или путем разделения изомеров соединения формулы (I).
Типичные предпочтительные соединения, соответствующие настоящему изобретению, обладают следующей стереохимической конфигурацией:
причем соединения, обладающие этой абсолютной стереохимической конфигурацией, являются более предпочтительными.
Специалисты в данной области техники должны понимать, что для некоторых соединений формулы I один изомер может обладать большей фармакологической активностью, чем другие изомеры.
Соединения по настоящему изобретению, которые содержат основные группы, могут образовывать фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примерами кислот, подходящих для образования солей, являются хлористоводородная, серная, фосфорная, уксусная, лимонная, щавелевая, малоновая, салициловая, яблочная, фумаровая, янтарная, аскорбиновая, малеиновая, метансульфоновая и другие неорганические и карбоновые кислоты, хорошо известные специалистам в данной области техники. Соль получают путем взаимодействия свободного основания с достаточным количеством необходимой кислоты с образованием соли. Свободное основание можно выделить путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор бикарбоната натрия. Свободное основание отличается от соответствующей соли по некоторым физическим характеристикам, таким как растворимость в полярных растворителях, однако для задач настоящего изобретения по остальным характеристикам соль эквивалентна соответствующему свободному основанию.
Некоторые соединения по настоящему изобретению являются кислотными (например, соединения, в которых содержится карбоксильная группа). Эти соединения могут образовывать фармацевтически приемлемые соли с органическими и неорганическими основаниями. Примерами таких солей являются соли натрия, калия, кальция, алюминия, золота и серебра. Также включаются соли, образующиеся с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксиалкиламины, N-метилглюкамин и т.п.
Соединения по настоящему изобретению обычно получают по методикам, известным в данной области техники, например по методикам, описанным ниже. В приведенных ниже общих методиках и примерах используются следующие аббревиатуры: Et означает этил, Me означает метил, Bn означает бензил, Ас означает ацетил, АсОН означает уксусную кислоту, THF означает тетрагидрофуран, DMF означает диметилформамид, реагент Дэвиса означает (1S)-(+)-(10-камфорсульфонил)-оксазиридин, LHMDS означает бис-(триметилсилил)-амид лития, DMAP означает 4-диметиламинопиридин, DBU означает 1,8-диазабицикло-[5.4.0]-ундец-7-ен, DCC означает 1,3-дициклогексилкарбодиимид и TMSI означает триметилсилилйодид.
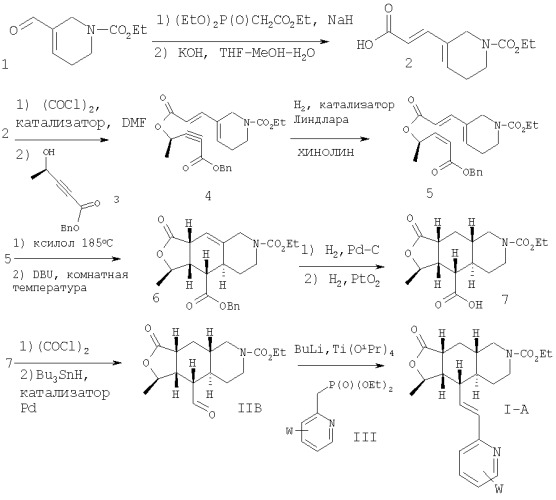
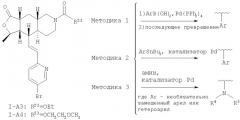
Соединения формулы I-A, где В означает -СН=СН-, Het означает W-замещенный пиридил, все R, R1, R3, R8, R9, R10 и R11 означают водород, R2 означает метил и R22 означает -CO2Et можно получить так, как показано на Схеме 1:
Схема 1:
Альдегид 1 превращают в диеновую кислоту 2 с помощью двустадийного превращения. Кислоту с помощью оксалилхлорида превращают в ее хлор-ангидрид, который затем вводят в реакцию сочетания со спиртом 3 и получают сложный эфир 4. Алкин селективно восстанавливают в цис-алкен 5, который после термической циклизации дает продукт 6. Дебензилирование с последующим восстановлением двойной связи дает трициклическую кислоту 7. Кислоту превращают в альдегид IIB через ее хлор-ангидрид, который вводят в реакцию сочетания с фосфонатом III и получают I-A.
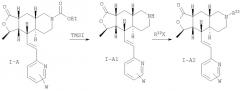
В соединениях формулы I-A этилкарбаматную группу можно расщепить и получить амин IA-1, который можно обработать с помощью самых различных электрофильных реагентов, таких как хлорангидриды кислот, сульфонилхлориды, изоцианаты, хлорформиаты и т.п., и получить амиды, сульфонамиды, мочевины и карбаматы и т.п., как показано на Схеме 2.
Схема 2:
Альдегид формулы IIB также можно ввести в реакцию сочетания с фосфонатом 8 и получить I-А3, который можно превратить в карбамат I-A4, как показано на Схеме 3. И I-А3 и I-A4 можно превратить в различные аналоги с использованием таких методологий, как сочетание по Судзуки, сочетание по Стиллу, аминирование по Бухвальду и т.п. (Схема 4).
Схема 3:
Схема 4:
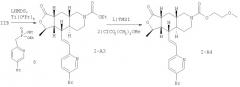
Арилбромид I-А3 также можно превратить в анилин I-A5, который можно обработать с помощью многих легко доступных электрофильных реагентов, таких как хлорангидриды кислот, сульфонамиды, изоцианаты и т.п., и получить соответствующие производные I-A6, как показано на Схеме 5.
Схема 5:
В α-положение лактонного фрагмента можно ввести функциональные группы, например соединения формулы I-А, в которых R3 означает водород, можно превратить в соответствующие соединения, в которых R3 означает ОН, путем обработки реагентом Дэвиса ((1S)-(+)-(10-камфор-сульфонил)-оксаридин) и LHMDS.
Аналогичные методики, известные специалистам в данной области техники, можно использовать для получения других необязательно замещенных групп Het и других групп "R". Специалисты в данной области техники должны понять, что эти методики в равной степени применимы для получения оптически активных или рацемических соединений.
Соединения формулы I, в которых R9 означает водород, можно превратить в соответствующие соединения, в которых R9 означает гидроксил, путем нагревания с окислительным реагентом, таким как SeO2.
Фосфонаты формулы III, в которых W означает арил или R21-арил, можно получить по методике, аналогичной описанной ниже для получения трифторметилфенилзамещенного соединения, IIIa.
Имеющееся в продаже производное гидроксипиридина превращают в соответствующий трифторметилсульфонат с помощью ангидрида трифторметилсульфоновой кислоты и затем его вводят в реакцию сочетания с имеющейся в продаже бороновой кислотой в присутствии Pd(0) в условиях проведения реакции Судзуки. Полученный продукт превращают в фосфонат путем обработки н-бутиллитием с последующей обработкой диэтилхлорфосфатом.
Исходные вещества для описанных выше способов или имеются в продаже, известны в данной области техники, или получают по методикам, хорошо известным в данной области техники.
Реакционно-способные группы, не принимающие участия в указанных выше реакциях, во время проведения этих реакций можно защитить с помощью обычных защитных групп, которые после завершения реакции можно удалить по стандартным методикам. В представленной ниже Таблице А приведены некоторые типичные защитные группы:
| Таблица А | |
| Защищаемая группа | Защищаемая группа и защитная группа |
| -СООН | -COOалкил, -COOбензил, -СООфенил |
| -NH2 | |
| -ОН |
Ниже приведены примеры получения исходных веществ и соединений формулы I.
Приготовление 1
Стадия 1
К раствору 1-этилового эфира 3-метилового эфира 5,6-дигидро-2Н-пиридин-1,3-дикарбоновой кислоты (35,4 г, 166 ммоль) в CH2Cl2 (600 мл) при -78°С медленно прибавляют раствор 1 М DIBAL (365 мл, 365 ммоль, 2,2 экв.) в CH2Cl2 и смесь перемешивают в течение 1,5 часов. Реакцию останавливают путем прибавления 1 л насыщенного водного раствора соли Рошеле и органический слой отделяют. Водный слой экстрагируют с помощью 2×250 мл CH2Cl2 и объединенные органические слои промывают с помощью 500 мл рассола, сушат над MgSO4, фильтруют, концентрируют и полученное неочищенное вещество хроматографируют с помощью 40% EtOAc-гексан и получают 17 г (55%) спирта в виде масла.
К раствору полученного выше спирта (17,0 г, 92 ммоль) в 150 мл CH2Cl2 при комнатной температуре прибавляют NaHCO3 (15,4 г, 183 ммоль, 2 экв.) и реагент Десса-Мартина (46,7 г, 110 ммоль, 1,2 экв.) и суспензию перемешивают в течение 45 минут. К ней прибавляют 300 мл Et2O и раствор Na2S2O3·5H2O (70 г, 282 ммоль, 2 экв.) и NaHCO3 (15,4 г, 183 ммоль, 2 экв.) в 600 мл Н2О. Смесь энергично перемешивают, пока два слоя не станут прозрачными. Органический слой отделяют и водный слой экстрагируют с помощью 2×150 мл Et2O. Объединенные органические слои промывают с помощью порций по 300 мл водного раствора Na2S2O3/NaHCO3 и рассола, сушат над MgSO4, фильтруют и выпаривают и получают 15,3 г (91%) масла. МСВР (масс-спектроскопия высокого разрешения): 184,0966 (МН+).
Стадия 2:
К суспензии 60% NaH (4,35 г, 109 ммоль, 1,3 экв.) в THF (300 мл) при 0°С по каплям прибавляют триэтилфосфоноацетат (20 мл, 109 ммоль, 1,3 экв.) и смесь перемешивают при 0°С в течение 30 минут. К ней прибавляют раствор продукта, полученного на стадии 1 (15,3 г, 83,5 ммоль) и смесь перемешивают в течение 30 минут при 0°С. Реакцию останавливают путем прибавления 600 мл водного раствора NH4Cl, THF выпаривают и водную взвесь экстрагируют с помощью 3×200 мл Et2O. Объединенные органические слои промывают с помощью 200 мл рассола, сушат над MgSO4, фильтруют, концентрируют и хроматографируют с помощью 15% EtOAc-гексан и получают 19,9 г (94%) масла. МС (масс-спектроскопия): 254 (МН+).
Стадия 3:
К раствору продукта, полученного на стадии 2 (19,9 г, 79 ммоль), в смеси, содержащей по 100 мл СН3ОН, THF и Н2О, прибавляют КОН (13,3 г, 237 ммоль, 3 экв.) и смесь перемешивают при комнатной температуре в течение 2 часов. Смесь разбавляют с помощью 200 мл Н2О, подкисляют с помощью 1 N HCl до ˜рН 2 и экстрагируют с помощью 3×200 мл EtOAc. Объединенные органические слои промывают с помощью порций по 200 мл Н2О и рассола, сушат над MgSO4, фильтруют и выпаривают и получают 17,0 г (96%) бледно-желтого твердого вещества. МСВР: 226,1083 (MH+)
Стадия 4:
К раствору диеновой кислоты (17,0 г, 76 ммоль) в 400 мл CH2Cl2 при комнатной температуре прибавляют оксалилхлорид (13,2 мл, 151 ммоль, 2 экв.) и DMF (120 мкл, 1,6 ммоль, 2 мол.%). Смесь перемешивают в течение 1 часа, концентрируют и выпаривают с 100 мл безводного толуола и получают хлорангидрид.
К раствору полученного выше хлорангидрида кислоты 200 мл CH2Cl2 при 0°С прибавляют DMAP (925 мг, 7,6 ммоль, 0,1 экв.), раствор продукта, полученного на стадии 3 (15,4 г, 75 ммоль, 1,0 экв.) в 15 мл СН2Cl2, а затем Et3N (12,7 мл, 91 ммоль, 1,2 экв.). Смесь перемешивают в течение 1,5 часов при 0°С, затем разбавляют с помощью 600 мл Et2O. Раствор последовательно промывают с помощью 200 мл Н2О, 2×200 мл 1 N HCl, 200 мл водного раствора NaHCO3 и 200 мл рассола. Его сушат над безводным MgSO4, фильтруют, концентрируют и хроматографируют с помощью 20% EtOAc-гексан и получают 20 г (78%) смолы. МСВР: 412,1764 (МН+).
Стадия 5:
Суспензию продукта, полученного на стадии 4 (10 г, 29 ммоль), хинолин (700 мкл, 5,9 ммоль, 0,2 экв.) и катализатор Линдлара (1,0 г, 10 мас.%) в 150 мл THF перемешивают при давлении Н2, равном 1 атм, в течение 2,5 часов. Другую порцию массой 10 г продукта, полученного на стадии 4 аналогичным образом, восстанавливают с помощью катализатора Линдлара. Порции объединяют, фильтруют через целит, выпаривают и остаток повторно растворяют в 600 мл EtOAc. Его промывают с помощью 3×200 мл 1 N HCl и 200 мл рассола, сушат над MgSO4, фильтруют и выпаривают и получают 20 г смолы, которую немедленно используют для реакции Дильса-Альдера на стадии 6. МСВР: 414,1919 (МН+).
Стадия 6:
Раствор продукта, полученного на стадии 5 (20,0 г), в 500 мл нагревают в автоклаве при 185°С в течение 6 часов. Его охлаждают до комнатной температуры, обрабатывают с помощью DBU (1,8 мл, 12 ммоль, 0,2 экв.) в течение 1 часа, концентрируют и хроматографируют с помощью 25% EtOAc-гексан и получают 11,3 г (56%) циклизованного экзо-продукта. МСВР: 414,1923 (МН+).
Стадия 7:
Суспензию продукта, полученного на стадии 6 (11,2 г, 27 ммоль), 10% Pd-С (1,2 г, 10 мас.%) в 200 мл EtOAc перемешивают при давлении Н2, равном 1 атм, до завершения реакции. Ее фильтруют через целит, концентрируют и повторно растворяют в 200 мл СН3ОН. К этому раствору прибавляют 900 мг PtO2 и суспензию встряхивают в сосуде Парра при давлении Н2, равном 50 атм. Смесь фильтруют через целит и концентрируют и получают 8,5 г смолы. МСВР: 326,100 (МН+).
Стадия 8:
К раствору продукта, полученного на стадии 7 (415 мг, 1,28 ммоль), в 10 мл CH2Cl2 при комнатной температуре прибавляют оксалилхлорид (225 мкл, 2,58 ммоль, 2 экв.), а затем 1 каплю DMF. Раствор перемешивают при комнатной температуре в течение 1 часа и к этому времени прекращается выделение газа. Его концентрируют и подвергают азеотропной перегонке с безводным толуолом, получая хлорангидрид. Хлорангидрид растворяют в 6 мл безводного толуола, охлаждают до 0°С и прибавляют Pd(PPh3)4 (74 мг, 0,064 ммоль, 5 мол.%), а затем Bu3SnH (520 мкл, 1,93 ммоль, 1,5 экв.). Смесь перемешивают при 0°С в течение 3 часов, концентрируют и хроматографируют с помощью 50% EtOAc-гексан и получают 360 мг (91%) искомого соединения в виде смолы. МС: 310,1 (МН+).
Приготовление 2
3-Формил-5,6-дигидро-2Н-пиран превращают в трициклический альдегид с использованием методики, аналогичной описанной выше для соответствующих аминных аналогов.
Приготовление 3
Схема реакции:
К раствору фосфоната (3,49 г, 11,3 ммоль, 2 экв.) в THF (50 мл) при 0°С прибавляют 1 М раствор LHMDS в THF (11,3 мл, 11,3 ммоль, 2 экв.). После перемешивания в течение 10 мин прибавляют Ti(OiPr)4 (3,4 мл, 11,3 ммоль, 2 экв.), а затем раствор продукта, полученного в Приготовлении 1 (1,75 г, 5,7 ммоль, 1 экв.) в THF (10 мл), и смесь перемешивают в течение 1 часа в атмосфере N2. Реакционную смесь выливают в 5% водный раствор винной кислоты (100 мл) и экстрагируют с помощью EtOAc (3×100 мл). Объединенные органические слои промывают рассолом (150 мл), сушат над MgSO4, фильтруют и выпаривают досуха. Очистка с помощью хроматографии на силикагеле при элюировании с помощью 5% СН3ОН-СН2Cl2 дает 1,80 г (70%) искомого соединения в виде бледно-желтого вспененного вещества. 1Н ЯМР (400 МГц, CDCl3): 8,59 (d, J=4,8 Гц, 1Н), 7,76 (dd, J=3 Гц, 8,4 Гц, 1Н), 7,06 (d, J=8,4 Гц, 1Н), 6,56 (dd, J=9,6 Гц, 15,2 Гц, 1Н), 6,45 (d, J=15,2 Гц, 1Н), 4,73 (m, 1H), 4,35-4,05 (m, 2H), 4,12 (q, J=6,8 Гц, 2Н), 2,73-2,69 (m, 2Н), 2,47-2,35 (m, 3Н), 1,96 (q, 6,0 Гц, 1Н), 1,74 (d, J=12,8 Гц, 1Н), 1,41 (d, J=6,0 Гц, 3Н), 1,35-1,18 (m, 7Н), 1,10-0,98 (m, 1Н).
Приготовление 4
К раствору продукта, полученного в Приготовлении 3 (0,270 г, 0,58 ммоль), в СН2Cl2 (15 мл) прибавляют TMSI (624 мкл, 4,4 ммоль, 7,5 экв.) и смесь кипятят с обратным холодильником. Через 6 часов смесь выливают в водный раствор NaHCO3 (30 мл) и экстрагируют с помощью CH2Cl2 (3×15 мл). Объединенные органические слои промывают рассолом, сушат над MgSO4, фильтруют и выпаривают досуха, получая 209 мг амина (92%).
К полученному выше продукту в CH2Cl2 (15 мл) при 0°С прибавляют Et3N (97 мкл, 0,69 ммоль, 1,3 экв.) и 2-метоксиэтиловый эфир хлормуравьиной кислоты (68 мкл, 5,9 ммоль, 1,1 экв.); при перемешивании в атмосфере N2 смеси медленно дают нагреться до комнатной температуры. Через 1 час смесь выливают в воду (30 мл) и экстрагируют с помощью СН2Cl2 (3×15 мл). Объединенные органические слои промывают рассолом (30 мл), сушат над MgSO4, фильтруют и выпаривают досуха. Очистка с помощью хроматографии на силикагеле при элюировании с помощью 3% СН3ОН-CH2Cl2 дает 183 мг искомого соединения в виде белого твердого вещества (69%). 1Н ЯМР (400 МГц, CDCI3): 8,59 (d, J=2,4 Гц, 1Н), 7,76 (dd, J=2,4, 8,2 Гц, 1Н), 7,06 (d, J=8,3 Гц, 1Н), 6,56 (dd, J=9,6, 15,4 Гц, 1Н), 6,45 (d, J=15,4 Гц, 1Н), 4,72 (m, 1H), 4,1-4,28 (m, 4H), 3,59 (t, J=4,49 Гц, 2Н), 3,38 (s, 3H), 2,75-2,68 (m, 2H), 2,32-2,51 (m, 3Н), 1,96 (dd, J=6,3, 12,8 Гц, 1Н), 1,73 (d, J=12,5 Гц, 1Н), 1,41 (d, J=5,95 Гц, 3Н), 1,37-1,00 (m, 4Н).
Приготовление 5
Стадия 1:
Тиопираненаль получают по методике, описанной в работе McGinnis and Robinson, J. Chem. Soc, 404 (1941), 407.
Стадия 2:
К суспензии 60% NaH (6,3 г, 158 ммоль, 1,3 экв.) в THF (200 мл) при 0°С прибавляют метилдиэтилфосфоноацетат (29 мл, 158 ммоль, 1,3 экв.) и смесь перемешивают при 0°С в течение 30 минут. Раствор затем прибавляют к раствору продукта, полученного на стадии 1 (15,6 г, 122 ммоль), в THF (100 мл) и перемешивают при 0°С в течение 1 часа. Реакцию останавливают путем прибавления водного раствора NH4Cl (500 мл) и THF выпаривают. Водную фазу экстрагируют с помощью Et2O (3×200 мл) и объединенные органические слои промывают с помощью Н2О и рассола (по 200 мл каждого). Раствор сушат над MgSO4, концентрируют, полученный остаток хроматографируют с помощью 5% EtOAc-гексан и получают 13,0 г (58%) масла. 1Н ЯМР (400 МГц, CDCI3): 7,26 (d, J=15,9 Гц, 1Н), 6,26 (t, J=4,4 Гц, 1Н), 5,78 (dd, J=15,9, 0,6 Гц, 1Н), 3,75 (s, 3Н), 3,25-3,23 (m, 2H), 2,71 (t, J=5,8 Гц, 2H), 2,57-2,53 (m, 2H).
Стадия 3:
К раствору продукта, полученного на стадии 2 (13,0 г, 70,6 ммоль), в THF и МеОН (по 50 мл каждого) прибавляют раствор КОН (11,9 г, 212 ммоль, 3,0 экв.) в Н2О (50 мл). Смесь перемешивают при комнатной температуре в течение 1 часа, разбавляют с помощью Н2О (100 мл) и подкисляют с помощью 1 N HCl. Водную фазу экстрагируют с помощью EtOAc (3×200 мл) и объединенные органические слои промывают с помощью Н2О и рассола (по 300 мл каждого). Раствор сушат над MgSO4, фильтруют и выпаривают и получают 11,66 г (97%) бледно-желтого твердого вещества. 1Н ЯМР (400 МГц, CDCI3): 7,34 (d, J=15,6 Гц, 1Н), 6,32 (t, J=4,4 Гц, 1Н), 5,78 (d, J=15,6 Гц, 1Н), 3,26 (d, J=1,6 Гц, 2Н), 2,72 (t, J=5,8 Гц, 2Н), 2,59-2,55 (m, 2H).
Стадия 4:
К раствору 4 (5,2 г) в EtOAc (120 мл) прибавляют катализатор Линдлара (520 мг) и суспензию перемешивают при давлении Н2, равном 1 атм. Другую порцию катализатора (500 мг) прибавляют через 45 мин и смесь перемешивают в течение еще 30 мин. Смесь фильтруют через слой целита и выпаривают и получают 5,2 г (99%) искомого алкена. 1Н ЯМР (400 МГц, CDCI3): 7,38-7,26 (m, 5Н), 6,32 (dd, J=11,9, 6,6 Гц, 1Н), 5,86 (d, J=12,0 Гц, 1Н), 5,18 (s, 2H), 5,12-5,07 (m, 1H), 3,20 (br s, 1H), 1,34 (d, J=6,6 Гц, 3Н).
Стадия 5:
К раствору продукта, полученного на стадии 3 (2,45 г, 14,39 ммоль), в CH2Cl2 (60 мл) при 0°С прибавляют DCC (3,27 г, 15,85 ммоль, 1,1 экв.), а затем DMAP (352 мг, 2,88 ммоль, 0,2 экв.) и смесь перемешивают при 0°С в течение 30 минут. К ней прибавляют раствор 3,27 г (15,85 ммоль, 1,1 экв.) спирта, полученного на стадии 4, в 10 мл CH2Cl2 и смесь перемешивают при 0°С в течение 5 часов и при комнатной температуре в течение 1 часа. Раствор разбавляют с помощью 350 мл Et2O и промывают с помощью 2×200 мл водного раствора лимонной кислоты, 200 мл водного раствора NaHCO3 и 200 мл рассола. Раствор сушат над MgSO4, фильтруют, концентрируют и полученный остаток хроматографируют с помощью 6% EtOAc-гексан и получают 2,1 г (41%) смолы. 1Н ЯМР (400 МГц, CDCI3) 7,38-7,32 (m, 5Н), 7,45 (d, J=16,0 Гц, 1Н), 6,38-6,34 (m, 1H), 6,26 (t, J=4,6T4, 1Н), 6,21 (d, J=11,6 Гц, 1Н), 6,19 (d, J=11,2 Гц, 1Н), 5,85 (dd, J=11,6, 1,2 Гц, 1Н), 5