Применение анастрозола для лечения женщин в постклимактерическом периоде, которые страдают ранним раком молочной железы
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается применения анастрозола или его фармацевтически приемлемой соли для снижения значения возникновения рецидивов рака и для снижения значения возникновения новой контралатеральной первичной опухоли у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы. Также раскрыт способ снижения значения возникновения рецидивов рака и снижения значения возникновения новой контралатеральной первичной опухоли у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы. Данное изобретение позволяет расширить арсенал средств борьбы с возникновением рецидивов рака молочной железы. 4 н. и 5 з.п. ф-лы, 4 ил., 3 табл.
Реферат
Антиэстроген цитрат тамоксифена (NOLVADEX™) стал общепринятым в качестве стандартного средства основного лечения прогрессирующего рака молочной железы у женщин в постклимактерическом периоде. Кроме того, свыше 34000 женщин принимали участие в клинических исследованиях адъюванта тамоксифена, который применялся после первичного хирургического вмешательства. Противораковый эффект цитрата тамоксифена (далее «тамоксифен») связан с его способностью конкурировать с эстрогеном за сайты связывания в целевых тканях, таких как ткань молочной железы. В дополнение, он имеет разнообразные другие сложные механизмы, которые могут опосредовать его эффект, включая индукцию трансформирующего фактора роста бета в стромальных фибробластах, снижение уровней циркулирующего инсулинподобного фактора роста 1, ингибирование ангиогенеза и индукцию апоптоза. Несмотря на это, состояние рецептора эстрогена (ER) в опухолях остается мощным прогнозирующим параметром ответа.
При прогрессирующем заболевании приблизительно 70% пациентов, которые являются позитивными по ER и по рецептору прогестерона (PR), будут чувствительными к тамоксифену по сравнению с <10% пациентов, которые являются негативными по ER и PR (Muss, 1992 Breast Cancer Research and Treatment 21: 51-26). В присутствии адъюванта состояние ER первичной опухоли является менее избирательным, и в более позднем обзоре совместной группы исследователей в области раннего рака молочной железы (EBCTCG) [Lancet 351: 1451-1467] было высказано предположение, что только негативные по ER пациенты в предклимактерическом периоде вряд ли могут получить эффект при использовании адъюванта тамоксифена. Вероятно, что другие эндокринные подходы к адъювантному лечению раннего рака молочной железы, которые предусматривают снижение уровня циркулирующего эстрадиола (супрессия яичников и ингибирование ароматазы), зависят от интактного механизма рецептора эстрогена в сайтах метастатического заболевания.
Ингибиторы ароматазы представляют собой класс соединений, которые действуют системно при ингибировании синтеза эстрогена в тканях. Эти соединения предотвращают биосинтез эстрогена путем ингибирования фермента ароматазы, который катализирует превращение андрогенов надпочечников (андростенедиона и тестостерона) до эстрогенов (эстрогена и эстрадиола). Таким образом, существует заинтересованность в развитии таких соединений в качестве потенциальных средств терапии для чувствительного к гормонам рака молочной железы у женщин в постклимактерическом периоде.
Аминоглютетимид был первым ингибитором ароматазы, который был одобрен для лечения рака молочной железы, и имел доказанную эффективность у женщин в постклимактерическом периоде с прогрессирующим раком молочной железы (Stuart-Harris и др. 1984, Acta Oncology 27: 721-728). Более широкое применение лекарственного средства было ограничено отсутствием у него специфичности, что приводило к необходимости совместного введения кортикостероидов, а также к возникновению побочных эффектов, причиняющих беспокойство (Wells и др. 1978, Annals Surgery 187: 475-487). В соответствии с этим исследования были сфокусированы на развитии ингибиторов ароматазы, которые имели большую специфичность и лучший профиль переносимости.
Аримидекс™ (анастрозол) представляет собой нестероидный ингибитор ароматазы, который является высокоселективным, хорошо переносимым и эффективным при лечении прогрессирующего рака молочной железы (Buzdar и др. 1995, The Breast 4 (3): 256-257, Abs 104; Jonat и др. 1995, European Journal of Cancer 32A (3): 404-412; Plourde и др. 1995, Journal of Steroid Biochemistry 53:175-179). (Дополнительная информация о клинических опытах при использовании Аримидекса может быть найдена на предписанной информационной странице для Аримидекса). Анастрозол описан в патенте США № 366717, который введен в данную заявку как ссылка.
Применение адъювантной системной терапии после локального лечения рака молочной железы (при использовании хирургии или при отсутствии использования радиотерапии) приводило к увеличению периода безрецидивного выживания и общего выживания (EBCTCG, 1992, Lancet 339: 1-15, 71-85). Тамоксифен в настоящее время представляет собой агент, который выбирают для адъювантной эндокринной терапии при раке молочной железы. Для пациентов, подвергавшихся лечению с помощью адъюванта тамоксифена в течение двух лет или более, можно рассчитывать на ежегодное снижение рецидивов на 39% и на ежегодное снижение смертности на 24% при отсутствии совместной химиотерапии (EBCTCG, 1992). У женщин в предклимактерическом периоде с позитивными на рецептор эстрогена опухолями достигается больший благоприятный эффект, чем у женщин в постклимактерическом периоде, однако это имеет менее благоприятный эффект для негативных по ER женщин в предклимактерическом периоде. В противовес этому для женщин в постклимактерическом периоде, которые являются как позитивными по ER, так и негативными по ER, можно ожидать благоприятного эффекта, хотя существует предположение, что чем выше уровень ER в первичной опухоли, тем большая вероятность благоприятного эффекта.
Терапия на основе тамоксифена также обеспечивает благоприятные эффекты, которые касаются частичного агонистического действия лекарственного средства. Такие эффекты включают эффекты снижения уровня холестерина (Love и др. 1994, Journal of the National Cancer Institute 86: 1534-1539), кардиозащитные эффекты (McDonald и др. 1995, British Medical Journal 311: 977-980) и защиту от потери костной массы (Love и др. 1992, New England Journal of Medicine 326: 852-856). Однако с тамоксифеном также ассоциируются вредные эффекты, которые могут быть классифицированы как те, что являются следствиями антиэстрогенного действия лекарственного средства, например внезапный прилив жара, вагинальное кровотечение или избыточные выделения или сухость, и те, которые представляют собой более общие эффекты, например желудочно-кишечная непереносимость, возникновение опухолей, легкое головокружение, кожная сыпь.
Увеличение случаев рака эндометрия также было описано в ассоциации с лечением тамоксифеном. Появление и модель такого повышения дают возможность предположить, что лежащий в основе этого механизм может быть связан с эстрогенными свойствами тамоксифена. Фиброзные опухоли матки и другие изменения эндометрия, включая гиперплазию и полипы, также были продемонстрированы у пациентов, которые получают тамоксифен.
Тем не менее, хорошие результаты были получены с помощью тамоксифена в качестве адъювантной терапии у пациентов с ранним раком молочной железы, это является основной причиной для оценки альтернативных эндокринных модальностей в такой популяции пациентов, несмотря на то, что можно предвидеть, что комбинационные терапии будут более эффективными. Благоприятные эффекты могут включать более длительный период эффективности и возможную свободу от побочных эффектов, ассоциированных с частичными агонистическими свойствами тамоксифена.
Одна возможная комбинация представляет собой комбинацию анастрозола и тамоксифена в свете доказанной эффективности анастрозола при прогрессирующем раке молочной железы, его благоприятной переносимости и механизма действия, отличного от тамоксифена.
Раннее исследование при использовании отдельно ингибитора ароматазы, аминоглютетимида, продемонстрировало усовершенствования в отношении безрецидивного периода выживаемости и общего выживания по сравнению с плацебо (Coombes и др., 1987, Cancer Research 47, 2494-2497), однако необходимость поддерживающего лечения, а также ограниченная приемлемость для пациентов помешали дальнейшему развитию этих исследований. В противовес этому анастрозол в фазе III опытов второго курса лечения прогрессирующего рака молочной железы не только продемонстрировал подобную эффективность с ацетатом мегестрола, но также имел благоприятный профиль переносимости, в частности, в отношении достигаемого веса тела.
Нолвадекс™ и Аримидекс™ являются торговыми наименованиями и представляют собой собственность группы компаний АстраЗенека.
Неожиданно мы обнаружили, что анастрозол является эффективным и хорошо переносимым при адъювантном лечении рака молочной железы, но еще более неожиданным явилось то, что мы обнаружили, что анастрозол является значительно более эффективным, чем тамоксифен, для безрецидивного периода выживания при раннем раке молочной железы. Таким образом, в соответствии с первым аспектом изобретения в данной заявке обеспечивается способ снижения значения возникновения рецидивов рака у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы, включающий введение эффективного количества анастрозола или его фармацевтически приемлемой соли указанной женщине.
В соответствии с дальнейшей особенностью первого аспекта изобретения обеспечивается применение анастрозола или его фармацевтически приемлемой соли для получения лекарственного средства для снижения значения возникновения рецидивов рака у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы.
У женщин, которые получают адъювантное лечение рака молочной железы, рак может возникать повторно в той же молочной железе, что и исходный рак, или может возникать в другой молочной железе, так называемый контралатеральный рак молочной железы. Неожиданно мы также обнаружили, что анастрозол был значительно более эффективным, чем тамоксифен, в отношении снижения возникновения контралатерального рака молочной железы, таким образом, в соответствии со вторым аспектом изобретения в данной заявке обеспечивается способ снижения значения возникновения новой контралатеральной опухоли у женщины в постклимактерическом периоде, которая страдает раком молочной железы, включающий введение эффективного количества анастрозола или его фармацевтически приемлемой соли указанной женщине.
В соответствии со следующей особенностью изобретения обеспечивается применение анастрозола или его фармацевтически приемлемой соли для получения лекарственного средства для снижения значения возникновения новой контралатеральной первичной опухоли у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы.
Тамоксифен был одобрен для применения при адъювантной терапии раннего рака молочной железы и таким образом можно ожидать, что анастрозол будет обладать синергическим эффектом вместе с тамоксифеном, который истощает эстрогенный рецептор его естественного лиганда, позволяя в это время тамоксифену проявить свой благоприятный эффект через альтернативные биологические механизмы. Однако неожиданно мы обнаружили, что вместо того, чтобы быть более эффективной, чем один тамоксифен, комбинация анастрозола и тамоксифена была только эквивалентной тамоксифену, а также была значительно хуже, чем только анастрозол, для адъювантного лечения раннего рака молочной железы. Таким образом неожиданно было обнаружено, что тамоксифен снижает эффективность анастрозола при адъювантном лечении раннего рака молочной железы. Таким образом, в соответствии с третьим аспектом изобретения обеспечивается способ снижения значения рецидивов рака у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы, включающий введение эффективного количества анастрозола или его фармацевтически приемлемой соли указанной женщине, при этом анастрозол или его фармацевтически приемлемая соль вводятся при существенном отсутствии тамоксифена.
В соответствии с дальнейшей особенностью третьего аспекта изобретения обеспечивается применение анастрозола или его фармацевтически приемлемой соли существенно при отсутствии тамоксифена в препарате лекарственного средства для снижения значения рецидивов рака у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы.
Фраза «существенно при отсутствии тамоксифена» означает, что анатрозол назначается пациенту при отсутствии тамоксифена. Пациенты, получающие адъювантную терапию рака молочной железы, по всей вероятности до этого подвергались лечению с помощью тамоксифена. Таким образом, эта фраза относится больше к способу лечения при использовании анастрозола, чем к пациенту, которого подвергают лечению.
Неожиданно мы также обнаружили, что комбинация анастрозола и тамоксифена была только эквивалентной тамоксифену и значительно уступала анастрозолу, введенному отдельно, в отношении предупреждения контралатерального рака молочной железы. Таким образом, в соответствии с четвертым аспектом изобретения обеспечивается способ снижения значения возникновения новой контралатеральной первичной опухоли у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы, включающий введение эффективного количества анастрозола или его фармацевтически приемлемой соли указанной женщине, при этом анастрозол или его фармацевтически приемлемая соль вводятся при существенном отсутствии тамоксифена.
В соответствии с дальнейшей особенностью четвертого аспекта обеспечивается применение анастрозола или его фармацевтически приемлемой соли существенно при отсутствии тамоксифена в препарате лекарственного средства для снижения значения возникновения новой контралатеральной первичной опухоли у женщины в постклимактерическом периоде, которая страдает ранним раком молочной железы
В каждом из аспектов изобретения анастрозол или его фармацевтически приемлемая соль преимущественно назначаются в качестве дополнения к хирургии, химиотерапии или радиации. Хирургия включает удаление опухоли молочной железы, квандрантэктомию или мастэктомию.
В другом аспекте изобретения анастрозол или его фармацевтически приемлемая соль назначается женщине, которая страдает ранним раком молочной железы, и женщине, которая является позитивной по эстрогенному рецептору или позитивной по рецептору прогестерона, более предпочтительно позитивной по эстрогенному рецептору и позитивной по рецептору прогестерона.
Анастрозол может назначаться в дозе от 0,1 до 10 мг/день, предпочтительно от 0,5 до 5 мг/день, наиболее предпочтительно анастрозол назначают в дозе 1 мг/день.
Как описано выше, в одном аспекте изобретения анастрозол или его фармацевтически приемлемая соль назначаются при существенном отсутствии тамоксифена. Однако в дальнейшей особенности третьего и четвертого аспекта изобретения анастрозол назначается при существенном отсутствии антиэстрогенного агента, такого как арзоксифен, тамоксифен, фулвестрант, лазофоксифен, ралоксифен, торемифен, трилостан или TSE424, предпочтительно при отсутствии тамоксифена.
Лечение женщин в постклимактерическом периоде предпочтительно проводить так, как описано выше, однако лечение женщин в предклимактерическом периоде также предполагается.
В одном аспекте изобретения введение осуществляют непрерывно в течение, по крайней мере, одного года, предпочтительно в течение, по крайней мере, двух лет. Период, составляющий пять лет беспрерывного лечения, является наиболее предпочтительным, хотя период, больший чем пять лет, также предполагается.
При осуществлении способов в соответствии с данным изобретением анастрозол может обеспечиваться в различных рецептурах, таких как для парентерального введения (например, водные или масляные суспензии) или перорального введения (например, таблетки, порошки, капсулы, гранулы, водные или масляные суспензии). Предпочтительно, когда анастрозол обеспечивается в препаратах, которые доставляются перорально предпочтительно в форме композиций, которые содержат от 1 до 10 мг анастрозола, наиболее предпочтительно 1 мг. В исследовании, описанном ниже, использовали таблетки, содержащие 1 мг анастрозола.
Изобретение будет далее проиллюстрировано со ссылкой на следующий нелимитирующий пример, фигуры и таблицы. На этой фигуре надписи HR представляют собой аббревиатуру степени риска. Значения, в которых степень риска является меньшей чем 1,00, означают, что значения являются благоприятными для анастрозола или комбинации анастрозола и тамоксифена соответственно. Значения, в которых степень риска больше чем 1,00, означают, что значения являются благоприятными для тамоксифена. «Время до события» представляет собой время от начала получения терапии в пределах опытов до диагностики рецидива рака молочной железы. Фигуры 1-3 показывают кривые Каплана-Мейера, которые известны специалисту в данной области, однако больше информации можно найти в работе D.Collett Modelling Survival Data in Medical Research (опубликовано Chapman & Hall, 1994).
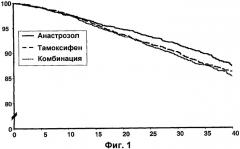
Фигура 1 - Кривые Каплана-Мейера безрецидивного выживания в популяции ITT.
Фигура показывает «время до возникновения события (месяцы)» по оси Х и «соотношение пациентов, у которых не наблюдается события, (%)» по оси Y.
| HR | 95,2% CI | Р-значение | |
| Анастрозол против тамоксифена | 0,83 | 0,71-0,96 | 0,0129 |
| Комбинация против тамоксифена | 1,02 | 0,88-1,18 | 0,7718 |
Эта фигура показывает, что в общей популяции анастрозол превосходит тамоксифен значительным снижением значения возникновения рецидивов заболевания, комбинация является подобной тамоксифену для общей популяции.
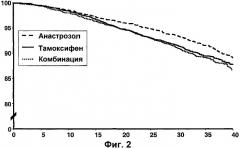
Фигура 2 - Кривые Каплана-Мейера безрецидивного выживания в позитивной по рецептору популяции. Фигура показывает «время до события (месяцы)» по оси Х и «соотношение пациентов, у которых отсутствует событие, (%)» по оси Y.
| HR | 95,2% CI | Р-значение | |
| Анастрозол против тамоксифена | 0,78 | 0,65-0,93 | 0,0054 |
| Комбинация против тамоксифена | 1,02 | 0,87-1,21 | 0,7786 |
Эта фигура показывает, что в общей популяции анастрозол превосходит тамоксифен значительным снижением значения возникновения рецидивов заболевания, комбинация является подобной тамоксифену для общей популяции.
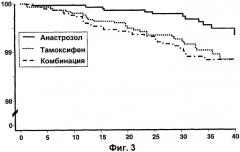
Фигура 3 - Анализ возникновения нового (контралатерального) первичного рака молочной железы. Фигура показывает «время до первого возникновения нового первичного контралатерального рака молочной железы (месяцы)» по оси Х и «соотношение пациентов без контралатерального рака молочной железы (%)» по оси Y.
| HR | 95,2% CI | Р-значение | |
| Анастрозол против тамоксифена | 0,42 | 0,22-0,79 | 0,0068 |
| Комбинация против тамоксифена | 0,84 | 0,51-1,40 | 0,5132 |
Эта фигура показывает, что превосходство анастрозола является также очевидным по значениям возникновения нового первичного (контралатерального) рака молочной железы по сравнению с тамоксифеном, в то время как комбинация является подобной тамоксифену.
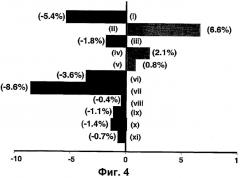
Фигура 4 - Существенная разница между анастрозолом и тамоксифеном в предварительно определенных неблагоприятных событиях, выраженная в процентах. Неблагоприятные события, которые менее превалируют у анастрозола, показаны с левой стороны фигуры, а неблагоприятные события, которые менее превалируют у тамоксифена, показаны с правой стороны фигуры. Показанные неблагоприятные события являются следующими:
(i) приливы жара
(ii) расстройства скелетной мускулатуры
(iii) достигнутый вес тела (значения с ≥10% достигнутого веса тела от базовой линии на второй год)
(iv) переломы любых костей
(v) переломы бедра, позвоночника, лодыжки (эти переломы являются индикаторами остеопороза)
(vi) вагинальное кровотечение
(vii) вагинальные выделения
(viii) рак эндометрия
(ix) ишемические сердечно-сосудистые случаи
(х) случаи венозной тромбоэмболии
(xi) тромбоз глубокозалегающих вен
Эта фигура показывает, что анастрозол является хорошо переносимым и что при осуществлении адъювантной программы не возникает никакой неожиданной опасности.
Таблица 1 - Обобщение характеристик пациентов в опыте.
Таблица 2 - Обобщение характеристик заболевания у пациентов в опыте.
Таблица 3 - Первые события в популяции ITT.
Сокращения: CI - доверительный интервал;
HR - степень риска;
ITT - цель - лечение;
od - один раз в день; и
OR - соотношение значений od.
Опыт был смоделирован и проведен для сравнения эффективности и безопасности тамоксифена и анастрозола, используемых в отдельности, а также анастрозола и тамоксифена в комбинации в качестве адъювантного лечения для женщин в постклимактерическом периоде, которые страдают ранним раком молочной железы и которые завершили свою первичную терапию. Опыт был смоделирован для сравнения тамоксифена (20 мг один раз в день [od]) и анастрозола (1 мг od) и для сравнения тамоксифена (20 мг od) и комбинации анастрозола (1 мг od) плюс тамоксифен (20 мг od) в качестве адъювантного лечения в следующих показателях:
a) время до возникновения рецидива рака молочной железы (определенное как наиболее ранний локальный или отдаленный рецидив, новый первичный рак молочной железы или смерть); и
b) безопасность и побочные эффекты.
Вторичные задачи этого опыта состояли в сравнении (1) тамоксифена и анастрозола и (ii) в сравнении тамоксифена и комбинации анастрозола плюс тамоксифен в качестве адъювантного лечения в следующих показателях:
a) время до возникновения отдаленного рецидива;
b) выживание; и
c) возникновение новых первичных опухолей молочной железы.
В частности, опыт был смоделирован как рандимизированное, двойное слепое, многофокусное исследование для сравнения эффективности и безопасности тамоксифена в отдельности, анастрозола в отдельности и анастрозола в комбинации с тамоксифеном в качестве адъювантного лечения рака молочной железы у женщин в постклимактерическом периоде. Пациентов, которые соответствовали критериям пригодности, случайно разделяли 1:1:1 в один из трех списков для перорального лечения при использовании одного из следующих препаратов:
а. активный анастрозол 1 мг один раз в день плюс тамоксифен плацебо один раз в день;
b. активный тамоксифен 20 мг один раз в день плюс анастрозол плацебо один раз в день;
с. активный анастрозол 1 мг один раз в день в комбинации с активным тамоксифеном 20 мг один раз в день.
Пациентов оценивали при поступлении спустя 3 месяца, 6 месяцев и потом через шестимесячные интервалы. Пациенты поступали из 381 центра из 21 страны. Пациентов набирали в период от июля 1996 до марта 2000. Девять тысяч триста шестьдесят шесть (9366) пациентов вступали в исследование и получали лекарственное средство, как описано ниже: 1) анастрозол (n=3125), 2) тамоксифен (n=2116) и 3) комбинация (n=3125).
Для того чтобы быть пригодным для вступления в исследование, пациенты должны были соответствовать всем приведенным ниже критериям:
a) пациенты с гистологически доказанным операбельным инвазивным раком молочной железы;
b) пациенты, которые полностью завершили первичную хирургию и химиотерапию (если проводилась) и представляли собой кандидатов для получения гормональной адъювантной терапии; и
c) женщины, которые были диагностированы как такие, которые находятся в постклимактерическом периоде в соответствии с одним или более следующими параметрами:
(i) возраст 60 лет и более
(ii) возраст 45-59 лет и соответствие одному или более из следующих критериев:
- аменоррея в течение, по крайней мере, 12 месяцев и интактная матка;
- аменоррея в течение, по крайней мере, 12 месяцев и показатель FSH в пределах границ, соответствующих постменопаузе;
включая:
- пациентов, которые подвергались гистероэктомии;
- пациентов, которые получали HRT;
- пациентов, которые были введены в состояние аменорреи с помощью адъювантной химиотерапии (такие пациенты должны были иметь значение FSH, измеренное спустя, по крайней мере, 6 недель после прекращения химиотерапии);
- билатеральное удаление яичников.
Пациенты, имеющие любое из перечисленного ниже, исключались из опыта:
а) пациенты, которые имели любой клинический признак метастатического заболевания;
b) пациенты, которые по любым причинам (например, стеснение, немощь, алкоголизм) не могли выполнять требования исследования;
c) пациенты, химиотерапия которых началась спустя более чем 8 недель (т.е. 56 дней) после завершения первичной хирургии, или химиотерапия которых завершилась более чем за 8 недель (то есть 56 дней) перед началом рандомизированного исследования; химиотерапия, если она проводилась, должна была назначаться постоперативно, то есть пациенты, которые получали неоадъювантную химиотерапию, были непригодными для исследования;
d) пациенты, которые не получали химиотерапию и первичная хирургия которых была завершена более чем за 8 недель (то есть 56 дней) перед началом рандомизированного лечения;
e) пациенты, которые получали предварительную гормональную терапию в качестве адъювантного лечения рака молочной железы, за исключением:
(i) первой хирургической процедуре предшествовал начальный период лечения с помощью тамоксифена, который получали менее чем 29 дней; или
(ii) гормональную терапию получали перед хирургическим вмешательством в контексте формального обследования, одобренного организационным комитетом;
f) пациенты, которые получали тамоксифен как часть любых исследований по предупреждению рака молочной железы;
g) пациенты, которые не желали останавливать прием любого лекарственного средства, известного как таковое, которое влияет на состояние половых гормонов (включая HRT), или те, которые не могли прекратить прием лекарственного средства;
h) предыдущая история инвазивного рака молочной железы, который имел место в любое время, или другие инвазивные злокачественные образования в пределах последних 10 лет, иные чем кожная карцинома чешуйчатых или базальных клеток или карцинома в области шейки матки, адекватно подвергнутые биопсии с помощью тубуса;
i) любое тяжелое сопутствующее заболевание, которое имеется у пациента с необычным риском, или неоднозначные результаты опыта, например длительная фамильная история остеопороза, тяжелое повреждение почек или печени (определенные как AST или ALT, которое в три раза больше верхнего предела стандартного интервала); или
j) лечение с помощью неодобренного или экспериментального лекарственного средства в течение 3 месяцев перед рандомизацией;
k) пациенты, которые по мнению исследователя имели риск переноса какой-либо инфекции через кровь или другие жидкости тела.
В двойном слепом исследовании использовали как активный анастрозол и плацебо анастрозол, так и таблетки тамоксифена, для того чтобы поддержать слепое исследование изучаемой терапии. Анастрозол 1 мг и сравниваемый плацебо анастрозол поставлялись как белые таблетки, покрытые пленкой. Активные таблетки тамоксифена 20 мг и сравниваемый тамоксифен плацебо обеспечивали как белые, круглые, двояковыпуклые таблетки. Пациентов подвергали рандомизации для получения одного из трех режимов пероральной терапии. Суточная доза представляла собой таблетку анастрозола (1 мг активного или плацебо) плюс одна таблетка тамоксифена (20 мг активного или плацебо). Пациенты были проинструктированы принимать свои суточные дозы примерно в одно и то же время каждый день. При вступлении в исследование пациенты обеспечивались исследуемым материалом либо на 13 недель, либо на 26 недель. Пациенты, которые обеспечивались материалом на 13 недель, получали материал на последующие 13 недель в первый последующий визит (через 3 месяца). При последующем визите по истечении шести месяцев пациенты обеспечивались исследуемым материалом еще на 26 недель. Для оценки чувствительности пациентов просили возвращать все неиспользованные таблетки при каждом визите.
Терапию начинали как можно быстрее после рандомизации, но не более чем через 8 недель после завершения хирургии и химиотерапии. Пациенты, которые получали первичную химиотерапию, могли начинать рандомизированное лечение до истечения максимального периода 8 недель после завершения химиотерапии или позднее у пациентов, анализ крови которых возвращался и возвратился к норме. Первичная химиотерапия должна была начинаться в пределах 8 недель после завершения первичной хирургии. Пациенты, которые завершили первичную терапию перед окончанием запланированного количества циклов, могли также подвергаться рандомизации. За исключением исследуемой терапии лекарственные средства, которые влияли на состояние половых гормонов или предотвращали возникновение рецидивов заболевания, были запрещены для применения после рандомизации до подтверждения рецидивов заболевания. Такие лекарственные средства включали следующие:
цитотоксическую химиотерапию;
пероральное введение кетоконазола (антигрибкового средства) или родственных соединений (то есть местное применение было приемлемым);
другие гормональные способы лечения рака молочной железы.
Процедура обеспечивала тот факт, что пациенты, страдающие серьезными симптомами, например сухостью влагалища или кровотечениями, приливами жара, абдоминальными спазмами, половой холодностью, должны были предпринимать следующие действия:
а. подать отчет о симптоме как о неблагоприятном событии;
b. если пациент желал этого, то он продолжал рандомизированное лечение;
с. в случае необходимости пациенты могли принимать прогестины в течение 3-6 месяцев.
Если вплоть до 6 месяцев прогестины оказались неэффективными для лечения симптомов менопаузы, назначали HRT и/или кремы на основе эстрогенов, при этом рандомизированное лечение можно было продолжать.
Получали и оценивали следующую информацию от пациента:
a) дата рождения и этническое происхождение (регистрировали при поступлении);
b) любую релевантную прошлую медицинскую историю, любое конкурентное заболевание, имел или не имел пациент гистероэктомию, курил ли ранее пациент или ранее имел HRT (регистрировали при поступлении);
c) все сопутствующие медикации/лечения (регистрировали при поступлении);
d) рост (регистрировали при поступлении) и вес (регистрировали при поступлении и до тех пор, пока пациент не прекращал рандомизированного лечения);
e) история рака молочной железы - хирургическое вмешательство, дата хирургического вмешательства, размер и стадия первичной опухоли, состояние лимфатических узлов, состояние ER и PR (если известно) и детали любой радиотерапии, химиотерапии и лечение с помощью тамоксифена, предшествующее хирургическому вмешательству (регистрировали при поступлении);
f) Приведенные ниже обычные лабораторные исследования осуществляли при поступлении: исследовали гемоглобин, количество тромбоцитов, лейкоцитов, креатинин, общий билирубин, щелочную фосфатазу, либо аспартатаминотрансферазу, либо аланинаминотрансферазу, натрий, калий и мочу. Если это было показано клинически, то дальнейшую лабораторную оценку проводили до тех пор, пока пациент не прекращал участие в рандомизированном лечении. Любое клинически значимое ненормальное значение регистрировали как неблагоприятный эффект, если это не являлось результатом рецидива заболевания. Образцы крови оценивали в местных условиях, лабораторные данные хранили в клинических/больничных карточках.
Пациенты подвергались осмотру на рак молочной железы во время всех последующих визитов при использовании следующих критериев, которые основываются на рекомендациях Британской группы по молочной железе: -
| Место возникновения рецидива | Метод подтверждения |
| Локально-региональный | |
| 1. Ипсилатеральная молочная железа* | Гистология или цитология |
| 2. Стенка грудной клетки | Гистология или цитология |
| 3. Подмышечные лимфатические узлы | Гистология или цитология |
| 4. Другие региональные узлы (то есть надключичные узлы и внутренние узлы молочной железы) | Гистология или цитология |
| Отдаленный | |
| 5. Скелетный | СТ• сканирование или сканирование костей с помощью рентгеновских лучей, оценка горячих точек. Биопсия может быть необходима в случае единичного повреждения |
| 6. Легочный | Рентгенограмма грудной клетки |
| 7. Печеночный | СТ или US сканирование |
| . Другой отдаленный | Визуализация и/или биопсия (только повышенное содержание опухолевых маркеров, например, СА 15.3, является неприемлемым) |
| * Карцинома молочной протоки in situ• Компьютерная томография Ультразвук |
Новые первичные опухоли молочной железы (либо контралатеральные, либо ипсилатеральные) расценивали как событие рецидива заболевания в статистических анализах времени до возникновения рецидива.
Первичной статистической конечной точкой исследований было время до возникновения рецидива заболевания (локально-регионального или отдаленного рецидива, нового первичного рака молочной железы или смерть по любой причине) и безопасность/переносимость. Вторичной статистической конечной точкой было время до возникновения отдаленного рецидива, время до смерти, появление новых первичных опухолей молочной железы и возникновение предварительно определенных неблагоприятных эффектов. В общей сложности проводили два сравнительных лечения: (1) только анастрозолом по сравнению с лечением только тамоксифеном и (2) только тамоксифеном по сравнению с анастрозолом и тамоксифеном в комбинации.
Для времени до возникновения рецидива заболевания, времени до возникновения отдаленного рецидива и времени до смерти осуществляли первичную стратегию анализа, включали всех рандомизированных пациентов и в соответствии с рандомизированным лечением проводили оценку (то есть «цель - лечение») с двумя в равной степени важными компонентами:
(i) Тест логарифмических рядов использовали для обеспечения основы для сравнения групп лечения без поправки на потенциальные прогностические факторы (это эквивалентно подгонке Сох модели пропорционального риска без поправки на базовые коварианты). Для статистической достоверности необходимо 1056 событий.
(ii) Сох модель пропорционального риска подгоняли, осуществляли поправку на базисное состояние рецептора, состояние лимфатических узлов, первичный размер опухоли, предыдущую химиотерапию, возраст и происхождение. Глобальный тест взаимодействий, включающий все два пути взаимодействий каждого из этих прогностических факторов рандомизированного лечения, осуществляли при 1% уровне для того, чтобы оценить - являются ли сравнения лечения последовательными для различных значений факторов. Предположение пропорционального риска также проверяли для каждого прогностического фактора при использовании зависимых от времени переменных. Если существовало отклонение в предположении (на уровне 5%), то фактор должен был включаться в качестве стратифицированной переменной.
Значения возникновения контралатерального рака молочной железы формально сравнивали между рандомизированными группами. Первичный анализ основывался на задаче подхода к лечению.
Также осуществляли вторичный анализ «по протоколу» и анализ подгрупп пациентов, которые имеют позитивную по рецептору эстрогена (ER) опухоль и/или позитивную по рецептору прогестерона (PR) опухоль, пациентов, имеющих опухоль, негативную по ER, и опухоль, негативную по PR, а также всех пациентов.
При основном анализе формально сравнивали значения возникновения следующих предварительно определенных неблагоприятных событий между группами лечения, определяемыми получаемым способом лечения: приливы жара, тошнота и рвота, астения, нарушения настроения, скелетно-мышечные расстройства, вагинальное кровотечение, вагинальные выделения, рак эндометрия, переломы, катаракта, венозные тромбоэмболические события и ишемические сердечно-сосудистые заболевания. Первичный анализ включал всех пациентов, которых подвергали изучаемому лечению, их анализировали в соответствии с лечением, которому их подвергали. Также осуществляли вторичный анализ подгрупп, анализ проводили в соответствии со способом лечения, который получал пациент, у пациентов, которые имеют позитивную по рецептору эстрогена (ER) опухоль и/или позитивную по рецептору прогестерона (PR) опухоль, пациентов, имеющих опухоль, негативную по ER, и опухоль, негативную по PR, и всех оставшихся пациентов, данные относительно безопасности суммировали и представляли в соответствии с получаемым лечением. Короткое изложение методологии представлено на Фигур